骨髓間充質干細胞對肝癌大鼠血管生成和細胞增殖的影響
胡方方 周家華 鄭國燦 程張軍 楊 揚
(東南大學附屬中大醫院肝膽外科,江蘇 南京 210009)
骨髓間充質干細胞對肝癌大鼠血管生成和細胞增殖的影響
胡方方 周家華 鄭國燦 程張軍 楊 揚
(東南大學附屬中大醫院肝膽外科,江蘇 南京 210009)
目的 探討骨髓間充質干細胞(BMSC)對肝癌大鼠血管生成和細胞增殖的影響。方法 分離得到Wistar大鼠BMSC。經流式細胞術鑒定后進行體外增殖培養,制作大鼠BMSC培養基(BMSC-CM)。結果 MTT測定顯示,25%、50%、75%及100%BMSC-CM組的吸光度(A值)均明顯高于0 BMSC-CM組,且隨著濃度的增加而升高(P<0.05)。流式細胞儀測定顯示,25%、50%、75%及100%BMSC-CM組的細胞增殖指數(PI)均明顯高于0 BMSC-CM組,且隨著濃度的增加而升高(P<0.05)。ELISA測定顯示,對于甲胎蛋白(AFP)的分泌情況,25%、50%、75%及100%BMSC-CM組均明顯高于0 BMSC-CM組,且隨著吸光度(A值)的增加而升高(P<0.05)。SABC法測定顯示,BMSC組血管內皮因子(VEGF)表達明顯高于單純造模組(P<0.05)。結論 BMSC能夠明顯促進肝癌大鼠血管生成與細胞增殖。
骨髓間充質干細胞;肝癌;血管生成;增殖
骨髓間充質干細胞(BMSC)是一種具有高增殖活性和多向分化潛能的未分化細胞〔1〕。有研究證實,BMSC經過內皮生長因子的誘導,可以分化為內皮細胞〔2〕。肝癌的發生與發展與BMSC也有著十分密切的聯系〔3〕。本文旨在探討BMSC對肝癌大鼠血管生成和細胞增殖的影響。
1 資料與方法
1.1 實驗動物 40只Wistar大鼠〔南京醫科大學實驗動物中心提供,動物合格證號:SCXK(蘇)2002-0032〕,體質量60~80 g,平均(69.23±8.02)g。大鼠飲水及飼料均經過高壓滅菌(121℃、30 min),動物飼養與實驗操作符合《實驗動物管理條例》等法規的要求。選取CBRH-7919肝癌細胞系(南京市人工細胞重點實驗室提供)。
1.2 實驗試劑 大鼠淋巴細胞分離液(上海朗頓生物科技有限公司),Gibco胎牛血清(FBS,上海玉博生物科技有限公司),DMEM/F-12培養基(北京索萊寶科技有限公司),四甲基偶氮唑鹽(上海研拓生物科技有限公司),大鼠甲胎蛋白(AFP)酶聯免疫檢測試劑盒(上海盈公生物技術有限公司),胰蛋白酶、青霉素、鏈霉素(美國Gibco公司),碘化丙啶染液。制備BMSC培養基:向DMEM/F-12培養基中混入10%FBS、100 U/ml青霉素、100 U/ml鏈霉素。
1.3 BMSC的分離培養 采取貼壁篩選法分離培養BMSC,具體措施如下〔4〕:①采取頸椎脫臼法處死10只大鼠,置于75%乙醇中15 min消毒。②在無菌環境下摘除大鼠腓骨與脛骨,注射器抽取L-DMEM多次沖洗骨髓腔直至腓骨與脛骨發白,沖出骨髓腔內細胞后加以分散制成單細胞懸液,將單細胞懸液緩慢加入含有大鼠淋巴細胞分離液的試管中后,2 000 r/min,離心20 min。③抽取試管中段單個核細胞層,用L-DMEM沖洗2次,除去殘留血清,1 000 r/min,離心5 min后,棄上清液。④將試管液混入含10%的FBS的DMEM/F-12培養基中,接種于70 cm2培養瓶中,5~6 d后換液,保留貼壁細胞。此后每4~5 d換液1次,培養環境為37℃、5%CO2。⑤觀察存在≥80%的細胞發生融合后,給予0.25%的胰蛋白酶消化,依照5×104ml-1進行傳代培養,并采用倒置顯微鏡觀察細胞形態變化。
1.4 BMSC的檢測 用胰蛋白酶消化P3代BMSC,充分吹打完全后制得含1×105ml-1細胞的單細胞懸液,先后加入CD29-FITC、CD44-FITC、CD45-FITC及CD34-PE流式抗體。避光、37℃條件下孵育30 min后用1%的多聚甲醛固定,采用流式細胞儀進行BMSC的檢測。
1.5 BMSC-CM的制備 BMSC傳代培養至第3代,當70%~80%的細胞發生融合時,培養瓶中的細胞數目約為3×106個,將培養瓶充分沖洗后,混入15 ml含有10%FBS的DMEM/F-12培養基,待24 h后用3 kD的超濾管濃縮該培養基25倍,即制備成BMSC的條件培養基(BMSC-CM),規定此培養基為100%BMSC-CM。
1.6 MTT比色法測定肝癌細胞的增殖情況 用胰蛋白酶消化生長良好的P3代的7919肝癌細胞,混入15 ml含有10%FBS的DMEM/F-12培養基得到重懸細胞,按照6×104/孔接種于96孔板內,每孔混入100 μl,培養12 h后,棄掉培養液,混入含25%、50%、75%及100%BMSC-CM及含5%FBS的DMEM/F-12培養液。將0 BMSC-CM設為對照組,其余4組作為觀察組,每組設6個復孔,繼續培養48 h。每孔混入10 μl MTT(5 mg/ml),培養4 h后,棄掉上清液,每孔混入150 μl二甲亞砜,10 min低速震蕩后,采用酶標儀測定A492 nm值。
1.7 流式細胞儀測定肝癌細胞的周期情況 用胰蛋白酶消化生長良好的P3代的7919肝癌細胞,混入15 ml含有10%FBS的DMEM/F-12培養基得到重懸細胞,按照1.4×105ml-1的方式接種于25 cm2的培養瓶中,培養12 h后,棄掉培養液,混入含25%、50%、75%及100%BMSC-CM及含5%FBS的DMEM/F-12培養液。繼續培養48 h后,采用胰蛋白酶對培養液進行消化,離心后PBS沖洗2次,計數,調整細胞數為1×105個后采用-20℃預冷的75%乙醇固定于-4℃的環境中,48 h后取出,PBS沖洗1次,混入碘化丙啶染液(500 μl/106個細胞),避光、4℃條件下孵育30 min后,采用流式細胞儀測定細胞分裂增殖指數(PI)。
1.8 ELISA測AFP的分泌情況 用胰蛋白酶消化生長良好的P3代的7919肝癌細胞,混入15 ml含有10%FBS的DMEM/F-12培養基得到重懸細胞,按照6×104/孔的方式接種于12孔板內,直至細胞能夠穩定生長時,棄掉培養液,混入含25%、50%、75%及100%BMSC-CM的無血清DMEM/F-12培養液,培養48 h后,采集上清液檢測AFP分泌情況。
1.9 SABC法測定微血管密度及VEGF的表達情況 將未處死的30只大鼠隨機分為BMSC移植組、單純造模組、空白對照組。①BMSC組:于第4、8、12周時經尾靜脈注入1×106個P3代BMSC;②單純造模組:于第4、8、12周時經尾靜脈注入等量生理鹽水;③空白對照組不予干預。造模21 w后采用頸椎脫臼法處死,取出肝臟組織,采用蘇木精-伊紅染色,觀察肝臟形態特點,并采用免疫組化SABC法測定微血管密度及VEGF的表達情況。微血管密度陽性以血管內皮細胞質內出現棕黃色顆粒狀染色為準;血管內皮生長因子(VEGF)陽性判定標準參照相關文獻〔5〕。
1.10 統計學處理 采用SPSS13.0軟件進行t檢驗。
2 結 果
2.1 BMSC的形態學變化 BMSC提取接種后,培養3 d后于顯微鏡下可觀察到貼壁細胞生長;培養7 d后可見細胞呈集落式生長;培養15 d后于顯微鏡下可觀察到梭形細胞貼壁生長,形態類似成纖維細胞,胞外有較長突起結構,折光性良好;培養45 d后細胞增殖速度明顯增快,發生首次傳代后,大約每7 d再次傳代,培養至P3代時,可見呈漩渦樣生長的單一細胞集落。
2.2 不同濃度BMSC-CM對肝癌細胞增殖情況的影響 25%、50%、75%及100%BMSC-CM組的吸光度(A值)及增殖率均明顯高于0 BMSC-CM組,且隨著濃度的增加而升高(P<0.05)。見表1。
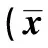
表1 不同濃度BMSC-CM對肝癌細胞增殖及細胞周期的影響±s)
與0 BMSC-CM組相比:1)P<0.05;與25% BMSC-CM比較:2)P<0.05;與50%BMSC-CM組比較:3)P<0.05;與75%BMSC-CM比較:4)P<0.05
2.3 不同濃度BMSC-CM對肝癌細胞周期情況的影響 流式細胞儀測定顯示,25%、50%、75%及100%BMSC-CM組的細胞增殖指數(18%、21%、24%、27%)均明顯高于0 BMSC-CM組(16%),且隨著濃度的增加而升高(P<0.05)。
2.4 不同濃度BMSC-CM對肝癌細胞AFP的分泌情況的影響 AFP的分泌情況,25%、50%、75%及100%BMSC-CM組(1.90、2.67、3.01、3.59)均明顯高于0 BMSC-CM組(0.19),且隨著吸光度(A值)的增加而升高(P<0.05)。
2.5 肝臟癌變過程中的病理變化 BMSC組:鏡下可見肝細胞廣泛脂肪變、壞死,肝小葉纖維支架塌陷,門管區-肝小葉中央靜脈延伸擴展形成纖維隔,形成假小葉,可見大量再生結節,癌細胞異型性明顯,細胞核顯著增大且深染;單純造模組:鏡下可見少量肝細胞脂肪變、壞死,癌細胞異型性不明顯;空白對照組:鏡下可見肝細胞膜完整,核大而圓,門管區內肝細胞排列整齊。見圖1。
2.6 微血管密度及VEGF的表達情況 免疫組化SABC法測定顯示,BMSC組與單純造模組均可觀察到VEGF陽性表達,且BMSC組VGEF表達明顯高于單純造模組;空白對照組可觀察到少量VGEF的陽性表達;BMSC組VGEF陽性表達明顯多于單純造模組,而單純造模組微血管密度則顯著高于空白對照組,見圖2、圖3。

圖1 兩組肝細胞病理變化(×400)

圖2 兩組VEGF測定(×400)

圖3 兩組微血管密度染色結果(×400)
2.7 VEGF與微血管密度表達的相關性分析 微血管密度與VEGF的表達呈正相關(r=0.721,P=0.003)。
3 討 論
BMSC是一種能夠從多種動物及人體的許多部位和組織中(包括骨髓、骨膜、脂肪組織等)提取的多能干細胞,其中骨髓組織中的BMSC含量最為豐富〔6〕。研究表明,BMSC可在不同環境和細胞因子的影響下,定向分化為成骨細胞、心肌細胞、肝細胞等〔7〕。BMSC還具有促進血管再生、改善組織供血的功能,BMSC促血管再生的機制為BMSC旁分泌的VGEF具有促進其向血管內皮細胞分化的潛能〔8〕。目前關于BMSC對肝癌的影響作用仍存在較大分歧,有報道證實,BMSC是肝癌壞死區肝細胞的主要細胞來源,促進了肝癌的發生與發展〔9〕。但也有研究指出,BMSC具有抑制肝癌細胞增殖的作用〔10〕。
本研究結果顯示,BMSC其旁分泌物質能夠促進肝癌細胞的增殖,且濃度越高,促增殖能力越強。這與李天然等〔11〕的研究結果一致,即BMSC能夠下調肝癌細胞的侵襲能力,上調肝癌細胞的增殖能力。此外,BMSC還促進了肝癌細胞AFP的分泌,且隨BMSC濃度的增加而增加。AFP是肝癌的特異性標志物,隨著病情惡化AFP的含量會急劇增加,這也反映出BMSC促進了肝癌的進展。本次研究結果還顯示,BMSC可使VGEF的陽性表達及微血管密度顯著增加。有研究表明,VGEF是一種具有強大促血管生成功能的生長因子〔12〕。說明BMSC能夠促進肝癌大鼠血管的生成。宋浩等〔13〕的研究結果也證實了這一點。綜上,BMSC能夠明顯促進肝癌大鼠血管生成與細胞增殖,但其具體的機制仍有待進一步闡明。
1 郭 輝,張于娟,魏曉光,等.低氧環境下骨髓間充質干細胞中血管內皮生長因子的表達〔J〕.中國組織工程研究,2014;18(23):3627-32.
2 束 波,范 芳.骨髓間充質干細胞移植對大鼠血管成形術后內膜增生及炎癥因子表達的影響〔J〕.中國老年學雜志,2012;32(14):2989-92.
3 袁 博,陳昆侖,張 嵐,等.大鼠骨髓間充質干細胞對RH-35肝癌細胞侵襲能力的影響〔J〕.西安交通大學學報(醫學版),2014;35(4):455-9.
4 王翠艷,魏芳晶,陰淑瑩,等.大鼠骨髓間充質干細胞的分離、培養和鑒定〔J〕.中國老年學雜志,2013;33(5):1086-8.
5 王東旭,姜海行,蘇思標,等.體外共培養大鼠骨髓間充質干細胞對肝星狀細胞增殖的影響:Cyclin D1與P27表達調控〔J〕.中國組織工程研究與臨床康復 2010;14(10):1764-8.
6 辛 毅,李 娜,黃益民,等.小鼠骨髓間充質干細胞定向誘導分化血管內皮細胞的實驗研究〔J〕.新鄉醫學院學報,2014;31(1):8-14.
7 康少平,姜文靜,李 萍.骨髓間充質干細胞向內皮細胞的分化和臨床應用〔J〕.中國組織工程研究與臨床康復,2011;15(49):9279-82.
8 劉軍朋,姜文學.骨髓間充質干細胞旁分泌促血管生成的研究進展〔J〕.天津醫科大學學報,2011;17(1):130-4.
9 周 軍,李天然,宋 斌.hMSC對高轉移潛能肝癌模型影響的實驗研究〔J〕.功能與分子醫學影像學(電子版),2013;2(2):102-6.
10 王 強,鞏 鵬,金 實,等.磁標記骨髓間充質干細胞對不同轉移潛能肝癌細胞作用的研究〔J〕.大連醫科大學學報,2015;37(1):13-6.
11 李天然,盧光明,宋 斌.骨髓間充質干細胞對高低轉移潛能肝癌細胞影響的實驗研究〔J〕.胃腸病學和肝病學雜志,2014;23(9):1056-60.
12 田 甜,賈赤宇.骨髓間充質干細胞誘導分化為血管內皮細胞在組織損傷修復中的研究現狀〔J〕.中華損傷與修復雜志,2012;7(4):418-21.
13 宋 浩,紀衛政,邰沁文.骨髓間充質干細胞對肝癌模型大鼠血管形成的影響〔J〕.中國組織工程研究,2012;16(14):2481-6.
〔2013-11-21修回〕
(編輯 苑云杰)
胡方方(1982-),男,碩士,醫師,主要從事肝膽胰疾病研究。
R735.7
A
1005-9202(2015)12-3226-03;
10.3969/j.issn.1005-9202.2015.12.017

