吻內(nèi)側(cè)被蓋核(RMTg)參與嗎啡引起的大鼠睡眠紊亂
胡珍真 尹 豆 葉宸搏 孫煥欣 楊素榮△
(1復旦大學基礎(chǔ)醫(yī)學院藥理學系 上海 200032; 2復旦大學藥學院藥理學與生物化學教研 上海 201203)
吻內(nèi)側(cè)被蓋核(RMTg)參與嗎啡引起的大鼠睡眠紊亂
胡珍真1尹 豆2葉宸搏1孫煥欣1楊素榮1△
(1復旦大學基礎(chǔ)醫(yī)學院藥理學系 上海 200032;2復旦大學藥學院藥理學與生物化學教研 上海 201203)
目的 旨在闡明吻內(nèi)側(cè)被蓋核(rostromedial tegmental nucleus,RMTg)是否參與嗎啡引起的大鼠睡眠障礙。方法 將雄性SD大鼠隨機分為溶劑對照組和嗎啡組,每組7只,對照溶劑為人工腦脊液(artificial cerebrospinal fluid,ACSF)。采用腦立體定位、核團微量注射和睡眠記錄與解析等技術(shù)觀察RMTg內(nèi)給予嗎啡對大鼠睡眠-覺醒周期的影響。結(jié)果 與對照組相比,雙側(cè)RMTg 給予嗎啡(16 mmol/L,每側(cè)0.5 μL)可以引起大鼠長達4 h的覺醒,期間非快動眼(non-rapid eye movement,NREM)睡眠深度降低、快動眼(REM)睡眠減少的現(xiàn)象與嗎啡臨床用藥所引起的睡眠障礙的表現(xiàn)相一致。結(jié)論 RMTg參與嗎啡引起的大鼠睡眠紊亂。
嗎啡; 睡眠; μ-型阿片受體(μOR); 吻內(nèi)側(cè)被蓋核(RMTg); 大鼠
嗎啡(morphine)作為一種阿片類的強效鎮(zhèn)痛劑在臨床廣泛使用。然而,它在治療疼痛的同時會引發(fā)一系列不良反應(yīng),包括睡眠障礙。本課題組前期研究表明,系統(tǒng)給予嗎啡可以通過作用于睡眠中樞腹外側(cè)視前區(qū)的μ-型阿片受體(μ-opioid receptor,μOR)抑制睡眠相關(guān)神經(jīng)元而誘導大鼠的覺醒行為[1]。2009年被正式命名的一個中腦結(jié)構(gòu)——吻內(nèi)側(cè)被蓋核(rostromedial tegmental nucleus,RMTg)被發(fā)現(xiàn)向覺醒相關(guān)核團腹側(cè)被蓋區(qū)(ventral tegmental area,VTA)有密集的神經(jīng)纖維投射[2],同時接受覺醒相關(guān)的網(wǎng)狀結(jié)構(gòu)和被蓋核的支配[3],且富含μOR[2-4]。與眾多神經(jīng)行為調(diào)節(jié)一樣,嗎啡治療中引起患者的睡眠紊亂可能也存在多靶點、多通路的調(diào)控網(wǎng)絡(luò)。本研究中,我們采用神經(jīng)核團微量注射的方法,觀察嗎啡對大鼠睡眠覺醒行為的影響,研究其促覺醒作用的潛在靶點,為治療嗎啡用藥伴發(fā)的睡眠障礙提供一定的參考。
材 料 和 方 法
實驗動物 SPF級雄性SD大鼠(290~340 g,8~10周齡)由中科院上海實驗動物中心提供,許可證號SCXK(滬)2007-0005。每只大鼠僅供一次實驗使用,不重復利用。動物分籠飼養(yǎng)在睡眠覺醒生物解析系統(tǒng)專用飼養(yǎng)籠中。飼養(yǎng)環(huán)境:恒溫(24±1) ℃、恒濕60%±2%、隔音、靜電屏蔽、自動光控12 h/12 h 明暗周期(光照度≈100 lux,開燈時間為7:00,關(guān)燈時間為19:00),動物可自由獲取食物和水。實驗過程中盡最大可能減少動物使用量及動物所遭受的痛苦。實驗方案得到復旦大學實驗動物倫理委員會批準。
試劑與藥品 鹽酸嗎啡注射液(morphine hydrochloride injection,東北制藥集團公司沈陽第一制藥廠,批號080808-2)以新鮮配制的人工腦脊液(artificial cerebrospinal fluid,ACSF)稀釋到16 mmol/L,避光保存,給藥量為每側(cè)0.5 μL。水合氯醛(國藥集團化學試劑有限公司,批號80096628);牙托粉和牙托水(上海張江生物材料有限公司)。
主要儀器 微型手持式顱鉆(型號78001,深圳市瑞沃德生命科學有限公司);腦立體定位儀(型號68002,深圳市瑞沃德生命科學有限公司);微量進樣器(1 μL,上海高鴿工貿(mào)有限公司);腦電波數(shù)據(jù)分析軟件SleepSign 3.0(日本Kissei Comtec株式會社);睡眠覺醒生物解析系統(tǒng)VitalRecorder 3.0(日本Biotex Kyoto公司)。
手術(shù)埋置記錄電極和給藥套管 用10%水合氯醛(360 mg/kg,i.p.)麻醉動物,用剃毛器剃去大鼠頭頸部毛發(fā),將其固定于腦立體定位儀上,用75%酒精消毒手術(shù)區(qū),切開顱頂皮膚,剝離皮下組織,刮除骨膜,暴露顱骨前后囟。參考文獻[5]進行定位,以前囟為參考點,中線右側(cè)旁開2~3 mm,前后方向(+2.0、-2.0 mm)以0.8 mm 鉆頭鉆孔,以穿透顱骨但不傷及腦組織為宜, 作為腦電圖(electroencephalogram,EEG)記錄電極螺絲安裝位置;中線左側(cè)對稱位置以1.0 mm鉆頭鉆孔,不打通顱骨,為參考電極螺絲安裝位置;后囟前后取中線左右等距離的兩點以1.0 mm 鉆頭鉆孔,不打通顱骨,為支持螺絲所在位置。
于大鼠前囟后6.8 mm,旁開0.3 mm,用0.8 mm 鉆頭鉆通顱骨,兩側(cè)開孔前外側(cè)2 mm 處分別鉆不通透的孔并旋上螺絲。借助腦立體定位儀垂直臂上的夾持器將不銹鋼套管(長度為19 mm,外徑為0.6 mm,帶內(nèi)芯)從顱骨表面緩慢豎直深入7.4 mm,套管末端至RMTg 正上方1 mm(圖 1),用牙科水泥固定套管于同側(cè)支持螺絲上,待水泥徹底固化后撤去夾持器。

圖1 核團微量注射給藥模式圖Fig 1 Schematic diagram of microinjection
將電極和套管裝好后,用牙托粉將電極與顱骨緊密貼合固定,將兩根采集肌電圖(electromyogram,EMG)的電極插入頸部肌肉內(nèi),涂撒青霉素鈉,縫合創(chuàng)口。將動物以側(cè)臥勢放置于37 ℃ 恒溫熱板上直至蘇醒,蘇醒后的動物單籠飼養(yǎng),恢復1周后用于腦電波記錄。動物在記錄籠中適應(yīng)至少2天后開始記錄。
實時記錄與核團微量注射給藥 7:00開始記錄腦電波,9:00 經(jīng)套管給予μOR 激動劑嗎啡(morphine,MOR),參考文獻[6]并經(jīng)預實驗確定MOR濃度為16 mmol/L(配藥濃度為3 mg/mL),以ACSF作為對照,給藥容積為0.5 μL/側(cè)。給藥時,給藥針深入并超出套管末端1 mm,保證給藥針尖端正好處于RMTg核團正中央位置。
EEG/EMG解析 EEG/EMG記錄完畢,采用SleepSign解析軟件,以10 s為解析單元,按統(tǒng)一設(shè)定的標準(圖2)自動掃描判定覺醒W(wake)、非快動眼睡眠S(non-rapid eye movement sleep,NREM)和快動眼睡眠R(REM)。自動掃描完畢,進行人工核查,必要時修正[7]。將大鼠睡眠覺醒分為:覺醒(W)、非快速眼動睡眠(S)和快速眼動睡眠(R):S 時,腦電δ波(0.65~4 Hz)占優(yōu)勢,波幅大,EMG安靜;R 時,EEG θ波(6~10 Hz)占優(yōu)勢,波幅較小,EMG安靜;W 時,EEG波幅進一步減小,EMG活躍。其中,REM屬于進入睡眠的第1階段,由淺入深又可細分為Ⅰ、Ⅱ、Ⅲ、Ⅳ期,EEG波幅越大、EMG越安靜表示睡眠越深;REM屬于睡眠的第2階段,有明顯的眼球運動,EMG安靜,但機體其他各項生理活動更趨向于覺醒時的狀態(tài)。
結(jié) 果
嗎啡微量注射引起大鼠覺醒增加 表1所示:給予ACSF或嗎啡前后8 h大鼠覺醒量、NREM睡眠量和REM睡眠量的時程分析,及給藥后4 h覺醒量、NREM睡眠量和REM睡眠量的總量。
RMTg局部微量注射16 mmoL嗎啡,觀察動物的睡眠覺醒量的改變。時程分析表明,嗎啡引起的覺醒相對ACSF 組在4 h內(nèi)有差異,NREM睡眠減少,REM睡眠無變化。統(tǒng)計4 h睡眠覺醒總量顯示,核團微量注射嗎啡可使大鼠覺醒量增加98.00% (P<0.001),同時NREM和REM睡眠分別減少89.40% (P<0.001)和98.99% (P<0.05)。以上結(jié)果表明RMTg局部給予嗎啡可以明顯減少大鼠NREM和REM睡眠量。
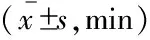
表1 微量注射嗎啡至RMTg引起大鼠覺醒量增加Tab 1 Wakefulness was increased by microinjection of morphine into RMTg in rats
ACSF:Artificial cerebrospinal fluid;MOR:Morphine.vs.ACSF control group,(1)P<0.05;(2)P<0.01.In each group,n=7.
嗎啡微量注射引起大鼠睡眠覺醒結(jié)構(gòu)改變 圖3顯示:給予ACSF或嗎啡后的4 h內(nèi),大鼠覺醒、NREM睡眠和REM睡眠3個時相不同時程的片段發(fā)作次數(shù)和時相轉(zhuǎn)換(圖3A),包括各時相片段總數(shù)(圖3B)、各時相片段的平均持續(xù)時間(圖3C)以及時相轉(zhuǎn)換次數(shù)(圖3D)。
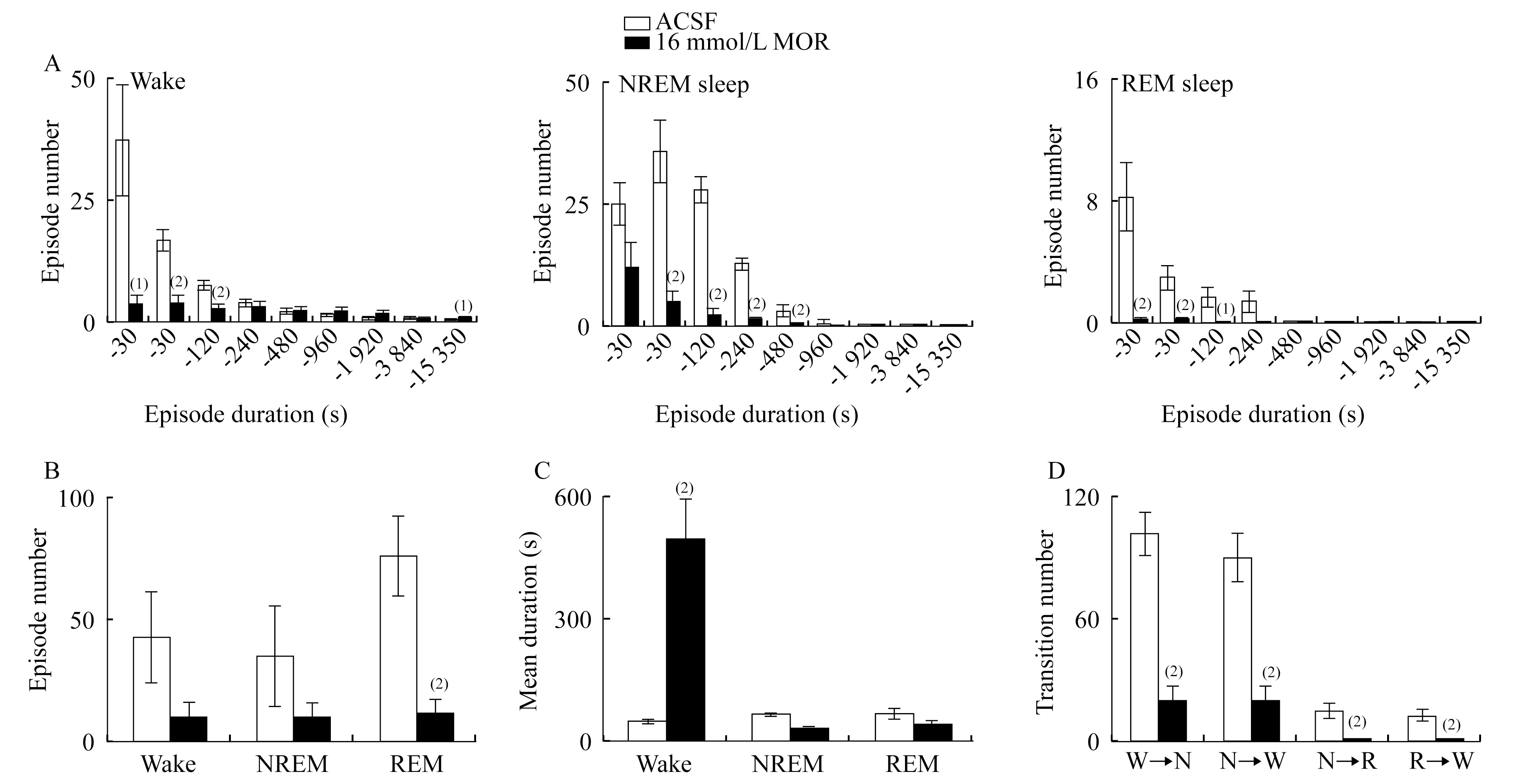
圖3 嗎啡微量注射后睡眠覺醒的片段發(fā)作次數(shù)與時相轉(zhuǎn)換分析Fig 3 Episode number and stage transition analysis of sleep-wake behavior after microinjection of morphineThe bars represented episode duration(A),episode number(B),mean duration(C)and transition number(D)during the following 4 h after the microinjection of ACSF or morphine.vs.ACSF control group,(1)P<0.05;(2)P<0.01.Data were shown as(n=7).
RMTg 局部微量注射嗎啡,觀察動物的睡眠結(jié)構(gòu)。該劑量嗎啡引起大鼠短時覺醒片段的減少但超長時程片段增加,而NREM和REM睡眠片段普遍減少。結(jié)果表明,覺醒和NREM睡眠片段有減少趨勢,但與ACSF組相比差異無統(tǒng)計學意義,而在REM睡眠片段的減少方面,差異有統(tǒng)計學意義。片段平均持續(xù)時間分析顯示,覺醒片段的平均持續(xù)時間顯著延長,而NREM和REM睡眠無顯著性改變。這些結(jié)果說明,嗎啡微量注射引起覺醒的增加來源于覺醒片段的平均持續(xù)時間大大延長,REM睡眠的減少主要是因為REM片段的發(fā)作次數(shù)明顯減少,而NREM睡眠的減少是片段次數(shù)和時程均有減少趨勢造成的。同時發(fā)現(xiàn),大鼠各時相之間的轉(zhuǎn)換次數(shù)均明顯減少,呈現(xiàn)去片段化睡眠現(xiàn)象。
嗎啡微量注射引起大鼠睡眠深度降低 RMTg局部微量注射嗎啡后觀察動物的睡眠深度,記錄給予ACSF或嗎啡后的4 h內(nèi)大鼠NREM睡眠腦波不同頻率的能量密度(圖4)。關(guān)注NREM睡眠(以0.5~4 Hz為主),可見此頻段的百分比降低,通常認為典型的REM睡眠(4~6 Hz)和覺醒(6~10 Hz)的成分有所增加,更高頻段(代表活躍狀態(tài)的覺醒)的分布連續(xù)增加,說明嗎啡不僅引起覺醒量的增加,且覺醒狀態(tài)的動物異常活躍;而動物睡眠量減少且深度有所降低。
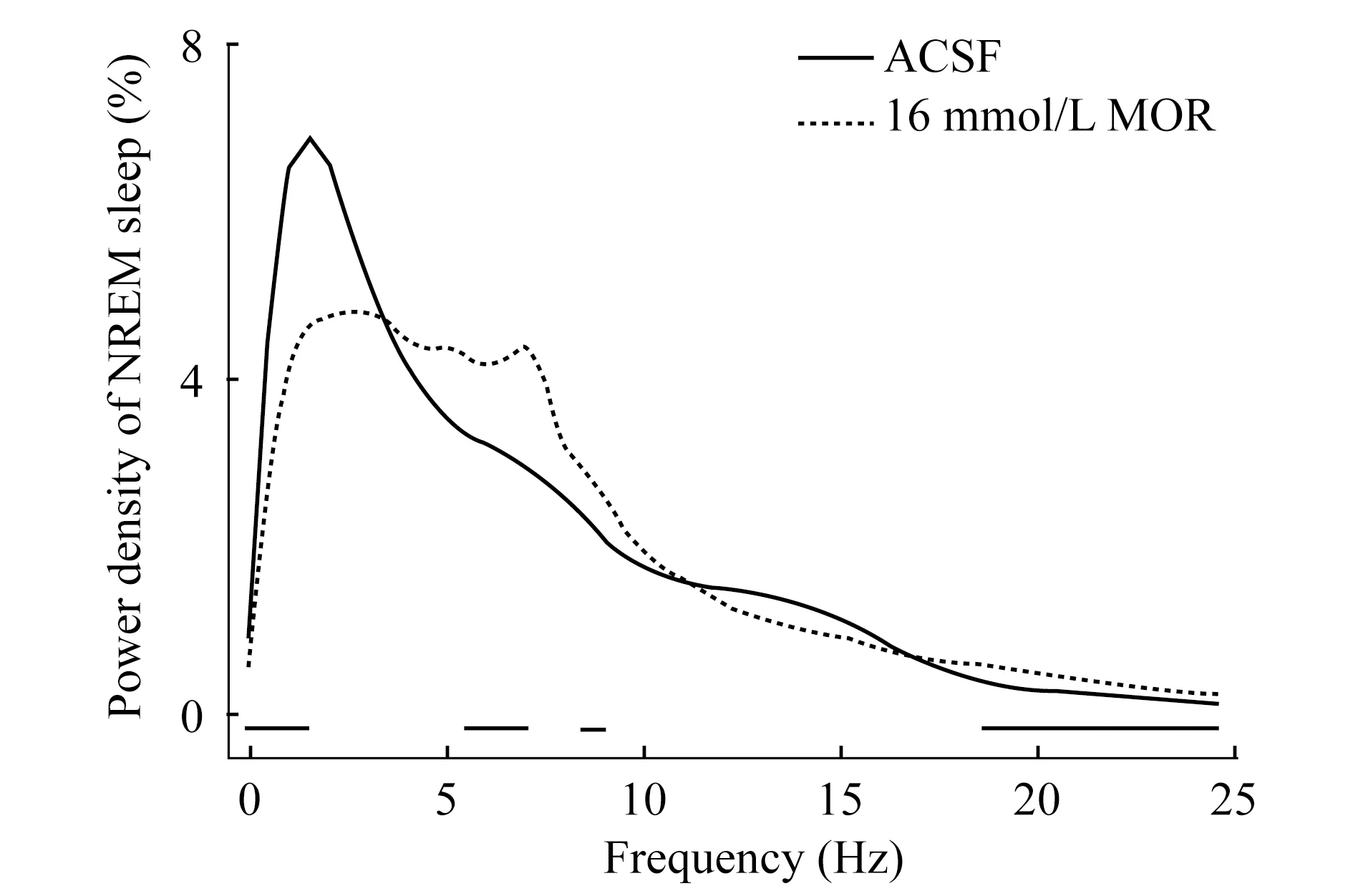

The curves represented logarithmic mean values of absolute power densities of NREM sleep during the 4 h after the administration.The horzontal bars indicated a statistical difference (P<0.05) between ACSF group and MOR group.ACSF:Artifical cerebrospinal fluid; MOR:Morphine.
討 論
睡眠是人類的普遍行為,人生大約1/3在睡眠中度過。然而很多人深受失眠之苦,睡眠醫(yī)學作為一門新生學科,仍有眾多謎團亟待破解。
睡眠障礙通常表現(xiàn)為入睡困難、維持睡眠困難、過早覺醒和睡后無恢復感,可引起軀體功能障礙或明顯不適,及時運用鎮(zhèn)靜催眠藥有助于避免失眠損害人體健康和正常生活。鎮(zhèn)痛藥嗎啡是從罌粟中提取的一種生物堿,近年來大量實驗發(fā)現(xiàn)植物中的多種化學成分具有不同程度的鎮(zhèn)靜安神作用,尤其一些中藥復方制劑治療失眠效果顯著且不良反應(yīng)少而備受關(guān)注。例如中藥復方制劑和顏?坤泰膠囊(熟地黃、黃連、白芍、阿膠、黃芩、茯苓)在治療女性圍絕經(jīng)期、卵巢早衰、婦科腫瘤的放化療或手術(shù)等引起的失眠具有獨到的療效,是個成功的案例。這些研究結(jié)果為我們二次開發(fā)和提取作用靶點明確的單體類鎮(zhèn)靜催眠藥提供了線索,同時也為開發(fā)新的鎮(zhèn)靜催眠藥物奠定了基礎(chǔ)。失眠機制與催眠藥物的研究并駕齊驅(qū),將能提高人們的睡眠質(zhì)量,降低失眠的痛苦。
嗎啡及其代謝物可以透過血腦屏障(blood brain barrier),這為研究其臨床療效(無論是鎮(zhèn)痛作用還是不良反應(yīng))的中樞機制提供了保證。核團微量注射是對局部神經(jīng)核團進行藥理學操控的常用手段,借助套管對特定核團給予特定受體的激動劑或拮抗劑可模擬該腦區(qū)神經(jīng)元的興奮或抑制效應(yīng)。我們用μOP激動劑嗎啡干預RMTg局部的神經(jīng)元,觀察到大鼠長達4 h的覺醒,伴隨NREM和REM睡眠減少,而且NREM睡眠深度降低,與嗎啡臨床應(yīng)用時引起患者淺睡眠增加、深睡眠減少的報道一致[8-9],說明RMTg是嗎啡引起睡眠紊亂可能的中樞作用靶點之一。
今后的研究中,我們需要關(guān)注RMTg參與嗎啡促覺醒作用的下游可能的神經(jīng)通路。其直接興奮皮層引起覺醒,還是通過去抑制GABA能的神經(jīng)投射興奮下游的多巴胺系統(tǒng)介導覺醒[10]?其次,嗎啡是μOR的非選擇性激動劑,需要進一步明確其覺醒作用的受體機制。另外,大量研究顯示RMTg與嗎啡成癮密切相關(guān)[11],但具體作用機制尚不明確,其成癮機制和覺醒機制是否有類似的神經(jīng)解剖學基礎(chǔ)也值得研究。本研究采用單次微量注射嗎啡觀察到RMTg參與了嗎啡促覺醒作用,而嗎啡慢性用藥引起睡眠障礙的情況可能更為復雜,有待進一步研究。
[1] Wang Q,Yue XF,Qu WM,etal.Morphine inhibits sleep-promoting neurons in the ventrolateral preoptic area via mu receptors and induces wakefulness in rats [J].Neuropsychopharmacology,2013,38(5):791-801.
[2] Jhou TC,Geisler S,Marinelli M,etal.The mesopontine rostromedial tegmental nucleus:A structure targeted by the lateral habenula that projects to the ventral tegmental area of Tsai and substantia nigra compacta [J].JCompNeurol,2009,513(6):566-596.
[3] Bourdy R,Barrot M.A new control center for dopaminergic systems:pulling the VTA by the tail [J].TrendsNeurosci,2012,35(11):681-690.
[4] Jhou TC,Xu SP,Lee MR,etal.Mapping of reinforcing and analgesic effects of the mu opioid agonist Endomorphin-1 in the ventral midbrain of the rat [J].Psychopharmacology(Berl),2012,224(2):303-312.
[5] Paxinos G,Watson G.大鼠腦立體定位圖譜 [M].3版.諸葛啟釧,譯.北京:人民衛(wèi)生出版社,2005.
[6] Lecca S,Melis M,Luchicchi A,etal.Effects of drugs of abuse on putative rostromedial tegmental neurons,inhibitory afferents to midbrain dopamine cells [J].Neuropsychopharmacology,2011,36(3):589-602.
[7] Qu WM,Huang ZL,Xu XH,etal.Dopaminergic D1 and D2 receptors are essential for the arousal effect of modafinil [J].JNeurosci,2008,28(34):8462-8469.
[8] Dimsdale JE,Norman D,DeJardin D,etal.The effect of opioids on sleep architecture [J].JClinSleepMed,2007,3(1):33-36.
[9] Shaw IR,Lavigne G,Mayer P,etal.Acute intravenous administration of morphine perturbs sleep architecture in healthy pain-free young adults:a preliminary study [J].Sleep,2005,28(6):677-682.
[10] Kaufling J,Veinante P,Pawlowski SA,etal.Gamma-aminobutyric acid cells with cocaine-induced delta FosB in the ventral tegmental area innervate mesolimbic neurons [J].BiolPsychiatry,2010,67(1):88-92.
[11] Jalabert M,Bourdy R,Courtin J,etal.Neuronal circuits underlying acute morphine action on dopamine neurons [J].ProcNatlAcadSciUSA,2011,108(39):16446-16450.
The rostromedial tegmental nucleus (RMTg) participates in sleep disruption caused by morphine in rats
HU Zhen-zhen1, YIN Dou2, YE Chen-bo1, SUN Huan-xin1, YANG Su-rong1△
(1DepartmentofPharmacology,SchoolofBasicMedicalSciences,FudanUniversity,Shanghai200032,China;2DepartmentofPharmacologyandBiochemistry,SchoolofPharmacy,FudanUniversity,Shanghai201203,China)
Objective To clarify the potential role of rostromedial tegmental nucleus (RMTg) in morphine-caused sleep disruption in rats. Methods Male SD rats were randomly divided into vehicle control group (n=7) treated with artificial cerebrospinal fluid (ACSF) and morphine group (n=7).By using brain stereotaxic,nucleus microinjection and sleep recording techniques,we observed the effects of microinjection of morphine into rat RMTg on the sleep-wake cycle. Results Compared with the control group,microinjection of morphine (16 mmol/L,0.5 μL perside) into the bilateral RMTgs induced 4-hour wakefulness.During this period,the depth of non-rapid eye movement (NREM) sleep became light and the amount of rapid eye movement sleep decreased,which conformed to the phenotype of sleep disruption caused by clinical morphine usage. Conclusions The RMTg may be involved in the sleep disruption caused by morphine in rats.
morphine; sleep; μ-opioid receptor (μOR); rostromedial tegmental nucleus (RMTg); rat
上海市科委資助項目(11ZR1402000);上海市重點學科建設(shè)項目(B119);上海市衛(wèi)計委資助項目(2010234)
R 96
A
10.3969/j.issn.1672-8467.2015.02.002
2014-09-24;編輯:段佳)
△Corresponding author E-mail:sryang@shmu.edu.cn
*This study was supported by the Project of Shanghai Committee of Science and Technology (11ZR1402000),Shanghai Leading Academic Discipline Project (B119),and the Project of Shanghai Municipal Commision of Health and Family Planning (2010234).

