骨髓間充質干細胞條件培養基對INS-1細胞凋亡的影響
趙坤,郝好杰,臧麗,楊國慶,李祥,韓為東,母義明
·基礎研究·
骨髓間充質干細胞條件培養基對INS-1細胞凋亡的影響
趙坤,郝好杰,臧麗,楊國慶,李祥,韓為東,母義明
目的 探討骨髓間充質干細胞條件培養基(BMSC-CM)對促炎因子誘導大鼠胰島素瘤細胞(INS-1)凋亡的影響及其作用機制。方法 培養大鼠骨髓間充質干細胞(BMSCs)至第3代,收集、濃縮其上清液,獲得富含BMSCs分泌因子的條件培養基。用含促炎因子TNF-α、IL-1β、IFN-γ的培養基處理INS-1細胞48h,造成炎癥損傷β細胞模型,加入不同濃度的BMSC-CM繼續培養12h,所獲細胞分為以下5組:正常對照組,促炎因子組,1×BMSC-CM組,2×BMSC-CM組,4×BMSC-CM組。采用CCK-8法檢測INS-1細胞存活率,膜連蛋白V/碘化丙啶(Annexin V/PI)檢測細胞凋亡率,二氯熒光素雙醋酸鹽(DCFH-DA)檢測細胞內活性氧(ROS)的生成量。結果 與正常對照組相比,促炎因子組INS-1細胞存活率下降至正常對照組的75.84%±1.53%,細胞凋亡率增加(17.23%±1.77%),細胞內ROS水平明顯升高(34.3%±0.80%),差異均具有統計學意義(P<0.01)。而BMSC-CM有效對抗了促炎因子導致的INS-1細胞損傷,其作用呈劑量依賴性,4×BMSC-CM組效果最佳,該組INS-1細胞存活率較促炎因子組升高了11.86%,達到87.7%±2.08%,細胞凋亡率下降至8.67%±1.59%,ROS生成量減少至17.1%±2.14%,差異均具有統計學意義(P<0.05)。結論 BMSC-CM可抑制促炎因子誘導的INS-1細胞凋亡,其作用機制可能與BMSC-CM降低細胞內ROS水平有關。
間質干細胞;細胞凋亡;炎癥;INS-1細胞
[Key words]mesenchymal stem cells; apoptosis; inflammation; INS-1 cells
骨髓間充質干細胞(bone marrow-derived mesenchymal stem cells,BMSCs)是具有不斷增殖、自我更新及多向分化等特點的成體干細胞[1-4]。目前越來越多的研究表明,BMSCs在多種免疫疾病中可起到免疫調節及抗炎作用,這種效應與其分泌的多種細胞因子密切相關[5-6]。近年來,大量研究證實2型糖尿病是一種慢性低度炎癥性疾病[7]。研究發現,2型糖尿病患者伴有多種炎癥因子升高,如C-反應蛋白(C-reactive protein,CRP)、IL-6、IL-1β、TNF-α等[8]。這些炎癥因子不僅直接參與胰島素抵抗[9],還能誘導β細胞凋亡[10]。因此,減少慢性炎癥引起的β細胞凋亡,對延緩2型糖尿病的進展具有重要意義[11]。本研究利用促炎因子處理大鼠胰島素瘤細胞(INS-1),建立慢性炎癥損傷β細胞的體外模型,探索BMSCs條件培養基(bone marrow-derived mesenchymal stem cell-conditioned medium,BMSC-CM)對促炎因子誘導INS-1細胞凋亡的影響及其可能機制。
1 材料與方法
1.1 材料
1.1.1 細胞 INS-1細胞株由解放軍總醫院基礎所分子生物室提供。大鼠BMSCs原代細胞提取自體重100~120g的健康雄性大鼠骨髓,培養至第3代時使用。
1.1.2 主要試劑與儀器 RPMI 1640培養基,胎牛血清,青霉素,鏈霉素,丙酮酸鈉(美國Gibco公司);DMEM(低糖)(美國Hyclone公司);β-巰基乙醇(美國Sigma公司);TNF-α、IL-1β、IFN-γ(美國Peprotech公司);PEG 20000(德國Merck公司);CCK-8試劑盒(日本Dojindo公司);Annexin V-FITC/Propidium Iodide(PI)凋亡試劑盒(美國BD Biosciences公司);活性氧(reactive oxygen species,ROS)檢測試劑盒(美國Molecular Probes公司)。酶標儀(美國Thermofisher公司),流式細胞儀(美國BD Biosciences公司)。
1.2 實驗方法
1.2.1 大鼠BMSCs的培養及收集、濃縮條件培養基 大鼠BMSCs的分離、培養及鑒定見參考文獻[12]。大鼠BMSCs傳至第3代時改用無血清培養基培養,48h后收集上清液,在4℃下3000r/min離心10min,將上清液轉移到可以截留分子量7kD的過濾袋中,4℃環境中使其在PEG 20000作用下濃縮至10×,再經220nm濾器過濾后無菌保存備用。根據實驗設計,對INS-1細胞進行處理時,將濃縮為10×的BMSC-CM分別稀釋為1×、2×、4×BMSCCM加入對應組的INS-1細胞中。
1.2.2 INS-1細胞的處理與分組 以含有TNF-α (30ng/ml)、IL-1β(5ng/ml)、IFN-γ(30ng/ml)的培養基處理INS-1細胞48h,然后加入不同濃度的BMSCCM繼續培養12h,檢測各項指標。實驗分為5組:正常對照組、促炎因子組、1×BMSC-CM組、2×BMSC-CM組、4×BMSC-CM組,各組最終處理時間均為60h。
1.2.3 CCK-8法檢測細胞存活率 INS-1細胞按5×103/孔密度接種于96孔板中,每組設5個復孔。各組干預完成后,吸棄原培養基,每孔加入含10μl CCK-8的新鮮培養基100μl,繼續孵育2h,用酶標儀檢測450nm波長下各孔的吸光度(A)值。
1.2.4 Annexin V-FITC/PI檢測細胞凋亡 各組經相應處理的INS-1細胞用不含EDTA的胰酶消化,收集細胞并用預冷的PBS洗2次,再加入結合緩沖液充分重懸細胞,最后加入Annexin V-FITC和PI試劑室溫避光反應10min,同時設定未處理空白對照、Annexin V-FITC單染、PI單染,用流式細胞儀檢測細胞凋亡情況。
1.2.5 ROS的檢測 各組細胞處理后吸棄培養基,收集胰酶消化后的細胞,無血清培養基洗1次,加入用無血清培養液按1:1000稀釋的DCFH-DA(終濃度為10μmol/L),37℃細胞培養箱內孵育20min。用無血清細胞培養液洗滌細胞3次,以充分去除未進入細胞內的DCFH-DA。用流式細胞儀檢測,激發波長488nm,發射波長535nm。
1.3 統計學處理 采用SPSS 17.0件進行分析,計量資料以±s表示,多組間比較采用單因素方差分析,進一步兩兩比較采用SNK-q檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1 BMSCs形態學表現與表型鑒定 大鼠BMSCs培養至第3代時,細胞多呈長梭形、紡錘形,細胞融合達80%~90%時,呈同心圓樣排列。將培養至第3代的BMSCs消化成單細胞懸液進行免疫熒光染色,流式細胞儀檢測顯示CD11a、CD45呈陰性表達,CD73、CD90、CD105呈陽性表達,符合BMSCs的典型特征(圖1)。
2.2 BMSC-CM對INS-1細胞存活率的影響 采用CCK-8法檢測INS-1細胞存活率,將對照組細胞存活率設為100%,結果顯示,促炎因子組INS-1細胞存活率下降至對照組的75.84%±1.53%(P<0.01);而加入3種濃度(1×、2×、4×)的BMSC-CM后,INS-1細胞的存活率分別升高至79.28%±1.67%(P>0.05)、85.7%±1.43%(P<0.01)、87.7%±2.08%(P<0.01),其中2×BMSC-CM組及4×BMSC-CM組與促炎因子組相比差異有統計學意義(圖2)。

圖1 大鼠BMSCs的形態與表型鑒定Fig.1 Morphology and identification of BMSC phenotypes (scale bar, 500μm)
2.3 BMSC-CM對INS-1細胞凋亡的影響 流式細胞儀檢測結果顯示,與正常對照組(3.90%±0.31%)相比,促炎因子組的INS-1細胞凋亡(早期凋亡+晚期凋亡)率(17.23%±1.77%)明顯增高(P<0.01)。加入BMSC-CM后,隨著濃度增加(1×、2×、4×),INS-1細胞凋亡率呈明顯下降趨勢,分別降至16.34%±1.22%(P>0.05)、11.53%±0.54%(P<0.05)、8.67%±1.59%(P<0.01),變化具有劑量依賴性,但其中1×BMSC-CM組與促炎因子組比較差異無統計學意義,提示BMSC-CM達到一定的有效濃度才能對促炎因子刺激的INS-1細胞起到抗凋亡作用(圖3)。

圖2 BMSC-CM對INS-1細胞存活率的影響Fig.2 Effect of BMSC-CM on cell survival rate of proinflammatory cytokines-treated INS-1 cells
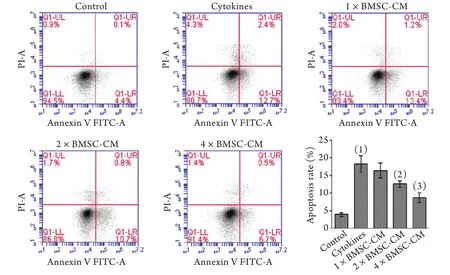
圖3 BMSC-CM對INS-1細胞凋亡的影響Fig.3 Effect of BMSC-CM on the apoptosis of pro-inflammatory cytokines-induced INS-1 cells
2.4 BMSC-CM對INS-1細胞內ROS含量的影響 流式細胞儀檢測結果顯示,與正常對照組(11.8%±1.21%)相比,促炎因子組INS-1細胞內ROS含量(34.3%±0.80%)明顯增加(P<0.01);而加入3種濃度(1×、2×、4×)的BMSC-CM后,INS-1細胞內ROS含量呈明顯下降趨勢,分別降至30.9%±0.99%(P>0.05)、23.73%±1.10%(P<0.01)、17.1%±2.14%(P<0.01),其中2×BMSC-CM組及4×BMSC-CM組與促炎因子組相比差異有統計學意義(P<0.01,圖4)。
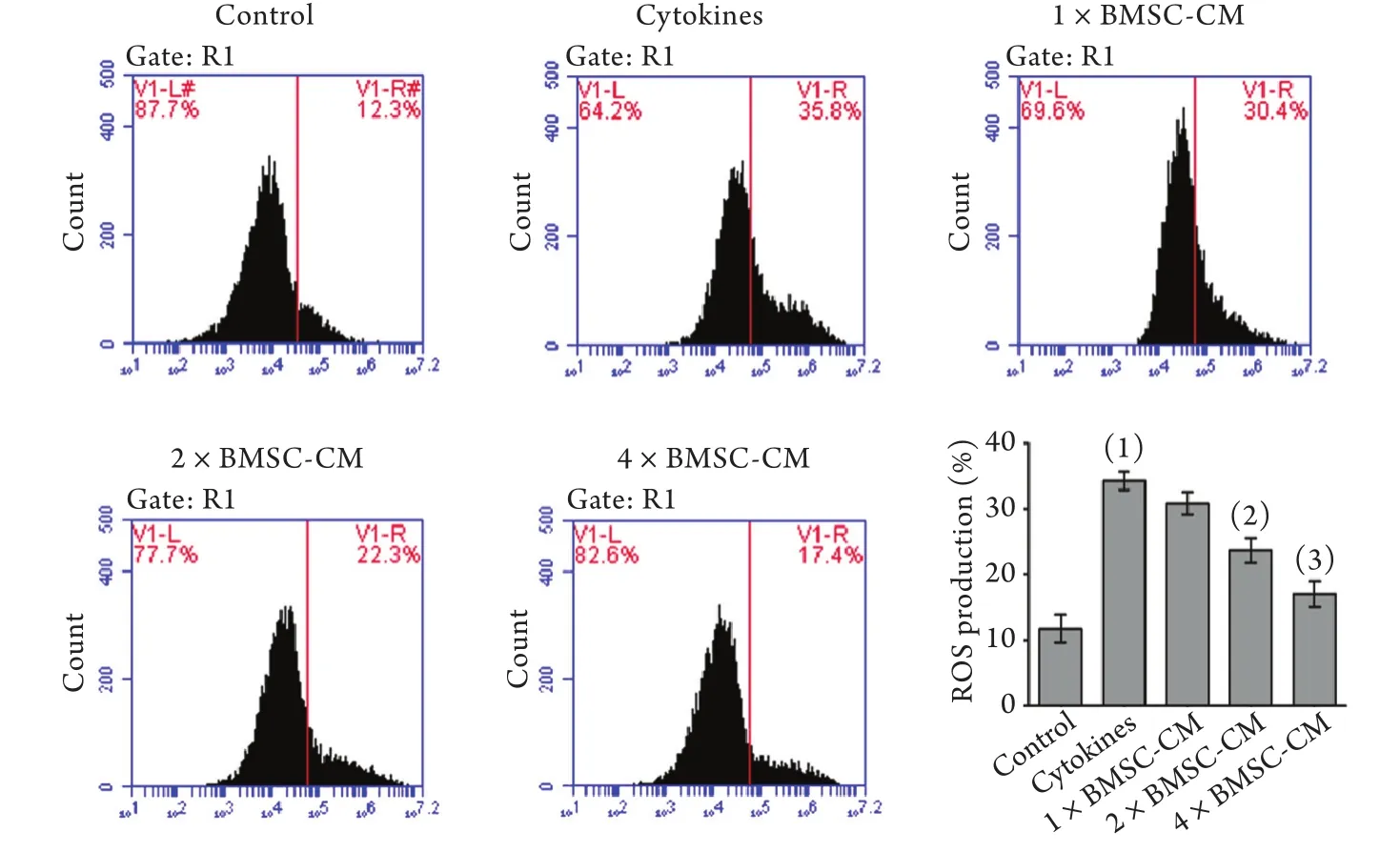
圖4 BMSC-CM對細胞內ROS含量的影響Fig.4 Effect of BMSC-CM on intracellular ROS in pro-inflammatory cytokines-treated INS-1 cells
3 討 論
慢性炎癥是影響2型糖尿病發生和發展的重要因素[8]。長期的慢性炎癥刺激可造成β細胞進行性損傷;TNF-α、IL-1β、IFN-γ等促炎因子可通過NF-κB、JNK等通路對β細胞產生細胞毒作用,引起β細胞凋亡[13]。本實驗中也發現促炎因子組的INS-1細胞存活率明顯下降,細胞凋亡增多。
在許多疾病中,BMSCs都表現出強大的免疫調節及抗炎能力[14]。Ortiz等[15]證實在博來霉素誘導的肺損傷模型中,BMSCs能有效減輕炎癥反應并抑制肺組織纖維化。Han等[16]的研究顯示,在大鼠脊髓損傷模型中,BMSCs可通過削弱TLR4信號通路及降低IL-1β、TNF-α水平來緩解脊髓炎癥反應。Yeung等[17]也發現BMSCs與離體胰島共培養后可明顯抑制促炎因子引起的β細胞凋亡,維持葡萄糖刺激的β細胞胰島素分泌功能。同時,大量研究結果指出BMSCs是通過分泌多種細胞因子發揮細胞保護、抗凋亡、抗炎作用的,如IGF-1、VEGF、HGF、bFGF等[6,18]。本研究應用富含BMSCs分泌因子的條件培養基干預炎癥損傷的INS-1細胞,結果顯示BMSC-CM能有效抑制促炎因子引起的INS-1細胞凋亡,而且隨著BMSC-CM濃度的提高,細胞凋亡率呈明顯下降趨勢,具有劑量依賴性,進一步說明BMSCs可通過分泌效應起到抗炎效果。
值得注意的是,本研究發現BMSC-CM明顯降低了促炎因子環境下INS-1細胞內的ROS水平。有研究表明,促炎因子的刺激可引起細胞內ROS生成增多[19],而胰島β細胞較其他細胞對ROS更為敏感,β細胞內累積的ROS可引起脂質過氧化、線粒體損傷、DNA鏈斷裂等一系列細胞內的異常變化,最終導致細胞凋亡。減少細胞內ROS含量能有效抑制β細胞凋亡[20-21]。因此,我們認為BMSC-CM降低ROS水平很可能是其抑制促炎因子誘導的INS-1細胞凋亡的途徑之一。
BMSCs具有來源廣泛、倫理爭議少等優勢,臨床應用前景廣闊。我們之前已有研究[9]證實BMSCs在治療2型糖尿病時能降低血糖,促進胰島修復,改善胰島素抵抗。本研究以INS-1細胞為研究對象,應用BMSC-CM進行培養進一步發現BMSCs可通過其分泌效應減少促炎因子誘導的INS-1細胞凋亡,為臨床應用BMSCs治療2型糖尿病的機制解析提供了新的理論依據。鑒于BMSCs分泌的物質較多,今后的研究將致力于分析起免疫調節及抗炎作用的具體的細胞因子,并探索能特異性增加這些因子分泌量的培養環境,使BMSCs更高效地應用到2型糖尿病的臨床治療中。
【參考文獻】
[1]Jiang Y, Jahagirdar BN, Reinhardt RL, et al. Pluripotency of mesenchymal stem cells derived from adult marrow[J]. Nature, 2002, 418(6893): 41-49.
[2]Hu S, Pang SG, Cui Y, et al. Osteogenic potential of bone marrow mesenchymal stem cells from streptozotocin-induced diabetic rats[J]. J Shandong Univ (Health Sci), 2013, 51(8): 7-12. [胡蘇, 逄曙光, 崔瑩, 等. 鏈脲佐菌素誘導糖尿病大鼠骨髓間充質干細胞成骨分化[J]. 山東大學學報(醫學版), 2013, 51(8): 7-12.]
[3]Liu DZ, Shi BY, Liu KL, et al. Immunomodulatory effects of bone marrow mesenchymal stem cells derived from homologous recipients in rat after heart transplantation[J]. Med J Chin PLA, 2012, 37(3): 185-189. [劉德忠, 石炳毅, 劉奎利, 等. 受者同系骨髓間充質干細胞對心臟移植大鼠的免疫調節作用[J]. 解放軍醫學雜志, 2012, 37(3): 185-189.]
[4]Mou XH, Zhang L, Zhang Y, et al. Transplantation of bone marrow mesenchymal stem cells improves the ability of learning and memory of a rat model of Alzheimer's disease[J]. J Logist Univ PAPF (Med Sci), 2012, 21(7): 499-502, 484. [牟心紅, 張嶺, 張玥, 等. 骨髓間充質干細胞移植對老年性癡呆大鼠學習和記憶能力的影響[J]. 武警后勤學院學報(醫學版), 2012, 21(7): 499-502, 484.]
增能理論和陸九淵心學各自有兩個核心觀念,增能理論的核心觀念是“權能”和“增強權能”,“增強權能”也被翻譯成“增能”,陸九淵心學的核心觀念是“本心”和“發明本心”。通過比較我們可以發現這四個觀念兩兩之間也存在相似性。
[5]Caplan AI, Dennis JE. Mesenchymal stem cells as trophic mediators[J]. J Cell Biochem, 2006, 98(5): 1076-1084.
[6]Kyurkchiev D, Bochev I, Ivanova-Todorova E, et al. Secretion of immunoregulatory cytokines by mesenchymal stem cells[J]. World J Stem Cells, 2014, 6(5): 552-570.
[7]Donath MY, Shoelson SE. Type 2 diabetes as an inflammatory disease[J]. Nat Rev Immunol, 2011, 11(2): 98-107.
[8]Pickup JC. Inflammation and activated innate immunity in the pathogenesis of type 2 diabetes[J]. Diabetes Care, 2004, 27(3): 813-823.
[9]Ruan H, Hacohen N, Golub TR, et al. Tumor necrosis factoralpha suppresses adipocyte-specific genes and activates expression of preadipocyte genes in 3T3-L1 adipocytes: nuclear factor-kappaB activation by TNF-alpha is obligatory[J]. Diabetes, 2002, 51(5): 1319-1336.
[10]Collier JJ, Fueger PT, Hohmeier HE, et al. Pro- and antiapoptotic proteins regulate apoptosis but do not protect against cytokinemediated cytotoxicity in rat islets and beta-cell lines[J]. Diabetes, 2006, 55(5): 1398-1406.
[11]Donath MY. Targeting inflammation in the treatment of type 2 diabetes: time to start[J]. Nat Rev Drug Discov, 2014, 13(6): 465-476.
[12]Si Y, Zhao Y, Hao H, et al. Infusion of mesenchymal stem cells ameliorates hyperglycemia in type 2 diabetic rats: identification of a novel role in improving insulin sensitivity[J]. Diabetes, 2012, 61(6): 1616-1625.
[13]Dinarello CA, Donath MY, Mandrup-Poulsen T. Role of IL-1beta in type 2 diabetes[J]. Curr Opin Endocrinol Diabetes Obes, 2010, 17(4): 314-321.
[14]Prockop DJ, Oh JY. Mesenchymal stem/stromal cells (MSCs): role as guardians of inflammation[J]. Mol Ther, 2012, 20(1): 14-20.
[15]Ortiz LA, Dutreil M, Fattman C, et al. Interleukin 1 receptor antagonist mediates the antiinflammatory and antifibrotic effect of mesenchymal stem cells during lung injury[J]. Proc Natl Acad Sci U S A, 2007, 104(26): 11002-11007.
[16]Han D, Wu C, Xiong Q, et al. Anti-inflammatory mechanism of bone marrow mesenchymal stem cell transplantation in rat model of spinal cord injury[J]. Cell Biochem Biophys, 2014, [Epub ahead of print].
[17]Yeung TY, Seeberger KL, Kin T, et al. Human mesenchymal stem cells protect human islets from pro-inflammatory cytokines[J]. PLoS One, 2012, 7(5): e38189.
[18]Gnecchi M, He H, Liang OD, et al. Paracrine action accounts for marked protection of ischemic heart by Akt-modified mesenchymal stem cells[J]. Nat Med, 2005, 11(4): 367-368.
[19]Hansen JB, Tonnesen MF, Madsen AN, et al. Divalent metal transporter 1 regulates iron-mediated ROS and pancreatic beta cell fate in response to cytokines[J]. Cell Metab, 2012, 16(4): 449-461.
[20]Maiese K, Morhan SD, Chong ZZ. Oxidative stress biology and cell injury during type 1 and type 2 diabetes mellitus[J]. Curr Neurovasc Res, 2007, 4(1): 63-71.
[21]Kajimoto Y, Kaneto H. Role of oxidative stress in pancreatic beta-cell dysfunction[J]. Ann N Y Acad Sci, 2004, 1011: 168-176.
Effect of bone marrow mesenchymal stem cells-conditioned medium on the apoptosis of INS-1 cells
ZHAO Kun1, HAO Hao-jie2, ZANG Li1, YANG Guo-qing1, LI Xiang2, HAN Wei-dong2, MU Yi-ming1*1Department of Endocrinology,2Laboratory of Molecular Biology, Institute of Basic Medicine, General Hospital of PLA, Beijing 100853, China
*
, E-mail: muyiming@301hospital.com.cn
This work was supported by the 863 Projects of the Ministry of Science and Technology of China (2013AA020105)
ObjectiveTo investigate the effect and mechanism of bone marrow mesenchymal stem cell-conditioned medium (BMSC-CM) on pro-inflammatory cytokines-induced apoptosis of insulinoma cells (INS-1).MethodsThe conditioned medium containing various cytokines and growth factors was collected and condensed from the supernatants of culture medium of BMSC of rats at passage three. After exposed to the medium with a pro-inflammatory cytokines cocktail containing TNF-α, IL-1β and IFN-γ for 48 hours, INS-1 cells were cultured with BMSC-CM in different concentrations for another 12 hours. INS-1 cells were divided into the following five groups: control group, pro-inflammatory cytokines-treated group, 1× BMSC-CM-treated group, 2× BMSC-CM-treated group and 4× BMSC-CM-treated group. The survival rate of INS-1 cells was assessed by CCK8 assay. The incidence of cell apoptosis was measured using Annexin V/PI staining. Intracellular reactive oxygen species (ROS) production was determined with dichlorofluorescein diacetate (DCFH-DA).ResultsCompared with the control group, prolonged exposure to pro-inflammatory cytokines induced significant decrease in the viability of INS-1 cells (75.84%±1.53%) and a great increase in the incidence of cell apoptosis (17.23%±1.77%), and also in intracellular ROS level (34.3%±0.80%) with statistically significant difference (P<0.01). However, BMSC-CM treatment protected INS-1 cells against pro-inflammatory cytokines-induced injury in a dose-dependent manner. Among the BMSC-CM of three different concentrations, 4× BMSC-CM exhibited best protective effects on pro-inflammatory cytokines-treated INS-1 cells, as reflected by increased cell viability (87.7%±2.08%) and significant reduction in the incidence of cell apoptosis (8.67%±1.59%), and also in intracellular ROS production (17.1%±2.14%) with statistically significant difference (P<0.05).ConclusionBMSC-CM protected INS-1 cells against pro-inflammatory cytokines-induced apoptosis, the possible mechanism underlying this effect might be associated with the reduction of intracellular ROS level.
R587.1
A
0577-7402(2015)05-0339-05
10.11855/j.issn.0577-7402.2015.05.01
2015-02-12;
2015-04-02)
(責任編輯:張小利)
國家高技術研究發展計劃(863計劃)(2013AA020105)
趙坤,碩士研究生。主要從事糖尿病干細胞治療的基礎與臨床研究
100853 北京 解放軍總醫院內分泌科(趙坤、臧麗、楊國慶、母義明),基礎醫學所分子生物室(郝好杰、李祥、韓為東)
母義明,E-mail:muyiming@301hospital.com.cn

