骨髓間充質干細胞在神經移植修復大鼠坐骨神經缺損過程中對調節性T 細胞亞群的影響
陳鷗 王建軍
周圍神經缺損是臨床常見的致殘性疾病,其常用治療方法是自體神經移植[1]。但自體神經移植存在一些局限性,包括供區功能障礙、感覺缺失、神經瘤形成以及長距離神經缺損時自體神經來源有限[2-3]。為克服這些缺點,研究者開始關注異體神經移植。但是,異體神經移植需要面臨排斥反應的問題。Hudson 等[4]用化學去細胞神經治療大鼠坐骨神經缺損,未發生強烈的排斥反應,但這種方法的治療效果與自體神經移植比較仍有較大的差距,主要原因在于修復過程中缺少促進神經生長的細胞及相關細胞因子,比如雪旺細胞、神經生長因子等。近年來,很多研究利用去細胞神經和骨髓間充質干細胞(bone marrow derived mesenchymal stem cells,BMSCs)、脂肪間充質干細胞及它們誘導分化的雪旺細胞等種子細胞共同移植修復大鼠坐骨神經缺損,并取 得 了 一 定 的 進 展[5-7]。如Wang 等[8]通 過BMSCs 和去細胞神經聯合移植治療大鼠坐骨神經缺損,取得了優于單純使用去細胞神經的效果。體外研究中發現,BMSCs 和T 細胞共培養后,可以促進調節性T 細胞的分泌和成熟[9-10]。但在利用去細胞神經移植治療神經缺損的過程中,聯合移植BMSCs 對T 細胞亞群有何影響還少有報道。因此,本研究旨在觀察BMSCs 和去細胞神經聯合移植修復大鼠坐骨神經缺損的過程中,大鼠外周血T 細胞亞群的變化,從而確定BMSCs 在此過程中的免疫調節作用。
1 材料和方法
1.1 實驗動物
選擇健康雄性SD 大鼠15 只及雄性Wistar 大鼠15 只,體質量均為150 ~200 g,月齡均為2 個月(均購自溫州醫學院動物實驗中心)。SD 大鼠作為受體,用于制作坐骨神經缺損動物模型及分離雪旺細胞。Wsitar 大鼠作為供體,用于提供去細胞神經。所有實驗方案經溫州醫學院動物倫理委員會批準通過。
1.2 實驗方法
1.2.1 制備去細胞神經
取15 只Wistar 大鼠,10%水合氯醛(上海碧云天公司)腹腔注射麻醉(0.4 mL/100 g),無菌條件下切取約2.0 cm 長的右側坐骨神經共15 條。參照Hudson 等[4]的方法,使用蒸餾水、sulfobetaine-10、sulfobetaine-16 和Triton-200(均購自上海碧云天公司)等依次浸泡萃取,以獲取去細胞神經。
1.2.2 坐骨神經缺損模型的建立及雪旺細胞的分離培養
SD 大鼠常規消毒后手術切取1.5 cm 長的坐骨神經一段,斷端回縮后造成2.0 cm 坐骨神經缺損。同時采用Lao 等[11]的方法分離培養大鼠雪旺細胞,將上述切取的坐骨神經放入含10%胎牛血清(美國Hyclone 公司)的DMEM/F12 培養基(美國Gibco 公司)。清除神經外膜及周圍神經結締組織,仔細地將神經分成單束并剪碎,放入含有0.25%胰蛋白酶和0.03%膠原蛋白酶(美國Sigma 公司)的2 mL PBS 中。37 ℃消化60 min 后,加入DMEM/F12 培養基終止消化,并用200 目篩網過濾。濾出液1 000 ×g離心5 min,即得細胞沉淀,加入DMEM/F12 培養基重懸浮后,將所得細胞以1 ×104個/mL密度種入培養瓶中,常規培養并通過免疫方法鑒定是否為雪旺細胞。
1.2.3 去細胞神經的細胞植入
將鑒定成功的雪旺細胞及大鼠BMSCs(廣州賽業生物有限公司)傳代培養,培養3 代后,用0.25%胰蛋白酶消化后制成密度為1.0 ×107/mL 的雪旺細胞,以備植入。如需同時植入雪旺細胞和BMSCs,則將兩種細胞按等比例混合后制成混合細胞懸液。用25 μL 微量注射器,每隔0.4 mm 向去細胞神經注射2 μL 細胞懸液,將相應細胞植入。處理好的去細胞神經置于含15%胎牛血清和1%青鏈霉素的DMEM/F12 培養基中過夜。
1.2.4 分組和坐骨神經修復方案
將15 只坐骨神經缺損的SD 大鼠隨機分為3 組,每組5 只。去細胞神經組,僅采取單純去細胞神經移植修復缺損;去細胞神經+雪旺細胞組,采用植入雪旺細胞的去細胞神經移植修復缺損;去細胞神經+雪旺細胞+BMSCs 組,采用同時植入雪旺細胞和BMSCs 的去細胞神經移植修復缺損。去細胞神經的植入方法為使用8-0 普羅靈縫線端端吻合去細胞神經的兩端與受體SD 大鼠坐骨神經的2 個斷端。
1.2.5 流式細胞儀檢測調節性T 細胞比例
分別在移植前和移植后3、7、14 d 4 個時間點采集受體SD 大鼠尾靜脈血50 μL,用淋巴細胞分離液(美國eBioscience 公司)分離出外周血單個核細胞。加入CD4-FITC 抗體(美國eBioscience 公司)2 μL及CD25-PE 抗體(美國eBioscience 公司)2 μL,4 ℃避光孵育30 min,用預冷PBS 溶液洗滌細胞,1 000 ×g 離心5 min,去上清液。加入專用破膜固定液(美國eBioscience 公司)1 mL,置于4 ℃冰箱避光孵育30 min,1 000×g 離心5 min,去上清液。加入專用緩沖液(美國eBioscience 公司)1 mL,1 000 ×g 離心5 min,去上清液。加入Foxp3 抗體(美國eBioscience公司)2 mL,輕輕震蕩搖勻后置于4 ℃避光孵育30 min。加入專用Buffer 緩沖液(美國eBioscience公司)1 mL,1 000 ×g 離心5 min,去上清液。加入PBS 緩沖液400 μL 重懸浮細胞,震蕩后進行流式細胞儀(FACSCalibur,美國BD 公司)檢測。
1.3 統計學方法
采用SSPS 16.0 統計學軟件進行數據處理。計量資料以均數±標準差()表示。多組間均數比較采用單因素方差分析,多組間兩兩比較、同組內多個時間點兩兩比較均采用LSD-t 檢驗。P <0.05 為差異具有統計學意義。
2 結 果
如表1 ~3 所示,移植前去細胞神經組、去細胞神經+雪旺細胞組及去細胞神經+雪旺細胞+BMSCs 組受體SD 大鼠CD4+、CD25+及CD4+CD25+Foxp3+T細胞比例差異均無統計學意義(P 均>0.05)。移植后,各組3 種T 細胞比例均呈逐漸上升趨勢,移植后14 d 達到峰值,與移植前、移植后3 d 及移植后7 d 相比,差異均具有統計學意義(P 均<0.05)。移植后14 d,去細胞神經組CD4+、CD25+及CD4+CD25+Foxp3+T 細胞比例分別為(39.9±1.9)%、(9.15 ±0.17)%及(2.37 ±0.09)%;去細胞神經+雪旺細胞組CD4+、CD25+及CD4+CD25+Foxp3+T細胞比例分別為(41.0 ±1.7)%、(10.11 ±0.15)%及(2.47 ±0. 05)%;去細胞神經+ 雪旺細胞組+BMSCs 組CD4+、CD25+及CD4+CD25+Foxp3+T 細胞比例分別為(38.1 ±1.6)%、(8.19 ±0.13)%及(2.79 ±0.12)%,可見移植后14 d 去細胞神經+雪旺細胞+BMSCs 組的CD4+及CD25+T 細胞比例均低于去細胞神經組和去細胞神經+ 雪旺細胞組(P 均<0.05),而CD4+CD25+Foxp3+T 細胞比例高于去細胞神經組和去細胞神經+ 雪旺細胞組(P <0.05)。
表1 采用不同坐骨神經修復方案的三組受體大鼠去細胞神經移植前后CD4 + T 細胞比例
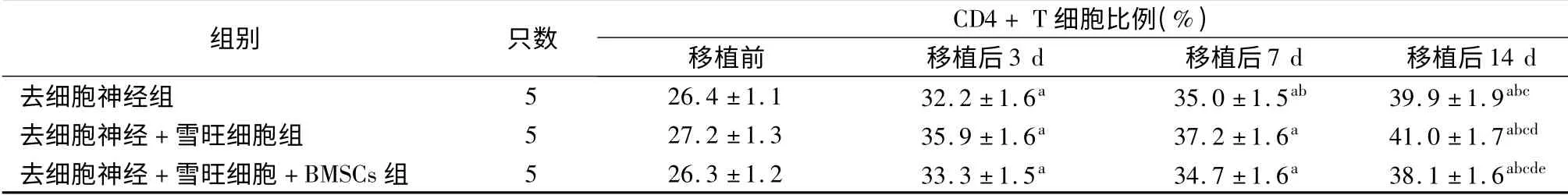
表1 采用不同坐骨神經修復方案的三組受體大鼠去細胞神經移植前后CD4 + T 細胞比例
注:與移植前相比,aP <0.05;與移植后3 d 相比,bP <0.05;與移植后7 d 相比,cP <0.05;與去細胞神經組相比,dP <0.05;與去細胞神經+雪旺細胞組相比,eP <0.05
表2 采用不同坐骨神經修復方案的三組受體大鼠去細胞神經移植前后CD25 + T 細胞比例
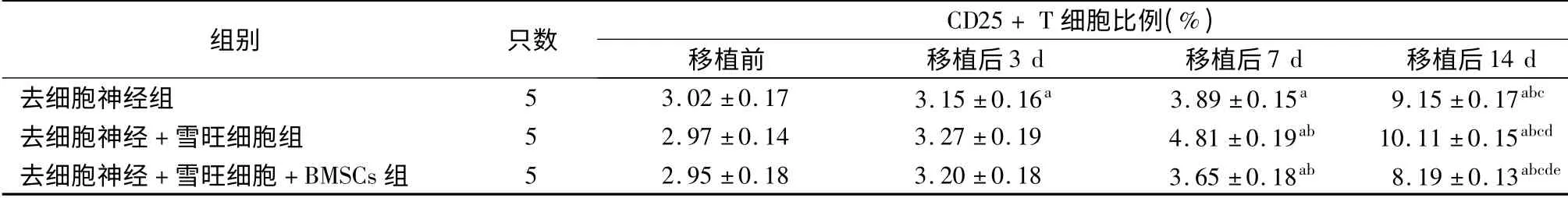
表2 采用不同坐骨神經修復方案的三組受體大鼠去細胞神經移植前后CD25 + T 細胞比例
注:與移植前相比,aP <0.05;與移植后3 d 相比,bP <0.05;與移植后7 d 相比,cP <0.05;與去細胞神經組相比,dP <0.05;與去細胞神經+雪旺細胞組相比,eP <0.05
表3 采用不同坐骨神經修復方案的三組受體大鼠去細胞神經移植前后CD4 +CD25 +Foxp3 + T 細胞比例
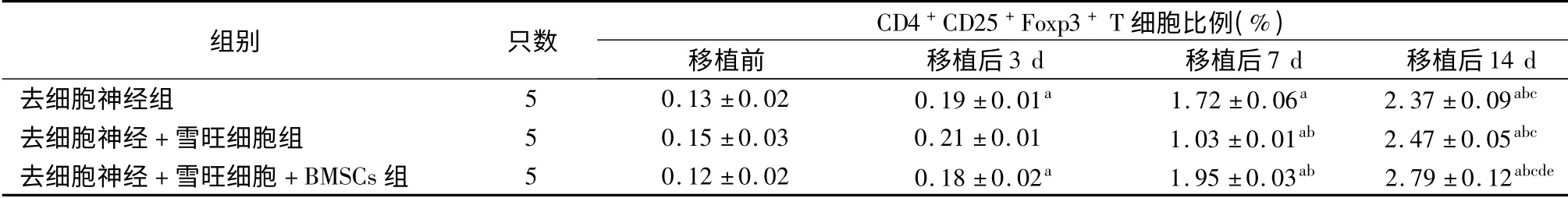
表3 采用不同坐骨神經修復方案的三組受體大鼠去細胞神經移植前后CD4 +CD25 +Foxp3 + T 細胞比例
注:與移植前相比,aP <0.05;與移植后3 d 相比,bP <0.05;與移植后7 d 相比,cP <0.05;與去細胞神經組相比,dP <0.05;與去細胞神經+雪旺細胞組相比,eP <0.05
3 討 論
化學萃取去細胞神經免疫原性較低,是目前實驗研究應用較多的組織工程學神經支架,但是化學萃取去細胞神經支架單獨用于修復周圍神經缺損的效果較自體神經仍有不足,因此在化學去細胞神經中種植種子細胞,共同促進周圍神經再生,成為了研究熱點。目前,大多數研究為向去細胞神經中種植自體雪旺細胞。雪旺細胞是神經細胞周圍的重要組成細胞,對于神經細胞(包括胞體、軸突及樹突)再生有重要作用。研究認為自體雪旺細胞植入異體去細胞神經橋接物修神經缺損有利于早期軸突再生及再生軸突數量的增加[12]。但是利用自體組織分離培養出種子細胞及其衍生細胞會造成供區的組織損傷,且來源有限。而利用異體組織分離培養種子細胞及其衍生細胞雖來源充足且廣泛,但無法消除抗原性,可能引發神經移植后免疫排斥反應;而應用免疫抑制劑又存在引起各種全身性并發癥的風險。
神經移植后的免疫排斥反應主要由T 細胞介導。T 細胞按照功能可分為輔助性T 細胞、效應性T 細胞以及調節性T 細胞。CD4+T 細胞是具有細胞免疫功能的效應性T 細胞,CD25+T 細胞為活化的CD4+T 細胞,二者均代表免疫激活狀態,反映免疫排斥反應的發生。CD4+CD25+Foxp3+T 細胞是調節性T 細胞,是T 淋巴細胞中唯一起負性免疫調節作用的亞群[13-14],但其調節機制尚不完全明確。目前認為可能和以下途徑有關:(1)細胞接觸途徑,通過細胞表面膜分子CTLA-4 和TGF-β 與效應性T 細胞相應配體結合,抑制效應性T 細胞分泌IL-2;(2)通過分泌TGF-β 等抑制性細胞因子,發揮負性免疫調節作用;(3)通過下調抗原提呈物質如MHC-Ⅰ,MHC-Ⅱ等,間接發揮負性免疫調節作用;(4)通過分泌顆粒蛋白酶B 和穿孔素導致NK 細胞和CD8+T 細胞的凋亡[15-18]。
綜上所述,在向去細胞神經植入雪旺細胞的同時,如能同時植入調節T 細胞免疫的種子細胞,則可能減輕或解決神經移植后的免疫排斥反應問題。BMSCs 是由骨髓中分離培養的干細胞,能多向分化為多種細胞。由于BMSCs 表面不表達或者低表達MHC-Ⅱ,因此在自體移植時免疫原性較低[19]。近年來,English 等[20]研究發現將BMSCs 和CD4+T 細胞共培養后,CD4+T 細胞Foxp3 表達升高,將CD4+T細胞重新純化分離培養后,其Foxp3 表達下降,這意味著BMSCs 可能具有增加調節性T 細胞比例的作用。現已有研究在去細胞神經移植修復坐骨神經的過程中應用BMSCs,并且發現同時植入BMSCs,神經修復的效果更佳[21],但其機制僅涉及BMSCs 的營養因子提供功能,并未涉及免疫調節功能。實際上,關于BMSCs 植入在神經修復過程中是否發揮免疫調節作用,還少有報道。本研究中,接受神經移植后,各組受體SD 大鼠的CD4+、CD25+及CD4+CD25+Foxp3+T 細胞比例呈增高趨勢,提示移植物具有一定的免疫原性,引起了免疫激活。去細胞神經+雪旺細胞+BMSCs 組CD4+及CD25+T 細胞的比例最低,但CD4+CD25+Foxp3+T 細胞的比例最高,因此,我們認為在神經移植過程中,BMSCs 具有增強免疫耐受的作用,其機制為BMSCs 增加調節性T 細胞比例從而抑制免疫活性。
1 Flores AJ,Lavernia CJ,Owens PW. Anatomy and physiology of peripheral nerve injury and repair[J]. Am J Orthop (Belle Mead NJ),2000,29(3):167-173.
2 de Ruiter GC,Spinner RJ,Yaszemski MJ,et al. Nerve tubes for peripheral nerve repair[J]. Neurosurg Clin N Am,2009,20(1):91-105
3 Kemp SW,Walsh SK,Midha R. Growth factor and stem cell enhanced conduits in peripheral nerve regeneration and repair[J].Neurol Res,2008,30(10):1030-1038.
4 Hudson TW,Zawko S,Deister C,et al. Optimized acellular nerve graft is immunologically tolerated and supports regeneration[J].Tissue Eng,2004,10(11-12):1641-1651.
5 Jesuraj NJ,Santosa KB,Newton P,et al. A systematic evaluation of Schwann cell injection into acellular cold-preserved nerve grafts[J].J Neurosci Methods,2011,197(2):209-215.
6 Carriel V,Garrido-Gomez J,Hernandez-Cortes P,et al. Combination of fibrin-agarose hydrogels and adipose-derived mesenchymal stem cells for peripheral nerve regeneration[J]. J Neural Eng,2013,10(2):026022.
7 Wang Y,Zhao Z,Ren Z,et al. Recellularized nerve allografts with differentiated mesenchymal stem cells promote peripheral nerve regeneration[J]. Neurosci Lett,2012,514(1):96-101.
8 Wang D,Liu XL,Zhu JK,et al. Repairing large radial nerve defects by acellular nerve allografts seeded with autologous bone marrow stromal cells in a monkey model[J]. J Neurotrauma,2010,27(10):1935-1943.
9 English K,French A,Wood KJ. Mesenchymal stromal cells:facilitators of successful transplantation[J]. Cell Stem Cell,2010,7(4):431-442.
10 Griffin MD,Ritter T,Mahon BP. Immunological aspects of allogeneic mesenchymal stem cell therapies[J]. Hum Gene Ther,2010,21(12):1641-1655.
11 Lao Jie,Hung LK ,GU Yudong ,et al. Modified Schwann cell culture from adult SD rats[J]. Chin J Hand Surg,1999,15(2):44-46.
12 王建云. 化學萃取同種異體神經種植自體雪旺細胞實驗研究[D]. 廣州:中山大學,2002.
13 Nik TN,Hambly BD,Sullivan DR,et al. Forkhead box protein 3:essential immune regulatory role[J]. Int J Biochem Cell Biol,2008,40(11):2369-2373.
14 Hanidziar D,Koulmanda M. Inflammation and the balance of Treg and Th17 cells in transplant rejection and tolerance[J]. Curr Opin Organ Transplant,2010,15(4):411-415.
15 Jenabian MA,Seddiki N,Yatim A,et al. Regulatory T cells negatively affect IL-2 production of effector T cells through CD39/adenosine pathway in HIV infection[J]. PLoS Pathog,2013,9(4):e1003319.
16 Ishigame H,Zenewicz LA,Sanjabi S,et al. Excessive Th1 responses due to the absence of TGF-beta signaling cause autoimmune diabetes and dysregulated Treg cell homeostasis[J]. Proc Natl Acad Sci U S A,2013,110(17):6961-6966.
17 Baecher-Allan C,Wolf E,Hafler DA. MHC class Ⅱexpression identifies functionally distinct human regulatory T cells[J]. J Immunol,2006,176(8):4622-4631.
18 Beeston T,Smith TR,Maricic I,et al. Involvement of IFN-gamma and perforin,but not Fas/FasL interactions in regulatory T cellmediated suppression of experimental autoimmune encephalomyelitis[J]. J Neuroimmunol,2010,229(1-2):91-97.
19 Trento C,Dazzi F. Mesenchymal stem cells and innate tolerance:biology and clinical applications[J]. Swiss Med Wkly,2010,140:w13121.
20 English K,Ryan JM,Tobin L,et al. Cell contact,prostaglandin E(2)and transforming growth factor beta 1 play non-redundant roles in human mesenchymal stem cell induction of CD4 + CD25(High)forkhead box P3 + regulatory T cells[J]. Clin Exp Immunol,2009,156(1):149-160.
21 丁昌榮,楊選影,韓迎秋,等. 富血小板血漿誘導骨髓間充質干細胞結合化學萃取去細胞神經修復坐骨神經缺損[J]. 中國組織工程研究與臨床康復,2010,14(27):4946-4950.

