甲狀旁腺激素相關蛋白研究進展
吳素珍,李加林
(1.贛南醫學院 生物化學與分子生物學教研室,江西 贛州 341000;2.贛南醫學院 天然藥物化學教研室,江西 贛州 341000)
?
甲狀旁腺激素相關蛋白研究進展
吳素珍1,李加林2
(1.贛南醫學院 生物化學與分子生物學教研室,江西 贛州 341000;2.贛南醫學院 天然藥物化學教研室,江西 贛州 341000)
甲狀旁腺激素相關蛋白(parathyroid hormone-related protein,PTHrP)是由多種組織細胞分泌的一種活性分子,具有廣泛的生物學功效,參與多種器官的生長發育,能促進乳腺癌、前列腺癌、非小細胞肺癌的浸潤和轉移,亦是骨溶解最重要的調節因子之一。隨著科學研究的進步,不斷有PTHrP新功能被發現,本文綜述近年來有關PTHrP的生物學功能的研究。
甲狀旁腺激素相關蛋白;生物學功能;研究進展
1 PTHrP及其受體
甲狀旁腺激素相關蛋白(parathyroid hormone-related protein,PTHrP)可表達于皮膚、骨髓、腦、心血管、甲狀腺、甲狀旁腺和骨等多種組織,主要以自分泌或旁分泌的形式發揮作用,最早于1987年由腎、肺及乳腺癌細胞中分離提取,與甲狀旁腺激素(parathyroid hormone,PTH)有一定的同源性,且通過相同的受體即PTH1型受體(PTH1R)發揮相似的生物學作用[1-2],因此得名。人類基因組DNA定位于12號染色體短臂上,其基因長度約15 kb,編碼PTHrP的cDNA主要包括9個外顯子、7個內含子、3個啟動子和多種剪接方法,經剪接c末端產生3種不同的原始翻譯產物,其氨基酸長度分別為139、141和173[3]。
PTHrP由于mRNA的可變性剪接產生一系列的分泌形式,因此有多種相應的受體存在[4],與中部和羧基端結合的受體目前研究還比較少,是否與PTH的N-端為同一受體也未明確。目前研究較多的是與氨基末端結合的受體,該受體與PTH或PTHrP的親和力幾乎相同,稱為PTH1R,主要分布在骨骼和腎臟組織中,屬G蛋白偶聯受體超家族中B亞族成員,結構較為復雜,其長度超22kb,含有15個外顯子和14個內含子,有7個跨膜結構、4個胞外區和4個胞內區,胞外區協同穿膜區的螺旋結構,共同參與配體的結合[5]。PTHrP與受體結合后,通過激活細胞內腺苷酸環化酶-cAMP-蛋白激酶A與磷脂酶C-胞質鈣離子-蛋白激酶C2條信號途徑發揮生物學作用[6-7]。PTHrP氨基端1~36區是PKA活化所必需的,它與PTH1R間存在多位點的接觸,涉及PTHrP(1-36)中23、27、28、33四個氨基酸位點。PTHrP對PKC的激活位點有2個,分別位于28~34區和107~111區。雖然PTH與PTHrP均可結合PTH1型受體,但前者誘導cAMP持續激活,后者只誘導cAMP短暫激活[8]。
Qiu T等[9]首次報道PTH/PTHrPI型受體(PTH1R)與TGFβⅡ型受體形成復合體的新功能,從而導致TGFβⅡ型受體-PTH/PTHrPI型受體復合體的內吞,最終降低了細胞對TGFβ和PTH的敏感性。說明TGFβ信號通路和PTH/PTHrP信號通路在骨組織相互拮抗。
2 PTHrP與骨代謝
PTHrP最初由惡性高鈣血癥中分離并鑒定,由于PTHrP與PTH對其靶細胞包括軟骨細胞有許多共同的功能,往往很難將它們的作用區分開來。因此,不少研究者在探討它們的功能時經常將2者放在一起研究。
2.1 PTH/PTHrP對成骨細胞增殖與分化的影響 PTH/PTHrP在骨代謝中具有促進骨形成和骨吸收的雙重作用,這2種作用主要由PKA和PKC信號傳導通路介導,并通過對成骨細胞和破骨細胞的功能調節來實現。體外實驗表明,短脈沖PTH及N-末端PTHrP多肽類可促進未融合成骨細胞的增殖,但對于高密度的成骨細胞的增殖則表現出抑制作用。這種雙重效應與細胞周期蛋白D1和幾種細胞周期抑制因子如p27的變化是一致的[10-11]。有研究表明,PTH在骨合成代謝中主要起凋亡抑制作用。每天給予成年小鼠一定劑量PTH,不久后就能觀察到股骨的干骺端成骨細胞凋亡有所下降。與此相反,持續給予PTH刺激則對成骨細胞的凋亡沒有影響[12-13]。PTHrP基因遭到破壞的小鼠,則表現出骨質量減少,骨的形成下降,這可能與成骨細胞的凋亡數目增加有關[14-15]。
體內外研究均表明PTH/PTHrP的短暫作用會使得成骨細胞的Runx2無論在蛋白水平還是mRNA水平都升高[16-18]。Runx2是一個重要的促進間葉細胞向成骨細胞家族轉化的轉錄因子。在未分化或分化不完全的成骨細胞中PTHrP的表達高于分化成熟的成骨細胞,從這一點也證明PTHrP對成骨細胞的分化具有一定的作用[19-20]。而且,間歇性地給予PTH/PTHrP刺激使得骨鈣蛋白表達上調,骨鈣蛋白是成骨細胞后期分化因子,在血漿中可以檢測到并且可以作為骨形成的標志[21]。Leafier D等[22]研究表明PTH/PTHrP可促進骨小梁表面的襯里細胞向成骨 細胞發生表型轉換,恢復成骨細胞的功能。
2.2 PTH/PTHrP對破骨細胞的功能調節 破骨細胞中存在PTH1R,有研究表明PTH可直接作用于破骨細胞,通過PKA與PKC傳導通路的共同作用誘導破骨細胞產生酸性物質促進骨吸收,但PTH對破骨細胞的調控仍需要成骨源性細胞的存在[23]。成骨細胞受PTH/PTHrP刺激后,還可分泌IL-6,IL-11,MCF等溶骨性細胞因子來活化破骨細胞。其中PTH/PTHrP對IL-6的作用機制研究最為深入。有研究表明,PTH對IL-6的轉錄調節啟動子區位于-224/+11序列。用佛波醇酯(phorbalester)抑制PKC的活性后,PTH上調IL-6 mRNA表達的能力顯著下降,而PKA的阻滯劑Rb-c AMP并不影響PTH(1-34)和PTHrP(1-34)對IL-6的誘導效應[24]。
2.3 PTH/PTHrP對骨形成的臨床研究 PTHrP從20世紀90年代開始應用于臨床試驗。Everhart-Caye M等[25]對志愿者持續靜脈輸注PTHrP(1-36),首先發現PTHrP(1-36)與PTH(1-34)對人體具有相同的作用,即大劑量持續應用可以引起高鈣血癥、磷酸尿、刺激腎小管重吸收鈣。低劑量、間歇性皮下注射PTH能促進骨形成已得到大量臨床試驗證實,并且得到美國FDA認可作為骨質疏松的治療藥物,于是學者們開始研究以同樣的給藥方法,觀察PTHrP是否具有與PTH相同的作用,甚至更好的效果。有學者[26]對13名健康的絕經后婦女皮下注射合成的人PTHrP(1-36),劑量分別為1.64 μg/(kg·d)、3.28 μg/(kg·d)及 6.56 μg/(kg·d),2周后受試者血鈣、血磷無明顯變化,反映骨形成的指標骨鈣素及堿性磷酸酶升高,其升高程度與PTH治療2周的結果相似,但反映骨吸收的指標N端肽及脫氧吡啶啉卻明顯下降,出現了骨形成與骨吸收的解偶聯現象,與PTH完全不同,這可能是由于2者的半衰期相似而藥代動力學存在差異,PTHrP(1-36 )在血中的峰值出現在皮下注射后的15 min,PTH則在給藥后30~45 min出現,PTHrP吸收速度比PTH快,也許PTHrP還存在未被發現的方式抑制骨吸收或間接激活破骨細胞抑制因子;因此有研究認為PTHrP只選擇性地刺激骨形成,不激活甚至降低骨吸收過程,是一種優于PTH的純粹的骨形成促進劑[27]。PTHrP有著非同一般的應用前景。
3 PTHrP在糖尿病中的作用
體內血糖平衡主要由胰島素和胰高血糖素控制,糖尿病時通常出現胰島β細胞損傷,從而影響胰島素的分泌和血糖控制。近年來發現了很多可促進胰島β細胞分化的細胞因子,其中甲狀旁腺激素相關蛋白PTHrP備受矚目,因為人類胰島的β細胞在分泌胰島素時可同時分泌PTHrP,并表達PTH I型受體[28]。臨床研究發現,II型糖尿病患者血糖及PTHrP的血清含量均明顯上升,正常對照組中PTHrP和血糖呈正相關[29]。在原代培養的小鼠胰島β細胞及β細胞系MIN6中,PTHrP可促進胰島素分泌,同時胰島素的mRNA水平也顯著提高[30]。有研究證實,成年小鼠分別按40、80、160 μg/kg皮下注射PTHrP(1-36),均可促進β細胞增殖,80、160 μg/kg組還可提高葡萄糖耐量,且無高鈣血癥、β細胞肥大或死亡等副作用。因此,目前不少研究者認為PTHrP多肽片段在糖尿病的治療方面頗有前景[31-32]。
4 PTHrP在糖尿病腎病中的作用
目前,PTHrP在糖尿病腎臟疾病(diabetic kidney disease,DKD)中的作用還知之甚少,PTHrP和PTHIR在腎臟組織中廣泛表達,并參與腎功能的調節。PTHrP可參與調節腎血流量和腎小球濾過率,以及調節腎小球系膜細胞、腎小管上皮細胞的增殖[33]。糖尿病腎臟疾病、急性腎功能不全和梗阻性腎病等均發現PTHrP水平增高,但原因和作用機制尚不清楚[34]。有研究發現[35],鏈脲佐菌素誘導的糖尿病小鼠腎臟組織PTHrP和PTHIR的蛋白水平在2~8周后顯著增高。用PTHrP(1-36)處理系膜細胞、足細胞24 h可促進細胞增殖,72 h則誘導細胞肥大,以上結果提示PTHrP可能參與了糖尿病腎臟疾病的發病過程。
5 PTHrP與惡性腫瘤
PTHrP在正常組織和腫瘤組織如鱗癌、乳腺癌、腎癌、前列腺癌、結腸癌及口腔癌中均有分泌,但在腫瘤組織中呈持續大量分泌趨勢。
5.1 PTHrP在乳腺癌骨轉移中的表達及意義 乳腺癌是女性最常見的惡性腫瘤之一,近年來發病率逐漸上升且趨于年輕化。骨是乳腺癌常見的遠處轉移部位之一,晚期乳腺癌患者約80%發生骨轉移,骨轉移一旦發生,預后較差,5年生存率僅為20%。乳腺癌易發生骨轉移是由于骨組織為乳腺癌細胞的侵襲行為提供了合適的生長環境,在此過程中,乳腺癌細胞分泌的甲狀旁腺激素相關蛋白(PTHrP)被認為是促進骨質溶解的主要因子。研究發現,PTHrP在乳腺增生癥中基本不表達,在無骨轉移的乳腺癌中表達明顯低于伴有骨轉移的原發乳腺癌以及骨轉移性乳腺癌。提示PTHrP可能參與乳腺癌的惡性轉化并與乳腺癌骨轉移有關[36]。然而,Henderson MA等[37]研究發現PTHrP高表達提示預后較好,并認為PTHrP的產生能夠降低乳腺癌的浸潤和轉移,并改善乳腺癌患者的預后。因此PTHrP在乳腺癌的發生發展中的作用仍無定論,有待于進一步研究。
5.2 PTHrP與口腔癌 在侵襲性腫瘤和惡性腫瘤中均能檢測到PTHrP,PTHrP可通過調節表皮生長因子受體信號通路來促進口腔癌惡化。PTHrP mRNA在靜息期的口腔癌細胞中表達很豐富,表皮生長因子(EGF)可通過ERK和p38 MAPK來刺激口腔癌細胞中PTHrP表達上調。RNA干擾PTHrP以及使用EGF受體抑制劑AG1478后,口腔癌細胞的增殖、遷移與侵襲均受到抑制。而且,AG1478和PTHrP基因敲除聯合治療對惡性腫瘤表現出協同抑制作用,而使用重組PTHrP后,這種抑制作用又會逆轉,細胞的運動能力增強。由此可見,EGF可通過激活下游的ERK與p38MAPK促使口腔癌細胞中PTHrP表達上調,進一步研究發現高表達的PTHrP又可作用于EGF信號通路的下游分子ERK促進細胞增殖、遷移與侵襲,這將為口腔癌的治療提供一個新的靶點。口腔癌細胞中EGF與PTHrP之間的協同作用如圖1[38]所示:
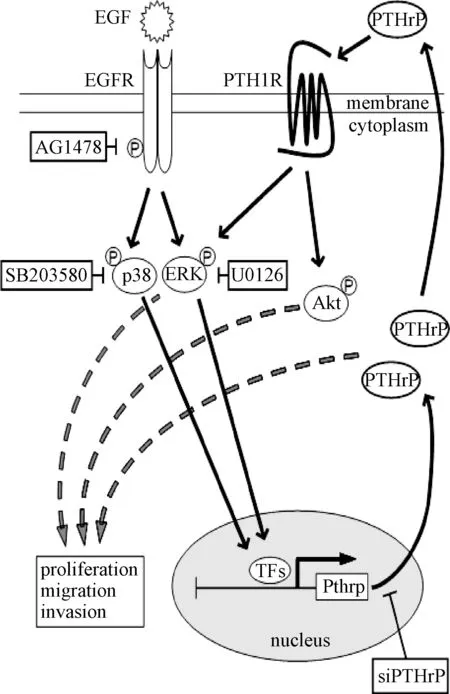
圖1 EGF與PTHrP之間協同效應模式圖Fig.1 Scheme of the PTHrP and EGF signaling in oral cancer cells
5.3 PTHrP在結腸癌中的作用 PTHrP通過α6β4整合素依賴方式激活Rac1來促進結腸癌細胞的遷移,浸潤。在人類結腸癌組織與細胞系中均有PTHrP表達。Rac1鳥苷三磷酸酶能夠增強結腸癌細胞的遷移與浸潤。在結腸癌細胞中PTHrP的表達與Rac1活性呈正相關。敲除α6β4后發現,PTHrP介導的Rac1活性升高現象消除[39]。在PTHrP過表達的結腸癌細胞系中,細胞的存活、遷移與浸潤能力提高,并且Akt的表達升高。PTHrP會導致細胞發生形態學上的改變,PTHrP過表達的細胞則會長出一些長的突出物,同時還會使Akt激活,糖原合成酶激酶(glycogen synthase kinase,GSK)失活。這表明PTHrP介導的α6β4整合素上調可能會激活 PI3-K 通路從而導致結腸癌細胞的遷移,浸潤與存活能力提高[40]。
5.4 PTHrP對前列腺癌的影響 PTHrP對前列腺癌的生長,發育,發展及遠端轉移也有一定的作用[41]。PTHrP 可以提高前列腺癌細胞中醛酮還原酶的表達[42]。近年來又有研究發現[43],PTHrP對骨癌細胞的粘附、遷移與浸潤能力有一定的調節作用。一直以來,PTHrP在腫瘤中的作用研究比較多,這里將不一一窮盡。
6 PTHrP是一個新的TGF-β誘導凋亡的調節物
有學者在對人類2種肝癌細胞株Hep3B and HuH-7進行研究后發現:TGF-β可以誘導PTHrP的mRNA蛋白質表達上調,PTHrP的分泌也增加,而PTHrP基因敲除或者中和掉分泌的PTHrP后,TGF-β誘導的凋亡現象受到抑制,值得一提的是TGF-β誘導的PTHrP表達是Smad3依賴性的。從這個角度來說PTHrP還具有腫瘤抑制活性[44],為抗腫瘤研究工作提供了新視野。
7 PTHrP在心血管疾病中的作用
PTHrP存在于整個心血管系統及平滑肌豐富的器官,如膀胱、子官、胃、小腸等處,是一類新的多功能肽。目前認為,PTHrP不僅是一種心血管調節肽,具有舒張血管和調節血壓的作用,而且在心血管系統發育方面也有著重要作用,PTHrP還是腎小管、胎盤、乳腺上皮細胞鈣轉運的一種調節因子[45]。
PTHrP的心血管作用特征主要是其降血壓效應。在對動脈管壁機械性牽拉、動脈血壓升高、血管緊張素Ⅱ的反應中,血管平滑肌中的PTHrP水平被上調。事實上,PTHrP在很多動脈血管床中能引起舒張作用,包括腎動脈系統、冠脈循環、肺脈管系統、腸系膜血管系統及中樞神經系統血管等,這種作用可能部分是由血管平滑肌細胞腺苷酸環化酶的激活和一氧化氮(NO)的產生所導致[46-47]。
8 結語
PTHrP及其受體廣泛分布于人體的各種組織,通過旁分泌或自分泌方式,對組織器官的發生、生長及分化過程發揮調節作用。PTHrP在骨細胞代謝,惡性腫瘤及心血管疾病中的作用研究比較多。PTHrP在骨代謝中具有促進骨形成和骨吸收的雙重作用。大部分研究都認為PTHrP可以促進腫瘤細胞的增殖,遷移,與侵襲,被認為是一種不好的細胞因子,然而,也有研究持相反的意見,PTHrP高表達的癌癥患者預后比PTHrP正常表達或低表達的癌癥患者預后效果好,并且還認為PTHrP高表達會降低乳腺癌的浸潤和轉移。在心血管方面,PTHrP可以促進血管平滑肌舒張,降低血壓。而且,PTHrP可以促進β細胞增殖,被認為在糖尿病和的治療方面頗有前景。還有學者認為PTHrP可能參與了糖尿病腎臟疾病的發病過程。總之,PTHrP廣泛分布于人體的各種組織,功能也多樣化,還需要進一步深入研究。
[1] Okazaki M,Ferrandom S,Vilardaga JP,et al.Prolonged signaling at the parathyroid hormone receptor by peptide ligands targeted to a specific receptor conformation[J].Proc Natl Acad Sci USA,2008,105(43):16525-16530.
[2] Wong MH,Stockier MR,Pavlakis N.Bisphosphonates and other bone agents for breast cancer[R].Cochrane Database Syst Rev,2012,15(2):3474.
[3] Li JR,Karaplis AC,Huang DC,et al.PTHrP drives breast tumor in innitiation,progression,and metastasis in mice and is a potential therapy target[J].J Clin Invest,2011,121(12):4655-4669.
[4] 李劍,魏啟幼.PTH/PTHrP對骨代謝調節機制的研究進展[J].國外醫學·生理、病理科學與臨床分冊,2004,24(1):54-57.
[5] 徐進,榮海欽.甲狀旁腺激素相關蛋白促進骨形成[J].國外醫學·骨科學分冊,2005,26(4):242-244.
[6] Guo J,Song L,Liu M,et al.Activation of a Non-cAMP/PKA Signaling Pathway Downstream of the PTH/PTHrP Receptor Is Essential for a Sustained Hypophosphatemic Response to PTH Infusion in Male Mice[J].Endocrinology,2013,154(5):1680-1689.
[7] Ogawa S,Kobri H,Ohashi N,et al.Angiotension Ⅱ Type I receptor blockers reduce urinary angiotensinogen excretion and the levels of uninry markers of oxidative strieness and inflammation in patients with type 2 diabetic nephrpathy [J]. Biomark insights,2009,23(4):97-102.
[8] Ferrandom S,Feinstein TN,Castro M,et al.Sustained cyclic AMP production by parathyroid homone receptor endocytosis[J].Nat Chem Biol,2009,5(10):734-742.
[9] Qiu T,Wu X,Zhang F,et al.TGF-beta typeⅡreceptor phosphorylates PTH receptor to integrate bone remodeling signaling [J].Nat Cell Biol,2010,12(3):224-234.
[10] Datta NS,Abou-Samra AB.PTH and PTHrP signaling in osteoblasts[J].Cell Signal,2009,21(8):1245-1254.
[11] Datta NS,Pettway GJ,Chen C,et al.Cyclin D1 as a target for the proliferative effects of PTH and PTHrP in early osteoblastic cells[J].J Bone Miner Res,2007,22(7):951-964.
[12] Jilka RL.Molecular and cellular mechanisms of the anabolic effect of intermittent PTH[J].Bone,2007,40(6):1434-1446.
[13] Bellido T,Ali AA,Plotkin LI,et al.Proteasomal degradation of Runx2 shortens parathyroid hormone-induced anti-apoptotic signaling in osteoblasts.A putative explanation for why intermittent administration is needed for bone anabolism[J].J Biol Chem,2003,278(50):50259-50272.
[14] Miao D,Li J,Xue Y,et al.Parathyroid hormone-related peptide is required for increased trabecular bone volume in parathyroid hormone-null mice[J].Endocrinology,2004,145(8):3554-3562.
[15] Toribio RE,Brown HA,Novince CM,et al.The midregion,nuclear localization sequence,and C terminus of PTHrP regulate skeletal development,hematopoiesis,and survival in mice[J].FASEB J,2010,24(6):1947-1957.
[16] Lozano D,de Castro LF,Dapia S,et al.Role of parathyroid hormone-related protein in the decreased osteoblast function in diabetes-related osteopenia[J].Endocrinology,2009,150(5):2027-2035.
[17] de Castro LF,Lozano D,Dapia S,et al.Role of the N- and C-terminal fragments of parathyroid-hormone-related protein as putative therapies to improve bone regeneration under high glucocorticoid treatment[J].Tissue Eng Part A,2010,16(4):1157-1168.
[18] de Castro LF,Lozano D,Portal-Nunez S,et al.Comparison of the skeletal effects induced by daily administration of PTHrP (1-36) and PTHrP (107-139) to ovariectomized mice[J].J Cell Physiol,2012,227(4):1752-1760.
[19] Suda N,Gillespie MT,Traianedes K,et al.Expression of parathyroid hormone-related protein in cells of osteoblast lineage[J].J Cell Physiol,1996,166(1):94-104.
[20] Martinez P,Esbrit P,Rodrigo A,et al.Age-related changes in parathyroid hormone-related protein and vascular endothelial growth factor in human osteoblastic cells[J].Osteoporos Int,2002,13(11):874-881.
[21] Horwitz MJ,Tedesco MB,Gundberg C,et al.Short-term,high-dose parathyroid hormone-related protein as a skeletal anabolic agent for the treatment of postmenopausal osteoporosis[J].J Clin Endocrinol Metab,2003,88(2):569-575.
[22] Leafier D,Swecney M,Kellerman L,et al.Modulation of osteogenic cell ultrastracture by RS-23581,an analog of human parethyroid hormone(PTH)- related peptide-(1-34),and bovine PTH(1-34) [J].Endocrinology,1995,136( 8):3624 - 3631.
[23] Uy HL,Guise TA,De La Mata J,et al.Effects of parathyroid hormone (PTH)-related protein and PTH on osteoclasts and osteoclast precursors in vivo[J].Endocrinology,1995,136(8):3207-3212.
[24] Huang YF,Harrison JR,Lorenzo JA,et al.Parathyroid hormone induces interleukin - 6 heterogeneous nuclear and messenger RNA expression in murine calvarial organ cultures [J].Bone,1998,23 ( 4):327- 332.
[25] Everhart-Caye M, Inzucchi SE, Guinness-Henry J,et al.Parathyroid hormone (PTH)-related protein(1-36) is equipotent to PTH(1-34) in humans[J].J Clin Endocrinol Metab,1996,81(1):199-208.
[26] Plotkin H,Gundberg C,Mitnick M,et al.Dissociation of bone formation from resorption during 2-week treatment with human parathyroid hormone-related peptide-(1-36) in humans: potential as an anabolic therapy for osteoporosis[J].J Clin Endocrinol Metab,1998,83(8):2786-2791.
[27] Esbrit P,Alcaraz MJ.Current perspectives on parathyroid hormone (PTH) and PTH-related protein (PTHrP) as bone anabolic therapies[J].Biochem Pharmacol,2013,85(10):1417-1423.
[28] Takahata M,Awad HA,O’Keefe RJ,et al.Endogenous tissue engineering:PTH therapy for skeletal repair [J].Cell Tissue Res,2012,347:545-552.
[29] Sho R,Halabe A,Aberbuh E,et al.PTHrP and insulin levels following oral glucose and calcium administration [J].Eur J Intern Med,2006,17(6):408-411.
[30] Legakis I,Mantouridis T.Positive correlation of PTH-related peptide with glucose in type 2 diabetes[J].Exp Diabetes Res,2009:291027.
[31] Legakis I.The role of parathyroid hormone-related protein (PTHrP) in the pathophysiology of diabetes mellitus[J].Mini Rev Med Chem,2009,9(6):717-723.
[32] Guthalu KN,Joshi-Gokhale S,Harb G,et al.Parathyroid hormone-related protein enhances human ss-cell proliferation and function with associated induction of cyclin-dependent kinase 2 and cyclin E expression[J].Diabetes,2010,59(12):3131-3138.
[33] Bosch RJ,Ortega A,Izquierdo A,et al.A transgenic mouse model for studying the role of the parathyroid hormone-related protein system in renal injury[J].J Biomed Biotechnol,2011,2011:290874.
[34] Izquierdo A,Lopez-Luna P,Ortega A,et al.The parathyroid hormone-related protein system and diabetic nephropathy outcome in streptozotocin-induced diabetes[J].Kidney Int,2006,69(12):2171-2177.
[35] Romero M,Ortega A,Izquierdo A,et al.Parathyroid hormone-related protein induces hypertrophy in podocytes via TGF-beta(1) and p27(Kip1):implications for diabetic nephropathy[J].Nephrol Dial Transplant,2010,25(8):2447-2457.
[36] Ortega A,Romero M,Izquierdo A,et al.Parathyroid hormone-related protein is a hypertrophy factor for human mesangial cells:Implications for diabetic nephropathy[J].J Cell Physiol,2012,227(5):1980-1987.
[37] Hendeson MA,Danks JA, Slavin JL,et a1.Parathyroid hormone related protein localization in breast cancer predict improved prognosis [J].Cancer Res,2006,66 ( 4 ) :2250-2256.
[38] Yamada T,Tsuda M,Ohba Y,et al.PTHrP promotes malignancy of human oral cancer cell downstream of the EGFR signaling[J].Biochem Biophys Res Commun,2008,368(3):575-581.
[39] Mula RV,Bhatia V,Falzon M.PTHrP promotes colon cancer cell migration and invasion in an integrin α6β4-dependent manner through activation of Rac1 [J].Cancer Lett,2010,298(1):119-127.
[40] Shen X, Mula RV, Evers BM, et al.Increased cell survival, migration, invasion, and Akt expression in PTHrP-overexpressing LoVo colon cancer cell lines[J].Regul Pept,2007, 141(1-3): 61-72.
[41] Tsigelny I, Burton DW, Sharikov Y, et al.Coherent expression chromosome cluster analysis reveals differential regulatory functions of amino-terminal and distal parathyroid hormone-related protein domains in prostate carcinoma[J].J Biomed Biotechnol,2005, 2005(4): 353-363.
[42] Downs TM, Burton DW, Araiza FL, et al.PTHrP stimulates prostate cancer cell growth and upregulates aldo-keto reductase 1C3[J].Cancer Lett,2011, 306(1): 52-59.
[43] Mak IW, Turcotte RE, Ghert M.Parathyroid hormone-related protein (PTHrP) modulates adhesion, migration and invasion in bone tumor cells[J].Bone,2013, 55(1): 198-207.
[44] Cao Y, Zhang W, Gao X, et al.PTHrP is a novel mediator for TGF-beta-induced apoptosis[J].Regul Pept,2013, 184: 40-46.
[45] Zhou J, Li YS, Nguyen P, et al.Regulation of vascular smooth muscle cell turnover by endothelial cell-secreted microRNA-126: role of shear stress[J].Circ Res,2013, 113(1): 40-51.
[46] Fritsch S, Lindner V, Welsch S, et al.Intravenous delivery of PTH/PTHrP type 1 receptor cDNA to rats decreases heart rate, blood pressure, renal tone, renin angiotensin system, and stress-induced cardiovascular responses[J].J Am Soc Nephrol,2004, 15(10): 2588-2600.
[47] Tomaschitz A, Ritz E, Pieske B, et al.Aldosterone and parathyroid hormone: a precarious couple for cardiovascular disease[J].Cardiovasc Res,2012, 94(1): 10-19.
(編校:王儼儼)
Research advances of parathyroid hormone-related protein
WU Su-zhen1, LI Jia-lin2
(1.College of Basic Medicine, Gannan Medical University, Ganzhou 341000, China; 2.College of Pharmacy, Gannan Medical University, Ganzhou 341000, China)
Parathyroid Hormone-related Protein(PTHrP) is a polyhormone secretory protein secreted by a variety of tissues and cells that plays fundamental roles in the growth and development of various organs, promotes migration and invasion in breast cancer, prostate cancer and non-small cell lung cancer and also plays a key role in osteolysis.With the development of scientific research, many unknown functions of the parathyroid hormone-related protein will be uncovered.
parathyroid hormone-related protein; biological function; review
贛南醫學院校級課題(YB201418)
吳素珍,女,博士,講師,研究方向:細胞信號轉導、糖尿病腎病分子機制,E-mail:wusuzhen2005@126.com。
R962
A
1005-1678(2015)07-0157-05

