豬多能性干細胞研究進展與前瞻
薛冰華 劉忠華
(東北農業大學胚胎工程實驗室,哈爾濱 150030)
豬多能性干細胞研究進展與前瞻
薛冰華 劉忠華
(東北農業大學胚胎工程實驗室,哈爾濱 150030)
多能干細胞具有能夠分化為多種特定細胞類型的能力,主要包括胚胎干細胞、胚胎生殖細胞和誘導多能干細胞。豬因其在免疫學、形態學和生理結構上與人有著諸多類似的特點,正逐漸成為人類異種移植、細胞治療和再生醫學研究的理想生物學模型。然而,目前對豬多能干細胞的來源、特征及機制認識的不足直接阻礙了該研究領域的發展。因此,將對豬多能性干細胞的種類、鑒定標準、研究進展、亟待解決的問題進行詳細地闡述,并在此基礎上對豬多能性干細胞的研究進行了展望,希望為該研究領域的科研人員提供參考。
豬;多能干細胞;胚胎干細胞;誘導多能干細胞;胚胎生殖細胞
干細胞是一類能夠自我更新,功能還未特化的細胞群,在特定的條件下,該類細胞可以分化為執行機體特殊功能的效應細胞,它們廣泛存在于機體生長發育過程中的多數組織和器官中。這些特性使得干細胞被廣泛應用于臨床疾病治療中,它可以為細胞治療和再生醫學提供種子細胞;其次,由于藥物篩選和安全檢驗不能直接以人為試驗對象,所以干細胞也是藥物研究的理想模型;最后,干細胞也在基礎研究、物種繁育等方面有著獨特的應用前景和優越性。然而,由于倫理道德、免疫排斥和生物安全性等問題,人的干細胞無法直接應用于臨床治療,這就要求科研工作者必需尋找合適的動物來代替人進行臨床前研究。
豬在免疫學、形態學和生理結構上與人有著諸多類似的特點,飼養和繁殖也較為簡單,因此被作為動物疾病模型廣泛地應用于人類疾病的臨床研究中。同時,豬作為大型家畜在畜牧業生產上有著舉足輕重的地位,這都使得豬的干細胞、特別是多能干細胞的建立尤為重要。然而,由于諸多因素的限制,豬多能性干細胞的建立雖然取得了較大的進展,但仍然面臨著建系難度大、成功率較低、多能性較差和分化能力弱等諸多問題,很多技術和理論問題也仍需要進一步探索,如豬多能性干細胞最適的培養體系、維持多能性的調控機制以及影響其獲得核移植和嵌合體動物的機理等。因此,本文將對豬多能性干細胞的分類、鑒定標準、研究進展、目前存在的問題及可能的解決辦法進行詳細論述。
1 多能性干細胞的定義和分類
來源于不同發育階段和不同組織器官的干細胞在基因表達調控、表觀遺傳狀態、體外增殖和分化潛能等方面都存在較大的差異。根據干細胞增殖能力和分化潛能的不同,可以把干細胞分為全能干細胞、多能干細胞和專能干細胞。全能干細胞是指除了能夠發育出構成機體的3個胚層的各類細胞外,還能發育出支持胎兒在母體存在所必需的胎盤組織和臍帶,最原始的全能干細胞就是哺乳動物精子和卵子結合后形成的受精卵,它在前幾個分裂過程中產生的卵裂球均為全能干細胞,提取這些卵裂球中的任意一個移植到子宮,均可發育出一個完整的生命體。多能干細胞是指能夠無限增殖且具有分化潛能的一類干細胞,它能夠產生內胚層、中胚層和外胚層來源的各種類型細胞,多能干細胞主要包括來源于囊胚內細胞團的胚胎干細胞、來源于原始生殖細胞的胚胎生殖細胞、來源于畸胎癌的胚胎腫瘤細胞和體外重編程得到的誘導多能性干細胞。專能干細胞是指只能分化為一種或密切相關的幾種類型的細胞的干細胞,主要包括造血干細胞、骨髓間充質干細胞和表皮干細胞在內的各類成體干細胞[1]。
胚胎干細胞、胚胎生殖細胞和誘導多能性干細胞這三種干細胞在生物學特性、免疫學、多能性和發育潛能等方面擁有相似的特征,均具有形成生殖系嵌合體的能力,這使得多能性干細胞在基礎研究領域(包括基因功能研究、細胞分化和機體發育機制的研究等)、臨床治療(包括藥物研發和再生醫學領域的研究等)和動物生產方面(包括核移植、嵌合體和轉基因動物的生產與研究等)具有獨特的應用前景和優越性。因此,后文將重點論述這三種多能性干細胞在豬中的研究現狀。
胚胎干細胞(Embryonic stem cells,ESCs)最早是在1981年由Evans[2]和Martin[3]兩家實驗室首次從植入前的小鼠囊胚內細胞團中分離培養獲得,其后對其它物種相繼建立了ESCs。Thomson等[4,5]在1995年和1998年分別建立了第一株非人靈長類的ESCs和人的ESCs,所獲得的ESCs可在免疫缺陷鼠體內形成畸胎瘤。Li等[6-8]三家實驗室在2008年同時宣布他們通過使用大鼠源的Lif(Leukemia inhibitory factor)、添加小分子抑制GSK3和MEK途徑以及使用一種來源于成年大鼠皮下連接組織的L細胞系作為飼養層可高效而穩定的得到大鼠ESCs。在各物種ESCs建立的同時,胚胎生殖細胞和誘導多能性干細胞也隨著ESCs培養條件的成熟逐漸被建立起來。胚胎生殖細胞(Embryonic germ cells,EGCs)最早是在1992年由Resnick等[9]和Matsui等[10]通過體外培養小鼠的原始生殖細胞(Primordial germ cells,PGCs)分離得到的,該細胞系有著與小鼠胚胎干細胞類似的生物學特性,其多能性及生殖系嵌合能力后被Stewart等[11]證實。誘導多能性干細胞(Induced pluripotent stem cells,iPSCs)最早是在2006年由Takahashi 和Yamanaka[12]首次將4個與多能性相關的基因(Oct4、Sox2、c-Myc和Klf4)利用逆轉錄病毒載體導入到小鼠成纖維細胞中,通過篩選Fbx15(多能性標志分子)陽性的細胞最終獲得的具有小鼠胚胎干細胞某些特性的多能性干細胞系,Yamanaka將其命名為“誘導性多能干細胞”(圖1)。iPSCs技術的誕生深化了人們對細胞多能性和基因組重編程的認知,并且為解決臨床治療引起的免疫排斥問題和人胚胎干細胞基礎研究所面臨的倫理學困境帶來了曙光,因此該技術自誕生就引發了iPSCs研究的熱潮,各實驗組迅速圍繞iPSCs建系過程中的篩選標記、載體系統、轉錄因子、源頭細胞類型和促進效率提高的化合物篩選等方面展開廣泛的研究。
2 豬類胚胎干細胞的研究進展
豬ESCs建系的研究始于1990年,建系過程主要依賴于小鼠等物種ESCs建系的經驗,所獲得的干細胞系均無法與小鼠ESCs媲美,主要表現是體內形成畸胎瘤的能力、體外自發或誘導向三胚層分化的能力以及生殖系嵌合的能力均較弱。因此,豬ESCs多被命名為“豬類胚胎干細胞”(豬類ESCs)。本文將從豬類ESCs的來源、培養體系和其它影響建系的因素三方面對豬類ESCs研究進展進行闡述(表1)。
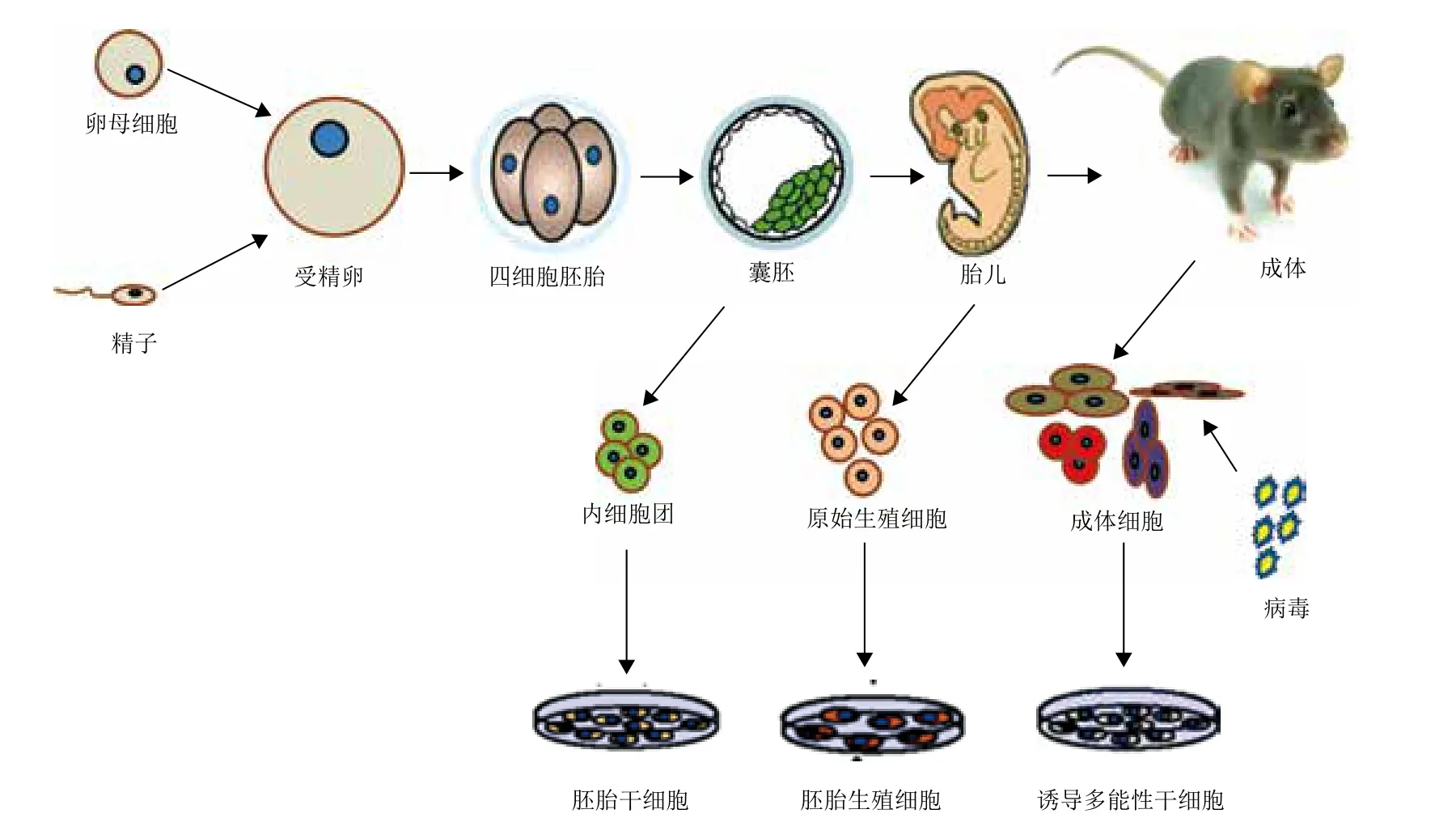
圖1 多能干細胞的起源(以小鼠為例)
首先,細胞來源方面主要包括以下三部分內容。第一,關于豬類ESCs建系所使用的源頭細胞的種類:豬類ESCs主要來源于囊胚內細胞團,雖然Li等[13]和Chen等[14]分別用4-8細胞階段的胚胎和桑葚胚作為材料進行建系,但由于胚胎貼壁率低、原代克隆無法形成等原因均未獲得穩定傳代的豬類ESCs。所以,迄今為止的豬類ESCs均來源于囊胚。第二,關于豬類ESCs建系所使用的囊胚的種類:2000年以前的研究主要使用體內囊胚作為實驗材料,在這之后開始使用體外受精囊胚、孤雌囊胚和核移植囊胚作為實驗材料[15-17]。Miyoshi等[18]用體外受精囊胚分離得到上皮樣的豬類ESCs,該細胞系用做核移植供體細胞后,能支持重構胚發育到囊胚階段。Telugu等[19]和Haraguchi等[20]利用iPSCs技術和小分子體系成功地從體外受精囊胚中分離得到能夠穩定傳代的內細胞團樣的豬類ESCs。Kim等[21]、Park等[22]和Jung等[23]用孤雌囊胚得到了類ESCs。Tan等[24]用不同天數的核移植胚胎獲得了類ESCs,但所獲得細胞系多能性狀態較差。第三,關于豬類ESCs建系所使用的囊胚的時期:從豬囊胚中分離ESCs的最佳時期并不確定,前期研究主要集中在5.5-9 d,各時期的囊胚均能夠分離得到類ESCs。Chen等[14]對比了不同發育階段胚胎的建系效率,結果表明早期孵化囊胚更適合建系,建系效率達21%,這與筆者實驗室的研究結果相符(結果暫未發表)。對此,筆者認為將胚胎按照天數劃分不能夠充分反應胚胎的發育狀況,各實驗室對胚胎天數的計算也存在差異。這種最佳時間的不確定性是真正制約豬ESCs分離的原因之一,只有對豬胚胎早期發育時程進行系統地研究和劃分,找到最適于多能性干細胞分離的時期才有可能分離得到真正的豬ESCs。
其次,培養體系方面。早期研究中使用的培養體系大多源于小鼠ESCs的培養體系,主要成分包括基礎培養液DMEM、谷氨酰胺、巰基乙醇、非必需氨基酸、抗生素和胎牛或新生牛血清[25-29]。Moore等[30,31]在培養體系中添加了Lif,但其最終研究結果表明人源Lif無法維持豬類ESCs的多能性狀態。近期研究中,各實驗組不約而同地將bFGF添加到豬ESCs培養體系中,Hall等[32]的研究也表明bFGF更利于豬類ESCs的分離培養。值得注意的是,Telugu等[19]和Haraguchi等[20]利用iPSCs技術和小分子體系分別建立了豬類ESCs,所獲得的細
胞系可以在體外長期培養并有一定的分化能力,兩個實驗組的培養體系中添加的細胞因子分別是Lif和bFGF,這表明所獲得的細胞系完全依賴著兩條不同的細胞信號通路,即LIF-STAT3和FGF-MEK。
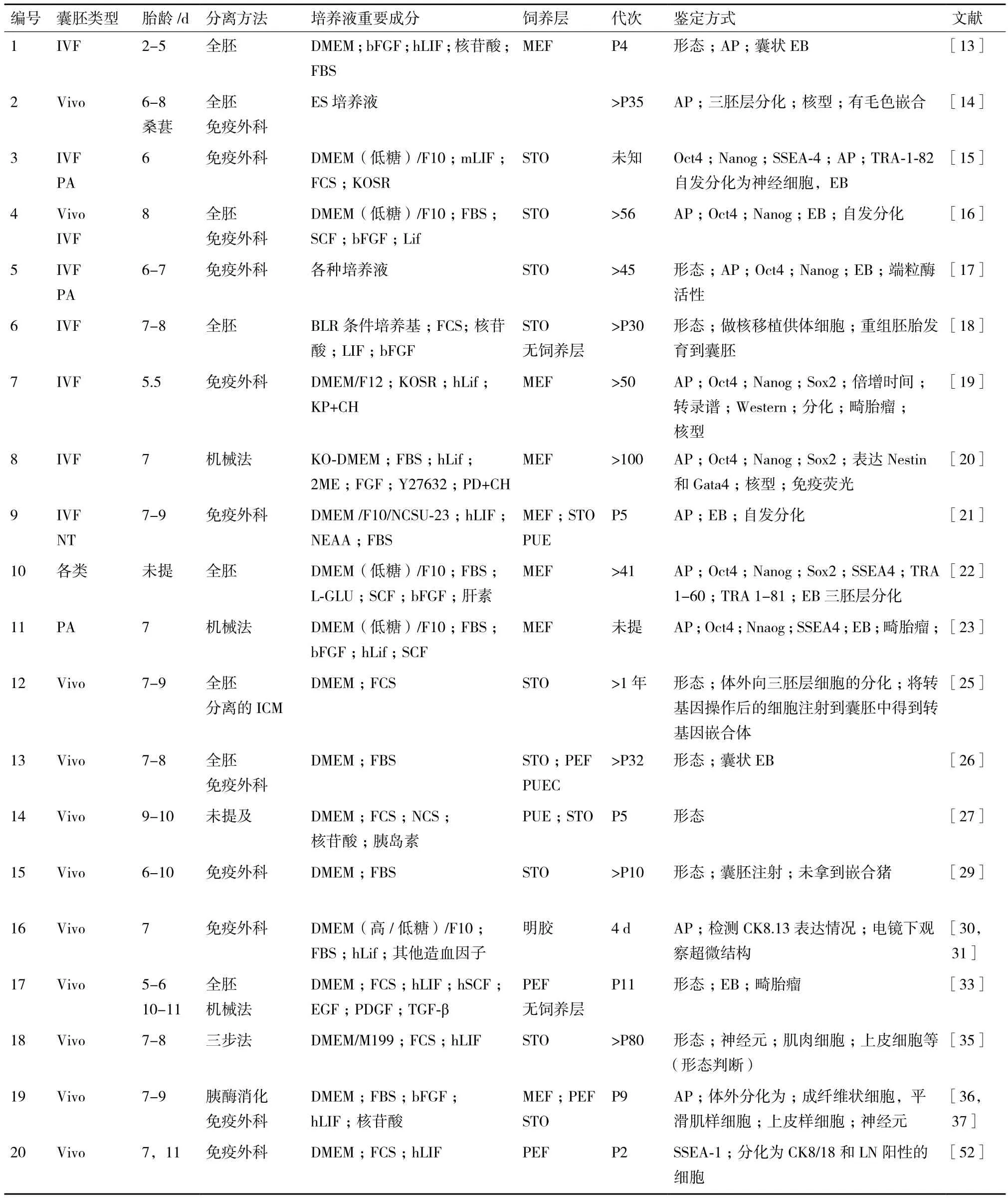
表1 豬類胚胎干細胞研究進展
最后,影響建系因素方面。影響豬類ESCs建系的主要因素包括飼養層細胞的類型、胚胎接種方式和傳代方法。第一,飼養層細胞的選擇,目前被廣泛使用的是小鼠胎兒成纖維細胞(Mouse embryonic fibroblasts,MEF)和STO(永生化的小鼠胚胎成纖維細胞系)細胞系,此外,很多實驗室也使用豬胎兒成纖維細胞(Porcine embryonic fibroblasts,PEF)和豬子宮上皮細胞(Porcine uterus epithelial,PUE)作為飼養層細胞。第二,胚胎接種方式,ESCs建系過程中胚胎的接種形式包括內細胞接種和全胚接種[18,21,33]兩種方法,內細胞團的分離方法主要有免疫外科手術法[16,34]、三步法[35]和酶消化法[36,37]。第三,傳代方法,各實驗組主要使用的是胰酶消化或機械切割的方法進行傳代,但由于已建成的豬類ESCs在形態上更接近人ESCs,胰酶并不適合此類細胞的消化,因此在人ESCs傳代過程中使用的膠原酶和Dispase被逐漸應用在豬ESCs的分離和傳代上,同時筆者前期研究結果顯示將機械切割法和膠原酶消化法結合起來更適于豬類ESCs的分離和培養(結果暫未發表)。
筆者認為,目前的研究結果顯示豬的多能性調控基因和調控網絡與小鼠、大鼠以及人可能是不同的,簡單地照搬其它物種的ESCs建系經驗是不可行的。在諸多影響豬ESCs建系的因素中,能夠維持豬ESCs多能性狀態的培養液和細胞信號通路是兩個主要因素,這就要求我們必需解析豬早期胚胎發育過程中關鍵基因的表達模式及相關基因的調控網絡,以便發現豬多潛能調控與小鼠等物種的區別,從而促進真正的豬多能性干細胞的建立。
3 豬誘導多能干細胞的研究進展
豬胚胎干細胞建系進展緩慢,因此,豬iPSCs的誕生和發展迅速地推動了豬在藥物研發、疾病臨床研究以及轉基因動物生產中的應用,本文對豬iPSCs的起源、轉錄因子、提高效率的化合物、載體系統和源頭細胞的研究進展做詳細論述(表2)。
3.1 關于豬iPSCs的起源
豬iPSCs最早建于2009年,Wu等[38]以豬耳緣成纖維細胞和骨髓間充質細胞作為源頭細胞,應用可誘導(Tet-on/off系統)慢病毒表達系統向源頭細胞內轉入人源六因子(Oct3/4、Sox2、Klf4、c-Myc、Nanog和Lin28)成功地將豬體細胞重編程為iPSCs。同年,Esteban等[39]和Ezashi等[40]分別使用經典四因子(Oct3/4、Sox2、Klf4和c-Myc)逆轉錄病毒誘導體系和慢病毒誘導體系成功地建立豬iPSCs。三個實驗組所獲得的iPSCs細胞系呈堿性磷酸酶陽性、表達多能性基因、核型正常、能夠形成擬胚體和畸胎瘤,但成瘤時間存在較大差異。值得注意的是,所獲得的細胞系細胞形態存在較大差異,表達不同的細胞表面標記物,Wu等[38]的iPSCs表達SSEA-3和SSEA-4,Ezashi等[40]的iPSCs表達SSEA-1,這可能是由不同的轉錄因子和培養體系導致的。
3.2 豬iPSCs轉錄因子的篩選
2012年,Liu等[41-43]三個實驗組分別利用豬源兩因子(Oct4和Klf4)和鼠源經典四因子在添加Lif的條件下誘導獲得了豬iPSCs,所獲得的細胞系形態和多能性都更傾向于小鼠ESCs,能夠向三胚層分化,這暗示了Na?ve狀態的豬iPSCs細胞系依賴的信號通路可能與小鼠胚胎干細胞依賴的信號通路一樣,即均依賴LIF-STAT信號通路。同年,Montserrat等[44]報道了在無飼養層的條件下利用三因子(Sox2、Klf4和c-Myc)將豬成纖維細胞重編程為iPSCs。另外,筆者實驗室[45]發現,在我們現有的培養體系下[46],Tbx3和Nr5a2在豬iPSCs誘導的過程中起到了重要作用,這兩因子不僅能提高重編程的效率,甚至單獨過表達Nr5a2因子就能使豬胎兒成纖維細胞重編成為豬iPSCs,這提示我們必需重新審視各轉錄因子在豬體細胞重編程及胚胎發育過程中是否起到至關重要的作用。
3.3 在豬iPSCs提高效率的化合物篩選方面
Liu等[41]獲得的兩因子豬iPSCs需要添加組蛋白去乙酰化抑制劑(Sodium Butyrate)、TGF-β信號通路抑制劑(SB431542)、ERK/MAPK信號通路抑制劑(PD0325901)、GSK3-β抑制劑(CHIR99021)和cAMP信號通路促進劑(Forskolin)這5個小分子化合物才能維持多能性狀態,但此時,iPSCs外源基因仍然不沉默,同時我們可以發現當誘導因子減少時則需要更多的外部條件來維持豬iPSCs的多能性。Telugu等[19]和Zhang等[47]分別用內細胞團和脂肪干細胞作為源頭細胞,在持續表達外源基因的同時添加小分子(Kenpaullone,KP和CHIR99021)才能維持豬iPSCs的多能性。Gu等[46]通過改善基礎培養液的配方,在添加小分子的基礎上獲得了能夠長期傳代的形態類似于小鼠ESCs的豬iPSCs,轉換后的豬iPSCs兩條X染色體處于激活狀態,能夠獲得畸胎瘤。以上團隊所得到的實驗結果均表明添加小分子化合物可以促進豬iPSCs的獲得,但2014年Petkov等[48]發現在豬iPSCs建立過程中添加2i(PD0325901,PD和CHIR99021,CH)會降低豬iPSCs的建系效率和多能性,這與Rodriguez等[49]在豬植入前胚胎的研究結果相近,說明曾在鼠類建系過程中起到重要作用的小分子抑制劑(PD和CH)是否真的適用于豬iPSCs的建立還有待進一步考證。
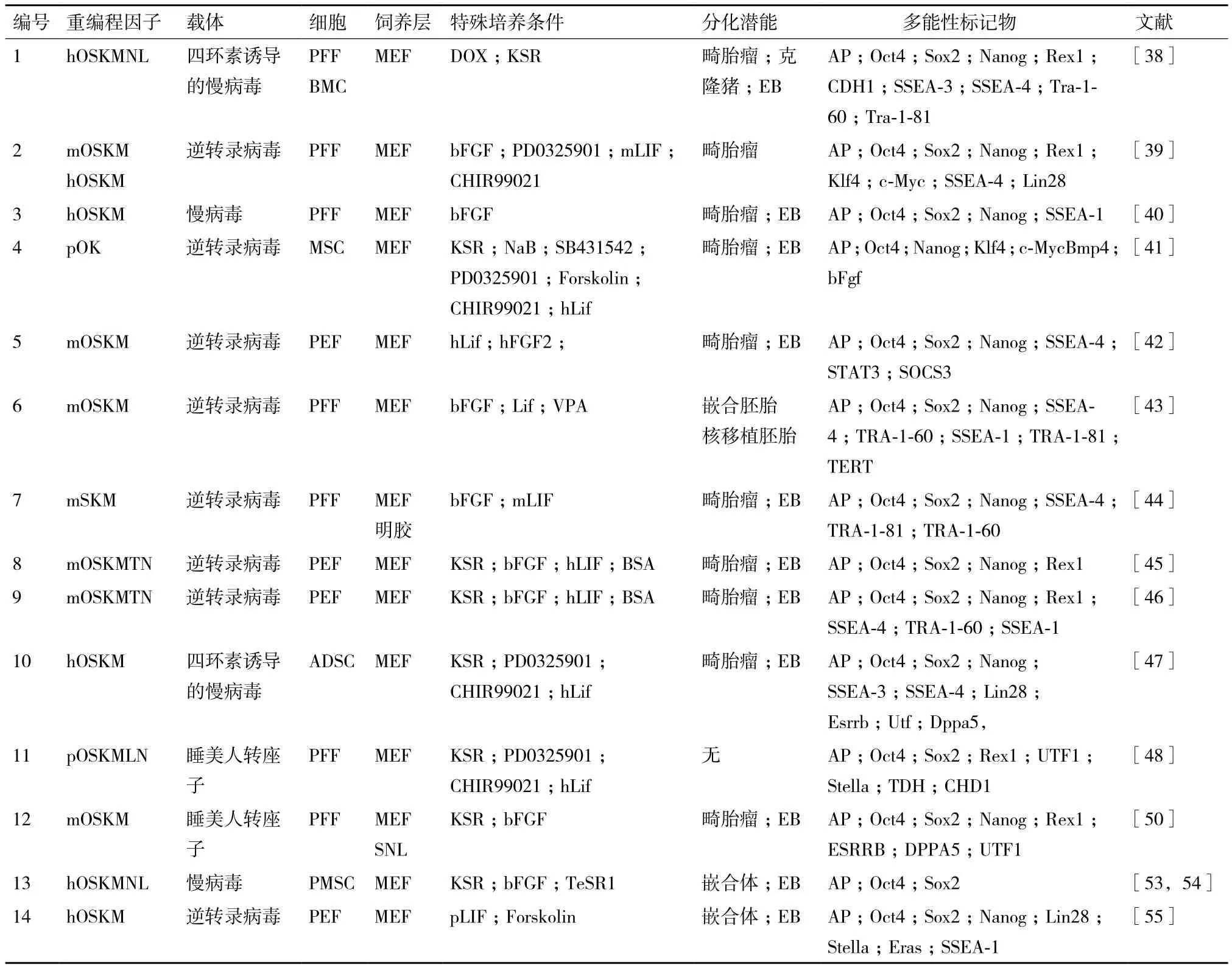
表2 豬誘導多能性干細胞研究進展
3.4 豬iPSCs載體系統和源頭細胞優化
Kues等[50]對豬iPSCs誘導載體進行探索,他們使用Sleeping Beauty轉座子質粒共表達鼠源經典四因子,將豬的成纖維細胞誘導為豬iPSCs,該誘導載體進入細胞后,游離在宿主細胞基因組外,這極大地降低了病毒感染過程中病毒重激活的頻率,為豬iPSCs后期臨床應用和畜牧生產的安全性帶來了新的希望。筆者實驗室[51]研究結果還發現豬iPSCs誘導效率和其源頭細胞的核移植囊胚率呈正相關,不同來源的豬iPSCs細胞系具有相似的、較低的核移植囊胚率,這與之前報道的豬iPSCs核移植效率低并且不能獲得核移植后代的結果相符。
現今,小鼠、大鼠、人、獼猴、豬、牛、羊和兔子等物種均成功建立iPSCs。雖然iPSCs已朝著誘導效率高和生物安全性高的方向快速發展,但目前iPSCs產生的具體分子機制仍然未知,其臨床應用的安全性也依然有待評估。同樣,豬iPSCs面臨著外源基因不沉默、內源基因激活不足、自我更新需要外源基因持續表達、無法得到發育到期的核移植胎兒等問題,這都說明我們所獲得的豬iPSCs多能性存在缺陷。針對上述問題,豬iPSCs的后續工作應主要集中在非病毒載體和減少因子誘導豬iPSCs、改變豬iPSCs的多能性狀態和獲得豬iPSCs的嵌合體后代三個方向。
4 豬類胚胎生殖細胞的研究進展
胚胎生殖細胞(EGCs)是胎兒原始生殖細胞(PGCs)在體外建系培養得到的。哺乳動物中,PGCs最早于原條尾部形成,后隨原條細胞內卷而到達尿囊附近的卵黃囊背側內胚層,接著PGCs以阿米巴運動,沿胚胎后腸和腸系膜遷移到中腎腹側的生殖嵴內,在此PGCs經歷表觀遺傳重編程并最終形成配子。將從胎兒生殖嵴分離的PGCs培養在含有血清和某些特定生長因子的條件下就會阻斷其向生殖細胞的特化,最終被重編程為EGCs,由于EGC與小鼠ESCs具有相似的生物學特性,PGCs也就為多能性干細胞的分離提供了一個新的來源。在對豬的研究中,與內細胞團相比,PGCs具有易獲得、數量大、發育時辰長和種間差異小等優點,更適于豬多能性干細胞系的建立。
豬的EGC最早建系于1997年,Shim等[56]以24-25日齡豬的生殖嵴為原材料建立了豬EGCs,該細胞系可以產生嵌合體豬;Piedrahita等[57]成功地對EGCs進行轉基因操作,獲得了轉基因嵌合體豬。目前已有包括筆者實驗室[58]在內的多個實驗組報道了他們對豬EGCs的研究工作,但所獲得的豬EGCs只是部分符合ESCs的鑒定標準,真正具有生殖系嵌合能力的豬EGCs還未被建立,這些所獲得的豬EGCs也只能被稱為“豬類胚胎生殖細胞”(豬類EGCs)。
雖然已有研究者對豬EGCs培養體系進行了探索,例如,基礎培養基和血清的選擇[59]、飼養層細胞的比較[60]、豬EGCs建系最適胚胎日齡的選擇[58]以及細胞因子和小分子的使用等[61],但是這都無法從根本上解決豬EGCs建系難的問題。筆者認為,只有立足于豬PGCs本身生物學特性、深入了解PGCs多能性維持的機制和積極探索生殖系標志基因表達模式才能夠有效地促進豬EGCs的最終建立。
5 豬多能性干細胞的鑒定標準
多能性干細胞的鑒定主要包括以下幾個內容:堿性磷酸酶(Alkaline phosphatase,AP)的活性檢測,細胞表面標記物及多能性因子的檢測,體外定向分化或自發分化潛能的檢測,畸胎瘤和嵌合體的檢測、生殖系嵌合能力以及四倍體補償能力的檢測。另外,核型檢測、啟動子甲基化分析、X染色體狀態分析、端粒酶活性分析和基因圖譜分析等均可作為多能性鑒定的輔助指標。在所有鑒定指標中,最嚴格的檢測標準是生殖系嵌合能力和四倍體補償能力的檢測,這也是多能干細胞鑒定的“黃金標準”。
豬類ESCs和豬類EGCs早期的鑒定指標主要是形態學觀察和擬胚體(Embryonic body,EB)分化實驗。豬類ESCs根據形態可被分為兩類,分別是內細胞團樣的克隆和上皮樣的克隆,這兩類克隆均能在體外長期培養并形成EB,說明細胞形態和分化潛能并無直接關聯,這促進了分子檢測和細胞水平上篩選純化的發展。分子檢測始于1993年,主要是堿性磷酸酶和階段特異性胚胎抗原-1(Stage specific embryonic antigen-1,SSEA-1)的表達被作為多能性的標記[35,52]。近年來的研究中已將核型分析、干細胞的定向分化、轉錄因子啟動子甲基化狀態分析、X染色體激活狀態分析、端粒酶活性分析和畸胎瘤分化分析應用到豬類ESCs的建系過程中[17,22,23,62],生殖系嵌合能力雖然已被作為檢查指標,但一直沒有細胞系能夠獲得具有生殖系嵌合能力的嵌合體動物。所以總的來看,已建成的豬類ESCs都只能在某一方面達到真正ESCs的要求。豬類EGCs的鑒定標準以及發展進程與此相似,此處不做贅述。
豬iPSCs的鑒定指標較為完善,主要是依循小鼠ESCs的鑒定標準,除了小鼠ESCs的“黃金標準”外,其余各鑒定指標豬iPSCs均可滿足。值得注意的是,West等[53,54]和Fujishiro等[55]報道他們誘導培養得到了能夠生產嵌合體豬的iPSCs細胞系,所獲得的胎豬或仔豬中并沒有明顯腫瘤的形成,在West等的研究結果中,共有4頭妊娠個體發育到期,出生仔豬數為36頭(34活,2死),成活個體中29頭為嵌合體(85.3%),但作為嵌合體的判斷依據僅有外源基因的RT-PCR結果,所以此結果的準確性有待商榷。
豬多能性干細胞的研究領域仍然存在許多問題有待解決,例如,如何高效地獲得各類豬多能性干細胞,如何維持其自我更新和分化的能力,如何得到發育到期的核移植和嵌合體胎兒,如何提高其在科研應用中的安全性,如何定向誘導豬多能性干細胞向某一特定類型的細胞分化并將其作為醫學治療的臨床前研究工具等,這些問題的解決有待于從根本上闡明體細胞重編程、豬多能性干細胞自我更新和定向分化的分子調控機制。豬基因組圖譜的公布使得人們更易于找到維持豬多能性干細胞狀態的細胞信號通路,通過篩選相應的細胞因子和小分子超激活或抑制該信號通路,剔除可能誘使豬多能性干細胞遺傳物質發生改變的因素,使得建立真正的豬多能性干細胞系成為可能。
[1]Stewart Sell. Stem cells handbook[M]. Totowa:Humana Press, 2004.
[2]Evans MJ, Kaufman MH. Establishment in culture of pluripotential cells from mouse embryos[J]. Nature, 1981, 292(5819):154-156.
[3]Martin GR. Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells[J]. Proc Natl Acad Sci USA, 1981, 78(12):7634-7638.
[4]Thomson JA, Kalishman J, Golos TG, et al. Isolation of a primate embryonic stem cell line[J]. Proc Natl Acad Sci USA, 1995, 92(17):7844-7848.
[5]Thomson JA, Itskovitz-Eldor J, Shapiro SS, et al. Embryonic stem cell lines derived from human blastocysts[J]. Science, 1998, 282(5391):1145-1147.
[6]Buehr M, Meek S, Blair K, et al. Capture of authentic embryonic stem cells from rat blastocysts[J]. Cell, 2008, 135(7):1287-1298.
[7]Li P, Tong C, Mehrian-Shai R, et al. Germline competent embryonic stem cells derived from rat blastocysts[J]. Cell, 2008, 135(7):1299-1310.
[8]Ueda S, Kawamata M, Teratani T, et al. Establishment of rat embryonic stem cells and making of chimera rats[J]. PLoS One, 2008, 3(7):e2800.
[9]Resnick JL, Bixler LS, Cheng L, et al. Long-term proliferation of mouse primordial germ cells in culture[J]. Nature, 1992, 359(6395):550-551.
[10]Matsui Y, Zsebo K, Hogan BL. Derivation of pluripotential embryonic stem cells from murine primordial germ cells in culture[J]. Cell, 1992, 70(5):841-847.
[11]Stewart CL, Gadi I, Bhatt H. Stem cells from primordial germ cells can reenter the germ line[J]. Dev Biol, 1994, 161(2):626-628.
[12]Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J]. Cell, 2006, 126(4):663-676.
[13]Li M, Li YH, Hou Y, et al. Isolation and culture of pluripotent cells from in vitro produced porcine embryos[J]. Zygote, 2004, 12(1):43-48.
[14] Chen LR, Shiue YL, Bertolini L, et al. Establishment of pluripotent cell lines from porcine preimplantation embryos[J]. Theriogenology, 1999, 52(2):195-212.
[15] Brevini TA, Tosetti V, Crestan M, et al. Derivation and characterization of pluripotent cell lines from pig embryos of different origins[J]. Theriogenology, 2007, 67(1):54-63.
[16] Son HY, Kim JE, Lee SG, et al. Efficient derivation and long term maintenance of pluripotent porcine embryonic stem-like cells[J]. Asian-Aust J Anim Sci, 2009, 22(1):26-34.
[17] Brevini TA, Pennarossa G, Attanasio L, et al. Culture conditions and signalling networks promoting the establishment of cell lines from parthenogenetic and biparental pig embryos[J]. Stem Cell Rev, 2010, 6(3):484-495.
[18]Miyoshi K, Taguchi Y, Sendai Y, et al. Establishment of a porcine cell line from in vitro-produced blastocysts and transfer of the cells into enucleated oocytes[J]. Biol Reprod, 2000, 62(6):1640-1646.
[19]Telugu BP, Ezashi T, Sinha S, et al. Leukemia Inhibitory Factor(LIF)-dependent, pluripotent stem cells established from inner cell mass of porcine embryos[J]. J Biol Chem, 2011, 286(33):28948-28953.
[20]Haraguchi S, Kikuchi K, Nakai M, et al. Establishment of selfrenewing porcine embryonic stem cell-like cells by signal inhibition[J]. J Reprod Dev, 2012, 58(6):707-716.
[21]Kim HS, Son HY, Kim S, et al. Isolation and initial culture of porcine inner cell masses derived from in vitro-produced blastocysts[J]. Zygote, 2007, 15(1):55-63.
[22]Park JK, Kim HS, Uh KJ, et al. Primed pluripotent cell lines derived from various embryonic origins and somatic cells in pig[J]. PLoS One, 2013, 8(1):e52481.
[23]Jung SK, Kim HJ, Kim CL, et al. Enhancing effects of serumrich and cytokine-supplemented culture conditions on developing blastocysts and deriving porcine parthenogenetic embryonic stem cells[J]. J Vet Sci, 2014, 15(4):519-528.
[24]Tan G, Ren L, Huang Y, et al. Isolation and culture of embryonic stem-like cells from pig nuclear transfer blastocysts of different days[J]. Zygote, 2012, 20(4):347-352.
[25] Evans M, Notaranni E, Laurie S, Moor RM. Derivation and preliminary characterization of pluripotent cell lines from porcine and bovine blastocysts[J]. Theriogenology, 1990, 33(1):125-128.
[26] Piedrahita JA, Anderson GB, Bondurant RH. Influence of feeder layer type on the efficiency of isolation of porcine embryo-derived cell lines[J]. Theriogenology, 1990, 34(5):865-877.
[27] Strojek RM, Reed MA, Hoover JL, et al. A method for cultivating morphologically undifferentiated embryonic stem cells from porcine blastocysts[J]. Theriogenology, 1990, 33(4):901-913.
[28]Piedrahita JA, Anderson GB, Bondurant RH. On the isolation of embryonic stem cells:Comparative behavior of murine, porcine and ovine embryos[J]. Theriogenology, 1990, 34(5):879-901.
[29]Anderson GB, Choi SJ, Bondurant RH. Survival of porcine inner cell masses in culture and after injection into blastocysts[J]. Theriogenology, 1994, 42(1):204-212.
[30]Moore K, Piedrahita JA. Effects of heterologous hematopoietic cytokines on in vitro differentiation of cultured porcine inner cell masses[J]. Mol Reprod Dev, 1996, 45(2):139-144.
[31]Moore K, Piedrahita JA. The effects of human leukemia inhibitory factor(hLIF)and culture medium on in vitro differentiation of cultured porcine inner cell mass(pICM)[J]. In Vitro Cell Dev Biol Anim, 1997, 33(1):62-71.
[32]Hall VJ, Christensen J, Gao Y, et al. Porcine pluripotency cell signaling develops from the inner cell mass to the epiblast during early development[J]. Dev Dyn, 2009, 238(8):2014-2024.
[33]Hochereau-de Reviers MT, Perreau C. In vitro culture of embryonic disc cells from porcine blastocysts[J]. Reprod Nutr Dev, 1993, 33(5):475-483.
[34]Yang JR, Shiue YL, Liao CH, et al. Establishment and characterization of novel porcine embryonic stem cell lines expressing hrGFP[J]. Cloning Stem Cells, 2009, 11(2):235-244.
[35]Talbot NC, Rexroad CE, Pursel VG, et al. Culturing the epiblast cells of the pig blastocyst[J]. In Vitro Cell Dev Biol Anim, 1993, 29A(7):543-554.
[36]Li M, Zhang D, Hou Y, et al. Isolation and culture of embryonic stem cells from porcine blastocysts[J]. Mol Reprod Dev, 2003, 65(4):429-434.
[37]Li M, Ma W, Hou Y, et al. Improved isolation and culture of embryonic stem cells from Chinese miniature pig[J]. J Reprod Dev, 2004, 50(2):237-244.
[38]Wu Z, Chen J, Ren J, et al. Generation of pig induced pluripotent stem cells with a drug-inducible system[J]. J Mol Cell Biol, 2009, 1(1):46-54.
[39]Esteban MA, Xu J, Yang J, et al. Generation of induced pluripotent stem cell lines from Tibetan miniature pig[J]. J Biol Chem, 2009, 284(26):17634-17640.
[40]Ezashi T, Telugu BP, Alexenko AP, et al. Derivation of induced pluripotent stem cells from pig somatic cells[J]. Proc Natl Acad Sci USA, 2009, 106(27):10993-10998.
[41]Liu K, Ji G, Mao J, et al. Generation of porcine-induced pluripotent stem cells by using OCT4 and KLF4 porcine factors[J]. Cell Reprogram, 2012, 14(6):505-513.
[42]Thomson AJ, Pierart H, Meek S, et al. Reprogramming pig fetal fibroblasts reveals a functional LIF signaling pathway[J]. CellReprogram, 2012, 14(2):112-122.
[43]Cheng D, Guo Y, Li Z, et al. Porcine induced pluripotent stem cells require LIF and maintain their developmental potential in early stage of embryos[J]. PLoS One, 2012, 7(12):e51778.
[44]Montserrat N, de Onate L, Garreta E, et al. Generation of feederfree pig induced pluripotent stem cells without Pou5f1[J]. Cell Transplant, 2012, 21(5):815-825.
[45]Wang J, Gu Q, Hao J, et al. Tbx3 and Nr5alpha2 play important roles in pig pluripotent stem cells[J]. Stem Cell Rev, 2013, 9(5):700-708.
[46]Gu Q, Hao J, Hai T, et al. Efficient generation of mouse ESCs-like pig induced pluripotent stem cells[J]. Protein Cell, 2014, 5(5):338-342.
[47]Zhang Y, Wei C, Zhang P, et al. Efficient reprogramming of naivelike induced pluripotent stem cells from porcine adipose-derived stem cells with a feeder-independent and serum-free system[J]. PLoS One, 2014, 9(1):e85089.
[48]Petkov S, Hyttel P, Niemann H. The small molecule inhibitors PD0325091 and CHIR99021 reduce expression of pluripotencyrelated genes in putative porcine induced pluripotent stem cells[J]. Cell Reprogram, 2014, 16(4):235-240.
[49]Rodriguez A, Allegrucci C, Alberio R. Modulation of pluripotency in the porcine embryo and iPS cells[J]. PLoS One, 2012, 7(11):e49079.
[50]Kues WA, Herrmann D, Barg-Kues B, et al. Derivation and characterization of sleeping beauty transposon-mediated porcine induced pluripotent stem cells[J]. Stem Cells Dev, 2013, 22(1):124-135.
[51]Xie B, Wang J, Liu S, et al. Positive correlation between the efficiency of induced pluripotent stem cells and the development rate of nuclear transfer embryos when the same porcine embryonic fibroblast lines are used as donor cells[J]. Cell Reprogram, 2014, 16(3):206-214.
[52]Wianny F, Perreau C, Hochereau de Reviers MT. Proliferation and differentiation of porcine inner cell mass and epiblast in vitro[J]. Biol Reprod, 1997, 57(4):756-764.
[53]West FD, Terlouw SL, Kwon DJ, et al. Porcine induced pluripotent stem cells produce chimeric offspring[J]. Stem Cells Dev, 2010, 19(8):1211-1220.
[54] West FD, Uhl EW, Liu Y, et al. Chimeric Pigs produced from induced pluripotent stem cells demonstrate germline transmission and no evidence of tumor formation in young pigs[J]. Stem Cells, 2011, 29(10):1640-1643.
[55]Fujishiro SH, Nakano K, Mizukami Y, et al. Generation of naivelike porcine-induced pluripotent stem cells capable of contributing to embryonic and fetal development[J]. Stem Cells Dev, 2013, 22(3):473-482.
[56]Shim H, Gutierrez-Adan A, Chen LR, et al. Isolation of pluripotent stem cells from cultured porcine primordial germ cells[J]. Biol Reprod, 1997, 57(5):1089-1095.
[57]Piedrahita JA, Moore K, Oetama B, et al. Generation of transgenic porcine chimeras using primordial germ cell-derived colonies[J]. Biol Reprod, 1998, 58(5):1321-1329.
[58] Cong Y, Ma J, Sun R, et al. Derivation of putative porcine embryonic germ cells and analysis of their multi-lineage differentiation potential[J]. J Genet Genomics, 2013, 40(9):453-464.
[59] Petkov SG, Anderson GB. Culture of porcine embryonic germ cells in serum-supplemented and serum-free conditions:the effects of serum and growth factors on primary and long-term culture[J]. Cloning Stem Cells, 2008, 10(2):263-276.
[60] Lee CK, Piedrahita JA. Effects of growth factors and feeder cells on porcine primordial germ cells in vitro[J]. Cloning, 2000, 2(4):197-205.
[61]Wen J, Liu J, Song G, et al. Effects of 6-bromoindirubin-3’-oxime on the maintenance of pluripotency of porcine embryonic germ cells in combination with stem cell factor, leukemia inhibitory factor and fibroblast growth factor[J]. Reproduction, 2010, 139(6):1039-1046.
[62]Choi KH, Park JK, Kim HS, et al. Epigenetic changes of lentiviral transgenes in porcine stem cells derived from embryonic origin[J]. PLoS One, 2013, 8(8):e72184.
Porcine Pluripotent Stem Cells:Facts,Challenges and Hopes
Xue Binghua Liu Zhonghua
(Lab of Embryo Biotechnology,Northeast Agriculture University,Harbin 150030)
Pluripotent stem cells, including embryonic stem cells, embryonic germ cells and induced pluripotent stem cells, have the ability to differentiate into a variety of specific cell lines. Swine is considered as a kind of ideal model for pre-clinical development of human xenotransplantation, therapeutic approaches and regenerative medicine due to its morphological and functional affinity with man. However, a number of open questions need to be addressed since we know little about the sorting, derivation, characterization and mechanisms of porcine pluripotent stem cells. In this review, we elaborated the latest progresses on the derivation of porcine pluripotent stem cells, the evaluation criteria of stemness, scientific and technique questions encountere, and we also provide our perspectives on the future study ofporcine pluripotentstem cells research, in the hope of sharing experimence of exploring this field with other researchers.
swine;pluripotent stem cells;embryonic stem cells;induced pluripotent stem cells;embryonic germ cells
10.13560/j.cnki.biotech.bull.1985.2015.03.009
2015-02-11
“973”重大科學問題導向項目(2011CBA01006),國家自然科學基金項目(31371457)
薛冰華,女,博士研究生,研究方向:多能性干細胞;E-mail:xuebinghua123@126.com
劉忠華,男,博士,教授,研究方向:發育生物學;E-mail:liu86@126.com

