桐花樹葉乙酸乙酯部位提取物對α-葡萄糖苷酶抑制活性作用
蔡建秀,顧雅青,黃曉冬,,黃建新,李元躍,吳春花(.泉州師范學院近海資源生物技術福建省高校重點實驗室,福建泉州6000;.福建省海洋漁業資源與生態環境重點實驗室,福建集美6000;.福建醫科大學附屬第二醫院,福建泉州6000)
桐花樹葉乙酸乙酯部位提取物對α-葡萄糖苷酶抑制活性作用
蔡建秀1,顧雅青1,黃曉冬1,2,黃建新3,李元躍2,吳春花1
(1.泉州師范學院近海資源生物技術福建省高校重點實驗室,福建泉州362000;2.福建省海洋漁業資源與生態環境重點實驗室,福建集美361000;3.福建醫科大學附屬第二醫院,福建泉州362000)
摘要:研究桐花樹葉乙酸乙酯提取物對α-葡萄糖苷酶活性的抑制作用。桐花樹葉70%醇提取物經萃取獲得石油醚部位、二氯甲烷部位、乙酸乙酯部位、正丁醇部位、水部位5個部位。對各部位進行多酚含量、總黃酮含量、DPPH·清除活性測定,從中篩選出活性物質含量高、自由基清除活性較強的桐花樹葉乙酸乙酯提取物,對其用α-葡萄糖苷酶進行體外活性抑制作用試驗,通過酶促動力學方法與繪制Lineweaver-Burk曲線,推斷桐花樹葉乙酸乙酯提取物的酶抑制類型,所得的結果與阿卡波糖進行比較。結果表明:桐花樹葉乙酸乙酯部位和桐花樹葉水部位對α-葡萄糖苷酶均有抑制作用,且抑制作用均優于阿卡波糖,其半抑制濃度(IC50)分別為40.59 μg/mL和60.79 μg/mL。桐花樹葉乙酸乙酯提取物抑制類型為混合Ⅱ型抑制,對游離酶(E)的抑制常數(Ki)為0.245 mg/mL,對酶-底物絡合物(ES)的抑制常數(Kis)為0.023 mg/mL。
關鍵詞:桐花樹;乙酸乙酯提取物;α-葡萄糖苷酶抑制
紅樹林是生長于熱帶和亞熱帶海岸和河口潮間帶的木本植物群落。紫金牛科Myrsinaceae桐花樹屬Aegiceras的紅樹植物桐花樹 [Aegiceras corniculatum (Linn.)Blanco]是紅樹林的廣布種之一,生于海邊灘涂上,是一種重要的紅樹植物,廣泛分布于海南、福建、廣東、廣西、浙江、香港、澳門等地[1]。桐花樹是常見的紅樹植物,樹皮平滑,紅褐至灰黑色,葉面有泌鹽現象。有研究顯示,桐花樹葉片中含有17種氨基酸,其中7種為人體必需氨基酸,還含有15種微量元素、8種揮發油化合物、10種脂肪酸[2],并且為了適應海洋鹽生環境而富含單寧等多酚類化合物[3-4]。民間藥用記載桐花樹有治療哮喘、糖尿病和風濕等疾病的作用[5-6],Gurudeeban,S的研究顯示桐花樹葉80%乙醇提取物灌胃給藥能穩定降低四氧嘧啶致糖尿病大鼠的血糖濃度[7]。本試驗利用體外α-葡萄糖苷酶抑制模型對泉州灣桐花樹葉片70%乙醇提取物不同萃取部位的α-葡萄糖苷酶抑制活性進行評價,以期發現具有抗糖尿病活性的有效部位,通過酶抑制動力學研究發現其抑制機制與類型,并初步測定其主要化學成分含量,為發現桐花樹降血糖活性成分提供參考。
1 材料
1.1原料
桐花樹:供試桐花樹葉于5月采自福建泉州灣紅樹林濕地。
1.2試劑
沒食子酸:標準品,批號149-91-7,貴州迪大生物有限公司;蘆丁:標準品,批號100080-200707,中國藥品生物制品檢定所;DPPH:066K1101,SIGMA;α-葡萄糖苷酶(α-glucosidase):用0.1 mmol/L PBS配置成相應濃度單位;4-硝基苯-α-D吡喃葡萄糖苷(4-N-trophenylα-D-glucopyranoside):PNPG;乙醇:95%配制為70%;石油醚(60℃~90℃);二氯甲烷、正丁醇、氫氧化鈉、三氧化氯鋁、亞硝酸鈉、二甲亞砜(DMSO)、磷酸二氫鈉、磷酸氫二鈉:國產分析純。
1.3儀器
RE-2000B旋轉蒸發儀、SHE-Ⅲ型循環水真空泵:上海亞榮生化儀器廠;SB-3200DT超聲清洗器:寧波新芝生物科技股份有限公司;賽多利斯電子天平:北京賽多利斯儀器有限責任公司,京制00000249號;V-1100可見分光光度計:上海美譜達儀器有限公司;MBE GZX-9240數顯鼓風干燥箱;PHB-4便攜式酸度計:上海偉業儀器廠;UVM340連續波長酶標儀。
2 方法
2.1桐花樹葉各部位提取物的制備
桐花樹葉采自泉州灣洛陽紅樹林、去雜、陰干,碾成桐花樹葉粉末,10倍量體積的70%乙醇避光浸提7d,反復浸提2次,浸提液抽濾,濾液減壓旋蒸去醇后,依次用1倍~2倍量的石油醚、二氯甲烷、乙酸乙酯、正丁醇充分萃取,50℃左右減壓濃縮各萃取液得到桐花樹葉的石油醚萃取部位、二氯甲烷萃取部位、乙酸乙酯萃取部位、正丁醇萃取部位及萃取后剩余的水層,水層再用無水乙醇調配成70%乙醇濃度,振搖后放入冰箱4℃靜置24 h醇沉,24 h后4 000 r/min離心取下層沉淀放入50℃的烘箱中烘干,烘干后得水部位。
2.2多酚含量測定
將各萃取物用DMSO配制成1 mg/mL的母液,作為測試樣液。
采用福林酚法,含量以沒食子酸計。取50 μL樣液(濃度1 mg/mL)加入75 μL去離子水,50 μL 10倍稀釋的Folin-Ciocalteu試劑,漩渦混勻,1 min后加入50 μL 20%Na2CO3溶液,充分混合后,暗處37℃反應60 min。酶標儀750 nm處測吸光度,代入沒食子酸標準曲線(線性范圍為0~4.00 μg)計算總酚含量[8-9]。
2.3分光光度法總黃酮含量測定
將各提取物用DMSO配制成1 mg/mL的母液,作為測試樣液。取250 μL的樣液與1.25 mL雙蒸水、75 μL 5%NaNO2(現配,棕色瓶)充分混合,6 min后加入150 μL 10%AlCl3水溶液,5 min后加入0.5 mL 1 mol/L NaOH,雙蒸水補足至總反應體積2.5 mL,混勻后510 nm測吸光度。以蘆丁(0~1 mg/mL)作標準曲線,計算總黃酮含量[10]。
2.4清除DPPH自由基試驗
參照Fukummoto等[11]的方法并略加修改。以DMSO為溶劑,在96孔酶標板中加20 μL供試樣液和150 μmol/L DPPH·溶液(用體積分數80%乙醇配制)180 μL,空白對照則加入180 μL DPPH·溶液(80%乙醇溶)和20 μL DMSO,同時測樣液背景值(加入180 μL體積分數80%乙醇和20 μL供試樣液),置于酶標儀中振動30 s,室溫避光靜置一定時間,522 nm波長下讀取吸光度。每個樣品設重復3次。根據公式計算DPPH·清除率:DPPH·清除率/%=[1-﹙As-Ab﹚/Ac]× 100。式中:Ac為空白的吸光度;Ab為樣液背景的吸光度;As為樣液的吸光度。
2.5α-葡萄糖苷酶抑制活性測定
2.5.1桐花樹葉不同部位提取物活性篩選
桐花樹葉各部位提取物用DMSO配制成0.1mg/mL的母液作為測試樣液。
在96孔板上進行,反應體系參照張麗[12]建立的方法,磷酸緩沖液PBS(pH 6.8)112 μL,加入0.2 U/mL α-葡萄糖苷酶20 μL,8 μL樣品溶液,37℃恒溫15 min,加入2.5 mmol/L PNPG 20 μL,37℃恒溫反應15 min。再加入80 μL 0.2 mol/L的Na2CO3溶液,于405 nm波長下測定A值。
按照抑制率(I)/%=[1-(Ac-Ad)/(Aa-Ab)]× 100計算抑制率。
式中:Aa、Ab、Ac、Ad分別為空白對照組吸光度值、空白對照組背景吸光度值、樣液組吸光度值、樣液組背景吸光度值。
所有測試樣品以DMSO溶解,并存儲于4℃冰箱中。
酶活力單位定義:37℃、pH 6.8條件下,每分鐘水解底物所產生1 μmol對硝基苯酚的酶量,規定為1個酶活力單位(U)[13]。
2.5.2桐花樹葉乙酸乙酯部位與水部位提取物的濃度對α-葡萄糖苷酶活性的影響
在2.5.1所述的測酶活反應體系中,改變提取物濃度,對活性高于陽性對照的桐花樹葉乙酸乙酯部位與水部位提取物用DMSO配制成(0.02、0.04、0.06、0.08 和0.10 mg/mL)的母液,作為測試樣液。測試不同樣液濃度對α-葡萄糖苷酶活性的影響,于波長405 nm處測定吸光度值,試驗重復3次,抑制率I計算方法同2.5.1。2.5.3桐花樹葉乙酸乙酯部位提取物對α-葡萄糖苷酶活性抑制的動力學研究
在2.5.1所述的測酶活反應體系中,改變PNPG底物濃度([S]分別為0.625、1.25、2.5、5.0、10.0 mmol/L),測定不同質量濃度([I]分別為0.00、0.04、0.06 mg/mL)的桐花樹葉乙酸乙酯部位提取物樣液對α-葡萄糖苷酶活性的影響,于波長405 nm處測定吸光度值,試驗重復3次。按Lineweaver-Burk作圖法,繪制1/[S]~1/V雙倒數曲線圖,確定其動力學特征及其Km、Ki值。
2.6數據處理與統計
采用Microsoft Excel 2003進行數據處理與統計分析及軟件作圖;試驗數據均為3次重復的平均值。
3 結果與分析
3.1桐花樹葉各提取物的得率
桐花樹葉各提取物的得率見表1。
從表1可看出,桐花樹葉醇提取物的萃取部位以水部位的得率最高為20.69%,其次為正丁醇部位與乙酸乙酯部位,說明70%醇提取物的主要化學成分類型為極性較大的成分。

表1 桐花樹葉各提取物的得率Table 1 The yield in different leaves of Aegiceras corniculatum extracts
3.2多酚含量標準曲線及桐花樹葉不同提取部位中多酚含量測定
沒食子酸加入量與吸光值的關系見表2、圖1,其回歸方程y=0.141 8x+0.071 1,相關系數R2=0.999,線性關系良好。
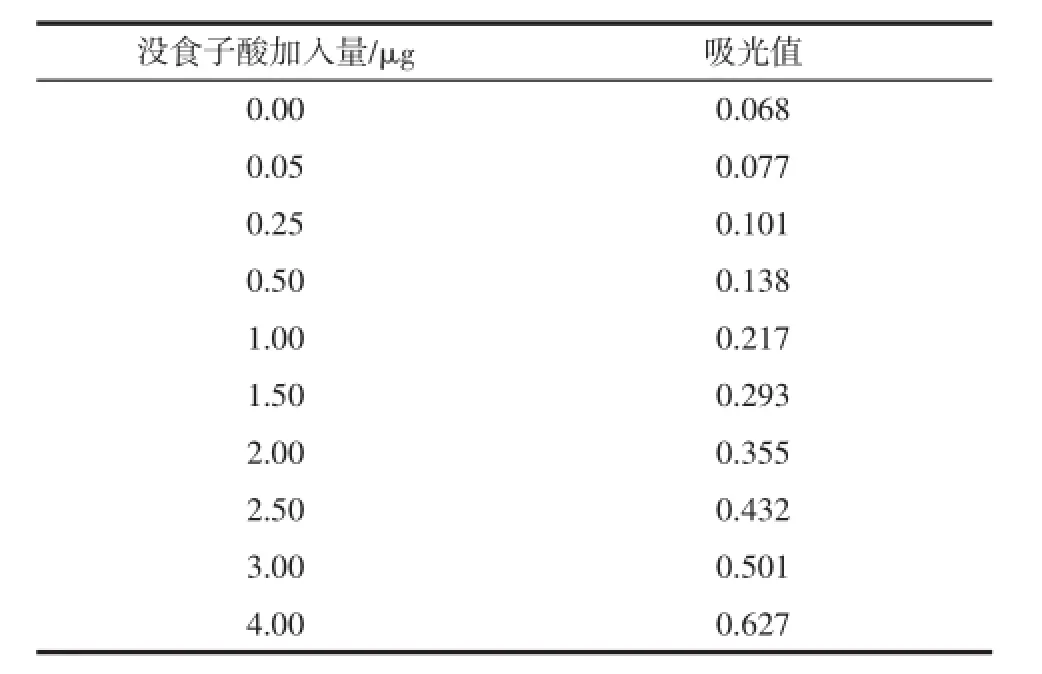
表2 沒食子酸加入量與吸光值的關系Table 2 The relationship of gallic acid added and absorbance

圖1 沒食子酸標準曲線Fig.1 Gallic acid standard curve
測定桐花樹葉各提取物中多酚含量,結果如表3。

表3 桐花樹葉不同提取物中多酚含量測定結果Table 3 Determination of polyphenols in different leaves of Aegiceras corniculatum extracts
表3顯示,桐花樹葉各提取物中乙酸乙酯部位提取物的多酚含量最高,為21.85%。
3.3總黃酮含量標準曲線及桐花樹葉不同提取部位中總黃酮含量測定
蘆丁質量濃度與吸光值的關系見表4(圖2),其回歸方程y=5.063 4x-0.04,相關系數R2=0.999,線性關系良好。

表4 蘆丁質量加入量與吸光值的關系Table 4 The relationship of rutin added and absorbance
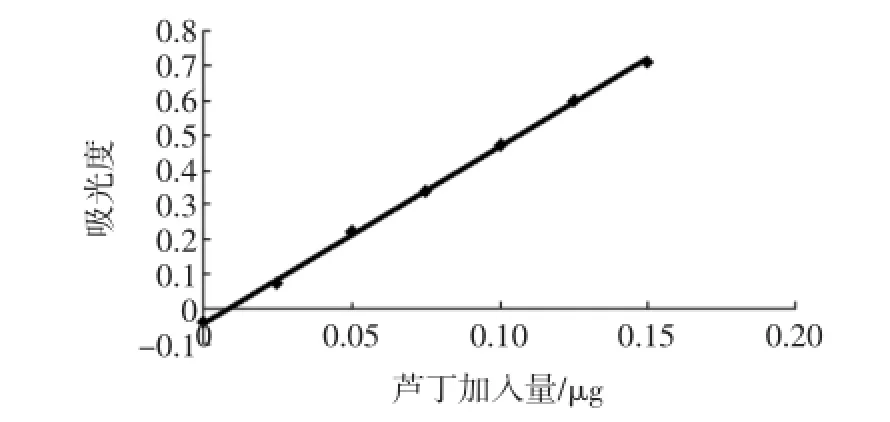
圖2 蘆丁標準曲線Fig.2 Rutin standard curve
總黃酮含量測定結果表明見表5。

表5 桐花樹葉不同提取物中黃酮含量測定結果Table 5 Determination of flavonoids in different leaves of Aegiceras corniculatum extract
桐花樹葉石油醚部位提取物、二氯甲烷部位提取物、乙酸乙酯部位提取物、正丁醇部位提取物和水部位提取物中乙酸乙酯部位提取物的總黃酮含量最高,為17.58%。
3.4清除DPPH自由基試驗
以1 mg/mL的測試濃度比較桐花樹葉各部位提取物的DPPH·清除能力,結果如表6。
表6顯示,桐花樹葉乙酸乙酯部位提取物自由基清除能力最強,30 min DPPH·清除率為66.12%,50 min的DPPH·清除率為79.26%。

表6 桐花樹葉不同提取物對DPPH·的清除作用Table 6 Scavenging effects on DPPH·different leaves of Aegiceras corniculatum extract
3.5桐花樹葉提取物對α-葡萄糖糖苷酶抑制作用
3.5.1提取物對α-葡萄糖糖苷酶抑制活性篩選
桐花樹葉不同部位提取物的α-葡萄糖糖苷酶抑制活性初篩結果見表7。

表7 不同部位提取物的α-糖苷酶抑制活性Table 7 The inhibitory activity of different extracts of α-glucosidase
表7顯示,桐花樹葉乙酸乙酯部位提取物和水部位提取物的初篩抑制率均高于陽性對照acarbose,兩者的IC50值均遠小于acarbose。分別為為40.59 μg/mL 和60.97 μg/mL。
3.5.2桐花樹葉乙酸乙酯部位與水部位提取物對α-葡萄糖苷酶活性的影響
對活性高于陽性對照的桐花樹葉乙酸乙酯提取物與葉水提取物對α-葡萄糖苷酶活性的抑制能力均隨樣液濃度的增大而增強,呈現明顯正相關的量效關系(R2分別為0.987 6、0.901),其劑量-抑制效應線性回歸曲線如圖3所示。
在質量濃度0.1 mg/mL時,桐花樹葉乙酸乙酯提取物與葉水提取物的α-葡萄糖苷酶活性抑制率分別高達81.44%與71.02%,同樣濃度下葉乙酸乙酯部位α-葡萄糖糖苷酶抑制活性較強于水部位。
3.5.3桐花樹葉乙酸乙酯部位抑制類型的確定
采用Lineweaver-Burk雙倒數法[14]作圖,通過米氏常數Km和酶促反應最大速率Vm的變化來判斷抑制類型。若為線性混合型抑制,其Lineweaver-Burk雙倒數方程形式為:
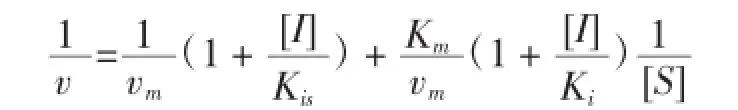
1/V對1/[S]作圖得一直線,其斜率Slope與截距Intercept分別為:
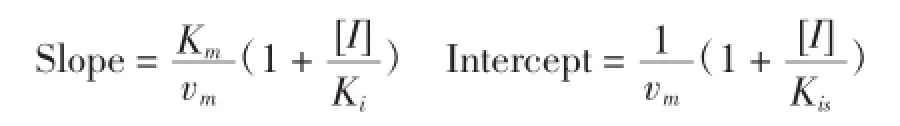
再以斜率、截距分別對樣液濃度[I]作圖,可以求得效應物對游離酶的抑制常數Ki與對酶-底物絡合物(ES)的抑制常數Kis[14]。
在測酶活反應體系中,改變底物PNPG濃度,測定桐花樹葉乙酸乙酯提取物樣液(0.00、0.04、0.06 mg/mL)對α-葡萄糖苷酶活力的影響,結果以1/V對1/[S]進行Lineweaver-Burk雙倒數作圖,得到一組相交于第三象限的直線(見圖4)。
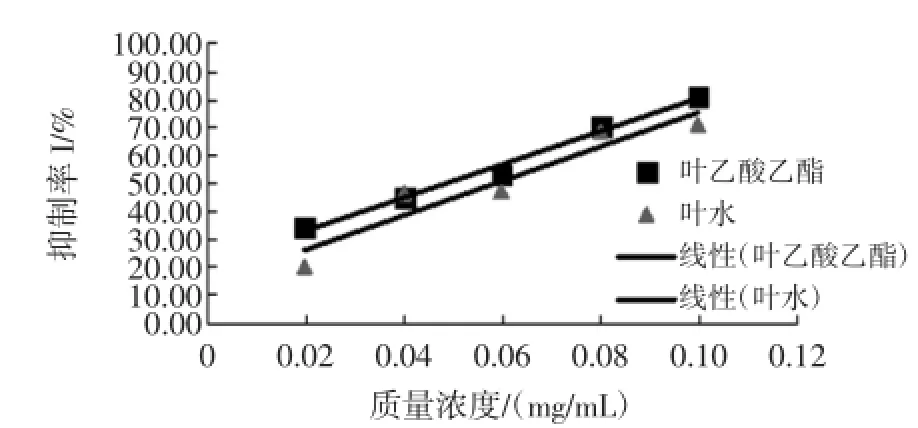
圖3 桐花樹葉乙酸乙酯提取物與葉水提取物對α-葡萄糖苷酶活性抑制的量效關系Fig.3 Dose-effect relationship of ethyl acetate extract from Aegiceras corniculatum or water extract from Aegiceras corniculatum on α-glucosidase inhibition
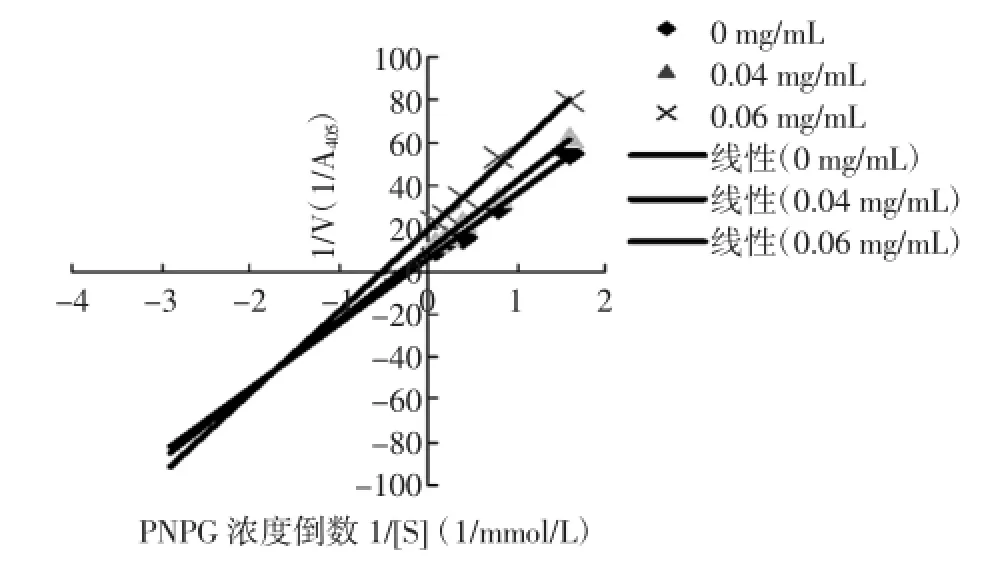
圖4 葉乙酸乙酯提取物的Lineweave-Burk曲線Fig.4 Lineweave-Burk plot of ethyl acetate extract in leaves
由Lineweaver-Burk方程發現其米氏常數Km與酶促反應最大速率Vm的變化表現為隨樣液質量濃度增加Km值減小、Vm值減小(見表8)。
這與混合Ⅱ型抑制類型的動力學特征相符,即桐花樹葉乙酸乙酯提取物既可以和游離酶(E)結合,也可以與酶-底物絡合物(ES)在非活性中心結合,導致酶活力降低。進一步以Lineweaver-Burk雙倒數圖的斜率與截距對相應的樣液濃度二次作圖均呈直線(見圖5、圖6)。
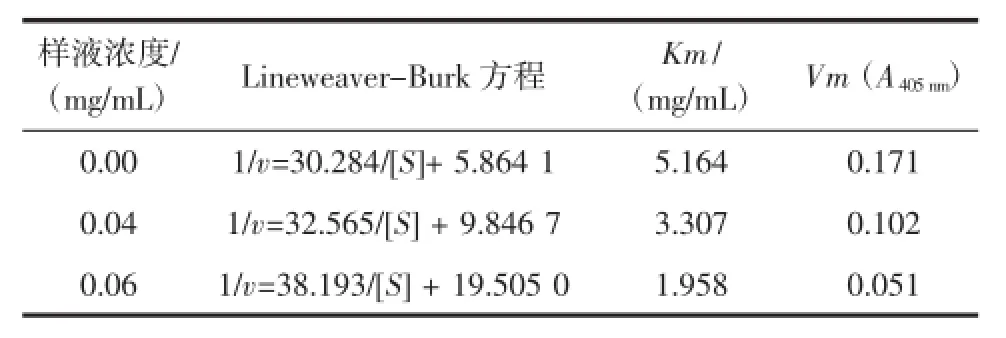
表8 桐花樹葉乙酸乙酯提取物對α-葡萄糖苷酶抑制的動力學參數Table 8 Kinetic parameter of α-glucosidase inhibition by the ethyl acetate extract from Aegiceras corniculatum
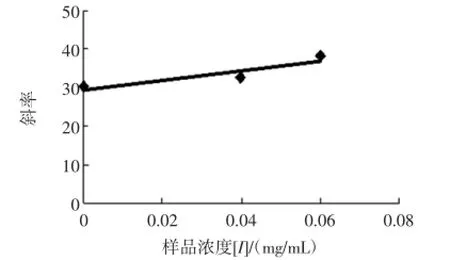
圖5 雙倒數直線斜率對樣液濃度作圖Fig.5 The plot of slope versus the concentration of sample for determining the inhibition constants Ki

圖6 雙倒數直線截距對樣液濃度作圖Fig.6 The plot of intercept versus the concentration of sample for determining the inhibition constants Kis
按上述的公式分別求得桐花樹葉乙酸乙酯提取物對游離酶的抑制常數Ki為0.245 mg/mL與對酶-底物絡合物抑制常數Kis為0.023 mg/mL,并且Ki為Kis 的10.73倍,說明桐花樹葉乙酸乙酯提取物與酶-底物絡合物(ES)的親和力大于其與游離酶(E)的親和力。
4 討論
糖尿病是嚴重危害人類健康的主要疾病之一,是人類致死、致殘的主要原因。糖尿病的發病率逐年增加,其中2型糖尿病的發病率占糖尿病發病率的90%以上[15]。我國糖尿病的治療主要依靠西藥進行控制,但容易產生耐藥性,且伴隨一些并發癥[16]。因此,從天然資源中尋找低毒高效的活性物質用于代替西藥非常重要。
而α-葡萄糖苷酶抑制劑如拜糖蘋(阿卡波糖)、倍欣(伏格列波糖)等通過調控小腸刷狀緣上該酶活性從而起到防治糖尿病、肥胖癥的作用[17]。此外,還有研究顯示糖尿病發病與自由基損害密切相關[18]。說明可以通過增強清除自由基的能力,而保護糖尿病機體免受自由基的氧化損傷。由于DPPH·反應體系具有簡便、快速、重復性好等特點,因而廣泛應用于自由基清除劑的篩選[19]。本試驗研究定位在葉構件上,桐花樹葉多酚與總黃酮主要集中在葉乙酸乙酯部位中含量分別為21.85%、17.58%,且該乙酸乙酯部位的DPPH·清除率高于其他部位。
體外α-葡萄糖苷酶抑制活性研究發現桐花樹葉乙酸乙酯部位與水部位是其抗糖尿病的有效部位,均具有一定的α-葡萄糖苷酶抑制活性,具有明顯的劑量依賴性,兩者的抑制活性均高于陽性對照acarbose,IC50分別為40.59 μg/mL和60.97 μg/mL,顯然,乙酸乙酯部位具有更強的抑制活性,這可能與其具有較高的多酚與總黃酮含量有關。
在判定酶抑制類型時,Lineweaver-Burk雙倒數作圖分析是一種常用的有效方法,作圖后如果得到一組相交于Y軸的直線,則為競爭性抑制;如果得到一組相交于X軸的直線,則為非競爭性抑制;如果得到一組平行的直線,則為反競爭性抑制;如果得到一組相交于第二或第三象限的直線,則為混合Ⅰ型(兼具競爭性與非競爭性抑制)或混合Ⅱ型抑制(兼具反競爭性與非競爭性抑制)[20]。在這些抑制類型中,混合型抑制較為常見[14]。抑制動力學分析發現,桐花樹葉乙酸乙酯提取物對α-葡萄糖苷酶抑制作用的Lineweaver-Burk雙倒數作圖所得直線相交于第三象限,動力學參數表現為隨樣液質量濃度增加Km值減小、Vm值減小,抑制類型為混合Ⅱ型抑制,其酶活抑制的實現一方面是通過桐花樹葉乙酸乙酯提取物與游離酶的結合,另一方面是通過與酶-底物絡合物(ES)的親和,使抑制作用兼具反競爭性和非競爭性作用的特點。進一步的分析發現桐花樹葉乙酸乙酯提取物對游離酶的抑制常數Ki 0.245 mg/mL大于其對酶-底物絡合物的抑制常數Kis 0.023 mg/mL,這說明了該提取物對酶-底物絡合物的抑制作用強于其對游離酶的抑制作用。
參考文獻:
[1]張忠華,胡剛,梁士楚.廣西紅樹林資源與保護[J].海洋環境科學, 2007,26(3):275-279,282
[2]宋文東,王浩,肖文發.紅樹植物桐花樹葉中氨基酸和微量元素的分析[J].食品研究與開發,2008,29(7):106-108
[3]李元躍,林鵬.3種紅樹植物葉片結構及其生態適應[J].海洋科學, 2006,30(7):53-57
[4]林益明,向平,林鵬.紅樹林單寧的研究進展[J].海洋科學,2005,29 (3):59-63
[5]Bandaranayake W M.Traditional and medicinal use of mangroves[J]. Mangroves and salt Marshes,1998(2):133-148
[6]徐佳佳,龍盛京.桐花樹化學成分及其生物活性作用的研究進展[J].時珍國醫藥,2006,17(12):2393-2395
[7]Gurudeeban S,Satyavani K,Ramanathan T,et al.Antidiabetic effect of a black mangrove species Aegiceras corniculatum in alloxaninduced diabetic rats[J].Journal of advanced pharmaceutical technology&research,2012,3(1):52-56
[8]Velioglu YS,Mazza G,Gao L,et al.Antioxidant activity and total phenolics in selected fruits,vegetables,and grain products[J].Agricultural Food Chem,1998,46(10):4113-4117
[9]P Matanjun,S Mohamed,N M Mustapha,et al.Antioxidant activities and phenolics content of eight species of seaweeds from north Borneo[J].Journal of Applied Phycology,2008,20(4):367-373
[10]Cox S,Abu-Ghannam N,Gupta S.An assessment of the antioxidant and antimicrobial activity of six species of edible Irish seaweeds[J]. International Food Research Journal,2010,17(1):205-220
[11]Fukumoto L R,Mazza G.Antioxidant and prooxidant activities of phenolic compounds[J].Journal of agricultural and food chemistry, 2000,48(8):3597-3604
[12]張麗,李曉梅,李彩芳,等.加拿大蓬α-葡萄糖苷酶抑制作用研究[J].河南大學學報:醫學版,2008,27(4):39
[13]王鏡巖,朱圣庚,徐長法.生物化學[M].北京:高等教育出版社, 2002:371
[14]陳清西.酶學及其研究技術[M].廈門:廈門大學出版社,2010: 79,120
[15]Ali D,Kunzel C.Diabetes mellitus:update and relevance for dentistry[J].Dent Today,2011,30(12):45-46,48-50
[16]袁紅.荔枝核多糖提取物對四氧嘧啶致糖尿病小鼠降糖作用[J].健康研究,2010,30(4):252-255
[17]沈忠明,丁勇,施堃,等.菝葜降血糖活性成分及對相關酶的抑制作用[J].中藥材,2008,31(11):1717-1720
[18]Guo YW.Nitric oxide synthetase and the effectof aminoguanidine and NG-monomethyl-L-arginineon the onset of diabetes in the spontaneously BB rat[J].Diabetes,1995,44(3):360-365
[19]陸占國,郭紅轉,封丹.芫荽莖葉精油成分及清除DPPH自由基能力研究[J].食品與發酵工業,2006,32(8):24-26
[20]張耀東,蔡亞楠,張琦,等.淫羊藿苷對乙酰膽堿酯酶的抑制作用[J].藥學學報,2012,47(9):1141-1146
DOI:10.3969/j.issn.1005-6521.2015.24.001
收稿日期:2015-08-20
基金項目:福建省(國家級)大學生創新創業訓練計劃項目(201510399003);福建省自然科學基金項目(2015J01146);福建省海洋漁業資源與生態環境重點實驗室開放基金資助項目(fmfre2014011);泉州市科技計劃B類項目(Z20140156);泉州師范學院海洋功能食品工程中心;泉州師院省生物學重點學科專項經費
作者簡介:蔡建秀(1957—),女(漢),教授,本科,主要從事功能保健食品和天然產物提取與開發研究。
Study on α-Glucosidase Inhibitory Activity of the Ethyl Acetate Extract from Leaves of Aegiceras corniculatum
CAI Jian-xiu1,GU Ya-qing1,HUANG Xiao-dong1,2,HUANG Jian-xin3,LI Yuan-yue2,WU Chun-hua1
(1.Fujian Advanced Education Key Laboratory of Inshore Resourses Biotechnology,Quanzhou Normal University,Quanzhou 362000,Fujian,China;2.Fujian Provincial Key Laboratory of Marine Resources and Eco-environment,Jimei 361000,Fujian,China;3.The Second Affiliated Hospital of Fujian Medical University,Quanzhou 362000,Fujian,China)
Abstract:Study on α-glucosidase inhibitory activity of the ethyl acetate extract from leaves of Aegiceras corniculatum.The petroleum from leaves of Aegiceras corniculatum ether part obtained from the extraction of 70%alcohol extract and methylene chloride and ethyl acetate,n-butanol part,water five parts.Polyphenol content determination,for each part to determination of flavonoids content and DPPH·scavenging activity,the siftinghighcontentofactivesubstance,radicalscavenging activitystrongerthe ethylacetate extracted from leaves of Aegiceras corniculatum with alpha glycosidase enzymes activity inhibition in vitro experiments,through enzymatic dynamics method with Lineweaver-Burk curve drawing,deduce the ethyl acetate extracted from leaves of Aegiceras corniculatum of the type of enzyme inhibition,the results comparing with acarbose.Results showed that ethyl acetate parts from leaves of Aegiceras corniculatum and water area from leaves of Aegiceras corniculatum of alpha glycosidase enzymes had inhibitory effect,and inhibition were better than acarbose,its half inhibitory concentration(IC50)were 40.59 μg/mL and 60.79 μg/mL.The ethyl acetate extracted from leaves of Aegiceras corniculatum inhibit type to mixed typeⅡsuppression,the inhibition of the free enzyme(E)constant (Ki)0.245 mg/mL,on the complex enzyme-substrate(ES)inhibition of constant(Kis)0.023 mg/mL.
Key words:Aegiceras corniculatum;ethyl acetate extract;α-glucosidase inhibition

