ShSAP1的原核表達及多克隆抗體的制備
李曉君 周文吉 周啟武等
摘要:將ShSAP1的閱讀框連接到原核表達載體pET32a(+)中,構建成ShSAP1原核表達載體PET-ShSAP1,然后將其轉入宿主菌BL21,經IPTG誘導后,宿主菌表達出與預期分子量大小相符的35 ku的融合蛋白;將純化后的融合蛋白免疫家兔,獲得了ShSAP1的特異性抗血清;以融合蛋白作抗原,用間接ELISA法測定其抗血清效價為1 ∶25 000。
關鍵詞:甘蔗;ShSAP1;鋅指蛋白;原核表達;多克隆抗體
中圖分類號: Q331 文獻標志碼: A
文章編號:1002-1302(2015)03-0043-03
逆境相關蛋白(stress assiated protein,SAP)是植物中一類含有A20與AN1鋅指結構的蛋白,該蛋白家族與植物的非生物脅迫應答密切相關。SAP基因的表達能夠被1種或多種非生物脅迫誘導,轉基因研究發現SAP家族基因可以增強轉基因植物的對1種或多種脅迫的抗逆性[1]。目前關于SAP的作用機制還不是很清楚,研究發現SAP可能通過泛素蛋白酶途徑、蛋白相互作用或作為氧化還原感受器參與植物的逆境應答過程[2-4]。ShSAP1(GenBank登錄號HM991960.1)是由甘蔗(Saccharum officinarum L.)中克隆到的SAP家族基因,研究發現該基因的表達具有逆境應答特性[5],目前正在開展ShSAP1的轉基因功能分析。本研究構建了ShSAP1的原核表達載體,通過大腸桿菌原核表達系統進行ShSAP1的蛋白表達與純化,并通過免疫家兔獲得了抗血清,為ShSAP1蛋白功能研究及的后續的轉基因檢測打下了基礎。
1 材料與方法
1.1 試驗材料
原核表達載體pET32a(+)由中國熱帶農業科學院熱帶生物技術研究所劉志昕實驗室惠贈,大腸桿菌菌株DH5α和BL21(DE3)感受態細胞感受態購自天根生化科技有限公司。rTaq酶購自大連寶生物工程有限公司,限制性內切酶,T4連接酶購自Fermantas公司,PCR產物純化試劑盒、膠回收試劑盒及質粒提取試劑盒購自Axygen公司,蛋白Marker、蛋白純化試劑盒購自天根生化科技(北京)有限公司,Goat Anti-Rabbit IgG-AP與BCIP/NBT堿性磷酸酯酶顯色試劑盒購自北京康為世紀生物科技有限公司,其他試劑為國產分析純。本試驗所用的引物序列如下,由上海生工生物工程技術有限公司合成。
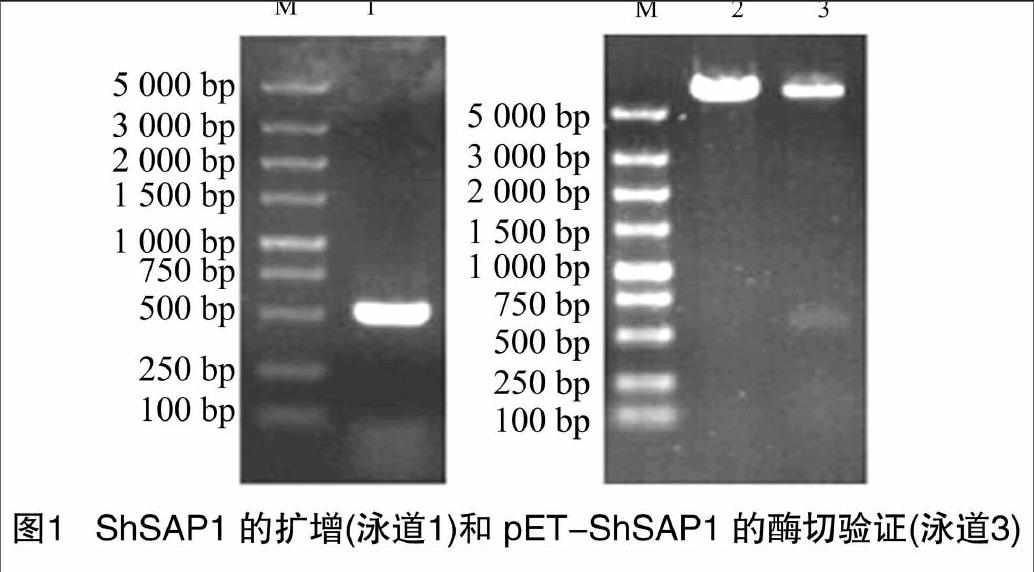
1.2 ShSAP1原核表達載體的構建
由甘蔗cDNA擴增ShSAP1基因閱讀框,所用引物為PETZP1和PTEZP2,PCR反應條件為:94 ℃ 3 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,30個循環;72 ℃ 10 min。純化PCR產物,用限制性內切酶BamHⅠ和HindⅢ對純化后PCR產物和pET32a(+)質粒進行雙酶切,瓊脂糖凝膠電泳后回收PCR產物酶切片段和pET32a(+)大片段,用T4連接酶連接轉化DH5α,重組質粒進行酶切驗證后送往上海生工生物工程技術服務有限公司測序,獲得原核表達載體pET-ShSAP1。
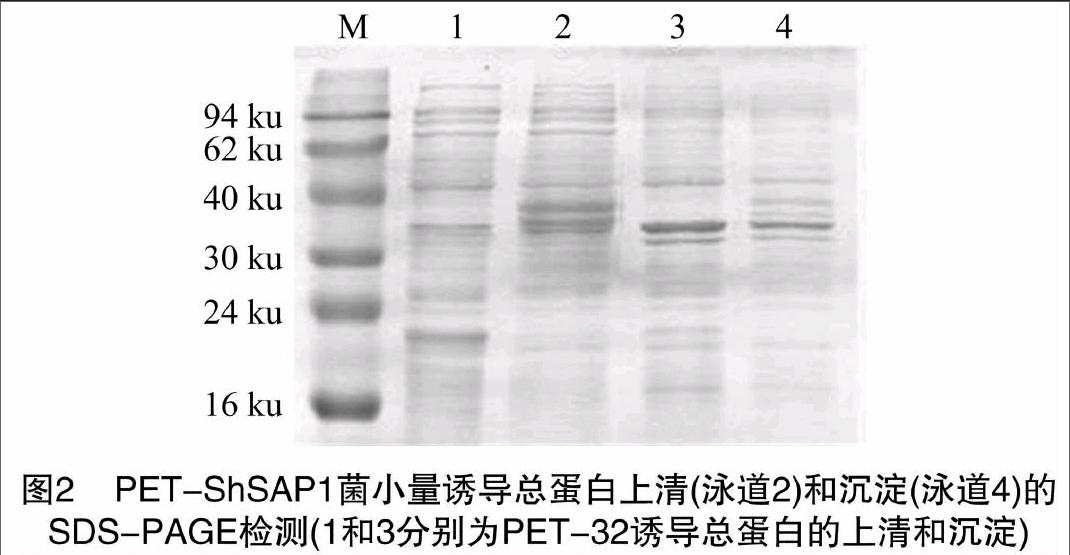
1.3 融合蛋白的小量表達
將pET32a(+)與測序驗證后的原核表達載體pET-ShSAP1轉化BL21(DE3),挑取陽性單菌落接種于10 mL含有Amp的LB液體培養基中,37 ℃、200 r/min培養。培養至D=0.6~0.8,各取1 mL分裝于滅菌的1.5 mL EP管中,加等體積35%甘油,混勻,-70 ℃保存。試管中剩余菌液用加入終濃度為1.0 mmol/L的IPTG誘導,37 ℃、200 r/min培養 3~4 h。超聲波破碎菌體,取1.5 mL的EP管,分別取1 mL破碎后的菌液,12 000 r/min離心1 min。沉淀用100 μL的無菌水吹散。分別取10 μL上清和10 μL沉淀懸浮液進行 SDS-PAGE 分析,考馬斯亮藍R-250染色30 min后進行脫色,鑒定表達產物的存在形式及表達量。
1.4 融合蛋白的大量表達與純化
將小量表達驗證過的pET32a(+)和pET-ShSAP1菌液進行劃線培養,挑取陽性單菌落接種于10 mL含有Amp的LB液體培養基中,于37 ℃活化培養8 h后,以1 ∶100稀釋到400 mL含有Amp的LB液體培養基中,振蕩培養至D600 nm值達到0.6~0.8,加入終濃度為1.0 mmol/L的IPTG,繼續于 37 ℃ 培養8 h誘導蛋白表達。8 000 r/min離心10 min,收集菌體,棄上清,加入30 mL Binding Buffer(500 mmol/L NaCl、20 mmol/L imidazole、10 mmol/L Tris-HCl,pH值8.0)重懸,使用超聲波破碎法在冰浴中對菌體進行破碎,8 000 r/min離心10 min,分離裂解液上清保存,取10 μL上清液進行SDS-PAGE分析。
蛋白純化:用6 mL滅菌水洗滌瓊脂糖樹脂2次后,以 6 mL Binding Buffer平衡親和柱。取6 mL裂解液上清上柱,用6 mL Wash Buffer(500 mmol/L NaCl、20 mmol/L imidazole、20 mmol/L Tris-HCl,pH值8.0)洗脫雜蛋白,再分別以由低至高的咪唑濃度的6 mL Elute Buffer(500 mmol/L NaCl,50、100、200、500 mmol/L imidazole,20 mmol/L Tris-HCl,pH值8.0)洗脫融合蛋白,取10 μL洗脫液進行SDS-PAGE分析。同時,將純化蛋白送往北京華大基因測序中心進行質譜測序分析。選取濃度與純度較好的洗脫液進行1×PBS透析,透析3次后進行蛋白濃度測定既可用于免疫兔子,蛋白濃度(mg/mL)=1.45D280 nm-0.74D260 nm[6]。

