苦參素對人肺腺癌A549細胞放射敏感性的影響及其機制
史衛林,李堅,陸建保,陳萍,周玉濤
(1.溧陽市人民醫院呼吸內科,江蘇溧陽213300;2.江蘇大學附屬醫院呼吸內科,江蘇鎮江212001)
苦參素對人肺腺癌A549細胞放射敏感性的影響及其機制
史衛林1,李堅2,陸建保1,陳萍2,周玉濤1
(1.溧陽市人民醫院呼吸內科,江蘇溧陽213300;2.江蘇大學附屬醫院呼吸內科,江蘇鎮江212001)
目的:觀察苦參素聯合放射線照射對人肺腺癌A549細胞增殖率以及DNA依賴性蛋白酶(DNA dependent protein kinase,DNA-PK)的兩類結構亞基DNA-PKcs及Ku80 mRNA表達的影響。方法根據不同的處理條件,將A549細胞分為對照組,單純照射組,單純藥物組,藥物聯合照射組。通過CCK-8法檢測細胞增殖率,并應用實時熒光定量PCR技術檢測DNA-PKcs及Ku80 mRNA的相對表達水平。結果:苦參素明顯抑制A549細胞的增殖,呈時間和劑量依賴性(P<0.05),其24 h和48 h的半數抑制濃度(IC50)值分別為3.2 g/L和2.4 g/L。單純照射組隨著照射時間的延長和放射線劑量的增加,細胞增殖率明顯下降(P<0.05);藥物聯合照射組細胞隨著照射時間的延長,細胞增殖率也隨之明顯下降(P<0.05);在同一時間點,藥物聯合照射組細胞增殖率下降比單純照射組更為明顯(P<0.05)。此外,在單純照射組中,A549細胞DNA-PKcs及Ku80 mRNA的相對表達水平隨著照射時間的延長和放射線劑量的增加而增高(P<0.01);較對照組而言,單純藥物組DNA-PKcs及Ku80 mRNA的相對表達水平明顯下調(P<0.01);與對應的單純照射組比較,藥物聯合照射組DNA-PKcs及Ku80 mRNA相對表達水平明顯下調(P<0.01)。結論:苦參素對腫瘤細胞具有放射線增敏作用。輻射可明顯增加肺癌細胞DNA-PKcs及Ku80 mRNA的相對表達水平,苦參素對A549細胞的放射線增敏效應至少部分是與抑制DNA-PKcs及Ku80 mRNA的表達,從而抑制DNA損傷修復有關。
肺癌;苦參素;放射敏感性;DNA依賴性蛋白酶
放療是中晚期肺癌患者的一個重要治療手段。腫瘤細胞受到放射線照射后主要發生堿基損傷、DNA單鏈斷裂、DNA雙鏈斷裂以及DNA-蛋白質交聯等損傷,其中最主要是雙鏈斷裂,而細胞可以修復雙鏈斷裂從而對放射線產生放療耐受。現有研究認為DNA依賴性蛋白酶(DNA dependent protein kinase,DNA-PK)通過修復雙鏈斷裂,影響細胞對放射線的敏感性[1]。DNA-PKcs及Ku80是DNA-PK的結構亞基,參與DNA非同源末端連接(non-homologous end joining,NHEJ)修復,是研究腫瘤細胞放療敏感性的重要靶點。近年來,雖然腫瘤放療技術已取得較大進展,但仍有部分患者放射治療失敗。而且對放射治療有效的患者復發后再放療效果常常不明顯,究其原因主要與腫瘤細胞對放射線耐受有關。苦參素是中藥苦參的主要活性成分之一,具有放療增敏作用[2],但機制尚未闡明。本實驗通過觀察苦參素聯合放射線照射對肺癌A549細胞增殖率以及DNA-PKcs、Ku80 mRNA表達的影響,探討苦參素放療增敏的作用機制。
1 材料與方法
1.1 主要試劑與儀器
DMEM培養基和0.25%胰蛋白酶(美國Gibco公司),苦參素標準品(北京中科儀友化工技術研究院),CCK-8試劑盒(生工生物工程上海股份有限公司),Trizol試劑盒(美國Invitriogen公司),反轉錄試劑盒和熒光定量PCR試劑盒(日本TaKaRa公司),倒置式生物顯微鏡(日本奧林巴斯公司),Clinac 600c 6MV直線加速器(美國Varian公司),HT-2型酶標儀(Austria公司),熒光定量PCR分析儀(美國Stratagene公司),人肺腺癌A549細胞株由江蘇大學醫學院提供。
1.2 苦參素作用于A549細胞后細胞增殖率的測定
取對數生長期的A549細胞,接種至96孔板,每孔100μL(細胞數約5×103/孔),每一實驗組(按苦參素濃度)設6個復孔,培養12 h后移液槍小心吸取上清液,分別將含有苦參素質量濃度為0,0.5,1.0,2.0以及4.0 g/L的培養基100μL加入對應的孔中,其中0 g/L設為陰性對照組,同時設立空白組。然后置于37℃、5%CO2培養箱孵育,分別在培養24 h和48 h后于對應的各孔中加CCK-8試劑10 μL,繼續于37℃恒溫條件下培養1 h,酶標儀上測定450 nm處光密度(D)值。實驗重復3次。用空白組調零后,計算各組細胞增殖率(細胞增殖率=實驗組D值/對照組D值×100%)。
1.3 單純照射和藥物聯合放射線作用后細胞增殖率的測定
根據細胞抑制率,利用SPSS 17.0軟件計算出半數抑制濃度(IC50)值,選擇48 h 20%抑制濃度(IC20)值0.9 g/L作為加藥濃度。將處于對數生長期的A549細胞分為對照組,單純照射組,藥物聯合照射組,照射劑量分為1,2,4和8 Gy。在24 h和48 h分別測定細胞增殖率,測定方法同上。
1.4 實時熒光定量PCR法檢測細胞DNA-PKcs及Ku80 mRNA的表達
將處于對數生長期的A549細胞分為對照組,單純照射組,單純藥物組,藥物聯合照射組,照射劑量分為1,2,4和8 Gy,單純藥物組與藥物聯合照射組中苦參素質量濃度選定為0.9 g/L。根據實驗分組,接種細胞,在藥物及射線干預后的24,48 h收集細胞,使用Trizol試劑提取RNA,測定RNA濃度,然后進行反轉錄,最后進行PCR擴增。擴增條件:95℃5 min預變性,95℃變性30 s,58℃退火30 s,72℃延伸30 s,共40個循環。引物序列由上海捷瑞生物工程有限公司合成。GAPDH:上游引物5′-CGCTGAGTACGTCGTGGAGTC-3′,下游引物5′-GCTGATGATCTTGAGGCTGTTGTC-3′,產物長度172 bp;DNA-PKcs:上游引物5′-ATCTGTCATCTGCTGTGTCTTCAAT-3′,下游引物5′-CTGCTTCTCTGGCTTCTTTCCTAA-3′,產物長度197 bp。Ku80:上游引物5′-GCTAATCCTCAAGTCGGCGT-3′,下游引物5′-ATGGAGTCAATCAAAGCATCAACA-3′,產物長度182 bp。以GAPDH作為內參照,定量分析DNAPKcs及Ku80 mRNA的相對表達水平。目的基因相對表達水平的計算公式:2-ΔΔCt=2-(ΔCt目的基因-ΔCt標準值)。
1.5 統計學分析
2 結果
2.1 苦參素對A549細胞增殖率的影響
不同質量濃度的苦參素處理A549細胞后,細胞增殖率隨苦參素作用時間的延長及濃度的增大而下降,呈時間(P<0.05)和劑量依賴性(P<0.05)。4種質量濃度的苦參素作用后細胞的增殖率見圖1。24 h的IC50值為3.2 g/L,48 h的IC50值為2.4 g/L,48 h的IC20值為0.9 g/L。
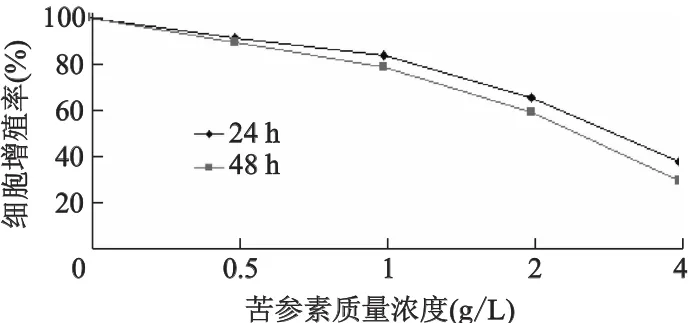
圖1 不同質量濃度苦參素作用后A549細胞的增殖率
2.2 單純照射和藥物聯合照射處理對A549細胞增殖率的影響
如圖2所示,當藥物聯合照射組中苦參素質量濃度設定為0.9 g/L時,隨著照射時間的延長和照射劑量的增加,單純照射組和藥物聯合照射組的A549細胞增殖率明顯下降(P<0.05);在同一時間點,與對應的照射組比較,藥物聯合照射組的細胞增殖率明顯下降(P<0.05)。以上結果表明,苦參素可明顯增加A549細胞對放射線的敏感性。

圖2 不同放射線劑量對兩組A549細胞增殖率的影響
2.3 單純照射和藥物聯合照射作用后A549細胞DNA-PKcs和Ku80 mRNA的相對表達水平
與對照組(對照組中DNA-PKcs和Ku80 mRNA的表達量設定為1)比較,單純照射組DNA-PKcs和Ku80 mRNA的相對表達水平隨著時間的延長和照射劑量的增加明顯增高(P<0.01),見表1、表2。單純藥物組的DNA-PKcs和Ku80 mRNA相對表達水平比對照組明顯下降(P<0.01);在同一時間及同一放射線劑量,藥物聯合照射組的DNA-PKcs和Ku80 mRNA相對表達水平較單純照射組顯著降低(P<0.01),見表3、表4。結果提示,放射線可以誘導A549細胞DNA-PKcs和Ku80基因表達的增加,而苦參素可下調A549細胞的DNA-PKcs和Ku80 mRNA表達水平。

表1 4種劑量X射線處理后A549細胞DNA-PKcsm RNA的相對表達水平

表2 4種劑量X射線處理后A549細胞Ku80 m RNA的相對表達水平

表3 5種劑量X-射線聯合苦參素(0.9 g/L)處理后A549細胞DNA-PKcsmRNA的相對表達水平

表4 5種劑量X射線聯合苦參素(0.9 g/L)處理后A549細胞Ku80 m RNA的相對表達水平
3 討論
苦參素(氧化苦參堿)來源于豆科植物苦參的干燥根,是中藥苦參的主要生物堿。近年來研究發現,苦參素有多方面的藥理活性,其中抗腫瘤作用受到了廣泛關注。它能夠抑制腫瘤細胞增殖,誘導腫瘤細胞分化和凋亡,抑制腫瘤新生血管形成和腫瘤侵襲[3-8]。也有少量報道表明其有放療增敏作用[2],但機制不甚清楚。本實驗結果顯示,苦參素能夠抑制A549細胞的增殖,這一作用呈時間和劑量依賴性。而且與單純照射組比較,苦參素聯合照射組的A549細胞增殖率明顯降低,表明苦參素可增加肺腺癌細胞對放射線的敏感性。
DNA是放射線作用的主要靶點,放射線的直接作用和電離效應產生的自由基共同導致DNA單、雙鏈斷裂損傷,其中以雙鏈斷裂為放射線殺傷腫瘤細胞最重要的機制。當DNA雙鏈受到損傷時,細胞將通過不同的途經啟動應答進行DNA修復以克服損傷。在哺乳動物細胞中,雙鏈斷裂修復有兩條途徑:同源性重組(homologous recombination,HR)和NHEJ,其中NHEJ途徑是主要修復途徑[9]。DNAPKcs基因位于染色體8q11,編碼相對分子質量為469 000的蛋白質,其C-末端結構域和參與信號傳導的磷脂酰肌醇3-激酶(PI3-K)有同源性[10]。人Ku80基因位于染色體2q33-34,編碼相對分子質量約為86 000的蛋白,參與DNA-PK與其他蛋白的相互作用,它與Ku70緊密結合,形成Ku蛋白[11]。當DNA雙鏈損傷時,2個Ku分子特異性地連接到DNA雙鏈損傷處,分別識別并結合于每一條DNA鏈末端,然后以ATP依賴的方式沿DNA鏈分別向兩端滑動一小段距離,同時Ku本身具有的弱解旋酶活性使兩個斷端局部解鏈,從而形成Ku-DNA復合物吸引DNA-PKcs到損傷部位,位于兩個斷裂末端的DNA-PK蛋白復合體通過各自的氨基端相互作用搭橋,拉近DNA損傷末端,并激活DNA-PKcs的絲/蘇氨酸激酶活性,磷酸化參與NHEJ的一系列蛋白質,對DNA損傷位點進行恰當的剪切和連接,當修復完成后DNA-PK發生自身磷酸化,使2個亞單位從DNA鏈上解離[12-13]。作為DNA-PK復合物的主要功能單位,DNA-PKcs與Ku80是研究腫瘤細胞放療敏感性的重要靶點。
大量研究顯示,DNA-PKcs和Ku80基因或者蛋白高表達的腫瘤細胞對放射線耐受,而低表達則對放射線高度敏感[14-15]。有研究顯示,通過抑制腫瘤細胞DNA-PKcs的表達或抑制其磷酸化,或者抑制Ku80的表達,均可提高腫瘤細胞對放射線的敏感性[16-21],說明DNA-PKcs和Ku80的表達水平是影響細胞對放射線敏感性的重要因素。本實驗結果顯示,單純用放射線照射后隨著照射時間的延長,照射劑量的增強,肺腺癌細胞DNA-PKcs和Ku80 mRNA的相對表達水平相應增加。這一結果表明,放射線在殺傷肺癌細胞的同時也誘導了DNA-PKcs和Ku80基因的表達增加,NHEJ通路的DNA損傷修復功能被激活,以抵抗放射線對肺癌細胞DNA的損傷作用,同樣證明了DNA-PKcs和Ku80在肺腺癌細胞對放療的耐受中起著重要作用,其表達水平可以作為預測腫瘤對放療敏感性的標志。我們的實驗結果還顯示,單純藥物組中DNA-PKcs和Ku80 mRNA的表達水平下調,藥物聯合照射組與對應的單純照射組相比較,其相對表達水平明顯下調,這也表明了苦參素可下調肺腺癌細胞DNA-PKcs和Ku80的表達水平,通過抑制DNA的修復功能,增加細胞對放射線的敏感性,這也可能是其放療增敏機制之一。
綜上所述,苦參素具有放射線增敏作用,其增敏機制之一可能是通過下調DNA-PKcs和Ku80的表達,抑制細胞DNA損傷的修復功能。苦參素放射線增敏作用的確切機制仍需進一步深入研究。
[1] Mi J,Dziegielewski J,Bolesta E,et al.Activation of DNA-PK by ionizing radiation is mediated by protein phosphatase 6[J].PLoSOne,2009,4(2):e4395.
[2] 田瑞華,陳祥明,楊雪.苦參素葡萄糖注射液聯合放療治療食管癌的臨床研究[J].實用臨床醫藥雜志,2010,14(23):67-68.
[3] Wu XS,Yang T,Gu J,et al.Effects of oxymatrine on the apoptosis and proliferation of gallbladder cancer cells[J].Anticancer Drugs,2014,25(9):1007-1015.
[4] Ho JW,Ngan Hon PL,Chim WO.Effects ofoxymatrine from Ku Shen on cancer cells[J].Anticancer Agents Med Chem,2009,9(8):823-826.
[5] Guo B,Zhang T,Su J,et al.Oxymatrine targets EGFR(p-Tyr845)and inhibits EGFR-related signaling pathways to suppress the proliferation and invasion of gastric cancer cells[J].Cancer Chemother Pharmacol,2015,75(2):353-363.
[6] Chen H,Zhang J,Luo J,et al.Antiangiogenic effects of oxymatrine on pancreatic cancer by inhibition of the NF-κB-mediated VEGF signaling pathway[J].Oncol Rep,2013,30(2):589-595.
[7] 彭向前,張文會,李軍.氧化苦參堿逆轉多藥耐藥細胞系K562/A02耐藥性的研究[J].中國腫瘤臨床,2008,35(19):1127-1130.
[8] 王銳,姜小軍,鄭婕,等.氧化苦參堿增強環磷酰胺對小鼠Lewis肺癌生長的抑制作用[J].第二軍醫大學學報,2008,29(4):399-403.
[9] Lieber MR,Ma Y,Pannicke U,et al.Mechanism and regulation of human non-homologous DNA end-joining[J].Nat Rev Mol Cell Biol,2003,4(9):712-720.
[10] Rivera-Calzada A,Maman JD,Spagnolo L,et al.Threedimensional structure of the human DNA-PKcs/Ku70/ Ku80 complex assembled on DNA and its implications for DNA DSB repair[J].Structure,2005,13(2):243-255.
[11] Singleton BK,Torres-Arzayus MI,Rottinghaus ST,et al.The C terminus of Ku80 activates the DNA-dependent protein kinase catalytic subunit[J].Mol Cell Biol,1999,19(5):3267-3277.
[12] Collis SJ,DeWeese TL,Jeggo PA,et al.The life and death of DNA-PK[J].Oncogene,2005,24(6):949-961.
[13] Spagnolo L,Rivera-Calzada A,Pearl LH,et al.Three-dimensional structure of the human DNA-PKcs/Ku70/ Ku80 complex assembled on DNA and its implications for DNA DSB repair[J].Mol Cell,2006,22(4):511-519.
[14] 張宇卉,折虹,王艷陽,等.宮頸癌組織LIG4、XRCC4、XRCC5、XRCC6、XRCC7的mRNA表達及與放療敏感性的關系[J].寧夏醫科大學學報,2013,35(4):398-401.
[15] Harima Y,Sawada S,Miyazaki Y,et al.Expression of Ku80 in cervical cancer correlates with response to radiotherapy and survival[J].Am JClin Oncol,2003,26(4):e80-e85.
[16] 莊亮,于世英,黃曉園,等.DNA-PKcs、Ku80及ATM備選宮頸癌放療增敏靶點的體外研究[J].癌癥,2007,26(7):724-729.
[17] 牛道立,蔣昌斌,甄俊杰,等.DNA-PKCS反義寡核苷酸轉染肺腺癌細胞系A549提高放射敏感性的實驗研究[J].中華放射腫瘤學雜志,2009,18(1):73-75.
[18] Sun X,Yang C,Liu H,etal.Identification and characterization of a small inhibitory peptide that can target DNAPKcs autophosphorylation and increase tumor radiosensitivity[J].Int JRadiat Oncol Biol Phys,2012,84(5):1212-1219.
[19] Zhou X,Zhang X,Xie Y,et al.DNA-PKcs inhibition sensitizes cancer cells to carbon-ion irradiation via telomere capping disruption[J].PLoSOne,2013,8(8):e72641.
[20] Zhang T,Zhang L,Zhang T,et al.Metformin sensitizes prostate cancer cells to radiation through EGFR/p-DNAPKCS in vitro and in vivo[J].Radiat Res,2014,181(6):641-649.
[21] 任振義,金兒,葉健,等.用Ku80 siRNA抑制Ku80基因表達以提高肺癌細胞放射敏感性的實驗研究[J].中國呼吸與危重監護雜志,2010,9(3):291-294.
Effect of oxymatrine on radiosensitivity of A549 cells and its possiblemolecular mechanism
SHIWei-lin1,LI Jian2,LU Jian-bao1,CHEN Ping2,ZHOU Yu-tao1
(1.Department of Respiratory Medicine,the People′s Hospital of Liyang City,Liyang Jiangsu 213300;2.Department of Respiratory Medicine,the Affiliated Hospital of Jiangsu University,Zhenjiang Jiangsu 212001,China)
Objective:To investigate the mechanism of oxymatrine in enhancing the sensitivity of lung cancer cells to radiation.M ethods:The A549 cellswere divided into control group,radiation group,drug group,drug plus radiation group according to treatment condition.The cell counting kit-8 assay was used to determine proliferation rate.The real-time quantitative PCR assays were conducted tomeasure DNA-PKcs and Ku80 mRNA expression levels at 24 h and 48 h following treatment with oxymatrine,or radiation,or oxymatrine plus radiation.Results:Oxymatrine significantly inhibited the proliferation of A549 cells in a dose and time dependentmanner(both P<0.05).IC50of A549 cells for oxymatrine at24 h and 48 h were 3.2 g/L and 2.4 g/L,respectively.The proliferation rates of A549 cells in the radiation group were decreased in a time and dose dependentmanner(both P<0.05).At the same time points,the cell proliferation rates in the drug plus radiation group were dropped markedly when compared with the radiation group(P<0.05).Additionally,the relative expression levels of DNA-PKcs and Ku80 mRNA were increased in a dose and time dependentmanner in the radiation group(both P<0.01).The relative expression levels of DNA-PKcs and Ku80mRNA in the drug plus radiation group were reduced significantly as compared with inthe radiation group(P<0.01).Conclusion:Oxymatrine enhanced the sensitivity of A549 cell to radiation,at least partially,by inhibiting DNA-PKcs and Ku80 mRNA expression and damage of DNA damage repairmechanisms.
lung cancer;oxymatrine;radiosensitivity;DNA dependent protein kinase
R734.1 [文獻標志碼] A [文章編號] 1671-7783(2015)03-0207-05
10.13312/j.issn.1671-7783.y150083
溧陽市科技計劃項目(溧科發[2013]5);江蘇大學醫學臨床科技發展基金資助項目(JLY20120116)
史衛林(1982—),男,江蘇溧陽人,主治醫師,主要從事肺癌分子診斷研究。
2015-04-04 [編輯]陳海林

