老年胃癌患者圍手術期營養評估及術后早期腸內營養的臨床研究
葉 春,張忻平,王希澤,張雪峰
·論 著·
老年胃癌患者圍手術期營養評估及術后早期腸內營養的臨床研究
葉 春,張忻平,王希澤,張雪峰
目的 評估老年胃癌患者圍手術期的營養狀況,為營養支持提供依據,觀察術后早期腸內營養的臨床價值。方法 選取2014年4月-2015年3月我院收治58例老年胃癌患者作為研究對象,應用營養風險篩查2002(NRS2002)進行營養評估,3分以下的10例患者未進行營養支持治療(NN)。將存在營養風險的48例患者隨機分為早期腸內營養(EN)組和腸外營養(PN)組,EN組23例術中置鼻腸管,給予早期腸內營養治療,TPN組25例給予腸外營養治療,比較兩組的臨床指標、胃腸功能和術后并發癥、營養狀態和免疫功能。結果 在老年胃癌患者中存在營養風險者所占比例為81.0%(47/58);兩組患者術中出血量、手術時間、術后48 h的液體引流量比較差異無統計學意義(P>0.05),患者術后的住院時間、住院費用及胃腸功能恢復時間比較差異具有統計學意義(P<0.05)。兩組患者術后1周的白蛋白和前白蛋白水平比較差異具有統計學意義(P<0.05)。EN組治療1周后CD3+T細胞、CD4+T細胞、CD4+/CD8+均較治療前升高(P<0.01),治療后與PN組相比,CD4+T細胞、CD4+/CD8+上升更明顯(P<0.01),而CD8+T細胞下降(P<0.05)。NN組在術后l周后白蛋白及前白蛋白與術前比較無明顯變化(P>0.05)。NN組在治療l周后白蛋白及前白蛋白與術前比較無明顯變化(P>0.05)。結論 NRS2002評分對于指導老年胃癌患者營養治療具有一定效果。老年胃癌患者圍手術期的營養評估對指導營養治療具有一定意義。早期腸內營養可以促進老年胃癌患者營養狀態和免疫功能的恢復,縮短住院時間。
老年胃癌;圍手術期營養評估;早期腸內營養;營養支持
胃癌是最常見的消化道惡性腫瘤,好發年齡在50歲以上,男性多發于女性。根治性手術依然是治療胃癌的首選方法[1]。但老年胃癌患者一般機體基礎條件較差,就診時多數為中晚期,且合并有不同程度的營養不良,對于手術的耐受性降低,從而導致術后并發癥的發生。腸內營養能有效改善機體營養狀況,提高機體對外界損傷的抵抗力[2?3]。本研究應用營養風險篩查2002(NRS2002)進行圍手術期的營養評估,并采用術中留置鼻腸管為23例老年胃癌患者進行術后早期腸內營養治療,觀察術后免疫功能及營養狀態的影響。
1 對象與方法
1.1 對象 選取2014年4月-2015年3月期間我院確診為胃癌的患者58例,男32例,女26例,臨床病理分期采用UICC第6版TNM分期標準。患者年齡(66.3±5.5)歲,均施行胃癌根治術。圍手術期行營養評估∶符合NRS2002評定標準,填寫營養風險篩查表格,3分以上提示存在營養風險。本組患者中10例為3分以下,未進行營養支持治療(nonutri?tion,NN)。將3分以上的48例老年胃癌患者隨機分為早期腸內營養(earlyenteral nutrition,EN)組23例,腸外營養(parentalnutrition,PN)組25例。兩組患者的年齡、性別、臨床病理分期、NRS2002評分差異無統計學意義,具有可比性(P>0.05)。
1.2 方法 EN組∶術中采用鼻腸管前端放入空腸上段,外部固定于鼻部,術后給予百普力腸內營養支持治療。具體實施方法∶術后24 h予葡萄糖液500 mL(40~60 mL/h)持續鼻空腸管滴注,如無不適經輸液泵勻速滴入營養液百普力。第1、2天給予500 mL,第3天給予1000 mL,第4天開始給予1500 mL,其余液體經靜脈補給。PN組∶給予葡萄糖、氨基酸、中長鏈脂肪乳、等滲鹽水、胰島素、維生素以及微量元素等組成的營養袋(2000 mL/袋),經中心靜脈滴入。術后第1天給予半量,術后第2天開始給予全量,24 h緩慢靜脈滴入。兩組營養支持維持時間為7~8 d。NN組∶術后給予等滲鹽水及葡萄糖液,2~4 d后根據患者胃腸功能恢復情況逐漸過渡至經口進食。
1.3 觀察指標 臨床指標∶術前評定患者NRS2002評分,記錄兩組患者的術中出血量、手術時間、術后48 h的液體引流量、住院時間、住院費用及胃腸功能恢復情況。營養狀態及免疫功能∶檢測術前、術后1 d與術后1周的血清白蛋白(ALB)、前白蛋白(PA)和T淋巴細胞亞群分布。
1.4 統計學處理 采用SPSS15.0軟件包進行統計學分析,計量資料用均數±標準差(ˉ±s)表示,兩組間均數比較采用t檢驗;計數資料以例(率)表示,組間比較采用χ2檢驗,重復測量采用方差分析。P<0.05為差異有統計學意義。
2 結 果
2.1 三組患者的一般臨床資料 三組患者的年齡、性別、臨床病理分期(Ⅱ、Ⅲ期)、NRS2002評分差異均無統計學意義(P>0.05)。見表1。

表1 三組患者的一般臨床資料比較
2.2 NRS2002評分結果 在老年胃癌中3分以上者占81.0%(47/58),EN和PN組評分比較差異無統計學意義(P>0.05),見表2。

表2 老年胃癌患者NRS2002評分比較[n(%)]
2.3 三組患者的臨床指標 EN與PN組患者的術中出血量、手術時間、術后48 h的液體引流量比較差異無統計學意義(P>0.05)。術后的住院時間、住院費用及胃腸功能恢復時間比較差異具有統計學意義(P<0.05),見表3。
表3 三組患者的臨床指標比較(s)
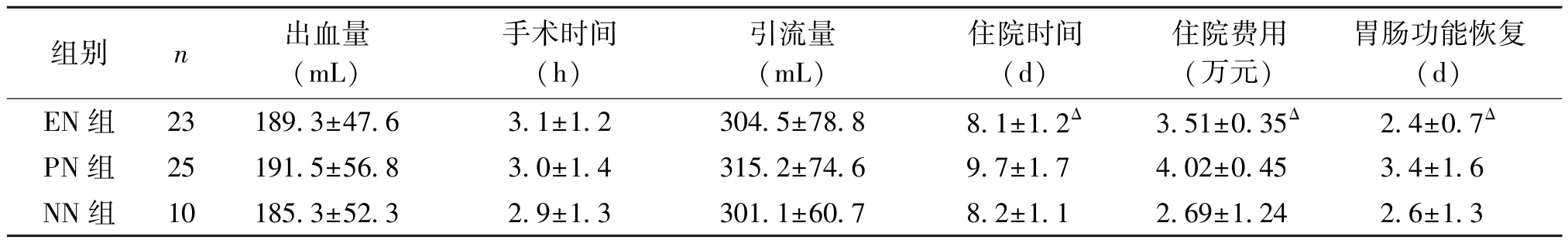
表3 三組患者的臨床指標比較(s)
注∶與PN組比較,ΔP<0.05
組別n出血量(mL)手術時間(h)引流量(mL)住院時間(d)住院費用(萬元)胃腸功能恢復(d)EN組23189.3±47.63.1±1.2304.5±78.88.1±1.2Δ3.51±0.35Δ2.4±0.7ΔPN組25191.5±56.83.0±1.4315.2±74.69.7±1.74.02±0.453.4±1.6 NN組10185.3±52.32.9±1.3301.1±60.78.2±1.12.69±1.242.6±1.3
表4 三組患者的臨床指標比較(ˉ±s)

表4 三組患者的臨床指標比較(ˉ±s)
注∶與PN組、EN組同組間、PN組同組間比較,ΔP<0.05
時間白蛋白(g/L)前白蛋白(mg/L)EN組(n=23)PN組(n=25)NN組(n=10)EN組(n=23)PN組(n=25)NN組(n=10)術前26.7±6.326.1±6.334.7±7.2116.1±12.1130.1±15.2234.8±15.3術后1周35.4±2.6Δ31.2±23.0Δ35.1±7.3287.2±17.5Δ225.3±18.6Δ239.2±17.4?
表5 兩組患者的免疫功能比較(ˉ±s)
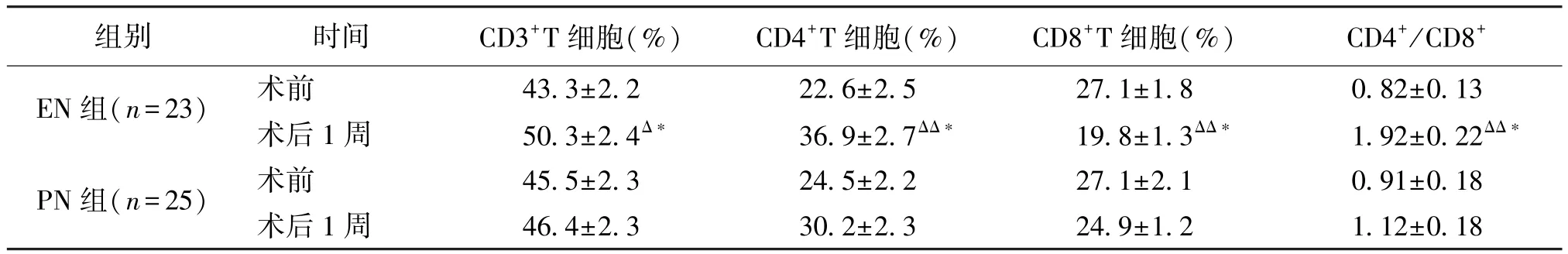
表5 兩組患者的免疫功能比較(ˉ±s)
注∶與PN組同期比較,ΔP<0.05,ΔΔP<0.01;EN組、PN組同組間與術前比較,?P<0.01
組別時間CD3+T細胞(%)CD4+T細胞(%)CD8+T細胞(%)CD4+/CD8+EN組(n=23)術前43.3±2.222.6±2.527.1±1.80.82±0.13術后1周50.3±2.4Δ?36.9±2.7ΔΔ?19.8±1.3ΔΔ?1.92±0.22ΔΔ?PN組(n=25)術前45.5±2.324.5±2.227.1±2.10.91±0.18術后1周46.4±2.330.2±2.324.9±1.21.12±0.18
2.4 三組患者的營養狀態 EN與PN組患者術后1周,兩組患者的血清白蛋白和前白蛋白水平比較差異具有統計學意義(P<0.05)。NN組在治療1周后白蛋白及前白蛋白與術前比較無明顯變化(P>0.05),見表4。
2.5 EN、PN組患者的免疫功能 EN組術后1周后CD3+T細胞、CD4+T細胞、CD4+/CD8+與治療前比較均升高(P<0.01),術后1周后EN組CD4+T細胞由(22.6±2.5)%上升為(36.9±2.7)%,CD4+/CD8+由(0.82±0.13)升高為(1.92±0.22),與PN組比較,均上升更明顯,差異有統計學意義(P<0.01),而CD8+T細胞下降更顯著(P<0.01),見表5。
3 討 論
有研究表明應對所有腫瘤患者進行營養風險篩查及評估[4?5]。本研究采用歐洲腸外腸內營養學會(ESPEN)推薦的篩查工具“營養風險篩查2002”(nutrional risk screening 2002,NRS2002)[6]進行營養評估,發現81.0%的老年胃癌患者存在營養風險,術后對NRS評分>3分的患者進行營養治療后營養不良得到不同程度的緩解。對于無營養風險的患者不必給予營養支持治療,本研究中NN組患者在治療1周后白蛋白及前白蛋白與術前比較無明顯變化(P>0.05)。因此,胃腸外科老年患者入院后進行圍手術期的營養評估尤為重要,可為存在營養風險和營養不良的高風險老年患者盡早實施營養支持提供依據。
老年胃癌患者因長期胃腸功能障礙致營養不良,根治性手術再次加重其功能障礙,使術后恢復時間延長,增加手術后并發癥發生率和住院時間及醫療費用[7?8],營養支持在手術后尤為重要。因此,本研究探討術后早期給予老年胃癌患者腸內營養支持,對老年胃癌患者營養狀態及免疫功能的影響[9]。
小腸功能的恢復通常于術后6~12 h,故胃腸腫瘤患者早期行腸內營養具有可行性。腸內營養具有營養素直接經腸吸收、利用的優點,符合生理需求,給藥方便,費用低廉,更有助于維持腸黏膜結構和屏障功能完整性,減少腸源性感染的發生。特別對于高齡胃癌患者,其消化器官功能衰退,胃白酶、胰脂肪酶等消化酶活性下降,小腸黏膜表面積減少,對營養的消化與吸收能力降低。腸內營養液的直接刺激有利于預防腸黏膜萎縮,提高黏膜代謝及增生。而長期的全腸外營養缺乏食物對其有效刺激,致腸黏膜屏障功能損害,腸道細菌易位,引起腸道結構的改變和免疫功能障礙,增加院內感染、膿毒癥和器官衰竭等并發癥[10]。因此,圍手術期腸內營養更有利于改善患者的營養狀態。EN組23例采取早期腸內營養,患者術后的住院時間和住院花費均明顯少于PN組,患者術后排氣和排便早于PN組,胃腸道反應和并發癥的發生率并無明顯增加。有少數患者出現腸內營養的相關并發癥,根據研究表明術后全腸內營養會引起較多的并發癥,例如腹瀉,腹脹和腹痛。這些癥狀會隨著腸內營養制劑攝入量的增加而變得更加明顯,嚴重時應中止腸內營養治療。因此本研究EN組采取術后早期腸內、腸外聯合營養方式,逐漸加大腸內營養量,且配合減慢腸內營養制劑的輸注速度、應用加溫棒[11]以及積極的藥物治療,均未出現嚴重的胃腸道癥狀。
前白蛋白,又稱轉甲狀腺素蛋白,由肝細胞合成,其半衰期很短,因此測定其在血漿中的濃度對于了解蛋白質的營養不良、肝功能不全具有較高的敏感性[12]。白蛋白可通過加速新陳代謝而達到修復組織的功能[13],血清白蛋白水平與危重癥患者的預后有顯著相關性,在炎癥、惡性病變時常隨著白蛋白、前白蛋白同時下降。在慢性肝疾病及營養不良時亦下降,可以作為營養狀態的指標[14]。因此前白蛋白、白蛋白水平能夠較為有效地反映患者的營養狀況。本研究顯示,術后1周兩組患者的血清白蛋白和前白蛋白具有明顯的差異,說明EN組患者的營養狀態優于PN組。由此可知術后早期應用腸內營養可有效提高術后患者營養狀態,促進傷口愈合。
小腸是機體重要的免疫器官之一,存在大量的淋巴組織,同時也是淋巴細胞的發生地之一。細胞免疫是機體抗腫瘤免疫的主要方式[15],其中T淋巴細胞是細胞免疫的主要細胞。而小腸淋巴集合淋巴管內具有豐富的T細胞亞群,當接觸外界抗原后,T細胞被迅速激活,并向腸系膜淋巴管轉移,通過胸導管進入血液循環,參與全身的免疫反應。依據功能性T淋巴細胞表面分化抗原的不同,可將成熟的T淋巴細胞分為CD4+T細胞和CD8+T細胞。其中CD4+T細胞具有協調體液免疫和細胞免疫的功能,對各種免疫細胞都有輔助作用,而CD8+T細胞為抑制性T細胞,抑制抗體的生成和分泌以及T細胞的增殖[16],兩者的平衡狀態對機體的正常的免疫功能起重要的作用,CD4+/CD8+比值的降低說明機體的免疫功能降低[17]。故恢復和維持患者的腸道功能對患者的細胞和體液免疫功能具有重要意義。本研究顯示EN組治療1周后CD3+T細胞、CD4+T細胞、CD4/CD8均較治療前升高(P<0.01),且治療1周后EN組CD4+T細胞、CD4+/CD8+與PN組相比上升更明顯,差異有統計學意義(P<0.01),而CD8+T細胞下降更顯著(P<0.01),表明EN有效地改善老年胃癌患者術后免疫功能,對免疫功能的恢復優于腸外營養,對臨床治療有更積極的意義。
綜上所述,老年胃癌患者的營養風險是不容忽視的問題,加強圍手術期的營養評估,術后早期EN可改善患者營養狀況,既符合生理需要,促進腸功能恢復,又可改善術后營養和免疫狀況,減少住院時間及費用,是老年胃癌患者術后首選的營養治療方式,值得臨床推廣應用。
[1] Li QG,Li P,Tang D,et al.Impact of postoperative complications on longterm survival after radicalresection for gastric cancer[J].World J Gastroenterol,2013,19(25)∶4060?4065.
[2] Nakagawa M,Nagai K,Minami I,et al.Copper?deficiency anemia after esophagectomy∶a pitfall of postoperative enteral nutrition through jejunostomy[J].Int J Surg Case Rep,2014,5(6)∶311?314.
[3] 王晨光,傅芬蘭,張鵬程,等.全胃切除術后早期腸內外營養的臨床研究[J].腸外與腸內營養,2013,15(1)∶30?32.
[4] Zhou W,Xu X,Yan J,et al Nutritional risk is still a clinical pre?dictor of postoperative outcomes in laparoscopic abdominal surgery[J].Surg Endosc,2013,27(7)∶2569?2574.
[5] Yu K,zhou X,He S.A multicentre study to implement nutritional risk screening and evaluate clinical outcome and qualify of Iife in patients with cancer[J].Eur Jclin Nutr,2013,67(7)∶732?737.
[6] Moeeni V,Walls T,Day AS.Nutritional status and nutrition risk screening in hospitalized children in New Zealand[J].Acfa Paedi?atlrica,2013,102(9)∶419?423.
[7] Chopra SS,Haacke N,Meisel C,et al,Postoperative immunosup pression after open and laparoscopic liverresection∶assessment of cellular immune function and monocytic HLA?Drexpression[J].JSLS,2013,17(4)∶615?621.
[8] Lassen K,Coolsen MM,Slim K,et al.Guidelines for perioperative careforpancreaticoduodenectomy∶EnhancedRecoveryAfter Surgery(ERAS?)Society recommendations[J].Clin Nutr,2012,31(6)∶817?830.
[9] Tavares de Araujo VM,Gomes PC,Caporossi C,et al.Enteral nutritionincriticalpatients;shouldtheadministrationbe continuous or intermittent[J]Nutr Hosp,2014,29(3)∶563?567.[10]Elke G,Wang M,Weiler N,et al.Close to recommended caloric and protein intake by enteral nutrition is associated with better clinical outcome of critically ill septic patients∶secondary analysis of a large international nutrition database[J].Crit Care,2014,10,18(2)∶R29.
[11]竇志飛.吞咽障礙患者不同鼻飼方式腸內營養相關性腹瀉的發生率比較[J].東南國防醫藥,2013,15(3)∶294?295.
[12]Zhu XH,Wu YF,Qiu YD,et al.Effect of early enteral combined with parenteral nutrition in patients undergoing pancreaticoduode?nectomy[J].World J Gastroenterol,2013,19(35)∶5889?5896.
[13]Shao F,Xin FZ,Yang CG,et al.The impact of microbial immune enteral nutrition on the patients with acute radiation enteritis in bowel functionand immune status[J].Cell Biochem Biophys,2014,69(2)∶357?361.
[14]Liu H,Ling W,Shen ZY,et al.Clinical application of immune?enhanced enteral nutrition in patients withadvanced gastric cancer af ter total gastrectomy[J].J Dig Dis,2012,3(8)∶401?406.
[15]Zhao H,Zhao H,Wang Y,et al.Randomized clinical trial of ar?ginine?supplement?ted enteral nutrition versus standard enteral nu?trition in patientsundergoing gastric cancer surgery[J].J Cancer ResClin Oncol,2013,139(9)∶1465?1470.
[16]Gunerhan Y,Koksal N,Sahin UY,et al.Effect of preoperative immunonutrition and other nutrition models oncellular immune pa?rameters[J].World J Gastroenterol,2009,15(4)∶467?472.
[17]Yu G,Chen G,Huang B,et al.Effect of early enteral nutrition on postoperative nutritionalstatusandimmunefunctioninelderly patients with esophageal cancer or cardiac cancer[J].Chin J Cancer Res,2013,25(3)∶299?305.
Research on the nutritional risk in elderly patients with gastric cancer and clinical study of early enteral nu?trition support in the postoperative elderly gastric cancer
YE Chun,ZHANG Xin?ping,WANG Xi?ze,ZHANG Xue?feng. Department of General Surgery,General Hospital of Shenyang Military Command,Shenyang,Liaoning 110840,China
Objective To evaluate perioperative nutritional status of the elderly patients with gastric cancer,provide the basis for nutritional support,and to observe the clinical value of early postoperative enteral nutrition.Methods Select 58 cases of elderly patients with gastric cancer from April 2014 to March 2015 in our hospital as the research object.the application of nutritional risk screening 2002(NRS2002)was applied in nutrition assessment and 10 patients below 3 points were not performed with nutritional sup?port therapy(NN).48 patients with nutritional risk were randomly divided into early enteral nutrition(EN)and parenteral nutrition(PN)group.23 cases of EN group inserted nasointestinal tube and gave early enteral nutrition therapy;25 cases of TPN group gave parenteral nutrition therapy.Clinical signs,gastrointestinal function and postoperative complications,nutritional status and immune function were compared between two groups.Results Patients with nutritional risk was shown in 81.0%(47/58)elderly patients with gastric cancer.There was no statistical difference(P>0.05)between two groups in intraoperative blood loss,operative time,postopera?tive 48 h liquid.Postoperative hospital stay,hospital expenses and gastrointestinal function recovery time were statistically different(P<0.05).There was statistical difference(P<0.05)in level of ALB and PA between two groups after postoperative 1 week.CD3+,CD4+,CD4+/CD8+of EN group after One week were higher(P<0.01)than before treatment.Compared with PN group,CD4+,CD4+/CD8+rised more obvious(P<0.01),while CD8+drop difference was statistically significant(P<0.05).NN groups l weeks after surgery compared with preoperative albumin and albumin has no obvious change(P>0.05).There was no statistical difference(P>0.05)of albumin and prealbumin in NN group after treatment for l weeks than before.Conclusion It is effective to guide nutri?tional treatment for elderly patients with gastric cancer by NRS2002 score.Nutritional evaluation is important to guide nutrition treat?ment in elderly patients with gastric cancer.Early enteral nutrition can promote the elderly gastric cancer patients nutrition status and immune function recovery,shorter hospital stay.
elderly gastric cancer patients;nutrition risk screening;early enteral nutrition;parenteral nutrition
R735.2
A
10.3969/j.issn.1672?271X.2015.06.006
∶2015?07?21;
∶2015?10?11)
110840遼寧沈陽,沈陽軍區總醫院普通外科
張雪峰,Email∶yechun65653@126.com
(本文編輯∶齊 名; 英文編輯∶王建東)

