濱海區黃花鳶尾的耐鹽堿性及氮磷去除效果
陳廣琳,陳友媛,2*,孫 萍,王翔宇,李勝玲,孫鵬鵬(.中國海洋大學環境科學與工程學院,山東 青島 26600;2.中國海洋大學海洋環境與生態教育部重點實驗室,山東 青島 26600)
濱海區黃花鳶尾的耐鹽堿性及氮磷去除效果
陳廣琳1,陳友媛1,2*,孫 萍1,王翔宇1,李勝玲1,孫鵬鵬1(1.中國海洋大學環境科學與工程學院,山東 青島 266100;2.中國海洋大學海洋環境與生態教育部重點實驗室,山東 青島 266100)
為探究黃花鳶尾(Iris pseudoacorus)在濱海區的耐鹽堿程度及對鹽堿污染水體中氮磷的去除能力,采用水培實驗,分析其幼苗在鹽堿交互脅迫下的生長狀況、生理響應及其對水體中氮磷的去除效果.結果表明,黃花鳶尾耐鹽堿范圍:pH值為7、8、9時,鹽度分別低于9‰、6‰、3‰.在其耐鹽堿范圍內,植株的含水量和葉綠素含量與對照相差在5.0%以內,而Na+、Cl-與甜菜堿、可溶性糖含量隨鹽度和pH值的升高而增加,但增幅均低于130.0%.在低鹽弱堿(pH 7、鹽度為3‰、6‰與pH 8、鹽度為3‰)條件下,黃花鳶尾幼苗相對生長速率比對照高0.6~6.1%,對水體中總氮、總磷的最大去除率分別為0.046mg/(g·d)、0.020mg/(g·d).在其耐鹽堿范圍外,Na+與脯氨酸含量與對照相比增幅高達14.0倍和91.4倍;黃花鳶尾生長受阻,對水體中氮磷的去除效果較差.因此,黃花鳶尾僅適用于濱海低鹽弱堿水體的生態修復.
黃花鳶尾幼苗;鹽堿脅迫;滲透調節;耐受能力;水質凈化
濱海河口區水體中的鹽堿一方面來自海水的潮汐運動,另一方面來自底質鹽堿土和咸化淺層地下水的傳質作用[1].鹽堿環境不利于大多數淡水植物生存,使得河口區水生態景觀蕭條,因此,亟需篩選耐鹽堿水生植物來修復濱海河口區生態系統.
植物可以通過吸收、吸附以及根系微生物的降解等途徑去除水體中污染物[2].研究顯示,植物的耐鹽能力、種植密度、植株大小和根系發達程度等因素直接影響植物去除含鹽堿水體中氮磷的能力[3].其中,耐鹽堿能力是限制其凈化效率最重要的因素.鹽堿會對植物產生滲透脅迫、離子毒害、造成營養虧缺、打破能量平衡等影響[4],使不耐鹽堿植物的生長受到抑制,降低植物去除氮磷的能力.而在鹽堿脅迫下,有些植物通過積累無機離子和脯氨酸等有機小分子物質調節滲透平衡[5],并能夠通過細胞的選擇性吸收、區域化作用以及跨膜轉運蛋白維持離子平衡[6],提高植物的耐鹽堿能力,增加植物在鹽堿環境中對氮、磷的吸收.植物的成活率、相對生長速率可直觀地反映植物耐鹽堿性強弱[7];含水量、根系活力、葉綠素含量、膜滲透性等生理指標能更準確的表征植物耐鹽堿程度[8].植物凈化淡水水體的研究已有大量報道[9-10],而水生植物耐鹽堿機理及鹽堿交互脅迫下的生長規律、凈化水體等方面的研究較少.
本研究選用青島濱海河口區較為常見且有較好景觀效果的水生植物,黃花鳶尾,為研究對象,針對其最敏感的幼苗階段,通過測量其相對生長速率、新增分蘗數等生長指標和含水量、根系活力、葉綠素含量、葉片相對電導率、滲透調節能力等生理指標,研究黃花鳶尾鹽堿耐受性,分析其去除鹽堿水體中氮、磷能力和影響因素,以期為濱海河口區鹽堿水體的植物修復提供理論依據.
1 材料與方法
1.1供試植物
黃花鳶尾(Iris Pseudoacorus),多年生草本,根狀莖粗壯,須根生長旺盛,喜水濕,較耐鹽,喜含石灰質弱堿性土壤.實驗所用黃花鳶尾通過種子萌發獲得長勢均一的幼苗.實驗前用霍格蘭營養液水培 1個月,讓植物適應無土水培環境,溫度在20~24℃之間,自然光照.
1.2實驗設計
實驗水質依據青島李村河下游 8個監測斷面的水質分析結果配制(表1).實驗前水體中氮、磷實測值為:氨氮 3.6mg/L,硝氮 2.6mg/L,總氮6.4mg/L,總磷 3.4mg/L.用NaCl調整水體鹽度分別為 0‰、3‰、6‰、9‰、12‰、15‰;用NaHCO3-Na2CO3按照0:0、1:0、10:1的比例調整水體pH值依次為7、8、9.因pH值用堿性鹽調節,故文中將pH值脅迫簡稱為堿脅迫.按照設定的鹽度和pH值梯度進行正交實驗,共18個鹽堿脅迫組,每組3個平行.鹽度為0‰,pH 7的實驗組中的植株為對照組植株.

表1 青島李村河下游水體理化性質Table 1 Physicochemical properties of the Licun river in Qingdao
實驗用高20cm,上口直徑10cm的燒杯作為實驗容器,水體體積1L.每個容器種植3~4長勢一致株幼苗.每組黃花鳶尾幼苗初始鮮重為(7.1± 0.2)g.種植密度為127株/m2.
為避免植株的鹽激效應,實驗開始前需對植株進行馴化,采用每天遞增3‰鹽度、0.5pH值的方式增加實驗水體中鹽度與 pH值,當達到設定值時,維持設定鹽度與pH值,沒有達到的繼續增加,直到第 7d完成全部植株的馴化.實驗的 15d期間,每天用蒸餾水補充蒸發的水分,保證鹽度在±0.2‰范圍內,pH值在±0.1范圍內變化.
1.3實驗儀器
TU-1810(普析,中國)紫外可見分光光度計.離子色譜儀(CS-3000,USA).
1.4分析方法
1.4.1植物生長、生理指標的測定 脅迫前后,測量植物鮮重、干重、分蘗數等生長指標,相對生長速率(RGR)通過公式(1)計算.選取各組植物的相同部位測定其生理指標,其中葉綠素含量采用乙醇提取法測定[11];根系活力采用氯化三苯基四氮唑法測定[12];葉片相對電導率采用浸泡法[12];葉片鮮重含水量采用烘干稱重法測定[12].
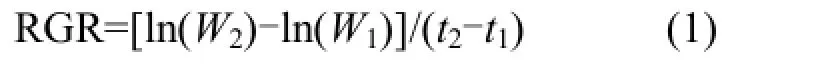
式中:W1為初始時刻 t1(d)的植物干重,g;W2為結束時刻t2(d)的植物干重,g.
1.4.2植物體無機離子和有機溶劑的測定 植物體內無機離子 K+、Na+、Cl-含量用離子色譜法測定[13].脯氨酸含量用酸性茚三酮比色法測定[11];可溶性糖含量用蒽酮比色法測定[11];甜菜堿含量用雷氏鹽比色法測定[14].
1.4.3水體氮、磷質量濃度的測定 水體中,總氮、硝氮采用紫外分光光度法測定[15];氨氮采用納氏試劑分光光度法測定[15];總磷采用鉬酸銨分光光度法測定[15].實驗始末分別測各組水體中的氮磷質量濃度,用水體中氮磷減少質量減去空白對照組氮磷減少質量的值除以植株質量和時間,計算單位時間、單位質量植物體對水體中氮、磷的去除率.
1.5統計分析
數據采用統計軟件 SPSS 16.0,通過雙因素方差分析比較各項測試指標在實驗條件下的顯著性差異,顯著性水平設置為P < 0.05.
2 結果與分析
2.1鹽堿脅迫下黃花鳶尾的生長狀況
黃花鳶尾在鹽堿脅迫下的相對生長速率(RGR)、新增分蘗數見表2.pH 7時,RGR隨鹽度增加而先升高后降低;鹽度為 3‰時達到最大,比對照高 6.1%;鹽度為 9‰時,與對照持平;鹽度為12‰時,RGR大幅下降(P<0.05).pH 8、pH 9脅迫下,RGR均隨鹽度的升高而降低,鹽度為 3‰時,RGR分別比對照高0.6%、低16.9%;鹽度分別達9‰與6‰時,鹽堿交互脅迫使植株RGR顯著降低(P<0.05).說明pH 7、鹽度為3‰、6‰與pH 8、鹽度為3‰(本文定義為低鹽弱堿)可促進黃花鳶尾幼苗的生長,但pH 8、鹽度高于9‰與pH 9、鹽度高于 6‰的鹽堿交互脅迫對其生長有較大的阻礙作用;鹽度相同條件下,pH值越高對植物生長阻礙作用越大.

表2 鹽度、pH值脅迫對黃花鳶尾的生長指標的影響Table 2 Effects of various salt and pH stresses on the growth indices of Iris Pseudoacorus seedlings
黃花鳶尾的分蘗能力隨鹽度、pH值的升高而降低.對照植株的新增分蘗數顯著高于鹽堿脅迫組植株(P<0.05).低鹽弱堿脅迫下,植株的新增分蘗數仍能維持在對照的50.0%以上.在pH值為8、9,鹽度分別為12‰與9‰的交互脅迫下,植株幾乎停止分蘗(P>0.05).
2.2鹽堿脅迫下黃花鳶尾的生理響應
細胞含水量充足時,植物的生理活動較為活躍.鹽堿脅迫下,黃花鳶尾的含水量見圖1a.總體來說,植株的含水量隨鹽度、pH值的升高而降低.在pH值為7、8、9,鹽度分別為9‰、6‰、3‰時,含水量均維持在與對照相差 5.0%范圍以內,鹽度達12‰、9‰、6‰時,含水量顯著降低(P<0.05).
葉綠素含量高低反映了植物光合作用的強弱[16].黃花鳶尾葉綠素含量見圖 1b.葉綠素含量總體趨勢是隨著鹽度和 pH值的升高而降低.在pH值為7、8、9,鹽度分別為9‰、6‰、3‰時,葉綠素含量維持在與對照相差5.0%范圍以內,鹽度為 12‰、9‰、6‰時,葉綠素含量顯著降低(P<0.05).低鹽促進、高鹽抑制黃花鳶尾幼苗葉綠素合成,且隨著鹽度和pH值的升高,鹽堿脅迫增大了對該過程的阻礙作用.
葉片相對電導率是表征植物膜損傷的典型指標之一.相對電導率增大,代表膜透性增大,其選擇透過性功能減弱或喪失[17].鹽堿脅迫下黃花鳶尾的葉片相對電導率變化如圖 1c.隨鹽度和pH值的升高而增大.在pH值為7、8、9,鹽度分別為9‰、6‰、3‰時,葉片相對電導率與對照相比增幅均低于50.0%,鹽度為12‰、9‰、6‰時,葉片相對電導率開始顯著升高(P<0.05).
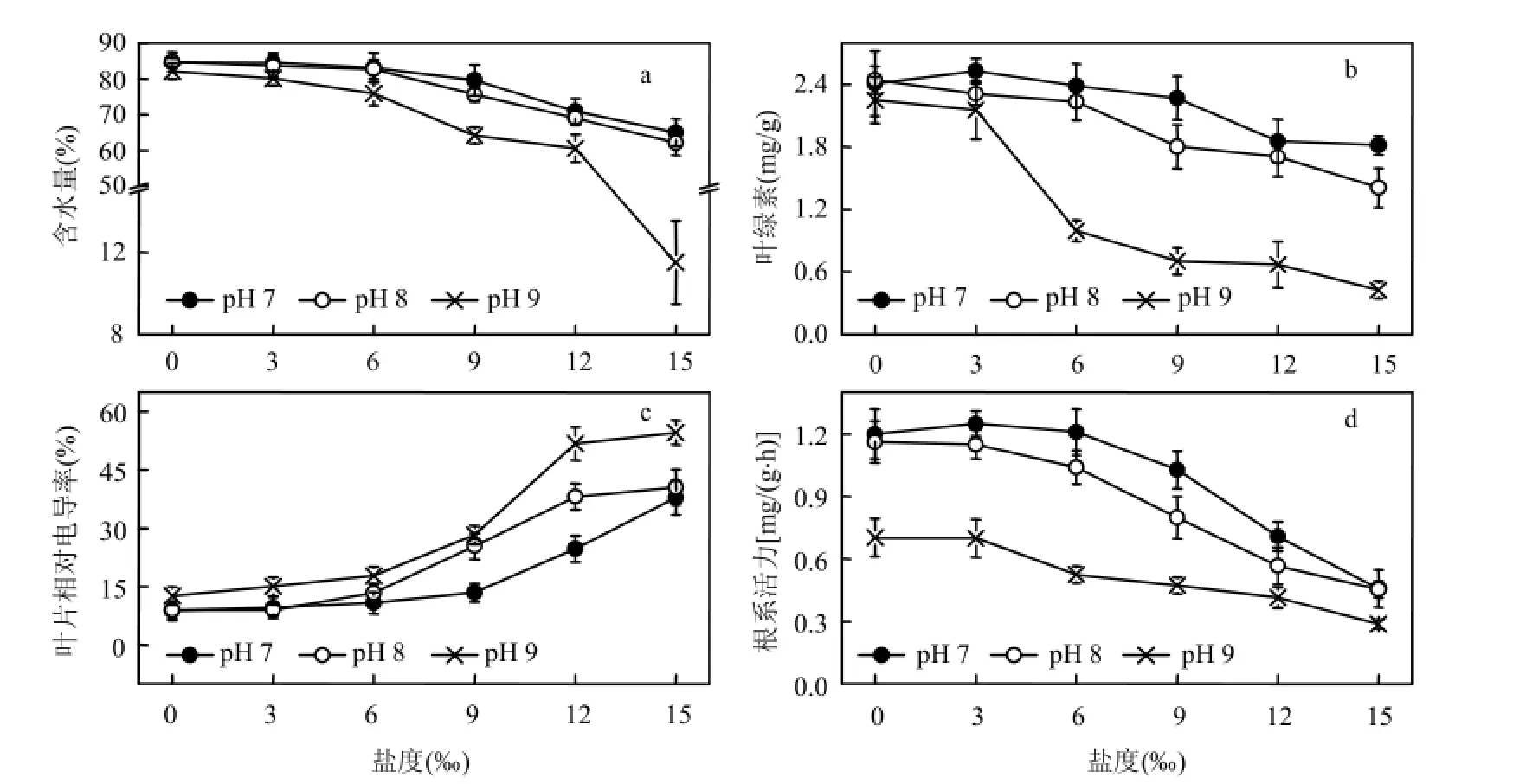
圖1 鹽度、pH值脅迫對黃花鳶尾生理指標的影響Fig.1 Effects of various salt and pH stresses on the physiological indices of Iris Pseudoacorus seedlings
根系活力與植物對水分、營養鹽的吸收過程聯系密切[18].圖1d為黃花鳶尾在鹽堿脅迫下根系活力的變化趨勢.在pH值為7、8,鹽度分別為6‰與3‰時,根系活力與對照相比相差在5.0%以內,其中,pH 7條件下,鹽度為3‰時達到最大.鹽度為9‰以及pH 9脅迫使得植株根系活力大幅下降(P <0.05).說明低鹽脅迫能刺激黃花鳶尾幼苗根系活力的升高,但高pH值嚴重抑制其根系活力.
2.3鹽堿脅迫下黃花鳶尾的滲透調節
2.3.1無機離子調節 鹽堿脅迫下,黃花鳶尾葉片和根系中Na+含量如圖2a、圖2b所示.葉片與根系中Na+含量均隨鹽度和pH值的升高而增加.葉片與根系中Na+含量在pH值為7、8、9,鹽度分別為9‰、6‰、3‰時,與對照相比增幅均低于130.0%;鹽度為12‰、9‰、6‰時,Na+含量開始顯著升高(P<0.05),與對照相比增幅最高達 14.0 倍.鹽堿脅迫下,鹽度升高是黃花鳶尾體內 Na+含量增加的主要因素,隨著鹽度和pH值的升高,鹽堿脅迫增大了進入植株體內 Na+的含量,且葉片中Na+增幅明顯高于根系(P<0.05).
鹽堿脅迫下葉片和根系中K+含量如圖2c、圖2d所示.隨著鹽度和pH值的升高,K+含量逐漸降低.葉片與根系中K+含量在pH 7、8,鹽度分別為9‰、6‰時,與對照相比降幅均在40.0%以內,而鹽度為12‰或pH值為9的脅迫對K+的吸收產生較大的阻礙作用,且葉片受到的影響更大(P<0.05).
鹽堿脅迫下葉片和根系中Cl-含量如圖2e、圖2f所示.葉片和根系中Cl-含量均隨鹽度的升高逐漸增大,但隨pH值升高而降低.pH 7、pH 8條件下,鹽度為 12‰時,Cl-含量開始急劇升高(P<0.05).鹽堿脅迫對葉片中Cl-含量的影響大.
2.3.2有機溶質調節 黃花鳶尾在鹽堿脅迫下,葉片、根系中脯氨酸含量如圖 3a、圖 3b所示.隨著鹽度和 pH值的升高,植株葉片和根系中脯氨酸含量顯著升高(P<0.05).葉片脯氨酸含量在pH 7、pH 8,鹽度為6‰與pH 9,鹽度為3‰時,與對照相比增幅在50.0%以內.鹽度為15‰時,比對照高91.4倍.根系脯氨酸含量較少,與對照相比最大增幅為3.1倍.鹽度和pH值較高時,葉片中脯氨酸含量急劇升高(P<0.05),最高達根系的35.1倍.
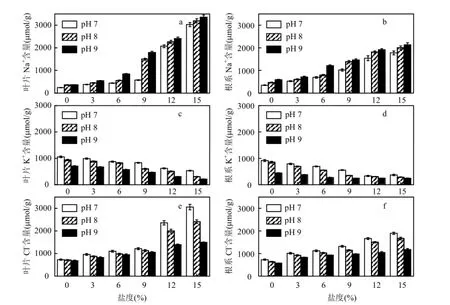
圖2 鹽度、pH值脅迫對黃花鳶尾葉片和根系中離子濃度的影響Fig.2 Effects of various salt and pH stresses on the ions concentrations in the leaves and roots of Iris Pseudoacorus seedlings
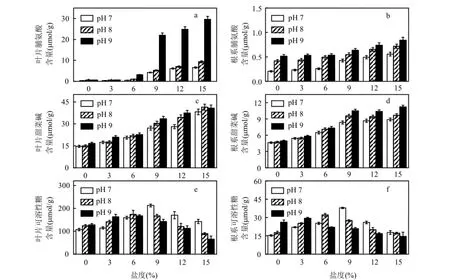
圖3 鹽度、pH值脅迫對黃花鳶尾有機溶質濃度的影響Fig.3 Effects of various salt and pH stresses on the organic solutes concentrations in the leaves and roots of Iris Pseudoacorus seedlings
鹽堿脅迫下葉片、根系中甜菜堿含量如圖3c、圖3d所示.植株中甜菜堿含量均隨鹽度、pH值的升高而增加.鹽度是導致其含量增加的主要因素,主要在葉片中積累.葉片甜菜堿含量在 pH值為 7~9、鹽度為 6‰時,比對照高50.0%以內;鹽度為9‰時其含量顯著升高(P<0.05).根系與葉片中的甜菜堿含量變化規律一致.
鹽堿脅迫下葉片、根系中可溶性糖含量見圖3e、圖3f.隨著鹽度的升高,葉片和根系中的可溶性糖含量先升高后降低.主要在葉片中積累.pH 7、鹽度為9‰時,葉片中可溶性糖含量最高,比對照高1倍.pH8與pH9脅迫下,葉片中可溶性糖含量分別在鹽度為6‰、3‰時達到最大,比對照高60.0%和50.0%.鹽堿脅迫下根系中可溶性糖含量變化趨勢與葉片一致.低鹽脅迫下,pH值升高對黃花鳶尾體內可溶性糖的積累有促進作用,而鹽度和 pH值較高時,可溶性糖的積累受到抑制作用顯著(P<0.05).
2.4黃花鳶尾對鹽堿水體氮、磷的去除效果
2.4.1對氨氮、硝氮、總氮的去除率 鹽堿脅迫下,黃花鳶尾對水體中氨氮、硝氮、總氮的去除率見圖4a、圖4b、圖4c.實驗期間,對照植株對氨氮、硝氮、總氮的去除率最高,隨著鹽度、pH值的升高,植株對水體中3種形態氮的去除率逐漸降低.低鹽弱堿條件下,植株對水體中總氮的去除率維持在 0.046mg/(g·d)以上,與對照相比降幅在7.0%以內;在pH 7、8、9,鹽度分別為9‰、6‰、0‰時,植株對水體中氨氮、硝氮與總氮的去除效率開始開始顯著降低(P<0.05).
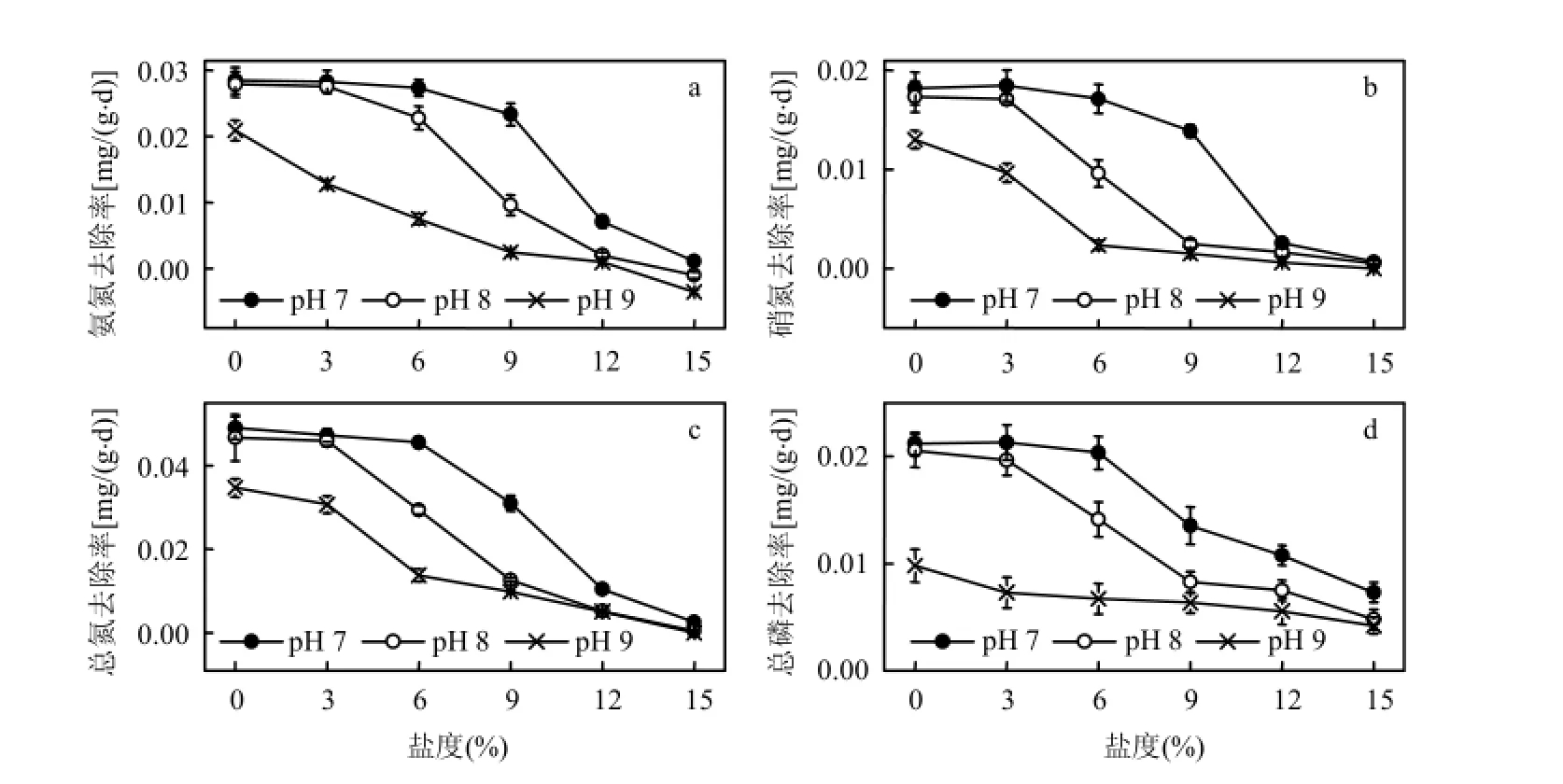
圖4 黃花鳶尾對鹽堿水體中氮磷的去除率Fig.4 The removal efficiency for nitrogen and phosphorus of the saline-alkaline water by Iris Pseudoacorus seedlings
2.4.2對總磷的去除率 黃花鳶尾對水體中總磷去除率見圖4d.植物對水體中總磷去除率隨鹽度和 pH值的升高而呈現明顯的下降趨勢.低鹽弱堿條件下,植株對水體中總磷去除率均維持在0.020mg/(g·d)以上,僅比對照低 4.1%和 7.3%;在pH 7、8、9,鹽度分別為9‰、6‰、0‰時,植株對水體中總磷的去除效率開始顯著降低(P<0.05).
3 討論
3.1黃花鳶尾的鹽堿耐受能力
綜合黃花鳶尾的生長指標和生理指標,可以得出黃花鳶尾幼苗的耐鹽堿范圍:pH值為7、8、9時,鹽度分別低于9‰、6‰、3‰.在其耐鹽堿范圍內,黃花鳶尾通過對無機離子和有機溶質不同程度的累積來調節滲透平衡,其中 Na+、Cl-與甜菜堿和可溶性糖含量與對照相比最大增幅均低于 130.0%,脯氨酸含量較少,但比對照高出 12.1 倍.與植株生長有關的含水量與葉綠素含量與對照上下相差在5.0%以內,保障了黃花鳶尾正常的光合作用、呼吸作用和營養鹽的吸收等生理代謝活動;在低鹽弱堿條件下,根系活力維持在較高的水平,有利于對營養鹽的吸收,促進了該植物在鹽堿環境中生長;在pH 7、鹽度為3‰條件下,黃花鳶尾幼苗的含水量、葉綠素含量和根系活力均比對照高,是其生長的最優條件.
在其耐鹽堿范圍外,質膜透性增加,導致大量Na+流入而K+外滲,細胞內離子平衡失調[19].葉片中 Na+含量遠遠高于根系,說明此時黃花鳶尾地上部分細胞膜已受到較大的損傷,這與鹽堿脅迫下其葉片相對電導率變化趨勢得出的結論一致.鹽堿交互脅迫對黃花鳶尾幼苗根系產生傷害,根系活力迅速下降表明根系的呼吸作用減弱,產生的能量減少,不利于對營養鹽的吸收,造成植物生長緩慢.同時,合成大量有機溶質,消耗了更多能量和物質,阻礙植物的正常生理代謝活動[20].結果導致含水量、葉綠素含量快速降低,生理代謝紊亂,植株生長、分蘗受到極大的抑制.
3.2無機離子的調節作用
鹽堿脅迫下,Na+、K+和 Cl-是黃花鳶尾滲透調節的主要物質,對降低細胞內滲透勢的貢獻率較高.研究表明,無機離子調節滲透平衡耗能少,植物更趨向于積累無機離子來降低細胞水勢[21].在其耐鹽堿范圍內,黃花鳶尾體內Na+與Cl-升高平緩、K+降幅較小,表明在該鹽堿脅迫下,植株對離子的選擇性吸收能力較強,限制了無機離子的過度積累,有利于細胞持續吸收水分,并維持了細胞內離子平衡,對其正常生長生存起重要作用,是其耐鹽堿的機制之一.葉片中Na+與Cl-含量低于根系,而K+高于根系,說明黃花鳶尾阻止了Na+與Cl-向地上部分的運輸,限制了葉片中的 K+大量流失,有助于減緩Na+與Cl-對葉片的損傷,這也是其耐鹽堿的重要機制.
在其耐鹽堿范圍外,滲透脅迫加劇,刺激了細胞對Na+與Cl-的大量吸收,使植株受到離子毒害.已有研究發現,高濃度的 Na+會置換細胞質膜上結合的 Ca2+,破壞膜結構的完整性,并且不利于Na+在液泡內積累,從而進入細胞質對其生理代謝過程產生抑制作用[22].葉片中Na+與Cl-急劇升高并高于根系說明鹽堿脅迫對葉片的選擇性吸收與外排能力受到較大阻礙.K+含量迅速降低一方面由于黃花鳶尾對 Na+和K+的吸收上可能存在競爭性抑制;另一方面因為高 pH值對該植物根系活力抑制作用較大,無法為K+的主動運輸提供足夠的能量.高pH值對Cl-的積累有抑制作用,根部尤為明顯.這可能是因為在堿性環境中,氨基酸的羧基多發生解離而處于負電狀態,根細胞對外部陰離子產生排斥作用,而更易吸收外部陽離子,導致細胞內部負電荷虧缺[23],植株體內離子嚴重失衡,對植物損傷嚴重.
3.3有機溶質的保護作用
鹽堿脅迫下,黃花鳶尾會積累脯氨酸、甜菜堿和可溶性糖等有機溶質來維持滲透平衡,并可作為滲透保護物質,減緩高濃度離子對細胞的損傷.葉片中合成的有機溶質比根系高,可能是因為葉片中共質體空間比根系大,且葉片對無機離子的忍受能力較低,需要無毒害作用的相溶性物質進行調節,這有利于維持葉片的吸水能力及膜功能,使葉片光合、呼吸過程正常進行[24].
在其耐鹽堿范圍內,甜菜堿、可溶性糖對細胞的滲透調節作用更大,可維持細胞膜和酶的穩定性,提高植物的耐鹽堿能力.其中,可溶性糖作為碳源為植物進行各種生理代謝活動補充能量[25].在其耐鹽堿范圍外,脯氨酸急劇增加,以調節滲透平衡,而且作為一種抗氧化劑具有清除活性氧的功能[26].鹽堿交互脅迫使得黃花鳶尾光合過程受到抑制,能量積累無法傳遞出去,結果會造成活性氧大量增加而破壞細胞質膜,從而需要合成脯氨酸來清除細胞中的活性氧,降低對細胞質膜的損傷.甜菜堿持續增加,可平衡液泡中大量無機離子產生的高滲透勢,還可促進幼苗體內脯氨酸的積累.可溶性糖減少,一方面是因為植物需要較高的能量抵抗鹽堿脅迫而被消耗,另一方面可能轉化成脯氨酸等兼容性更大的有機溶質來保護植物免受鹽堿的迫害.
3.4氮、磷去除效果
黃花鳶尾對鹽堿污染水體中氮磷的去除能力受限于其耐鹽堿程度.在黃花鳶尾生長狀況良好的情況下,對水體中氮磷的去除效率較高.因此水質凈化效果較好時的鹽堿范圍小于其能夠耐受的鹽堿范圍.
當黃花鳶尾的生長維持在正常水平以上時,根系活力較高,有利于植株對氮磷的正常吸收,且葉片光合過程的正常運轉也有利于其根系泌氧功能,促進根系微生物對氮磷的去除[27].且中性環境中,無機磷主要以的形式存在,該形態有利于植物對磷的吸收[28].
而在其生長受到抑制時,植物氮磷吸收能力減弱,且嚴重超過黃花鳶尾耐鹽堿范圍時,植株不但無法正常吸收氮素,反而由于植株根系腐爛將氮素釋放到水環境中,導致水體中氨氮、總氮濃度高于初始值.pH 9時,水體中分子態氨比例增加,占總氨氮濃度的 30%左右[29],對植物的傷害較大,導致黃花鳶尾不能高效的去除水體中的氮素;且占無機磷元素的 98.5%.當水體中Ca2+較高,形成微溶的CaHPO4,植物難以吸收.
因此,在篩選能夠凈化濱海河口區鹽堿水體的植物時,確定植物在鹽堿水體中的耐受能力是首要任務.
4 結論
4.1黃花鳶尾幼苗在低鹽弱堿條件下可保持較好的生長、生理狀況與水體凈化效果.其耐鹽堿范圍為pH 7、8、9,鹽度分別低于9‰、6‰、3‰.在其耐鹽堿范圍外,鹽堿交互脅迫加大了對黃花鳶尾的傷害(P<0.05).
4.2耐鹽堿范圍內,黃花鳶尾幼苗能積累適量無機離子與有機溶質,維持植株含水量、葉綠素含量等生理指標在正常水平.耐鹽堿范圍外,Na+、Cl-與脯氨酸含量急劇升高,其中,葉片受到的影響比根系大,植株的生長受到較大的阻礙.
Zhao W Y, Wang Q S, Wu L B, et al. Qualitative anlysis and quantitative simulation on Yin-Huang water salinization mechanism in Bei-Da-Gang Reservoir [J]. Journal of Environment Science, 2005,10,17(5):853-856.
向速林,朱夢圓,朱廣偉,等.太湖東部湖灣大型水生植物分布對水質的影響 [J]. 中國環境科學, 2014,34(11):2881-2887.
Keizer-Vlek H E, Verdonschot P, Verdonschot R, et al. The contribution of plant uptake to nutrient removal by floating treatment wetlands [J]. Ecological Engineering, 2014,73:684-690.
Brown C E, Pezeshki S R, DeLaune R D. The effects of salinity and soil drying on nutrient uptake and growth of Spartina alterniflora in a simulated tidal system [J]. Environmental and Experimental Botany, 2006,58:140-148.
Benzarti M, Rejeb K B, Messedi D, et al. Effect of high salinity on Atriplex portulacoides:Growth, leaf water relations and solute accumulation in relation with osmotic adjustment [J]. South African Journal of Botany, 2014,95:70-77.
Belkheiri O, Mulas M. The effects of salt stress on growth, water relations and ion accumulation in two halophyte Atriplex species [J]. Environmental and Experimental Botany, 2013,86:17-28.
Katschning D, Broekman R, Rozema J. Salt tolerance in the halophyte Salicornia dolichostachya Moss: Growth, morphology and physiology [J]. Environmental and Experimental Botany,2013,92:32-42.
Pedro C A, Santos M S, Ferreira S M, et al. The influence of cadmium contamination and salinity on the survival, growth and phytoremediation capacity of the saltmarsh plant Salicornia ramosissima [J]. Marine Environmental Research, 2013,92:197-205.
Zhao Y, Xia X, Yang Z. Growth and nutrient accumulation of Phragmites australis in relation to water level variation and nutrient loadings in a shallow lake [J]. Journal of Environmental Sciences,2013,25(1):16-25.
Zhao F, Xi S, Yang X, et al. Purifying eutrophic river waters with integrated floating island systems [J]. Ecological Engineering,2012,40:53-60.
董樹剛,吳以平.植物生理學實驗技術 [M]. 中國海洋大學出版社,2006:33-34.
郝建軍,劉延吉.植物生理學實驗技術 [M]. 沈陽:遼寧科學技術出版社, 2001:56-57.
趙可夫.植物抗鹽生理 [M]. 北京:中國科技出版社, 1999: 22-23.
黃紅娜,張丹參,鄭曉霞,等.甜菜堿的提取,分離及測定含量方法的研究進展 [J]. 醫學綜述, 2009,15(22):3492-3494.
國家環境保護總局.水和廢水監測分析方法 [M]. 4版.北京:中國環境科學出版社, 2002:12-13.
Shafer D J, Kaldy J E, Sherman T D, et al. Effects of salinity on photosynthesis and respiration of the seagrass Zostera japonica: A comparison of two established populations in North America [J]. Aquatic Botany, 2011,95:214-220.
廖寶文,邱鳳英,張留恩.鹽度對尖瓣海蓮幼苗生長及其生理生態特性的影響 [J]. 生態學報, 2010,30(23):6363-6371.
李志霞,秦嗣軍,呂德國,等.植物根系呼吸代謝及影響根系呼吸的環境因子研究進展 [J]. 植物生理學報, 2011,47(10):957- 966.
Sahu B B, Shaw B P. Salt-inducible isoform of plasma membrane H+ATPase gene in rice remains constitutively expressed in natural halophyte, Suaeda maritime [J]. Journal of Plant Physiology,2009,166:1077-1089.
Zhang P, Fu J, Hu L. Effects of alkali stress on growth, free amino acids and carbohydrates metabolism in Kentucky bluegrass [J]. Ecotoxicology, 2012,21:1911-1918.
Touchette B W. Seagrass-salinity interactions: Physiological mechanisms used by submersed marine angiosperms for a life at sea [J]. Journal of Experimental Marine Biology and Ecology,2007,350:194-215.
Brant W T. Seagrass-salinity interactions: Physiological mechanisms used by submersed marine angiosperms for a life at sea [J]. Journal of Experimental Marine Biology and Ecology,2007,350:94-215.
Yang C W, Chon J N, Li C Y, et al. Osmotic adjustment and ion balance traits of an alkali resistant halophyte Kochia sieversiana during adaptation to salt and alkali conditions [J]. Plant Soil, 2007,294:263-276.
Hartley N P, Hartley J, Shabala L, et al. Salinity-induced accumulation of organic osmolytes in barley and wheat leaves correlates with increased oxidative stress tolerance: In planta evidence for cross-tolerance [J]. Plant Physiology and Biochemistry,2014,83:32-39.
唐中華,郭曉瑞,于景華,等.弱光對長春花幼苗中可溶性糖、生物堿及激素含量的影響 [J]. 生態學報, 2007,27(11):4419-4424.
孫瑞蓮,王文興,周啟星.球果蔊菜脯氨酸的積累及與Cd耐性的關系[J]. 中國環境科學, 2009,29(2):142-146.
孔祥龍,葉 春,李春華,等.苦草對水-底泥-沉水植物系統中氮素遷移轉化的影響 [J]. 中國環境科學, 2015,35(2):539-549.
劉晶晶,李 敏,曲 博,等.濕地挺水植物根系土壤中的磷形態變化與分析 [J]. 中國環境科學, 2013,33(11):2040-2046.
Collos Y, Harrison P J. Acclimation and toxicity of high ammonium concentrations to unicellular algae [J]. Marine Pollution Bulletin,2014,80:8-23.
致謝:感謝青島市科技攻關項目與青島市政府采購項目提供的支持,感謝中國海洋大學環境科學與工程學院水土污染分析實驗室成員對采樣及實驗過程提供的幫助!
The Iris Pseudoacorus' tolerant ability and removal efficiency for nitrogen and phosphorus in saline-alkaline waterof coastal region.
CHEN Guang-lin1, CHEN You-yuan1,2*, SUN Ping1, WANG Xiang-yu1, LI Sheng-ling1, SUN Peng-peng1(1.College of Environmental Science and Engineering, Ocean University of China, Qingdao 266100, China;2.Key Laboratory of Marine Environment and Ecology, Ministry of Education, Ocean University of China, Qingdao 266100, China).
China Environmental Science, 2015,35(11):3422~3430
The study investigated the saline-alkaline tolerant ability of Iris pseudoacorus seedlings in coastal regions as well as the nitrogen and phosphorus removal capability under hydroponic culture. The growth characteristics,physiological response of I. pseudoacorus and the removal efficiency for nitrogen and phosphorus by I. pseudoacorus were analyzed in saline-alkaline water. The results showed the limits of salinities that I. pseudoacorus could tolerate were less than 9‰, 6‰ and 3‰, corresponding the pH values of the water were 7, 8, 9, respectively. Within the limits, the differences of water content and leaf chlorophyll content between the plants in salt-alkali treated groups and those in control group (without salt or pH stress) were less than 5.0%. The concentrations of Na+, Cl-, betaine and soluble carbohydrates increased by 130% at most within the limits. At low salinities and low alkalinities (salinities were 3‰ and 6‰ while the pH was 7and salinity was 3‰ while the pH was 8), the relative growth rate of the plants in treated groups was 0.6~6.1% higher than those in control group, and I. pseudoacorus removed 0.046mg/(g·d) and 0.020mg/(g·d) of total nitrogen and total phosphorus, respectively. Beyond the limits, however, the concentrations of Na+and proline of I. pseudoacorus were 14.0 and 91.4 times higher than those in control group in response to salt-alkali stresses. In addition,the growth of I. pseudoacorus were inhibited and the removal efficiency for nitrogen and phosphorus reduced significantly. In summary, I. pseudoacorus could be chosen to purify the coastal water with low salinity and low alkalinity.
Iris Pseudoacorus seedlings;salt-alkaline stress;osmotic adjustment;tolerant ability;water purification
X55
A
1000-6923(2015)11-3422-09
2015-04-01
青島市科技攻關項目(12-4-1-58-HY);青島市政府采購項目(T-20150205-018)
* 責任作者, 副教授, youyuan@ouc.edu.cn
陳廣琳(1990-),女,山東濰坊人,中國海洋大學碩士研究生,研究方向為近海水體污染控制與修復技術研究.發表論文1篇.

