大鼠腦挫傷后caspase-3和HAX-1的表達
李周儒 ,滕道輝 ,董國凱 ,殷文江 ,蔡紅星
(1.徐州醫學院法醫學教研室,江蘇 徐州 221002;2.徐州市銅山區公安局刑警大隊,江蘇 徐州 221100)
損傷時間是指從受傷到死亡所經歷的時間,推斷損傷時間是法醫病理學研究的重點與難點[1]。腦損傷是法醫學檢案常見的死亡原因,腦損傷時間的準確推斷能為案件的偵破提供重要線索。
腦損傷后神經元和神經膠質發生凋亡,半胱氨酸天冬氨酸蛋白酶(caspase)家族是與凋亡密切相關的調節基因,而caspase-3是家族中最重要的凋亡執行者[2-3]。研究[4-5]發現,caspase-3在腦挫傷后呈現一定的時序性變化。而造血干細胞特異性相關結合蛋白-1(HCLS1-associated protein X-1,HAX-1)是一種新的細胞凋亡調節蛋白,具有強大的凋亡抑制作用[6-7]。
基于此,本實驗通過建立大鼠腦挫傷模型,利用Western印跡法、末端脫氧核苷酸轉移酶介導的dUTP缺口末端標記法(TdT-mediated dUTP nick-end la-beling,TUNEL)和激光共聚焦顯微鏡檢測技術,檢測腦挫傷后凋亡蛋白caspase-3及抗凋亡蛋白HAX-1在不同時間段表達的變化規律,從而為腦損傷時間的推斷提供新的理論依據。
1 材料與方法
1.1 材料
1.1 實驗材料
健康SD雄性大鼠80只(徐州醫學院實驗動物中心提供),體質量(190±30)g。
caspase-3(sc-22139)一抗、β-actin(sc-130656)一抗、HAX-1(sc-34273)一抗(美國 Santa Cruz公司),AP標記的二抗(美國Sigma Chemical公司),驢抗兔熒光二抗(A21207,美國 Invitrogen公司),BCA 試劑盒(浙江碧云天生物試劑有限公司),TUNEL試劑盒(北京中山生物試劑公司),NBT/BCIP試劑盒(美國Promega公司)。
ZH-ZYQ型自由落體腦損傷模型打擊器(淮北正華生物儀器設備有限公司),FV1000激光共聚焦顯微鏡(日本Olympus公司),JD801病理圖像分析系統。
1.2 方法
1.2.1 動物分組及模型的建立
Western印跡法和激光共聚焦顯微鏡技術各用40只大鼠,40只大鼠隨機分為正常組,假手術組,顱腦損傷后 2h、6h、12h、1d、3d、7d 組,每組 5 只。
利用自由落體腦損傷模型打擊器建立大鼠腦挫傷模型:大鼠用20%水合氯醛(350g/kg)腹腔麻醉后,俯臥位固定頭部及四肢,除去頭皮處鼠毛。用手術刀切開大鼠頭部中線皮膚,切口后端以45°角向左前下延伸,形成三角形皮瓣。向頭側翻開皮瓣,剝離骨膜,充分暴露左側露骨。以左側顱骨眼眶凹陷為支撐點,用持針器咬開,暴露硬腦膜,并向后在左頂骨擴大成直徑6mm的圓形骨窗,注意保護腦膜。將撞桿頭端置于骨窗硬腦膜外,其外垂直金屬套管,用40g打擊棒(圓柱形,直徑1.3cm,高5.3cm,打擊棒頭部球形直徑3mm)沿外周金屬管從25cm高度自由落下沖擊撞針,造成大鼠左側局部腦挫裂傷。假手術組麻醉及手術步驟與腦挫傷模型相同,但不用打擊棒打擊動物頭部。正常組及假手術組均在相應部位進行取材作為對照。
1.2.2 蛋白樣品制備及Western印跡法檢測
在腦挫傷模型建立后 2 h、6 h、12 h、l d、3 d 和 7 d各取5只直接斷頸處死,以挫傷灶為中心做腦冠狀切面取材(大小為3 mm×3 mm×2 mm),置液氮中凍存,備用。進行組織樣品的提取及caspase-3和HAX-1蛋白含量的測定,分裝,置-80℃冰箱待用。
等量蛋白樣品經7.5%SDS聚丙烯凝膠電泳分離后,以濕轉法轉移至PVDF膜上,經3%BSA封閉后加入一抗4℃過夜。用洗滌液洗膜,加入相應的二抗,37℃反應2h,洗膜。以NBT/BCIP顯色,結果用圖像分析系統處理,蛋白表達水平以目的蛋白與對照蛋白(β-actin)的比值來表示。
1.2.3 TUNEL染色及激光共聚焦顯微鏡技術檢測
分別在建立大鼠腦挫傷模型后的各時間點,用20%水合氯醛(350 mg/kg)腹腔麻醉大鼠,于劍突下橫向沿胸壁左右向剪開暴露心臟,用平頭穿刺針從心尖插入左心室,剪開右心耳,依次用生理鹽水、4%多聚甲醛溶液灌注,斷頭取腦,置于4%多聚甲醛溶液后固定6 h,30%的蔗糖脫水至腦組織下沉,OCT包埋。切片,厚度25μm。取冰凍切片,0.4%的Triton X-100-PBS打孔15min,4℃血清封閉1h,加入 HAX-1一抗4℃過夜,0.1%Triton X-100-PBS洗滌5 min×3次,加入熒光二抗,避光室溫孵育2h,甘油-PBS封片,激光共聚焦顯微鏡掃描圖片。紅色熒光為HAX-1,代表HAX-1的陽性細胞。
參照試劑盒上的說明書,提取樣品組織的冰凍切片,貼片,用TUNEL反應液在濕盒內37℃避光孵育1 h,0.01 mol/L PBS洗片 10 min×3次,甘油-PBS封片,激光共聚焦顯微鏡掃描圖片。綠色熒光為TUNEL染色細胞,代表凋亡細胞。
1.3 統計學分析
2 結 果
2.1 Western印跡法檢測腦挫傷后caspase-3和HAX-1的表達
蛋白半定量結果顯示:腦挫傷后caspase-3表達開始升高,與正常組及假手術組比較差異有統計學意義(P<0.05),6 h~1 d 逐漸升高,至傷后 3 d 左右,caspase-3表達強度達峰值(P<0.05),此后開始下降,但7d左右仍維持在較高表達水平(P<0.05)(圖1A)。HAX-1在正常組及假手術組有低表達,傷后2h在損傷部位的表達開始升高,與正常組及假手術組比較差異有統計學意義(P<0.05),傷后 6 h,HAX-1 表達強度達峰值(P<0.05),隨后逐漸下降,但傷后 12 h~1 d,HAX-1 表達仍高于正常水平(P<0.05),至傷后 3~7d幾乎測不到(圖1B)。
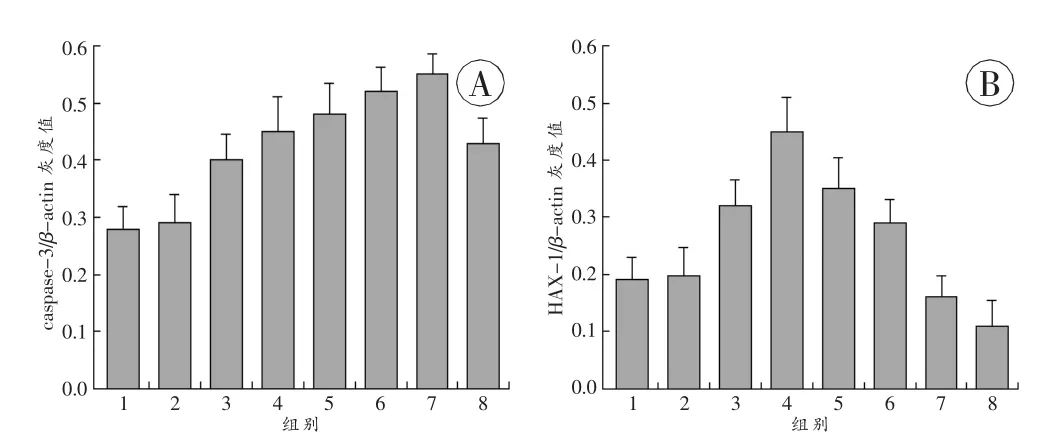
圖1 腦挫傷后各組caspase-3和HAX-1的半定量結果
2.2 激光共聚焦顯微鏡下腦挫傷后HAX-1陽性細胞和TUNEL染色細胞
正常組及假手術組HAX-1陽性細胞數較少。腦損傷后2h HAX-1陽性細胞數明顯增加(P<0.05),傷后 6 h左右最多(P<0.05),12 h后逐漸下降,傷后 3 d HAX-1陽性細胞數極少(圖2A)。
正常組及假手術組TUNEL染色細胞數較少,存活細胞最多。傷后2h,凋亡細胞數明顯增加(P<0.05);此后逐漸增多,至傷后3 d左右凋亡細胞數最多(P<0.05),此后逐漸下降,但7 d左右與正常組比較仍維持較高水平(P<0.05,圖 2B)。
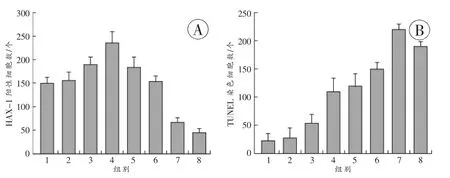
圖2 腦挫傷后激光共聚焦顯微鏡下各組HAX-1陽性細胞及TUNEL染色細胞的表達
腦挫傷后激光共聚焦顯微鏡下HAX-1及TUNEL染色細胞的變化見圖3~4。
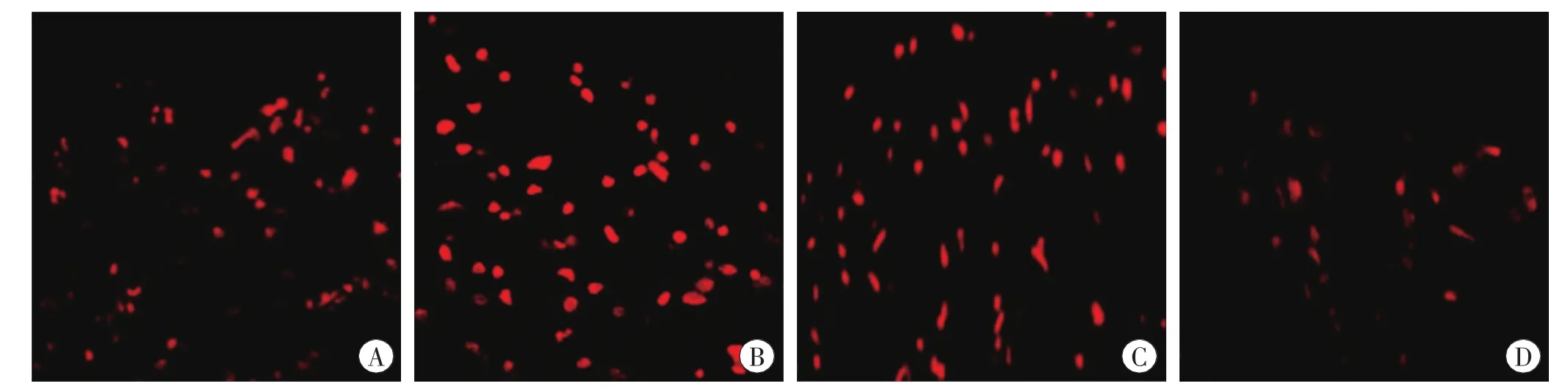
圖3 腦挫傷后激光共聚焦顯微鏡下HAX-1陽性細胞的表達 ×100
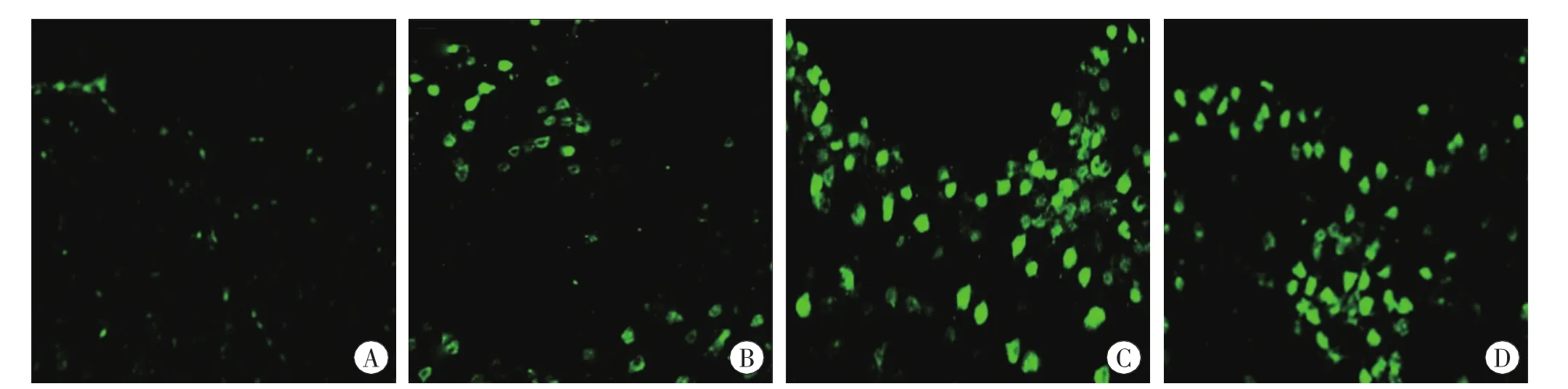
圖4 腦挫傷后激光共聚焦顯微鏡下TUNEL染色細胞的表達 ×100
3 討 論
腦損傷時間推斷是法醫病理學研究的重要課題,推斷腦損傷時間能為案件的偵破提供重要線索,在縮小偵察范圍等方面提供幫助。法醫病理學者在檢測腦內多種生物活性物質的時序性表達方面進行了大量研究[8-10]。
caspase-3是重要的凋亡執行者,能切割不同的底物,從而放大蛋白酶級聯反應,最終導致細胞死亡,既參與凋亡啟動,又參與凋亡程序執行,尤其在凋亡執行階段,負責對全部或部分關鍵蛋白進行酶切(激活或滅活),與細胞凋亡關系密切[11-13]。caspase-3在腦及皮膚損傷等方面已有大量的研究[4,14-15],也證實了其作為一種指標可以用來推斷腦損傷時間[5]。HAX-1是能與造血系統細胞特異性蛋白1(hematopoietic lineage cell-specific protein 1,HS1)存在相互作用的蛋白,廣泛表達于多種組織、細胞的線粒體內,少數分布在內質網和核膜上[16-17],能夠在腦部缺血缺氧過程中降低caspase-3的活性,抑制細胞的凋亡,HAX-1過表達的實驗進一步證實了HAX-1對細胞凋亡的抑制作用[18]。上述研究主要運用了傳統的免疫組織化學及圖像處理技術進行分析,本實驗加入激光共聚焦顯微鏡免疫組化檢測方法,進一步增加實驗結果的準確性、客觀性。
本實驗結果表明,caspase-3蛋白定量趨勢與TUNEL染色細胞表達趨勢基本平行,且損傷當時二者均開始升高,3d左右達峰值,后逐漸下降,但7d左右仍維持較高水平。因此認為,可以用TUNEL染色檢測細胞凋亡及caspase-3蛋白定量來推斷腦損傷經過時間。
在腦損傷動物實驗[12-13]中發現,全腦缺血再灌注后皮質神經元中HAX-1在短期缺血中表達升高,可能參與神經元的抗凋亡,隨著缺血時間延長,其表達水平降低,與神經元的凋亡增強相關。本實驗結果顯示,HAX-1在腦挫傷后2h表達開始升高,傷后6h左右達峰值,隨后逐漸下降,3d后低于正常水平。因此認為,HAX-1免疫組化染色可以用于腦損傷時間的推斷。
本實驗表明,在腦挫傷后凋亡蛋白caspase-3和抗凋亡蛋白HAX-1的表達均具有時序性變化,可以用來推斷腦損傷時間。在損傷早期,HAX-1隨著細胞凋亡的出現會大量表達,達到抑制凋亡的作用,但在損傷后,凋亡是個不可逆的過程,隨著時間的延長,凋亡蛋白表達越來越多,而HAX-1受到抑制,表達慢慢下降。因此,可以認為HAX-1適用于早期腦損傷時間的推斷,而caspase-3適用于稍晚期腦損傷時間的推斷。
Jitkaew等[19]認為HAX-1的抗凋亡作用是通過抑制caspase-3途徑發揮作用的。Lee等[7]研究表明,在細胞凋亡過程中HAX-1細胞內水平受caspase-3調節。綜上,我們推測在某一個時間點同時檢測抗凋亡蛋白HAX-1和凋亡蛋白caspase-3兩者的表達更有利于腦損傷時間的推斷,且聯合應用更多的指標,綜合判斷、分析,對于腦損傷時間推斷具有更大價值,更具科學性和準確性。

