金線蓮叢生芽增殖的液體懸浮培養條件優化
劉榮+申剛+羅曉青等

摘要: 研究金線蓮液體懸浮培養的基本培養基和不同激素濃度配比對叢生芽增殖的影響,以篩選出金線蓮叢生芽增殖液體懸浮培養的最優培養基和激素濃度配比,提高叢生芽增殖系數,為金線蓮快速繁殖開辟一條新途徑。結果表明:影響液體懸浮培養金線蓮叢生芽增殖的主要因素是基本培養基和6-芐氨基嘌呤(6-BA),主次關系為6-BA>NAA>IAA>2,4-D。篩選得到的最佳培養條件是1/2MS+6-BA 2.5 mg/L+NAA 0.2 mg/L+IAA 0.3 mg/L+2,4-D 0.5 mg/L,外加蔗糖30 g/L,pH 值5.8。
關鍵詞: 金線蓮;叢生芽增殖;懸浮培養;正交設計
中圖分類號: S682.310.4+3 文獻標志碼: A
文章編號:1002-1302(2015)08-0061-02
金線蓮[Anoectochilus roxburghii(Wall. )Lindl]是一種蘭科開唇蘭屬多年生草本,具有清熱涼血、除濕解毒等多種功效,兼具賞葉和觀花之功用,民間稱其為“神藥” [1-2]。金線蓮喜陰涼、潮濕,為典型的陰性藥用植物 [3]。因野生資源瀕危,而且其種子小、種胚發育不全、發芽困難、對生長條件要求頗為嚴格,所以在自然條件下,該植物難以大量繁殖,利用組織培養進行繁殖可以有效保存種質資源及用于商業化生產 [3-5]。通過組織培養方法對珍稀植物進行快繁研究,不僅可以克服種子繁殖中存在的諸多問題,還可以克服扦插繁殖速度慢、繁殖率低、難生根等缺點,而且組織培養繁殖快,不受季節、環境條件和場地的制約 [6]。近年來,研究者們先后開展了金線蓮的組織培養、內生真菌的分離、內生真菌與其共培養體系的建立及相互作用機制的研究 [7-11]。目前,金線蓮組織培養快速繁殖技術主要通過原球莖增殖和叢生芽增殖2種途徑進行。多數研究集中在原球莖增殖途徑,但其歷時較長且后代再生植株中有較高的變異率 [12-13],而叢生芽增殖途徑能夠克服此類難題 [14]。由于固體培養基存在營養分配不均、接觸面積小等缺點,金線蓮叢生芽增殖途徑速度依然較慢,生長不均勻,影響標準化生產體系的建立。因此,食用液體懸浮培養可彌補以上缺點。本試驗研究了液體懸浮培養的基本培養基和不同激素濃度配比對叢生芽增殖的影響,旨在為金線蓮的快速繁殖開辟一條新途徑。
1 材料與方法
1.1 試驗材料
野外采集的金線蓮植株。將采集回來的野生金線蓮用自來水沖洗干凈,徹底清理葉、葉苞鞘、根,用肥皂水浸泡 20 min,流水沖洗30 min,在超凈工作臺用75%乙醇消毒 30 s,0.1% HgCl2消毒10 min,無菌水洗3~5次,無菌濾紙拭干,將植株切為0.5 cm帶節莖段,接種于固體培養基上誘導叢生芽。
1.2 基本培養基的選擇
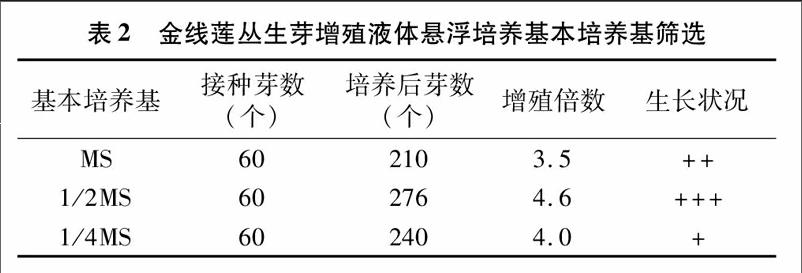
以MS、1/2MS、1/4MS為液體培養的基本培養基,每組培養基同時添加6-BA 0.2 mg/L+NAA 0.2 mg/L+蔗糖 30 g/L,pH值調至5.8。接種莖段于裝有50 mL基本培養基的三角瓶中,在25 ℃ 120 r/min條件下振蕩培養45 d,比較增殖效果。
1.3 激素濃度配比的篩選
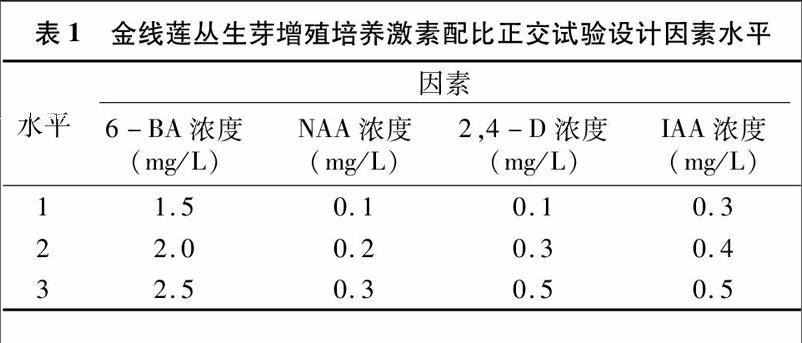
以1/2MS+30 g/L蔗糖為基本培養基,采用L9(34) 4因素3水平正交試驗篩選6-芐氨基嘌呤(6-BA)、萘乙酸(NAA)、2,4-二氯苯氧乙酸(2,4-D)、吲哚乙酸(IAA) 的最佳配比,試驗因素水平見表1。選取在固體培養基上誘導出的顏色較綠、長勢良好的叢生芽作為接種材料,每個處理20瓶,每瓶接種5個叢生芽,接種后在25 ℃ 120 r/min條件下振蕩培養45 d后觀察長勢,計數。數據分析采用SPSS 200軟件進行。
2 結果與分析
2.1 基本培養基對叢生芽增殖的影響
由表2可見,金線蓮在1/2MS液體培養基中培養后的芽數達到最高,生長狀況最佳,其后依次為1/4MS、MS。由此看出,1/2MS是金線蓮叢生芽增殖的最佳液體基本培養基。
2.2 不同濃度激素配比對叢生芽增殖的影響
正交試驗方差分析。從單因素水平出發,由表4、表5可見,6-BA對增殖芽數有顯著影響(P<0.05),其他激素無顯著影響,所以數據未列出。方差分析結果(表6)表明,6-BA 的P<0.05,NAA 和IAA的P>0.05;而且F值顯示6-BA>NAA>IAA,說明6-BA能顯著促進金線蓮液體懸浮培養叢生芽增殖,而NAA 和IAA表現為無顯著性差異。綜合以上試驗結果,金線蓮液體懸浮培養叢生芽增殖的最佳培養條件是6-BA 2.5 mg/L+NAA 0.2 mg/L+IAA 0.3 mg/L+2,4-D 0.5 mg/L,外加蔗糖30 g/L,pH值5.8。
3 結論與討論
金線蓮的組織培養技術研究較早,影響其組織培養的因素主要有基本培養基、不同添加物、激素配比及培養條件等,其中激素配比尤為重要 [15-17]。金線蓮成苗主要通過原球莖和叢生芽2種途徑進行,據相關研究,原球莖的年理論增殖系數能達到1.83×106 [18]。但是原球莖途徑從誘導起始材料開始,必須經歷脫分化和再分化,這比叢生芽途徑多用2個多月的時間,而且長出來的苗大多數纖細,還必須壯苗才能培養出更好的植株,另外原球莖后代再生植株中變異率較高,難以保持母株的優良遺傳特性。為了進一步減少遺傳變異的發生,有人提出采用叢生芽途徑直接出苗。這在大花蕙蘭和蝴蝶蘭的組織培養快速繁殖中已取得成功 [19-20]。叢生芽途徑可以直接出苗,1個芽在2.5個月內增殖6.53倍,年理論增殖系數約為0.82×104,其繁殖系數比原球莖低2個數量級,但叢生芽途徑繁殖周期短,而且可以跨越原球莖途徑中的分化、壯苗等;不僅節約了時間,還降低了生產成本,最主要的是叢生芽途徑再生植株變異率低,能較好地保持母株優良特性。
液體懸浮培養在鐵皮石斛、大花蕙蘭等植物中已獲得成功。因此,本試驗確認1/2MS為金線蓮叢生芽液體懸浮培養的基本培養基,在此基礎上,采用正交試驗研究6-BA、NAA、2,4-D、 IAA等4種激素濃度配比對液體懸浮培養金線蓮叢生芽增值的影響,得出金線蓮液體懸浮培養叢生芽增殖的最佳培養條件為6-BA 2 5 mg/L+NAA 0 2 mg/L+IAA 0 3 mg/L+2,4-D 0 5 mg/L,外加蔗糖30 g/L,pH值5 8。其中影響較大的激素是6-BA,其他3種激素對其的影響均不顯著。
參考文獻:
[1] 趙元藩 金線蓮的開發利用價值及林下栽培技術初步研究[J] 林業調查規劃,2008,33(3):61-63
[2]鐘岑生 金線蓮的藥用價值與開發[J] 廣西農業科學,1997(2):51-53
[3]楊柏云,高蔭榆,李春華,等 金線蓮原球莖的誘導與快速繁殖[J] 安徽農業科學,2008,36(10):3999-4001
[4]闞世超,張明生,李 花 金線蓮叢生芽誘導研究[J] 安徽農業科學,2009,37(3):981-982
[5]肖木興 臺灣金線蓮增殖培養試驗[J] 福建林業科技,2007,34(2):124-126
[6]吳安湘,金曉玲,熊 芳 珍稀瀕危植物組織培養研究進展[J] 西北植物學報,2006,26(1):211-216
[7]于雪梅,郭順星 金線蓮與內生真菌共生培養體系的建立[J] 中國中藥雜志,2000,25(2):17-19
[8]唐明娟,郭順星 內生真菌對臺灣金線蓮栽培及酶活性的影響[J] 中國中藥雜志,2004,29(6):28-31
[9]唐明娟,孟志霞,郭順星,等 內生真菌對福建金線蓮栽培及酶活性的影響[J] [HJ1 86mm]中國藥學雜志,2008,43(12):890-893
[10] 羅安雄,孟志霞,陳曉梅,等 福建金線蓮種子萌發及幼苗培養研究[J] 中國藥學雜志,2012(15):1199-1203
[11]伍成厚,馮毅敏,賀漫媚,等 金線蓮種子培養的研究[J] 中國野生植物資源,2008,27(1):47-50
[12]何松林,十鳥三和子,王 獻,等 不同基本培養基及培養方式對文心蘭原球莖增殖的影響[J] 華北農學報,2001,16(1):88-91
[13]Kerbally G B In vitro flowering of oncidirm varicosum meri-clones[J] Plant Science Letters,1984,35(1): 73-75
[14]丁 蘭,付庭治 蘭花生物工程研究進展[J] 西北師范大學學報:自然科學版,2000,36(3):111-116
[15]韓曉紅,王春龍,段春紅 不同激素水平對金線蓮組織培養的影響[J] 廣東農業科學,2012,39(18):94-97,封2
[16]劉潤東,郭文杰,林忠寧,等 金線蓮組織培養及營養成分的分析研究[J] 廣西農業科學,2006,37(5):506-509
[17]陳漢鑫,王雅英,楊忠耿,等 金線蓮組織培養快繁技術[J] 廣西農業科學,2004,35(4):325-326
[18]張正梁,尹 華 文心蘭分株繁殖和控花栽培[J] 中國花卉園藝,2003(12):26-27
[19]李進進,廖俊杰,柯麗婉,等 蝴蝶蘭根段的組織培養[J] 植物生理學通訊,2000,23(1):37
[20]鄭迎冬,楊承勇,蔣 林 大花蕙蘭的莖段培養[J] 仲愷農業技術學院學報,2000,13(1):19-22

