轉ICE1基因水稻耐冷性與膜脂過氧化和抗氧化酶活性的關系
楊悅 張興梅 孫壯等
摘要: 為探討轉 ICE1 基因水稻耐冷性與膜脂過氧化和抗氧化酶活性的關系,以轉 ICE1 基因和非轉基因水稻墾鑒稻10號為材料,研究4 ℃低溫脅迫對水稻幼苗膜脂過氧化程度和抗氧化酶活性的影響。結果表明,低溫脅迫期間,轉 ICE1 基因水稻的相對電導率及丙二醛(MDA)含量均顯著低于非轉基因水稻,說明 ICE1 基因的過量表達減輕了膜脂過氧化程度,保護了細胞膜系統;隨著冷處理時間的延長,超氧化物歧化酶(SOD)、過氧化物酶(POD)和過氧化氫酶(CAT)活性均呈現先增強后減弱的趨勢,轉 ICE1 基因水稻的SOD、CAT活性均強于非轉基因水稻,但POD活性弱于非轉基因水稻。說明 ICE1 基因的過量表達可能通過減輕膜脂過氧化程度與調整抗氧化酶活性來增強轉基因水稻的耐冷性。
關鍵詞: 水稻; ICE1 基因;低溫脅迫;耐冷性;膜質過氧化;抗氧化酶活性
中圖分類號:Q943.2;S511.034 文獻標志碼: A
文章編號:1002-1302(2015)08-0071-03
黑龍江省地處高寒地區,水稻(Oryza sativa L.)因受到低溫冷害會導致減產甚至絕收,因此,冷害極大地限制了黑龍江省水稻產量的進一步提高。水稻整個生長發育過程中都存在低溫冷害的可能,低溫可導致水稻生長緩慢、發育不良,甚至停滯生長;特別在水稻揚花期遭遇低溫容易導致花粉敗育、受精不良、影響結實。在黑龍江省有限的積溫條件下,低溫會對水稻產量及其品質造成極大地不良影響。 ICE1 (inducer of CBF expression 1)基因是從擬南芥中克隆到的、能調節植株耐冷性的轉錄因子,在低溫條件下可以活化ICE1蛋白,活化了的ICE1蛋白能激活 CBF3 基因表達,CBF3蛋白通過調控 CBF3 基因下游低溫應答基因的表達,從而增強擬南芥的抗冷性 [1]。前期從擬南芥中克隆到了 ICE1 基因,并將其與35S 啟動子連接,構建了植物表達載體pCAMBIA1300-35S- ICE1 ,導入墾鑒稻10號水稻植株中,從而獲得轉 ICE1 基因水稻的再生植株,并進行繼代培養 [2]。本研究對轉 ICE1 基因水稻耐冷性與膜脂過氧化和抗氧化酶活性的關系進行研究,以揭示轉 ICE1 基因水稻膜脂特性及抗氧化酶活性。
1 材料與方法
1.1 試驗材料
本研究采用轉 ICE1 基因水稻墾鑒稻10號第4代T4-8和T4-9株系及未轉基因水稻品種墾鑒稻10號(CK)為試驗材料,轉 ICE1 基因水稻株系來自黑龍江八一農墾大學生命學院分子生物學實驗室,該實驗室利用PCR檢測目的基因的方法對轉基因水稻的遺傳穩定性進行檢測,轉基因水稻材料的 ICE1 基因穩定遺傳 [2]。
1.2 試驗方法
采用轉 ICE1 基因T4-8株系、T4-9株系與CK水稻種子,在25 ℃恒溫條件下浸種,播種在小培養缽中,每個品種(系)18個重復,共計54個處理。將培養缽置于光照培養箱中,[JP3]培養條件為溫度25 ℃,光照16 h/d,照度250 μmol/(m2·s), 相對濕度80%,培養期間澆灌Hoagland營養液。水稻幼苗培養4周后,放置4 ℃條件下進行冷處理,分別在0、2、4、6、8、10 d后停止冷處理,測定水稻植株中相對電導率、丙二醛(MDA)含量及超氧化物歧化酶(SOD)、過氧化物酶(POD)、過氧化氫酶(CAT)的活性。冷處理10 d非轉基因水稻幼苗外觀表現萎蔫,轉基因水稻變化不大 [2]。
1.3 測定項目
水稻植株電導率的測定采用郝建軍等的方法 [3];水稻植株丙二醛(MDA)含量的測定參照王學奎等的方法 [4];水稻植株酶活性的測定 [4]:超氧化物歧化酶(SOD) 活性的測定采用氮藍四唑法(NBT),過氧化物酶(POD)活性的測定采用愈創木酚法,過氧化氫酶(CAT)活性的測定采用紫外吸收法。
1.4 統計分析
試驗數據采用 Excel 和 SPSS 13.0 軟件進行統計分析。
2 結果與分析
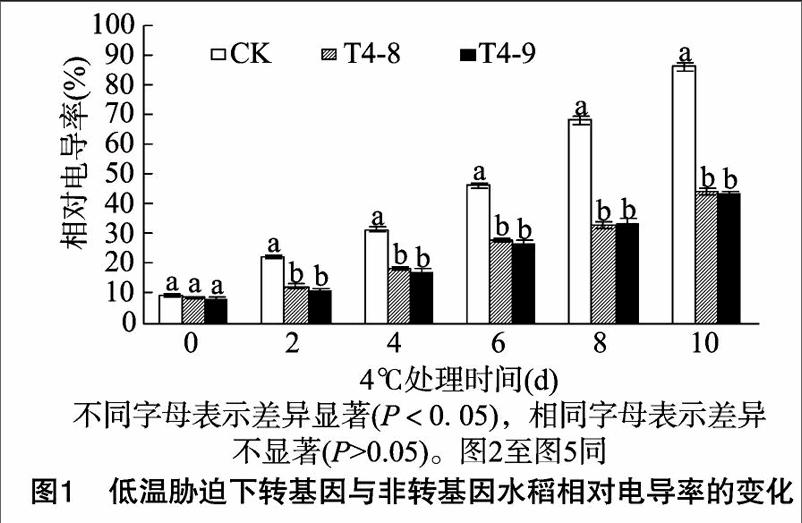
2.1 低溫脅迫下轉 ICE1 基因水稻電導率的變化
植物組織外滲液電導率的變化能夠反映出細胞質膜的傷害程度和植物抗逆性的強弱。低溫脅迫下,細胞膜的結構和功能會受到傷害,導致膜透性增大,電解質外滲,電導率增大 [6]。本研究水稻幼苗經低溫處理后的相對電導率結果如圖1所示,低溫處理前(0 d),轉 ICE1 基因水稻的相對電導率略低于CK,但差異不顯著。低溫處理后,轉基因水稻與CK的相對電導率均增加,且隨著低溫脅迫時間的延長呈直線增加的趨勢,相對電導率與處理時間的關系擬合的直線方程分別為y=5.072+7.674x,r=0.990(CK);y=6.570+3.536x,r=0.989(T4-8);y=5.563+3.609x,r=0.989(T4-9),CK增幅較大,T4-8、T4-9增幅相對較小。低溫脅迫2 d,CK水稻相對電導率為22.51%,分別比T4-8、T4-9水稻高994、11.08百分點;低溫脅迫10 d,CK水稻相對電導率達最大,為86.30%,[JP3]分別比T4-8、T4-9水稻高42.00、42.60百分點。方差分析結果表明,在低溫脅迫期間,轉 ICE1 基因水稻與CK之間的相對電導率差異顯著,而T4-8與T4-9之間差異不顯著。
低溫脅迫后,轉 ICE1 基因和非轉基因水稻的電導率變化規律相同,其相對電導率均是隨著低溫脅迫時間的延長趨于增大,但分析數據結果表明,轉 ICE1 基因水稻的相對電導率顯著低于CK,說明低溫脅迫下 ICE1 基因的導入保護了細胞膜,減少了細胞液的外滲,提高了水稻的耐冷性,使植株受傷害的程度較輕。由此可見,低溫脅迫下 ICE1 基因具有增強水稻對低溫冷害的抗御作用。
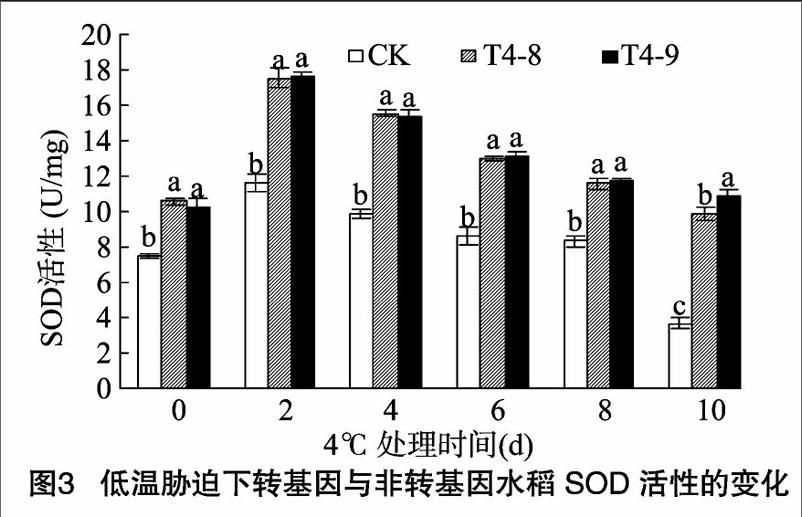
2.2 低溫脅迫下轉 ICE1 基因水稻丙二醛含量的變化
植物在逆境條件下往往發生膜脂過氧化作用,MDA是膜脂過氧化的產物之一,其含量可以反映細胞膜脂過氧化程度及細胞遭受傷害的程度 [7]。本試驗水稻幼苗經低溫處理后的MDA含量如圖2所示,低溫處理前(0 d),轉 ICE1 基因水稻的MDA含量與CK相近。在低溫脅迫下,CK水稻中MDA含量隨冷處理時間的延長呈線性增加的趨勢,MDA含量與處理時間的關系可以擬合為直線方程:y=3.259+1.350x,r=0.980;低溫處理2 d,轉基因水稻中MDA含量略有增加,其后基本處于相對穩定狀態。由圖2可以看出,低溫脅迫2 d,CK水稻中的MDA含量快速增加,與脅迫前相比提高了71.9%;而T4-8、T4-9水稻MDA含量與脅迫前相比分別提高291%、30.2%。低溫脅迫10 d,CK水稻MDA含量最高達1531 μmol/g;而T4-8、T4-9水稻MDA含量分別為4.53、 4.63 μmol/g。低溫處理前,CK與T4-8、T4-9水稻MDA含量差異不顯著;低溫處理后,CK與T4-8、T4-9水稻差異顯著,T4-8、T4-9的MDA含量相差不大。由此可見,外源基因 ICE1 提高了水稻細胞膜脂的抗氧化能力。
一些試驗結果證明 [8-10],低溫會使植物幼苗的MDA含量增加,從而促進膜脂過氧化過程,導致膜傷害。此外,MDA本身也是具有細胞毒性的物質,它與細胞體內的酶結合、交聯后[CM(25],會使之失去活性,從而進一步破壞膜結構。本試驗中轉ICE1 基因水稻在低溫脅迫下MDA含量顯著低于CK,表明低溫脅迫下外源基因 ICE1 可能對膜保護系統發揮作用。
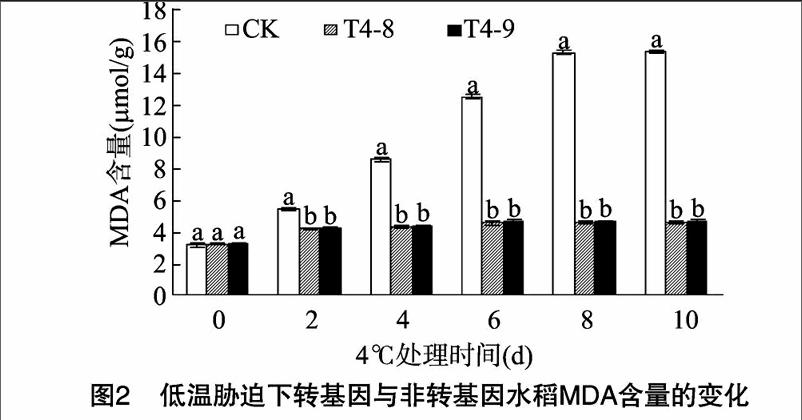
2.3 低溫脅迫對轉 ICE1 基因水稻SOD的影響
SOD是生物體內特異清除超氧陰離子自由基的酶,能催化超氧陰離子發生歧化反應,清除植物組織和細胞內的超氧自由基,減緩氧自由基對細胞膜的損傷,減輕活性氧對植物的危害。圖3為低溫脅迫下轉 ICE1 基因與非轉基因水稻SOD活性的變化。在低溫脅迫期間,水稻中SOD活性呈規律性變化,低溫脅迫初期,水稻中的SOD活性增強,低溫脅迫2 d 3個品種(系)水稻中的SOD活性均達到最大值,分別為1163、17.55、17.61 U/mg,其后CK和轉基因水稻的SOD活性均呈下降趨勢。低溫脅迫10 d,CK水稻SOD活性減至368 U/mg;而T4-8、T4-9水稻中的SOD活性與脅迫前相近。在整個低溫脅迫期間,轉 ICE1 基因水稻SOD活性均強于CK,且差異顯著。表明在低溫脅迫條件下, ICE1 基因的過量表達有助于增強SOD活性,增強水稻清除超氧自由基的能力,保護細胞膜,從而提高水稻的耐冷性。
2.4 低溫脅迫對轉 ICE1 基因水稻POD的影響
由圖4可知,低溫處理前,轉基因和非轉基因水稻的POD活性差異不大,低溫處理后,非轉基因水稻的POD活性顯著增強,低溫脅迫 2 d時達到最大值,為33.08 U/(mg·min),其后POD活性直線減弱,低溫脅迫 10 d時減至 19.86 U/(mg·min)。[JP3]T4-8和T4-9水稻的POD活性在低溫處理后雖然有所增強,但明顯弱于CK,在低溫脅迫 4 d時達到最大值,為19.41、19.53 U/(mg·min), 其后POD活性處于相對穩定水平,低溫脅迫 10 d時T4-8和T4-9水稻POD活性分別減至14.84、15.16 U/(mg·min)。方差分析結果表明,低溫處理后T4-8和T4-9水稻POD活性均顯著弱于非轉基因水稻,但T4-8和T4-9之間差異不顯著。由此推測,外源基因可能插入到影響POD基因表達的相關序列中, ICE1 基因可能削弱了原水稻植株中POD基因的表達,從而使轉基因
水稻的POD活性低于非轉基因水稻。
2.5 低溫脅迫對轉 ICE1 基因水稻CAT的影響
CAT是植物體內分解過氧化物、消除其對植物的危害、防止植物衰老的抗性酶,它可以促使H2O2分解為O2和H2O,防御細胞遭受H2O2的毒害。通過檢測CAT活性可以看出, ICE1 基因的表達是否提高了水稻抵御過氧化氫的能力。由圖5可知,隨著低溫脅迫時間的延長,水稻中的CAT活性表現為先增強后逐漸減弱,并且轉基因水稻T4-8和T4-9的CAT活性均強于CK,其差異顯著,而T4-8和T4-9之間差異不顯著。低溫脅迫前,轉基因與非轉基因水稻體內CAT活性均相對較弱,但T4-8、T4-9水稻CAT活性強于CK,分別比CK強14.88%、16.72%。低溫脅迫2 d,CK水稻CAT活性達到最大值,為13.35 U/(mg·min),但弱于同期T4-8和T4-9水稻,其后CK水稻的CAT活性持續減弱,低溫脅迫 10 d時減至最低值,為9.92 U/(mg·min)。T4-8、 T4-9水稻 CAT活性在低溫脅迫 4 d時達到最大值,較同期CK強4815%、49.72%,其后T4-8、T4-9水稻CAT活性緩慢減弱,低溫脅迫 10 d時分別減為11.8、12.2 U/(mg·min), 但分別比同期CK強1.88、2.28 U/(mg·min)。以上結果表明, ICE1 基因過量表達能提高水稻體內的CAT活性,或促進CAT的合成,從而提高水稻清除H2O2的能力。
3 結論與討論
植物體自身具有復雜的抗冷防御機制,在逆境條件下可以開啟多個防御系統。1個基因可以調控多個防御應答機制,而1個應答機制也受多個基因的調控。在植物體內 ICE1 作為上游轉錄因子,可能調控多個級聯反應,參與到耐冷機制中,從而使植株獲得較高的耐冷性 [11]。
應用組成型啟動子CaMV35S與 ICE1 基因構建植物表達載體, ICE1 基因可以在轉基因植株內組成型表達。由試驗結果可知,常溫下轉基因和非轉基因水稻植株在表型上沒有表現出明顯的差異,兩者抗氧化酶活性差異不大。由此可見,在正常生長條件下,過量表達 ICE1 基因對水稻植株的生長及生理指標影響不大。常溫下可能 ICE1 基因表達產物不起作用或作用較弱,因此,過量表達 ICE1 基因沒有產生級聯反應,水稻植株的表型和體內生理指標沒有表現出明顯的差異。低溫脅迫條件下,轉基因水稻抗冷性增強,主要表現為轉 ICE1 基因水稻的相對電導率遠低于非轉基因水稻;低溫脅迫期間轉基因水稻MDA含量變化不大,且顯著低于非轉基因水稻,說明 ICE1 基因的過量表達減輕了膜脂過氧化程度,抑制了MDA的積累,保護了細胞膜系統,減少了細胞內容物的外滲。SOD、POD和CAT是膜保護系統重要的3種酶,具有清除植物組織和細胞內的自由基,使植物體內自由基維持在一個較低水平,減緩自由基對細胞膜傷害的作用 [12]。本研究結果表明,低溫脅迫期間,水稻中的SOD、POD、CAT活性表現為先增強后減弱,說明低溫脅迫初期水稻啟動了體內抗氧化系統,抗氧化酶活性增強,清除自由基能力提高了;隨著脅迫時間的延長,抗氧化酶活性減弱,可能是因為隨著低溫脅迫的加劇,自由基產生量增加,對抗氧化酶造成傷害,抗氧化酶活性減弱,這又會加重自由基對植物細胞和組織的傷害。轉基因水稻SOD、CAT活性均高于非轉基因水稻,酶活性差異顯著,在低溫處理后期表現更為突出,說明在低溫脅迫條件下, ICE1 基因過量表達并發揮了作用,通過提高抗氧化酶活性來提高清除自由基的能力,從而減輕自由基對植物細胞和組織的傷害。 ICE1 基因可能是通過一系列級聯反應作用于抗氧化酶,從而維持植物較高的抗氧化酶活性,有利于細胞的正常代謝,最終表現出轉基因水稻耐冷性增強。
本研究中轉基因水稻POD活性的變化趨勢與SOD、CAT不同,雖然低溫脅迫期間POD活性緩慢減弱,但低溫脅迫后酶活性低于非轉基因水稻。這暗示著外源基因 ICE1 的轉入和過量表達對過氧化物酶活性產生了一定的影響。 ICE1 基因的轉入可能插入到影響POD基因表達的序列內,影響了POD的表達,或者 ICE1 自身表達產物對POD活性有作用,從而使轉基因水稻的POD活性弱于非轉基因水稻;另外,也有可能與CAT活性有關,CAT和POD同為清除H2O2的主要酶類,CAT活性的增強影響了POD活性,CAT對低溫脅迫表現敏感而POD表現不敏感。總體上看,POD的不敏感并沒有影響轉基因植株整體的耐冷性,低溫脅迫條件下轉 ICE1 基因水稻的耐冷性仍高于非轉基因水稻。
綜上所述,盡管在低溫脅迫條件下轉基因和非轉基因水稻各種抗氧化酶活性的變化存在一定的差異,但轉基因水稻整體表現出了明顯的耐冷性,本研究結果表明,轉 ICE1 基因水稻抗膜質過氧化能力高于非轉基因水稻。本試驗中轉 ICE1 基因水稻膜脂過氧化酶和抗氧化酶活性方面的研究與前人的研究結果 [13]基本一致。
[HS2*3][HT8.5H]參考文獻:
[1] Chinnusamy V,Ohta M,Kanrar S,et al. ICE1 :a regulator of cold-induced transcriptome and freezing tolerance in Arabidopsis[J]. Genes Dev,2003,17:1043-1054.
[2]張興梅,孫 壯,殷奎德,等. 低溫脅迫下轉 ICE1 基因水稻養分變化的研究[J]. 干旱地區農業研究,2013,31(6):140-145.
[LM]
[3] 郝建軍,康宗利,于 洋.植物生理學實驗技術[M]. 北京:化學工業出版社,2007:169-173.
[4]王學奎.植物生理生化實驗原理和技術[M]. 北京:高等教育出版社,2006:167-172,280-281.
[6]李海林,王林輝,黃燕湘.低溫脅迫對水稻再生芽抗冷性的影響[J]. 江西農業學報,2007,19(1):10-13.
[7]Katsuhara M,Otsuka T,Ezaki B.Salt stress-induced lipid peroxidation is reduced by glutathione S-transferase,but this reduction of lipid peroxides is not enough for a recovery of root growth in Arabidopsis[J]. Plant Sci,2005,169:369-373.
[8]侯麗霞.CaCl2浸種對低溫脅迫下水稻幼苗生理指標的影響[J]. 江蘇農業科學,2013,41(8):70-71.
[9]黃秋鳳,羅興錄,王春蓮,等. 低溫脅迫對木薯幼苗生理特性的影響[J]. 中國農學通報,2010,26(17):172-177.
[10] 劉世彪,易 萍,羅 奧,等. 低溫脅迫對絞股藍和五柱絞股藍抗寒性生理指標的影響[J]. 熱帶作物學報,2008,29(5):572-576.
[11]Lee B H,Henderson D A,Zhu J K. The Arabidopsis cold responsive transcriptome and its regulation by ICE1 [J]. Plant Cell,2005,17:3155-3175.
[12]Hernandez J,Imenez A,Mullineaux P,et al.Tolerance of pea(Pisum sativum L.) to long-term salt stress is associated with induction of antioxidant defenses[J]. Plant Cell Biology,2000,23:853-862.
[13]Xiang D J,Hu X Y,Zhang Y,et al. Over-expression of ICE1 gene in transgenic rice improves cold tolerance[J]. Rice Science,2008,15(3):173-178.

