BRCA-1、ERCC mRNA在大腸癌組織中的表達及對鉑類化療預后的影響
王先國 陳景華 李 宇 張山燕 周 遠 (泰安市腫瘤防治院化療二科,山東 泰安 271000)
目前鉑類化療方案(即包含奧沙利鉑的FOLFOX方案)被認為是化療的金標準,但是,許多大腸癌患者在接受鉑類化療后出現(xiàn)耐藥性,使得化療失敗〔1〕。乳腺癌敏感蛋白(BRCA)-1具有調(diào)控基因表達的作用,可對DNA進行重組修復,調(diào)節(jié)細胞周期,從而能抑制腫瘤的發(fā)生,若其功能失活乳腺癌和卵巢癌的發(fā)病率將顯著提高。研究發(fā)現(xiàn),BRCA-1和核苷酸切除修復交叉互補基因(ERCC)1與鉑類化療耐藥性有很大的關(guān)聯(lián)性〔2〕。本研究旨在探討此兩種基因的表達與鉑類化療后患者各項生存指標的相關(guān)性。
1 資料與方法
1.1 入選對象 選取我院2007年1月至2010年3月的大腸癌患者58例。所有患者進行手術(shù)切除,已經(jīng)病理證實為大腸癌患者,所選對象中所有患者心、肝、腎功能均正常,未合并兩種及以上腫瘤,在術(shù)前均未接受過放療和化療,并且隨訪資料完整。排除標準:術(shù)前接受過放、化療患者;哺乳期婦女、孕婦;有精神性疾病患者;兩種及以上腫瘤合并患者。58例大腸癌患者中,男38例(65.51%)、女20例(34.48%),年齡38~82歲,中位年齡62歲。按照TNM分期標準,Ⅰ期6例,Ⅱ期32例,Ⅲ期20例。28例有淋巴結(jié)轉(zhuǎn)移,30例無淋巴結(jié)轉(zhuǎn)移。
1.2 研究方法 詳細記錄58例研究對象的姓名、性別、年齡、接受手術(shù)時間、病理類型及分期。通過電話隨訪,對患者的身體狀況、疾病復查狀況、疾病進展狀況、患者死亡原因及時間進行詳細記錄。以患者死亡為結(jié)局,至隨訪截止仍存活者視為結(jié)尾數(shù)據(jù)。隨訪至2013年5月結(jié)束,隨訪總時間為70個月。
1.3 化療方案 應(yīng)用FOLFOX化療方案:奧沙利鉑(L-OHP)100 mg/m2,靜滴,第 1 天;亞葉酸鈣(CF)200 mg·m-2·d-1,在5-氟尿嘧啶(5-FU)前2 h靜滴,第1~2天;5-FU 400 mg/m2,靜脈注射,第1天,然后再用 2400 mg/m2,46 h持續(xù)靜滴,第1~2天;14 d后重復治療,共12個療程。
1.4 試劑 主要包括鼠抗人ERCC mRNA和鼠抗人BRCA-1單克隆抗體試劑盒以及SP試劑盒(即用型)、二氨基聯(lián)苯胺(DAB)顯色試劑盒(內(nèi)含底物、顯色劑、緩沖液),應(yīng)用試劑來自上海研域生物科技有限公司。
1.5 BRCA-1、ERCC mRNA檢測 使用快速免疫組化法對BRCA-1、ERCC mRNA進行測定,組織切片取自入選的58例研究對象,實驗過程如下:(1)用4%的甲醛對患者組織標本進行固定,制作石蠟切片,經(jīng)蘇木素-伊紅(HE)染色后確診為大腸癌者制作成5 μm切片,置于載玻片上,經(jīng)烤片后使組織貼于載玻片上,然后對其脫蠟、水化(每例標本均制作兩張玻片)。(2)用3%H2O2將玻片培育10 min后,再用蒸餾水按照每次2 min的方法沖洗3次。(3)在每例兩張載玻片上,分別滴加1滴BRCA-1、ERCC1單克隆抗體試劑(按1∶100稀釋)。(4)將載玻片室溫培育,20 min后滴加DAB顯色液。(5)蒸餾水沖洗10 min后,用蘇木精染色1 min,經(jīng)酒精分化后,再用氨水返藍。(6)用蒸餾水沖洗后,使用酒精梯度脫水。(7)二甲苯透明后使用中性樹脂將撥片封固。(8)將制好的玻片置于顯微鏡下找到癌細胞并觀察。
1.6 結(jié)果判斷 高倍鏡下觀察細胞核,若ERCC mRNA和BRCA-1陽性,則在鏡下細胞核中可以觀察到棕褐色或棕黃色顆粒沉著物,且此沉著物顏色較背景色明顯、細胞結(jié)構(gòu)完整。本實驗以Fromowitz為評判標準:(1)陽性細胞所占百分比:10個高倍鏡視野中,黃染的陽性細胞的總數(shù)與10個視野中所有細胞總和的百分比。細胞陽性數(shù)賦值方法,0分:<5%;1分:5% ~25%;2分:26% ~50%;3分:51% ~75%;4分:>75%。細胞著色強度賦值,0分:不著色 ;1分:淡黃色;2分:棕黃色;3分:棕褐色。(2)以細胞陽性得分與著色強度得分的乘積判斷細胞陽性水平,0~1分:陰性;>2分:陽性。
1.7 統(tǒng)計學方法 運用SPSS17.0軟件進行分析,運用Pearson相關(guān)分析,應(yīng)用Kaplan-Meier法進行生存曲線估計。
2 結(jié)果
2.1 BRCA-1實驗結(jié)果 大腸癌組織切片顯示BRCA-1均有表達,其中BRCA-1陽性表達37例(63.8%),陰性表達21例(36.2%)。不同的分化水平、臨床分期、淋巴細胞轉(zhuǎn)移與否與BRCA-1表達差異均有統(tǒng)計學意義(P<0.05)。BRCA-1陽性表達者平均生存期為(52.00±4.00)個月(95%CI:44.16~59.84),中位生存期(MST)為48.35個月(95%CI:23.47~64.53);陰性表達者平均生存期為(40.86±3.04)個月(95%CI:34.89~46.82),MST為 44.58個月(95%CI:38.24~55.77)。BRCA-1陽性與陰性者生存時間之間差異有統(tǒng)計學意義(P <0.05)。見表 1,圖1。
2.2 ERCC mRNA實驗結(jié)果 大腸癌組織切片顯示ERCC mRNA均有表達,其中陽性表達25例(43.1%),陰性表達33例(56.9%)。臨床分期、淋巴細胞轉(zhuǎn)移與否與ERCC mRNA表達差異均有統(tǒng)計學意義(P<0.05)。ERCC mRNA陽性表達者平均生存期為(43.75±4.70)個月(95%CI:34.54~52.96),MST為36.72個月(95%CI:33.24~47.18);陰性表達者平均生存期為(48.60±1.99)個月(95%CI:44.7~52.5),MST為48.10個月(95%CI:47.12~48.88)。ERCC mRNA陽性與陰性者生存時間之間差異無統(tǒng)計學意義(P>0.05)。見表2,圖2。
2.3 BRCA-1、ERCC mRNA表達水平與生存時間相關(guān)性研究經(jīng)Pearson相關(guān)性檢驗發(fā)現(xiàn),BRCA-1陽性表達及ERCC mRNA陰性表達與生存時間呈正相關(guān)性(r=0.651,0.579;均P<0.01),即BRCA-1和ERCC mRNA表達水平對經(jīng)鉑類治療后的患者生存時間均有影響。

表2 ERCC mRNA表達與大腸癌患者臨床病理特征的關(guān)系〔n(%)〕
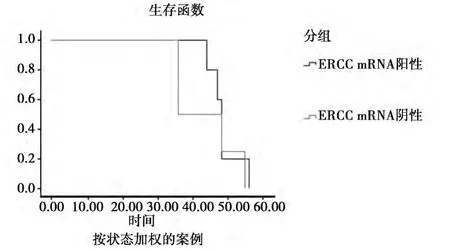
圖2 不同ERCC mRNA表達患者的生存分析
3 討論
機體在維持基因表達的過程中,基因組的功能整體性、機體的抗癌過程以及對致癌基因的損傷性修復是極為重要的,而這些功能主要是通過核苷酸切除修復(NER)過程來實現(xiàn)。經(jīng)研究表明,癌癥患者經(jīng)鉑類治療的效果受DNA修復能力的影響,在NER過程中,ERCC1是一種極其關(guān)鍵的核苷酸內(nèi)切酶,并且是此過程的重要限速酶,在DNA損傷的識別功能和基因切割修復上起關(guān)鍵作用〔3〕。若ERCC1表達水平低或者無表達,就能導致細胞基因不穩(wěn)定,增加細胞的惡性程度,癌細胞易出現(xiàn)轉(zhuǎn)移。因此,許多學者將ERCC1認為此基因可能是相關(guān)腫瘤患者的預后指標〔4,5〕。BRCA1在基因的損傷修復過程中同樣起著重要作用,BRCA-1能夠調(diào)節(jié)G2-M期檢測點,其所影響細胞分化過程主要是通過控制細胞有絲分裂時期染色體的分離和重組過程〔6〕。在以小鼠為模型進行的研究中發(fā)現(xiàn),具有BRCA-1基因的人乳腺癌組織生長過程抑制水平低〔7〕。BRCA-1能夠?qū)σ咽軗p的DNA進行編碼,并產(chǎn)生相關(guān)蛋白產(chǎn)物,這些產(chǎn)物能夠與參與基因修復的蛋白質(zhì)之間進行相互作用,若BRCA-1表達水平低,則其對基因修復能力減弱,從而機體對鉑類藥物敏感性增強〔8〕。目前,臨床上應(yīng)用的鉑類藥物治療大腸癌患者時,有許多患者產(chǎn)生耐藥性,并且不同患者之間對鉑類藥物的敏感性也有所不同。Chang等〔9〕報道,當DNA受損時,可以通過激活的ERCC1核苷酸內(nèi)切酶的作用將受損的基因切除,對腫瘤患者進行鉑類治療后,鉑類與DNA能夠形成加合物,次加合物能夠使ERCC1結(jié)合XPF因子,進一步激活ERCC1,達到基因修復功能。可見在鉑類藥物治療腫瘤患者產(chǎn)生耐藥性過程中,ERCC1具有重要意義。Shirota等〔10〕認為,癌癥患者ERCC mRNA高表達這總生存期為1.9個月,低表達者總生存期為10.2個月,且差異具有統(tǒng)計學意義。
本研究顯示,ERCC mRNA陰性表達患者生存期高于陽性表達患者。這可能是由于陰性表達患者的ERCC1對DNA修復能力減弱,使機體對藥物敏感性增大,鉑類藥物治療效果明顯。在本研究的相關(guān)性檢驗發(fā)現(xiàn),尚不能認為ERCC mRNA表達水平與大腸癌患者的年齡、性別等有關(guān),而陽性表達者經(jīng)過鉑類藥物治療后收益更大。
1 Martin LP,Hamilton TC,Schilder RJ.Platinum resistance:the role of DNA repair pathways〔J〕.Clin Cancer Res,2008;14(5):1291-5.
2 逯曉波,安春麗,TaharVan Der Straaten,等.ERCC1蛋白表達及對草酸鉑細胞毒作用影響〔J〕.中國公共衛(wèi)生,2007;23(2):206-7.
3 林 莉,劉曉晴,宋三泰.DNA損傷修復與鉑類耐藥研究進展〔J〕.中國腫瘤,2006;15(1):29-31.
4 Cobb MA,Badylak SF,Janas W,et al.Porcine small intestinal submucosa as a dural substitute〔J〕.Surg Neurol,1999;51(1):99-104.
5 Hall JM,Lee MK,Newman B,et al.Linkage of early-onset familial breast cancer to chromosome17q21〔J〕.Science,1990;250(4988):1684-9.
6 Park DJ,Zhang W,Stoehlmacher J,et al.ERCC1 gene polymorphism as a predictor for clinical outcome in advanced colorectal cancer patients treated with platinum-based chemotherapy〔J〕.Clin Adv Hematol Oncol,2003;1(3):162-6.
7 Dejardin LM,Arnoczky SP,Clarke RB.Use of small intestinal submucosal implants for regeneration of large fascial defects:an experimental study in dogs〔J〕.J Biomed Mater Res,1999;46(2):203-11.
8 蘇麗婭,岳秀蘭,曹虹然,等.散發(fā)性乳腺癌中BRCA1基因突變的研究〔J〕.中國腫瘤臨床雜志,2007;34(5):289-90.
9 Chang IY,Kim MH,Kim HB,et al.Small interfering RNA-induced suppression of ERCC1 enhances sensitivity of human cancer cells to cisplatin〔J〕.Biochem Biophys Res Commun,2005;327(1):225-33.
10 Shirota Y,Stoehlmacher J,Brabender J,et al.ERCC1 and thymidylate synthase mRNA levels predict survival for colorectal cancer patients receiving combination oxaliplatin and fluorouracil chemotherapy〔J〕.J Clin Oncol,2001;19(23):4298-304.

