三氧化二砷脂質體治療大鼠C6 腦膠質瘤的實驗研究
張 旭 陳 巖 趙世光 任 穎
1)哈爾濱醫科大學附屬第一醫院神經外科 哈爾濱 150001 2)黑龍江省第二醫院ICU 病房 哈爾濱 150001
體外研究[1]結果表明,As2O3也可抑制腦膠質瘤細胞的增殖,但因對BBB 的低透過率,難以發揮有效的作用。此外,砷劑在體內代謝快、有效作用時間短等問題也未能完全解決。所以,確定As2O3治療腦膠質瘤的最佳給藥途徑及確保腫瘤部位的有效濃度是目前研究的重點。脂質體類藥物可解決很多藥物不能透過BBB 的問題,且脂質體類藥物的局部靶向作用也可提高藥物的療效[2]。本實驗制備As2O3脂質體,對C6腦膠質瘤模型大鼠進行尾靜脈注射,觀察對大鼠腦膠質瘤的作用。
1 材料與方法
1.1 材料及試劑日本關西醫科大學提供的大鼠C6腦膠質瘤細胞株;北京東方丁香園國際醫學研究院提供的Wistar雄性大鼠,體質量230~250g;As2O3注射液(哈爾濱醫科大學,伊達制藥廠);注射級大豆卵磷脂(上海太偉藥業);膽固醇、維生素E粉、葡聚糖聚50水凝膠(Sigma公司)等。
1.2 主要 儀器RE-52AAB 旋 轉 蒸 發 器;JY92-2D 型 超 聲波細胞粉碎機(浙江);UV-2550分光光度計(日本島津);1.5 TVISRT 型磁共振機(日本東芝);透射電子顯微鏡(JENM1220);倒置相差顯微鏡(OLYMPUS);AFS-930原子熒光光譜儀(吉天儀器公司)。
1.3 制備As2O3 脂質體精密稱取卵磷脂:膽固醇:維生素E(20︰5︰1)于茄形瓶,向內加入適量氯仿溶解,均勻混合,40 ℃減壓旋轉蒸發;精密稱取適量As2O3,溶于去離子水,加熱溶解,制備成含As2O31 mg/mL 的溶液,該溶液加入上述具有磷脂和膽固醇脂質膜的茄形瓶中,旋轉水化15 min,冰浴超聲,即得穩定的乳白色As2O3脂質體溶液,通過選擇的超聲時間及強度可獲得粒徑為0.25~1μm 的單層脂質體。根據《中華人民共和國藥典》,銀鹽法檢測As2O3脂質體的包封率[3]。
1.4 檢測大鼠腦組織中的砷含量大鼠84 只,隨機分為2組(As2O3脂質體組、As2O3組),每組42 只,分別經尾靜脈注射As2O3脂質體和As2O3注射液,劑量為2mg/(kg·d);分別在給藥后0.5、1、2、4、8、16、24h各取6只大鼠腦組織,液氮凍存,研磨,原子熒光法檢測組織中的砷含量。
1.5 載瘤動物模型的建立制備C6膠質瘤細胞懸液(1×106/10μL),應用大鼠頭部立體定向儀在大鼠右側尾狀核種植10μL細胞懸液[4-5]。7d后進行MRI檢查,觀察鼠腦成瘤情況。選取腫瘤生長情況較一致的大鼠共54只,隨機分組,分別給予尾靜脈注射As2O3水溶液、As2O3脂質體、生理鹽水,給藥1次/d,共7d;用藥后第3、7天每組分別隨機處死6只大鼠,剝離腦膠質瘤,對其進行電鏡觀察和凋亡檢測。
1.6 觀察指標(1)大鼠的存活情況:每組6只大鼠,觀察其生存狀態及生存期。(2)MRI檢查觀察腫瘤體積:于停藥后第2天和第7天做2次MRI檢查。腫瘤體積計算公式:體積(V)=長·寬·高·π/6。(3)電鏡觀察:以2%戊二醛固定鼠腦膠質瘤組織,透射電鏡觀察亞細胞結構。(4)凋亡檢測TUNEL法檢測凋亡情況:操作按照原位細胞凋亡檢測試劑盒進行,細胞核內的棕褐色染色為陽性細胞,每張切片隨機選擇5個視野,兩人雙盲高倍鏡下計數500個細胞中的陽性細胞數,取均值。
1.7 統計學處理計量資料數據以±s表示,SAS.913統計軟件對砷的含量、凋亡檢測數據進行析因方差分析;對生存期進行Kaplan-Meier生存分析,并做Log-Rank檢驗。
2 結果
2.1 包封率銀鹽法檢測As2O3脂質體的包封率為90%。
2.2 砷含量檢測采用原子熒光法測定大鼠腦組織中的砷濃度,結果發現,給藥后各時間點As2O3脂質體組均高于As2O3組,經析因方差分析,差異有統計學意義(P<0.001)。見圖1。

圖1 大鼠腦組織中砷含量
2.3 大鼠存活情況觀察接種腫瘤第3天開始,大鼠飲水、進食及運動減少,攻擊性下降,精神萎靡,毛色失去光澤,逐漸消瘦。第14天時,生理鹽水組和As2O3組部分大鼠逐漸出現對側或雙側肢體無力、活動不靈活,亦有部分大鼠出現突發抽搐、易激惹等表現;瀕死前該2組大鼠均表現刺激反應減弱,甚至木僵狀態、呼吸細弱或不規則,不進飲食、極度消瘦、惡液質等癥狀。生理鹽水組和As2O3組的中位生存時間分別為為21和23d;As2O3脂質體組的大鼠在給藥后7d情況逐漸好轉,一般情況基本正常,直至58d時僅1只死亡,剩余5只在給藥后第70天處死,其中3只大鼠的大腦切片未見腫瘤,2 只大鼠腦內仍有腫瘤存在。由此可見,As2O3脂質體組的生存期與生理鹽水組和As2O3組相比明顯延長(P<0.01),且未見有砷中毒現象。
2.4 MRI檢查結果給藥第7天,生理鹽水組和As2O3組腫瘤體積增大,As2O3脂質體組腫瘤體積未見增大;停藥后第7天,As2O3脂質體組腫瘤體積較其他2組比較,明顯縮小(圖2),生理鹽水組和As2O3組腫瘤體積增大。見表1。
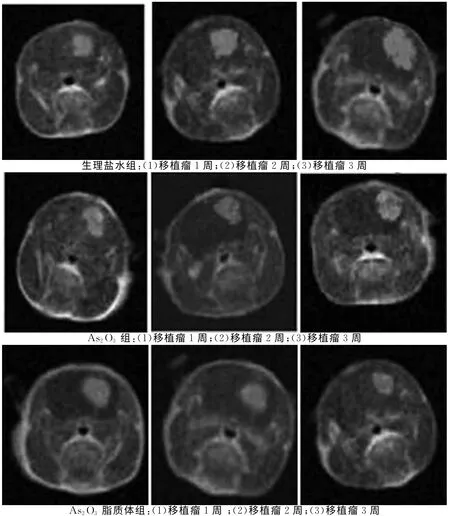
圖2 MRI影像
2.5 凋亡檢測給藥第3天、7天,生理鹽水組、As2O3組、As2O3脂質體組陽性染色率依次分別為(3.15±0.34)%和(3.92±0.57)%,(3.18±0.41)%和(4.09±0.54)%,(13.53±1.68)%和(20.03±0.79)%。析因方差分析結果顯示,As2O3脂質體組的陽性染色率明顯高于As2O3組和鹽水組,差異有統計學意義(P<0.01)。且As2O3脂質體組給藥7d大于給藥3d的腫瘤組織陽性細胞數(P<0.01)。見圖3。
2.6 電鏡觀察結果As2O3脂質體組腫瘤細胞粗面內質網脫顆粒,線粒體嵴斷裂,髓樣變甚至空泡樣變性,細胞核固縮,核膜下有高密度的染色質斑塊邊集等凋亡改變,凋亡細胞多于As2O3組和生理鹽水組。As2O3組和生理鹽水組中,周邊部腫瘤異型性明顯,生長活躍,腫瘤中心的凋亡細胞多于周邊部。見圖4。
表1 各組移植瘤體積測定結果比較 ±s,mm3)

表1 各組移植瘤體積測定結果比較 ±s,mm3)
注:與As2O3 脂質體組比較,*P<0.01
?

圖3 TUNEL 法凋亡檢測(可見細胞核內的棕褐色染色為陽性細胞TUNEL×400倍)

圖4 As2O3 脂質體組腫瘤組織的凋亡細胞結構
3 討論
神經膠質瘤是中樞系統最常見的惡性腫瘤,在我國統計占顱內腫瘤的33.3%~58.9%,目前,膠質瘤主要采取以手術為主的綜合治療措施,但復發仍無法避免[6],因此,探索更為有效的腦膠質瘤治療方法已成為迫切的臨床要求。
As2O3可 抑 制U87MG 和T98G 膠 質 瘤 細 胞 增 殖[7],但BBB對As2O3的低透過率,成為臨床應用研究的障礙。BBB的內皮細胞緊密聯接排列,只允許親脂性、低分子量的藥物被動轉運[8]。脂質體模擬細胞膜結構,由磷脂雙層構成,具有水相內核,作為抗癌藥物的載體具有很以下褚多優點:增加在血液中的保留時間,靶向作用于癌細胞,不良反應低,療效高。脂質體腦內給藥,可以產生腦靶向性,延緩藥物的消除,延長作用時間,有利于向病變組織分布,可持續釋放藥物,顯著增加藥物在腦組織內的轉運量[9]。故本實驗為選用脂質體為載藥系統,期望為砷劑的在體應用尋求一個新途徑。
本實驗將As2O3制成單層脂質體,可以避免巨噬細胞對As2O3的吞噬、清除,可以增加As2O3的載藥量及對血腦屏障的透過率,原子熒光法檢測的大鼠腦組織中砷含量明顯高于單純的As2O3注射組,所以As2O3脂質體提高了As2O3對血腦屏障的透過率。
體外實驗結果證實As2O3可誘導膠質瘤細胞凋亡[7],本研究中大鼠腦膠質瘤組織電鏡及切片可觀察到,As2O3脂質體組膠質瘤細胞結構出現了細胞凋亡,但生理鹽水組和As2O3組除了腫瘤中心壞死區,其他部位凋亡的膠質瘤細胞少見。因此,我們認為As2O3不能高效透過血腦屏障,無法對對膠質瘤發揮有效的治療作用。原位凋亡檢測也證實了As2O3脂質體組能明顯誘導膠質瘤細胞凋亡,而As2O3組和生理鹽水組誘導膠質瘤細胞凋亡作用不明顯。另外,As2O3脂質體組第7天的凋亡率高于第3天,以上結果均證實脂質體可以載As2O3高效透過血腦屏障,提高了其對膠質瘤的治療效果。
實驗中MRI影像顯示,As2O3脂質體組大鼠的腫瘤體積明顯小于As2O3組和生理鹽水組,As2O3組和生理鹽水組膠質瘤體積隨時間的延長而增大,2組間差異無統計學意義。大鼠的生存期觀察也表明As2O3脂質體較單用As2O3和生理鹽水可明顯抑制大鼠腦部移植膠質瘤的生長,我們認為其抑制作用與有效劑量的As2O3進入血腦屏障從而誘導腫瘤細胞凋亡有關。
綜上所述,As2O3脂質體可以通過誘導C6膠質瘤細胞凋亡,抑制大鼠腦膠質瘤組織的生長。As2O3的毒性作用,尤其是其對正常腦組織的損害,隨著As2O3進入腦組織的量增大而增加,本實驗所給的藥物劑量是屬安全范圍之內的As2O3劑量[10],我們在預實驗中也未發現此劑量對大鼠肝、腎等主要臟器有明顯的損害。因此,As2O3脂質體可能為As2O3治療腦膠質瘤提供一種可行的、有效的途徑。但探索As2O3的藥物代謝動力學以及其在局部腦組織中的適宜治療濃度等問題仍有待進一步研究。
[1] Zhao S,Tsuchida T,Kawakami K,et al.Effect of As2O3on cell cycle progression and cyclins D1and B1expression in two glioblastoma cell lines differing in p53status[J].Int J Oncol,2002,21(1):49-55.
[2] Glavas-Dodov M,Fredro-Kumbaradi E,Goracinova K,et,al.5-Fluorouracil in topical liposome gels for anticancer treatment-Formulation and evaluation[J].Acta Pharm,2003,53(4):241-250.
[3] 國家藥典委員會.中華人民共和國藥典(二部)[M].北京:化學工業出版社,2005:51-53.
[4] 趙世光,滕雷,趙洪波,等.熒光引導鼠腦膠質瘤切除的實驗研究[J].中華神經外科雜志,2006,22(2):120-122.
[5] 李明,馮華,李飛,等.大鼠C6 腦膠質瘤模型的病理特征與MRI的觀察[J].中華神經外科雜志,2005,21(5):279-282.
[6] 陳忠平.腦膠質瘤的綜合治療[J].實用臨床醫藥雜志,2004,8(1):38-40.
[7] 趙世光,李力仙,張建華,等.As2O3對不同P53表型的人膠質瘤細胞系細胞周期蛋白B1,D1表達的影響[J].中華神經外科雜志,2004,20(3):202-206.
[8] Doolittle ND,Abrev LE,Blever WA,et al.New frontiers in translational research in neuro-oncology and the blood-brain barrier:report of the tenth annual Blood-Brain Barrier Disruption Consortium Meeting[J].Clin Cancer Res,2005,11(21):421-428.
[9] Pardridge WM.Vector-mediated drug delivery to the brain[J].Adv Drug Del Rev,1999,36(2/3):299-321.
[10] Kim JH,Lew YS,Kolozsvary A.Arsenic trioxide enhances radiation response of 9Lglioma in the rat brain[J].Radiat Res,2003,160(6):662-666.

