藥品專利在我國藥品分類采購中的應用
丁錦希 龔婷 李偉 田然
(中國藥科大學 南京 211198)
藥品專利在我國藥品分類采購中的應用
丁錦希 龔婷 李偉 田然
(中國藥科大學 南京 211198)
目的:為完善我國專利藥品采購制度提出建議。方法:分析藥品專利在我國藥品采購質量分層中的應用現狀及存在問題。結果:我國藥品招標采購制度質量分層存在各省專利藥品認證標準不統一、不同藥品專利分組缺乏科學性、專利藥品采購方式單一等問題。結論:結合我國香港地區和德國的先進經驗,按照“單一貨源判斷”模式和“專利藥品療效突破”模式,分階段對我國專利藥品采購制度進行改革。
分類采購 藥品專利 質量分層
近年來,我國藥品招標采購制度不斷改革,作為國際普遍推廣的醫療機構終端準入模式,對藥品價格形成甚至臨床用藥產生深遠的影響。2015年2月28日,國務院辦公廳出臺的《國務院辦公廳關于完善公立醫院藥品集中采購工作的指導意見》提出了藥品的分類采購,其管理思路為:對“臨床用量大、采購金額高、多家企業生產的基本藥物和非專利藥品,部分專利藥品,獨家生產藥品”進行不同的采購方法。至此,分類采購將作為新的采購模式在我國進行推廣。專利作為我國分類采購中應用的重要標準,主要體現在專利藥品認定及質量分層方法上。本文期望通過對藥品專利在我國藥品采購質量分層中的應用現狀及存在問題的探討,借鑒域外地區經驗,為完善我國專利藥品采購制度提出建議。
1 專利在我國藥品采購質量分層中的應用現狀
通過檢索各省藥品招標采購機構網站,筆者對我國16個省份的藥品招標采購實施辦法中關于質量分層的方法進行分析,在選取的16個省份中,10個省份采取劃分質量層次的方法對藥品進行質量區別(表1),6個省份采取質量評分的方法對藥品質量進行技術審評(表2)。
通過表1、表2數據分析,可以發現:
1)藥品專利類型在質量分層中普遍使用。筆者統計分析的16個省份的藥品招標采購管理辦法中,15個省份都將藥品專利類型作為藥品質量分層或藥品質量評分的標準,僅有四川省在藥品質量分層時沒有使用藥品專利類型這一標準,福建省在2014年醫療機構藥品集中采購實施方案中沒有規定質量分層。
2)藥品質量分層中藥品專利類型與其他標準共同使用。以上15個使用藥品專利類型作為質量分層或質量評分標準的省份中都將藥品注冊新藥分類的方法、藥品獲獎情況、中藥保護品種等與其他質量標準相結合,作為藥品質量分層或質量評分的綜合標準。
3)不同層次專利的藥品屬于不同質量層次。筆者統計的16個省份中,根據專利創新程度的不同,大部分省份都將不同層次的專利藥品屬于不同質量層次,例如《2012年安徽省縣級公立醫院藥品集中招標采購實施方案》中不同層次的藥品專利分別屬于不同的質量層次。
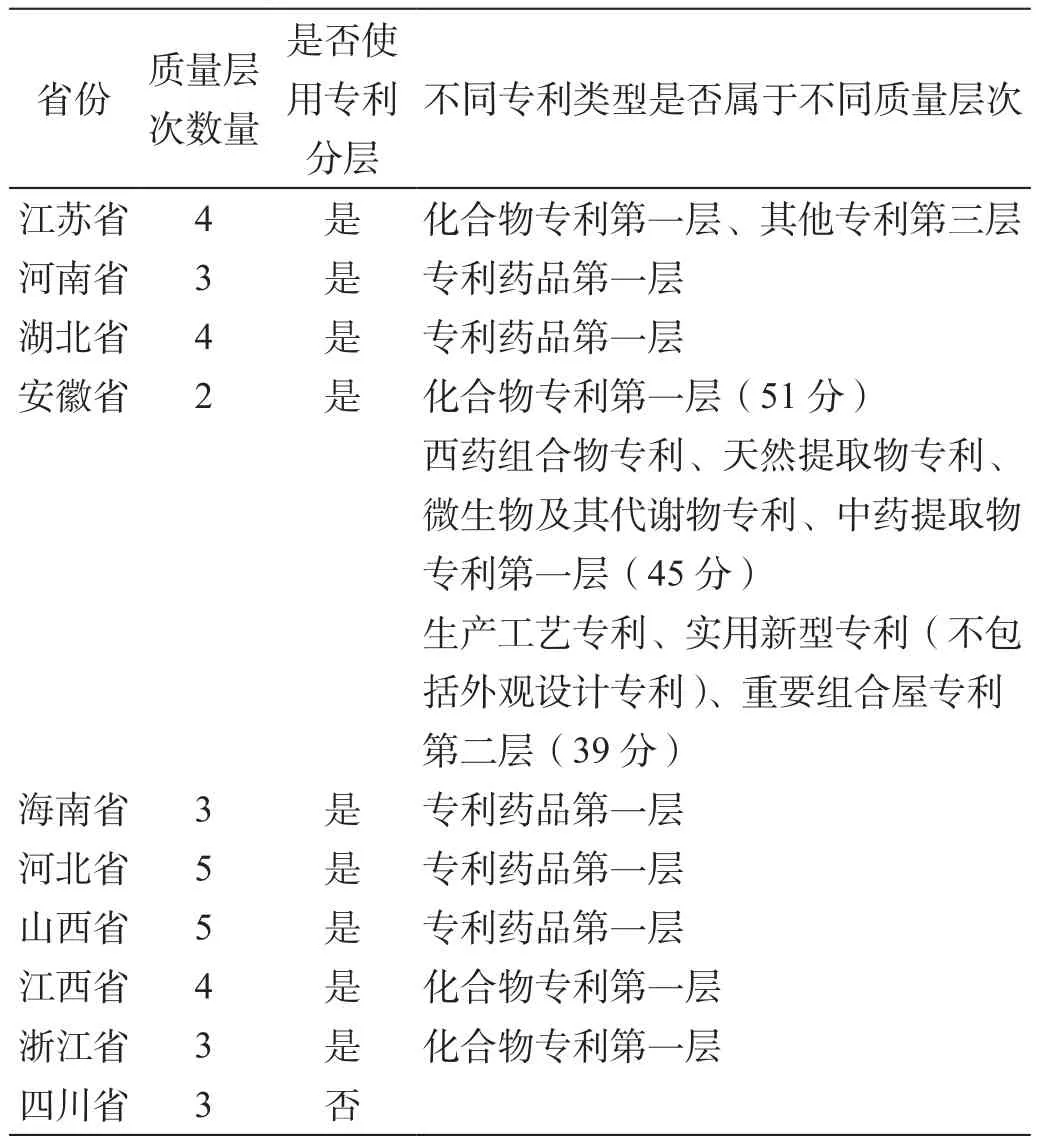
表1 部分省份藥品質量分層方法

表2 部分省份質量評價標準

表3 部分省份質量分層標準及指標權重
2 我國藥品采購制度中質量分層方法存在的問題
由于專利藥品一般具有貨源單一、療效較好、臨床需要的特點,因此其界定及采購模式是藥品招標采購實踐中十分重要的環節。通過對我國大部分省份專利藥品界定標準、質量分層方法的分析,筆者認為我國藥品招標采購制度質量分層存在以下問題:
1)各省專利藥品認證標準不統一。在已統計的16個省份中,對于專利藥品的認證標準并不一致,藥品招采實踐過程中缺乏對專利藥品認證標準的統一,缺乏統一的機構對專利藥品進行界定,這就使得同一藥品在不同省份的招標采購事件中處于不同的質量層次,從而享有不同的定價標準。
2)不同藥品專利分組缺乏科學性。藥品招標遵循“質量優先、價格合理”的原則,在招標中以質量層次之名行高價之實的行為遭到了業界的批評。然而,至今也沒有找到一套可以科學進行藥品質量評價的方法。將不同藥品專利賦予不同的質量得分缺乏合理的科學依據,應當對其專利創新性進行準確評估。
3)專利藥品采購方式單一。由于專利藥品的特殊性,筆者認為僅依靠雙信封方式并不能保障臨床用藥及降低藥品價格,應當在專利藥品采購中引入談判機制,以省、市或者醫院集團為單位,與專利藥品生產企業進行“帶量談判”,借鑒國外“量價協議”等新方法,在保障臨床新藥使用的前提下降低藥品價格。
3 德國和我國香港地區專利藥品采購制度的經驗
國際上多數國家根據采購對象的專利狀態,采取質量分類采購模式:即對仿制藥采取招標競價采購模式,而對專利藥采取單獨議價采購模式。
其中,德國對于專利藥品與仿制藥品的采購政策差別較大,前者通過協商議價采購,但需要雙重認證標準,因此本文選擇德國為典型國家,對其專利藥品的采購制度進行分析。然而,由于德國國情與中國不同,且國家發展程度與中國相差較大,因此本部分還選取與內地情況較為相似的,采取單一專利認定標準的我國香港地區進行分析,通過對香港地區專利藥品采購制度的研究,給我國建立合理的專利藥品采購制度提供借鑒。
3.1 我國香港地區專利藥品采購制度
1)專利藥品認定標準。在香港,能夠采取單一來源供應,與政府單獨談判定價的專利藥品僅有核心專利藥品,而工藝、制劑、組合方式等類型的專利都不屬于可以單一招標的專利藥品。香港認定的核心專利標準為:應當是制造某種產品必須使用技術所對應的專利,而不能通過一些規避設計手段避開。對于藥品,核心專利主要是指通過某一種特殊手段研發出一種新的化合物或提取出一種新的天然制劑,且具有明顯的治療優勢,有新的技術突破。因此,香港核心專利藥品主要包括:化合物專利藥品、天然提取物專利藥品、微生物及其代謝物專利藥品。
2)專利藥品分類采購制度。香港醫管局對藥品按專利狀態進行分類采購。香港把藥品分為專利藥、核心專利權屆滿的藥品(有仿制藥的出現)和非專利藥(全開放市場仿制藥品)這3類。對專利藥實施在單一貨源承諾制的基礎上,與供應商進行談判議價的采購方式,對第二、三類非專利藥品采用公開競爭招標方式采購[1](圖1)。
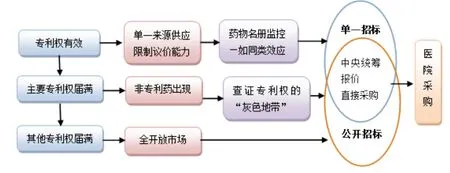
圖1 香港質量分層的藥品招標采購制度
香港醫管局對于核心專利藥品統一采取單獨議價談判方法,醫管局與藥品生產企業直接進行談判并最終確定價格。此外,醫管局通過關注具有相同療效的專利藥品價格變化趨勢,優先采購使用價格低且下降速度快的藥品。
對于第二類核心專利權到期,但工藝制劑等其他專利仍在保護期內的藥品,如果市場上有其他仿制藥的出現,醫管局下設的藥物評選委員會將主動研究改用仿制藥的權限和風險,稱為“灰色地帶”調查。通過“灰色地帶”調查,可以確保采購的藥品不會侵犯專利藥品專利權。如果“灰色地帶”調查確定不出現問題,通過進一步確定仿制藥與專利藥的可替換性,醫管局就會盡快改用仿制藥。這種做法可以有效控制藥品費用增長[2]。
3.2 德國專利藥品采購制度
1)專利藥品認定標準。德國的專利藥品主要是指產生出新的活性物質的藥品,且此類藥品有一定的治療優勢。按照我國藥品專利的分類,德國專利藥品主要包括化合物專利藥、天然提取物專利藥、微生物及其代謝物專利藥。此外,公共保險公司(AOK)會針對此類藥品的功效、市場價值、壟斷程度分別進行評估,從而判定此類藥品是否需要特殊談判,不采用回扣政策。
AOK對于療效上可替代的專利藥統一采用回扣政策,只有對于在療效上有重大突破的原研藥,療效優于市場其他類型的藥品,在市場中處壟斷地位的品牌藥采取特殊的談判政策。因此,德國對于專利藥品的認定為雙重標準:①屬核心專利藥品;②在療效上有重大突破。
2)專利藥品采購制度。在德國,已被認定的專利藥品將私下與醫療保險基金協會進行談判。專利藥品將首先提出價格及藥品優勢,由德國聯邦委員會(GBA)進行評估。GBA會對專利藥品優勢進行評估,如果此類專利藥品被認定并沒有明顯的優勢,GBA將會與醫保目錄中和此類藥品有相同治療效果的原研藥價格進行比較,如果專利藥品被認定給出了額外的折扣,則GBA將會承認此價格,并納入醫保目錄。如果專利藥品價格被認定過高,將不會被GBA通過,廠商則需要與醫療保險基金協會進行談判,協議定價,敲定價格后由GBA審核,GBA將會與其他15個歐洲國家的價格相對比,決定是否將其納入醫保目錄。如果GBA判定此類專利藥品有明顯的藥品優勢,將由醫療保險基金協會直接進行談判,最終敲定價格,并在13個月后納入醫保目錄。
4 對完善專利在我國藥品采購制度中應用的政策建議
現階段藥品專利制度在我國藥品招標采購過程中作為質量分層的主要評價指標,筆者認為在該制度中政策制定者期望通過其達到激勵創新、保證質量、控制費用這3個政策指標。基于這3個政策指標,筆者認為我國藥品招標采購制度中專利制度的現行應用模式沒有取得良好的政策預期。具體來說:①藥品專利與其質量控制間并無必然聯系;②現有以專利為質量分層評分標準達不到控制專利藥價格和醫療費用總支出的目標。
綜上所述,筆者建議在設計招標采購制度時,應根據專利制度本源,有選擇性地確定其在藥品采購制度中應用目標和應用模式,從而根據政策預期調整現有招標采購制度。應順應藥品招標采購發展的國際大趨勢,回歸專利保護的本質,即將藥品專利狀態(是否具有核心專利),作為分類采購的主要判斷依據(即是談判議價,還是公開招標競價),而不是判斷藥品質量的標準,從而強化專利制度保護藥品創新激勵效應。在此基礎上,逐步引入藥物經濟學評價方法[3],將藥品療效作為專利藥品采購談判中重要的議價標準。
具體可分為兩個階段:
第一階段是借鑒我國香港地區的“單一貨源判斷”模式。即將藥品專利狀態作為分類采購的主要判斷依據,將藥品分為專利藥、核心專利權屆滿的藥品(有仿制藥的出現)和非專利藥(全開放市場仿制藥品)這3類,對專利藥實施在單一貨源承諾制的基礎上,與供應商進行談判議價的采購方式,對于第二、三類專利藥品采用公開競爭招標方式采購。同時對于第二類產品其相關專利進行是否侵權調查。
第二階段是借鑒德國的“專利藥品療效突破”模式。即引入藥物經濟學評價判斷具有核心專利的藥品是否在藥品療效上具有突破性,從而根據藥物經濟學評價結果與專利藥生產企業進行談判采購。在專利藥品認定標準上,采取“專利+療效”的雙重判斷標準,在核心專利基礎上,針對此類專利藥品的功效、市場價值、壟斷程度分別進行藥物經濟學評估,從而判斷其是否屬于在療效上有重大突破的專利藥,并將藥物經濟學評價結論作為采購價格的談判基礎。此模式需要藥物經濟學評價工具介入,操作難度較大,是未來全球發展的趨勢。
[1] 閆峻峰. 香港特區藥物采購策略與內地基本藥物采購機制比較[J]. 中國藥房, 2011, 20(22):1855-1857.
[2] 孫敬磊. 我國藥品集中采購法律制度研究[D]. 北京: 中國政法大學, 2011.
[3] 羅賽男, 馬愛霞. 美國和日本藥品采購管理模式及對我國的啟示[J]. 上海醫藥, 2008, 29(6) :258-260.
Application of drug patents in the classification and purchase of drugs in China
DING Jinxi, GONG Ting, LI Wei, TIAN Ran
(China Pharmaceutical University, Nanjing 211198, China)
Objective: To perfect the purchase system of patent medicine in China. Methods: The current status and existing problems in the application of pharmaceutical patents in the quality stratification of pharmaceutical purchase in China were analyzed. Results: There existed some problems such as the disunity standards for the certification of patent drugs in various provinces of China, the lack of scientific clarification and the single method for the purchase of patent drugs in the quality of the drug bidding system. Conclusion: The system for patent medicine purchase in China should be reformed step by step based on the modes of “single supply judgment” and “the breakthrough of patent medicine effect” and the advanced experience of Hong Kong and Germany.
classified purchasing; drug patents; quality stratification
藥物研發
R199
C
1006-1533(2015)17-0061-03
2015-05-29)

