脊髓損傷截癱患者序列對指運動fMRI研究
朱凌,吳光耀,文之,李潔蘭
脊髓損傷(spinal cord injury,SCI)影響腦與脊髓間信息傳遞的上下行通路,導致損傷平面以下感覺和運動功能缺失,失去聯系的感覺和運動腦區仍然完整,但運動信號的輸出無法達到效應器,輸入反饋也無法繼續[1]。大腦損傷后中樞神經系統發生可塑性改變即功能重組。同樣,SCI后腦功能也可發生代償性重組,動物實驗研究表明SCI后感覺和運動功能正常的皮質代表區功能有向失去聯系區域皮質代表區擴張的趨勢[2]。關于SCI后皮質功能發生代償重組的相關改變,文獻報道的結果并不一致。有學者采用EEG進行研究,結果顯示SCI患者M1激活區向后移位[3];而有學者采用PET和經顱磁刺激(transcranial magnetic stimulation,TMS)的方法進行研究,結果顯示SCI患者M1功能未受影響代表區激活向去輸出肢體代表區移位,如截癱患者M1手功能代表區向軀體及下肢功能代表區方向移位[4]。功能磁共振成像由于其無創性、無輻射、能有效地將功能與解剖圖像相結合的優點,已廣泛應用于腦科學研究及臨床相關領域[5],本研究基于血氧水平依賴功能磁共振成像(BOLD-fMRI)分析脊髓損傷后截癱患者在序列對指運動過程中的腦激活模式,探討SCI后腦運動功能的代償重組機制。
材料與方法
1.研究對象
本研究通過中南醫院倫理委員會批準,所有受試者簽署知情同意書。SCI受試者為外傷致截癱(指椎管內神經組織損傷后,導致脊髓胸段、腰段或骶段運動和/或感覺功能的損害或喪失)、無腦損傷,手感覺運動功能正常,生命體征穩定SCI患者,共12例,其中3例因頭動過大被剔除;男8例,女1例,平均年齡(42.89±12.17)歲。對照組為性別、年齡匹配受試者12例;男6例,女6例,平均年齡(42.83±12.49)歲。所有受試者經愛丁堡利手量表(Edinburgh handedness inventory)評估為右利手,無高血壓、心臟病、糖尿病、代謝性疾病,精神系統疾病,酗酒或藥物濫用史,常規顱腦MR掃描無異常改變,無磁共振禁忌癥。SCI截癱患者臨床評估采用脊髓損傷神經學分類國際標準(international standards for the neurological classification of spinal cord injury,ISNCSCI),評估內容包括損傷平面、運動及感覺評分和損傷程度(完全性或不完全性損傷)。
2.數據采集
使用Siemens Magnetom Trio 3.0T磁共振成像儀和8通道陣列頭線圈,fMRI掃描采用梯度回波(gradient echo,GRE)單次激發回波平面成像(echo planar imaging,EPI)。掃描參數:TR 2000ms,TE 30ms,翻轉角90°,矩陣64×64,24cm×24cm,層厚4.5mm,層間隔0mm,30層。采集數據前向受試者詳細解釋實驗方案并在檢查前練習右手序列對指運動,檢查時受試者采取仰臥位,海綿填塞固定頭部。實驗方案:采用組塊設計,交替進行30s靜止和30s右手序列對指運動,重復4次,共240s;為避免掃描開始時磁場波動,最初6s設置為空掃,掃描時間共246s。采集時通過同步刺激提示患者運動開始及終止,靜止時患者保持清醒、平躺;對指運動時全身放松,避免任務以外身體部位運動,序列對指運動頻率約1~2Hz。
3.數據分析
基于 Matlab 2010b操作平臺,運行SPM8(http://www.fil.ion.ucl.ac.uk/spm)。數據預處理包括時間校正、頭動校正(剔除3個方向平移超過3mm,3個方向轉動超過3°受試者的數據)、空間標準化、平滑(采用6mm半高全寬平滑核)。使用SPSS 20.0軟件,對兩組受試者對側激活最強點T值及對側M1激活體積行兩樣本T檢驗,對SCI患者對側激活最強點T值、對側M1激活體積與損傷后時間、損傷平面(為將損傷平面加入Pearson相關分析,將損傷平面T1計為9,T2記為10,以此類推)及ISNCSCI評分行Pearson相關分析,P<0.05為差異具有統計學意義。對照組及SCI組分別進行單樣本t檢驗,統計閾值設定為P<0.05,FDR校正,獲得群組水平對側最強激活點MNI坐標。兩樣本t檢驗得到組間統計結果,統計閾值設定為P<0.05,FDR校正,激活體素閾值設定為10,采用Xjview軟件顯示結果,將激活圖重疊于T1W圖像上。
結 果
兩組受試者性別、年齡差異均無統計學意義(P>0.05)。SCI組患者進行MRI檢查的時間為損傷后為3~17個月,平均(7.6±4.4)個月,損傷平面為 Th3~L2;其中1例為完全性損傷,8例為不完全性損傷。
兩組受試者個體水平統計對側最強激活點T值及對側M1激活體積的平均值、標準差及兩樣本t檢驗結果見表1。兩組中對側大腦最強激活點T值及對側M1激活體積的差異均無統計學意義(P>0.05)。Pearson相關分析顯示SCI患者損傷平面與對側M1激活體積呈負相關(r=-0.807,P=0.009)。

表1 脊髓損傷組與對照組最大t值及M1激活體積
對照組在進行序列對指運動時,腦激活區位于對側初級運動皮質、初級體感皮質及丘腦、雙側輔助運動區、前運動皮質及雙側小腦前葉,其中以小腦前葉以同側激活最顯著;SCI組中相應腦區也顯示有激活,對照組和SCI組腦組織最強活激點坐標分別為(-48,-24,60)和(-48,-27,45)(圖1、2)。
數據分析處理后顯示,與對照組相比,SCI組雙側初級運動皮質、輔助運動區、頂下小葉及島葉激活增強(表2)。
討 論
盡管SCI并沒有直接損傷患者的腦皮質神經元,但SCI對與損傷部位相聯系的M1會產生影響,從而使M1及周圍腦組織發生功能重組,來代償感覺運動功能的缺失。腦重組的發生依賴于結構及功能的改變,如樹突分支的長度及直徑改變或形成新的分支,為新突觸的形成提供機會;功能改變包括神經活動改變、突觸效能或星形細胞活動增加等[6]。SCI患者損傷平面以下感覺運動功能受損將會影響損傷平面以下部位執行運動任務,如頸髓損傷患者通常無法正常執行上肢或手部的運動任務,所有SCI患者下肢功能均受到不同程度影響。研究表明運動任務完成努力程度、頻率和力量對fMRI信號產生影響,隨著努力程度、頻率和力量的增加,M1及SMA激活信號的強度和范圍呈線性增加,超過一定限度會達到飽和,甚至可因疲勞而有所下降[7]。Curt等[8]研究發現SCI四肢癱瘓患者在進行腕部運動時,上肢功能受損越嚴重,對側M1、SMA及同側小腦激活程度越低。本研究中選擇手部運動感覺功能正常的SCI截癱患者,采用相同頻率、幅度進行右手序列對指運動作為運動任務。
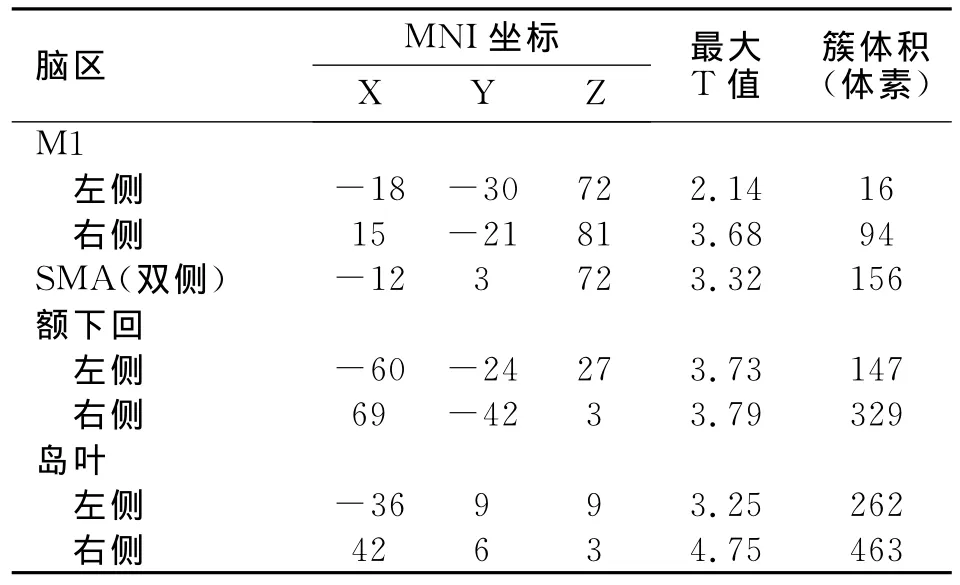
表2 脊髓損傷組與對照組相比激活增強腦區
本組研究結果顯示,SCI組與對照組在進行右手序列對指運動時,最強激活點位于對側大腦,相應坐標分別為(-48,-27,45)及(-48,-24,60),提示SCI組最強激活點的位置較對照組偏后。與Green等[3]采用EEG研究SCI患者,發現運動電位向后移位的結果相似,推測S1軸突比M1軸突走行更靠近內側和后方,SCI中損傷相對較小,有助于破壞皮質脊髓束功能代償,導致S1激活增加,激活區向后移位;而SCI后M1軸突丟失增加。Turner等[9]使用fMRI研究胸腰段SCI患者手運動時也發現激活最強點向后移位,而感覺代表區卻未顯示向后移位。
有研究顯示SCI患者M1激活區向去輸入肢體代表區移位,如Bruehlmeier等[10]的研究中發現手部運動時SCI患者手部激活向去輸入腿部代表區移位,Mikulis等[11]對9例SCI后右上肢輕癱患者及14例健康受試者進行對照研究,發現在進行右上肢運動時皮質最強激活點在2組中無顯著差異,舌部運動時M1激活最強點向去輸入上肢代表區移位。Lotze等[4]發現SCI截癱患者肘部運動時M1代表區激活向去輸入胸部代表區移位。與M1激活向去輸入肢體移位類似,S1激活也可向去輸入肢體代表區移位。Endo等[12]發現大鼠胸髓完全橫斷后前肢刺激激發BOLD信號向內側感覺剝奪后肢區擴張,Rao等[13]研究5只單側胸髓損傷恒河猴上肢體感任務,發現S1上肢激活區向支配腿部區移位。而Moore等[14]發現刺激SCI截癱患者損傷平面附近會引起身體其它部位出現幻肢感覺,fMRI顯示刺激過程中感覺皮質出現多個不相鄰腦區激活,包括被刺激區及出現幻肢感覺區,提示SCI后感覺功能重組可能并非皮質代表區擴張。
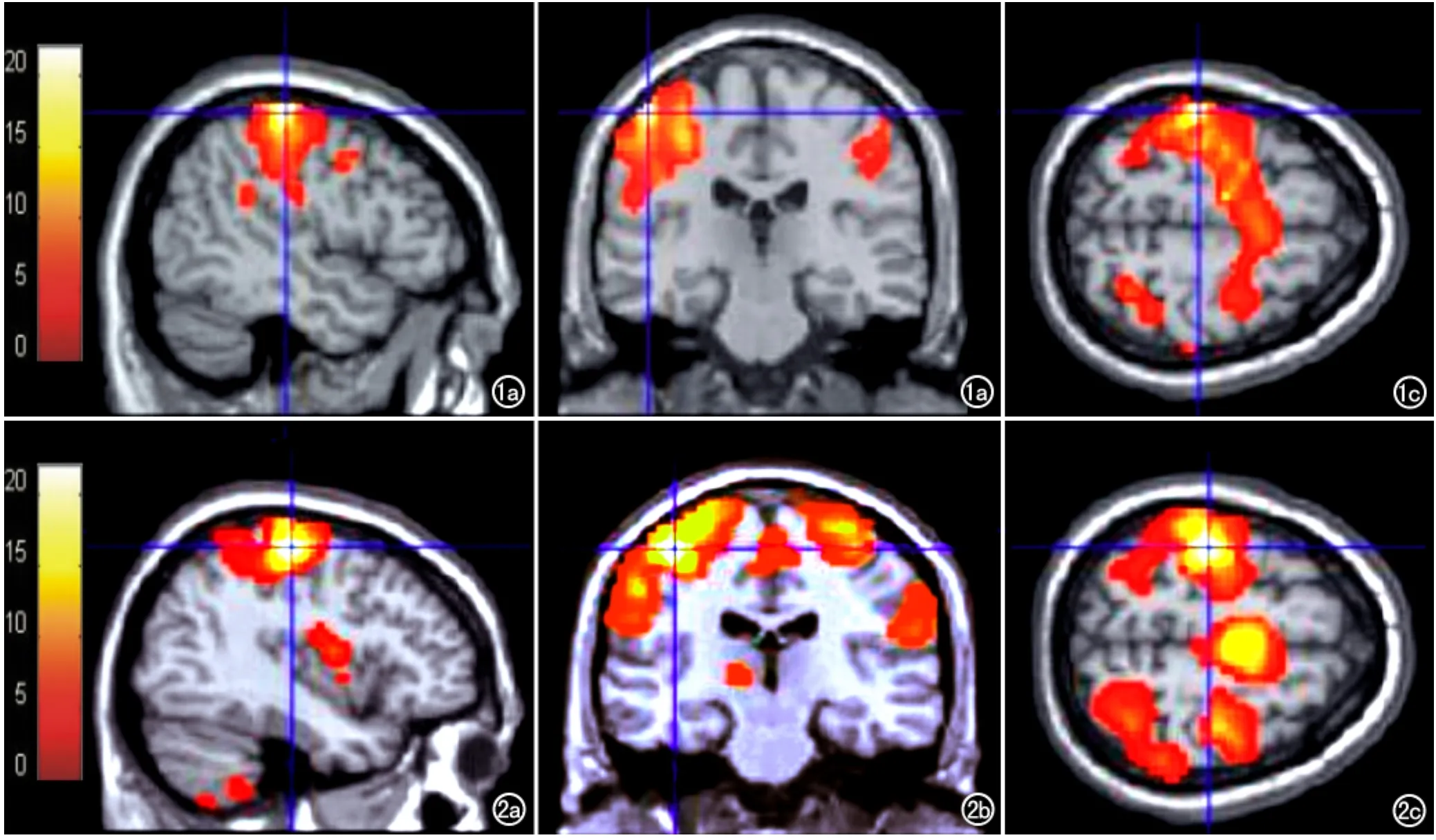
圖1 對照組腦功能MRI,顯示對指運動任務中對側大腦最強激活點坐標為(-48,-24,60)。a)矢狀面圖像;b)冠狀面圖像;c)橫軸面圖像。 圖2 脊髓損傷組腦功能MRI,顯示對指運動任務中對側大腦最強點激活位于坐標為(-48,-27,45)。a)矢狀面圖像;b)冠狀面圖像;c)橫軸面圖像。
本研究顯示對照組與SCI組對側最強激活點T值及對側M1激活體積無明顯差異,提示手功能代表區未向周圍擴張。有研究發現SCI截癱患者手部運動時對側M1激活體積增大[15];SCI患者損傷平面與M1激活體積呈負相關,即損傷平面越高M1功能重組越明顯。與對照組比較,SCI組雙側 M1、SMA、頂下小葉及島葉激活增強,與Curt等[15]報道的結果類似,提示SCI患者腦功能發生重組。SCI患者完成不同運動任務時腦激活強度存在差異,激活程度可增強、無明顯改變或減少。有研究顯示激活方式可能與損傷平面[8,10]和損傷后時間有關[7,16]。導致這些研究出現差異的原因可能為受試者特征不同。各研究中SCI患者包括亞急性及慢性、完全性及不完全性損傷、截癱及四肢癱等,由于損傷后時間、損傷程度及損傷部位不一致等原因,較難明確SCI對腦功能代償重組的影響。
SCI后腦功能重組的變化可能具有一定的時間特征。Jurkiewicz等[7]采用縱向研究觀察6例SCI患者1周至1年內伸腕運動時的腦激活方式的變化,結果顯示:與對照組比較,亞急性期SCI患者M1激活減少,輔助運動區、扣帶回皮層、前運動皮質及后枕葉皮質等次級運動區激活增加;經過一段時間患者功能恢復進入慢性期,顯示M1激活持續增加,次級運動區激活減少,直至與正常受試者激活相似。隨后研究者發現,癱瘓持續無功能改善的SCI患者在損傷后一年內在執行右踝背屈時的腦激活方式的變化為損傷最初M1激活與對照組類似,同時出現對照組沒有的感覺運動相關皮質廣泛激活,癱瘓持續一段時間后M1激活顯著減少,感覺運動相關皮質激活持續減少[16]。
SCI后功能代償重組為患者神經功能的恢復提供了可能,但功能重組并非等同于運動功能改善,皮質重組過度或異常可導致患肢感覺異常及神經痛等[17]。康復治療能為患者的功能恢復提供幫助,Cramer等[18]使用運動想象訓練慢性截癱、四肢癱SCI患者,顯示接受訓練的SCI患者對側蒼白球激活強度顯著提高。Winchester等[19]發現跑步機計劃增加SCI患者腦激活,提高了患者行走能力。SCI后腦功能代償重組是一個動態變化的過程,可隨著功能自發恢復及治療干預而發生改變,今后的研究應該力求區分SCI后腦功能重組的改變是基于如細胞移植、藥物或康復訓練等干預治療還是自發地恢復過程。
總之,本研究發現SCI截癱患者遠隔部位運動相關腦區代償重組,且與脊髓損傷平面相關。本研究病例數少,研究脊髓損傷時間跨度相對較短,應繼續擴大樣本量并進行縱向研究。
[1]Nardone R,Holler Y,Brigo F,et al.Functional brain reorganization after spinal cord injury:systematic review of animal and human studies[J].Brain Res,2013,1504(1):58-73.
[2]Kokotilo KJ,Eng JJ,Curt A.Reorganization and preservation of motor control of the brain in spinal cord injury:a systematic review[J].J Neurotrauma,2009,26(11):2113-2126.
[3]Green JB,Sora E,Bialy Y,et al.Cortical motor reorganization after paraplegia:an EEG study[J].Neurology,1999,53(4):736-743.
[4]Lotze M,Laubis-Herrmann U,Topka H.Combination of TMS and fMRI reveals a specific pattern of reorganization in M1in patients after complete spinal cord injury[J].Restor Neurol Neurosci,2006,24(2):97-107.
[5]趙晶,李宏軍,員達,等.HIV相關腦癡呆BOLD fMRI運動功能成像[J].放射學實踐,2011,(10):1028-1031.
[6]Dunlop SA.Activity-dependent plasticity:implications for recovery after spinal cord injury[J].Trends Neurosci,2008,31(8):410-418.
[7]Jurkiewicz MT,Mikulis DJ,Mcilroy WE,et al.Sensorimotor cortical plasticity during recovery following spinal cord injury:a longitudinal fMRI study[J].Neurorehabil Neural Repair,2007,21(6):527-538.
[8]Curt A,Bruehlmeier M,Leenders KL,et al.Differential effect of spinal cord injury and functional impairment on human brain activation[J].J Neurotrauma,2002,19(1):43-51.
[9]Turner JA,Lee JS,Schandler SL,et al.An fMRI investigation of hand representation in paraplegic humans[J].Neurorehabil Neural Repair,2003,17(1):37-47.
[10]Bruehlmeier M,Dietz V,Leenders KL,et al.How does the human brain deal with a spinal cord injury[J].Eur J Neurosci,1998,10(12):3918-3922.
[11]Mikulis DJ,Jurkiewicz MT,Mcilroy WE,et al.Adaptation in the motor cortex following cervical spinal cord injury[J].Neurology,2002,58(5):794-801.
[12]Endo T,Spenger C,Tominaga T,et al.Cortical sensory map rearrangement after spinal cord injury:fMRI responses linked to Nogo signalling[J].Brain,2007,130(Pt 11):2951-2961.
[13]Rao JS,Manxiu M,Zhao C,et al.Atrophy and primary somatosensory cortical reorganization after unilateral thoracic spinal cord injury:a longitudinal functional magnetic resonance imaging study[J/EB].Biomed Res Int,2013:753061-753069.doi:10.1155/20B1753061
[14]Moore CI,Stern CE,Dunbar C,et al.Referred phantom sensations and cortical reorganization after spinal cord injury in humans[J].Proc Natl Acad Sci,2000,97(26):14703-14708.
[15]Curt A,Alkadhi H,Crelier GR,et al.Changes of non-affected upper limb cortical representation in paraplegic patients as assessed by fMRI[J].Brain,2002,125(11):2567-2578.
[16]Jurkiewicz MT,Mikulis DJ,Fehlings MG,et al.Sensorimotor cortical activation in patients with cervical spinal cord injury with persisting paralysis[J].Neurorehabil Neural Repair,2010,24(2):136-140.
[17]Moxon KA,Oliviero A,Aguilar J,et al.Cortical reorganization after spinal cord injury:always for good[J].Neuroscience,2014,283(1):78-94.
[18]Cramer SC,Orr EL,Cohen MJ,et al.Effects of motor imagery training after chronic,complete spinal cord injury[J].Exp Brain Res,2007,177(2):233-242.
[19]Winchester P,Mccoll R,Querry R,et al.Changes in supraspinal activation patterns following robotic locomotor therapy in motorincomplete spinal cord injury[J].Neurorehabil Neural Repair,2005,19(4):313-324.

