熒光金納米團簇及其在生命分析中的應用
施小瓊,鄧豪華,王菲菲,陳偉
福建醫(yī)科大學藥學院藥物分析學系,福州 350108
熒光金納米團簇及其在生命分析中的應用
施小瓊,鄧豪華,王菲菲,陳偉
福建醫(yī)科大學藥學院藥物分析學系,福州 350108
金納米團簇(gold nanoclusters,AuNCs),一種新型的熒光納米材料,是指在一定的分子層保護下,由幾個到幾百個金原子組成的相對穩(wěn)定的分子級聚集體。由于其直徑一般小于2 nm,接近于電子的費米波長,產生了類似分子的性質,如離散的電子態(tài)、尺寸依賴的熒光發(fā)光等。熒光金納米團簇具有尺寸小、生物相容性好、光學穩(wěn)定性好、Stokes位移大、發(fā)射光譜可調諧以及無毒等優(yōu)點,彌補了傳統(tǒng)的有機熒光染料、熒光蛋白、熒光量子點等熒光探針的一些缺點,近年來已經成為國際上的研究熱點。本文結合當前的研究現狀,重點闡述金納米團簇的性質、制備方法及其在生物活性小分子檢測和細胞標記成像中的應用。
金納米團簇;熒光探針;納米材料;制備;生命分析
納米科技已經成為21世紀前沿科學技術的代表領域之一,新納米材料的開發(fā)與應用對社會的發(fā)展有著極為深刻的影響。世界各國,都已將發(fā)展納米科技作為國家戰(zhàn)略。近年來,金納米團簇(gold nanoclusters,AuNCs),作為一種新型的熒光納米材料,由于其易于制備、易于修飾、穩(wěn)定性好、生物相容性好,Stokes位移大等優(yōu)點受到了國內外研究者的廣泛關注。目前,這類材料已經被廣泛應用于生物分析與檢測、催化、能源、光學、電學、磁學等領域。
AuNCs是指在一定的分子層保護下,由幾個到幾百個金原子組成的相對穩(wěn)定的聚集體。AuNCs的直徑通常小于2 nm,介于單原子和納米粒子或者大體積的貴金屬之間,該尺度接近電子的費米波長,此時連續(xù)的能態(tài)分裂為離散的能態(tài),并出現類似分子的尺寸依賴效應[1,2]。
迄今為止,研究人員已經開發(fā)出多種不同類型的熒光納米材料,包括半導體量子點[3]、石墨烯量子點[4]、染料摻雜納米粒子[5]、摻雜上轉換納米粒子[6]、二氧化硅納米粒子[7]、碳納米點[8]等。熒光量子點有許多優(yōu)點,包括顏色與尺寸相關,穩(wěn)定性高,熒光壽命長,激發(fā)譜寬,發(fā)射譜窄,可以多組分標記同時檢測,抗光漂白能力強,生物相容性好,不受生物代謝的影響,可在活細胞內保持數月熒光等。但同時熒光量子點也存在著合成條件苛刻,表面難以鈍化,粒徑較大,含有毒性元素,具有閃爍現象,非分子冪率熒光等問題[9],在一定程度上限制了其應用。傳統(tǒng)的羅丹明、熒光素、哌洛寧和菲啶類熒光染料也普遍存在細胞毒副作用、光穩(wěn)定性差、激發(fā)光譜較窄發(fā)射譜寬、易被光解和對氧敏感等問題[9]。相比于這些小分子熒光染料和量子點,金納米團簇具有毒性低、表面易于修飾、熒光穩(wěn)定性強且可調、Stokes位移大等優(yōu)點。隨著對金納米簇研究的深入,必將對光電子學、生物醫(yī)學、能源、環(huán)境分析、功能材料學、超分子化學等領域的發(fā)展起到積極的推動作用。本文就金納米團簇材料的制備、性質及其在生命分析中的應用做一綜述。
1 AuNCs的制備
事實上,對于貴金屬光致發(fā)光現象的觀察研究可以追溯到四十幾年前,但是因為量子產率太低[10],當時并沒有引起太多人的關注。然而,近些年來,國內外的研究者們對金納米團簇的合成方法做出了很大的改進,提出了多種不同的方法制備水溶性好的金納米團簇,熒光量子產率相比于之前也大大提高。因此,對熒光金屬納米簇的開發(fā)應用又重新被人們所重視。
由于金納米團簇的各項性質強烈依賴于其尺寸和原子個數。因此,發(fā)展簡易的尺寸和原子數可控的制備方法是進一步研究和應用的前提。目前AuNCs的合成方法包括:微波協(xié)助合成法、超聲合成法、種子生長法、微乳液法、光照還原合成法、動力學控制合成法、相轉移合成法、模板輔助合成法、蝕刻法等[11-13]。金屬離子在溶液中被還原更傾向于生成較大粒徑的納米粒子而不是具有熒光的小粒徑納米簇,這是由于金屬納米簇表面積大,表面活化能高,更容易聚集。因此,在納米簇表面需要有特定基團的保護才可以避免其在溶液中進一步聚集成沒有熒光的納米粒子。另一方面,選擇合適的保護劑和模板能很好地控制納米簇的尺寸,并能顯著影響金納米團簇的熒光等物理化學性質。在一定條件下,保護劑或模板劑中含有富電子原子(N、O等)或富電子基團(-COOH、-NH2)可以在一定程度上提高熒光強度。熒光AuNCs可以用小分子、氨基酸、核酸、多肽、蛋白質、樹狀高分子、聚合物等作為保護試劑來合成[14-27]。現以不同類型的保護劑或模板對熒光金納米團簇的合成做個簡單介紹。近年來,金屬納米團簇配體的發(fā)展趨勢如圖1所示。
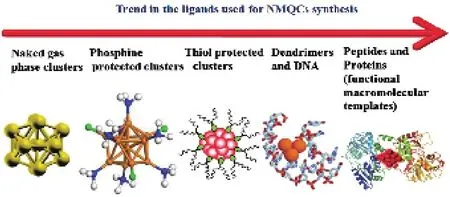
圖1 用于合成貴金屬納米團簇的配體的發(fā)展趨勢[23]Fig. 1 Trend in the ligands used for NMQCs synthesis[23]
1.1 硫醇類化合物
硫醇類化合物作為保護劑分子用于金屬納米團簇的合成研究大概開始于20年前。受到硫醇在金表面單層自組裝等研究的啟發(fā),Brust 等[28]最先利用硫醇類化合物用于金納米團簇的合成。他們利用兩相法萃取氯金酸,控制硫醇分子同氯金酸的摩爾比,直接合成單分子層保護的金納米團簇。隨后,各種改良的Brust-Schiffrin法被不斷地用于金納米團簇的合成。目前大多采用Bottomup法(主要是液相化學反應一步合成)。此外,文獻相繼報道了各種硫醇類化合物用于金納米團簇的合成,如2,3-二巰基琥珀酸(meso-2,3-dimercaptosuccinic acid,DMSA)[29]、谷胱甘肽(glutathione,GSH)[30]、半胱氨酸(cysteine)[31]、D-3-巰基纈氨酸(DPA)[32]、二氫硫辛酸(DHLA)[24]、3-巰基丙酸[33]和二硫蘇糖醇(DTT)[34]等。硫醇類化合物是目前最常見的一種保護劑,通過較強的相互作用形成穩(wěn)定的Au-S鍵結合在AuNCs的表面。研究者們通過控制不同鏈長度的烷硫醇可以制備出不同發(fā)射波長的熒光金納米簇[35]。
此外,硫醇也經常被用作蝕刻劑,通過蝕刻大粒徑的金納米粒子(AuNPs)形成小粒徑尺寸的AuNCs。Muhammed[36]等用谷胱甘肽在不同pH條件下(pH 3 和pH 7-8)蝕刻MSA-AuNCs的方法,制備兩種不同原子數的金簇Au25和Au8。Yuan[37]等報道了一種以NaOH調解的NaBH4還原的方法制備單硫醇保護、雙硫醇保護、三硫醇保護的AuNCs。通過NaOH調控AuNCs的合成速率,降低NaBH4的還原能力提高硫醇的蝕刻能力,從而制備Au25NCs(圖2)。

圖2 NaOH調解的NaBH4還原的方法制備硫醇保護的AuNCs[37]Fig. 2 NaOH-mediated NaBH4reduction method for the synthesis of thiolated AuNCs.[37]
1.2 樹狀大分子和聚合物
樹枝狀大分子(dendrimers)是一種納米級的“容器形”分子,具有多層結構,高度枝化,分子量和結構可控,分子內存在空腔、外圍大量官能團等特點。樹枝狀大分子可以隔絕水溶液中的金屬離子,常被用于金簇合成的模板。Dickson等[38]利用聚酰胺-胺型樹枝狀高分子(PAMAM)為模板成功合成Au8NCs,改變PAMAM/ Au的濃度和PAMAM的類型[1]可以獲得發(fā)射從紫外到近紅外不同波長的金簇,量子產率高達42%。雖然此法合成金簇的量子產率極高,但因為此法合成金簇的同時也伴隨著大粒徑的金納米粒子的產生,因此產率較低。
大分子高聚物通常含有豐富的羧酸,因此也被用來作合成水溶性金簇的模板。Cooper等[39]用NaBH4還原的方法合成了多齒狀突起的高分子保護的金簇。這種高聚物包含一條支鏈的水溶性甲基丙酸烯單元和末端三個疏水的未反應的硫醇部分,通過改變合成時高聚物與氯金酸的摩爾比率,可以獲得粒徑1.1-1.7 nm的金簇。Santiago González等[18]用簡單的電化學的方法制備出了僅包含兩個或三個金原子的聚乙烯吡咯烷酮(PVP)保護的金簇。特別之處是,PVP-AuNCs不僅具有穩(wěn)定的電致發(fā)光特性并且表現出較好的磁性(圖3)。電化學方法制備金簇的優(yōu)點是可以較快速的制備粒徑可控的金納米團簇。
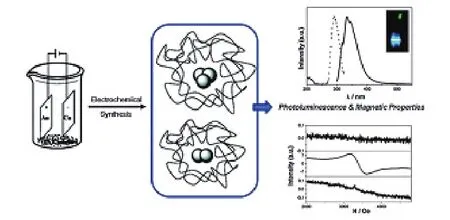
圖3 以PVP合成僅含兩個、三個金原子的AuNCs[18]Fig. 3 Synthesis of AuNCs containing only two and three atoms in the presence of PVP[18]
模板法合成金屬納米團簇中,聚合物是最早被使用的一類高分子化合物,不僅能使粒徑得到很好地控制,還能防止外界物質對金納米團簇熒光的猝滅作用。聚磷酸鹽(polyphosphate)首次被報道用作保護基團以防止AgNCs聚合[40]。此后,聚苯胺(polyaniline,PANI)[41]、聚酰胺氨型樹狀大分子(polyamidoamine,PAMAM)[38]、聚乙醇胺(polyethylenimine,PEI)[17]等更多用于合成金簇的聚合物被陸續(xù)報道。然而這些聚合物模板由于存在制備方法復雜、耗時長等缺點,給金屬納米團簇的合成過程增加了難度。
1.3 蛋白質
蛋白質也可以作為合成金納米團簇的模板。蛋白質一般含有豐富的結合位點,可以有效地結合并進一步還原金屬離子。Xie等[16]提出了一種簡單、綠色的一步合成方法,以BSA同時作為穩(wěn)定劑和還原劑制備出發(fā)射強紅色熒光的金簇。Yu等[42]首次運用了微波加熱的方法,僅用7 min就合成了高量子產率的BSA-AuNCs。Yu等[27]通過CO調控改變BSA的構象合成了不同尺寸大小的(Au4,Au8,Au10,Au13,Au25)的AuNCs。Wen等[14]用辣根過氧化物酶(HRP)合成了同時具有金簇的熒光特性和HRP的催化活性雙重作用的HRP-AuNCs。其他蛋白質如卵清蛋白[43]、人血清白蛋白[16],溶菌霉素[20],人轉鐵蛋白[21],胰島素[22]等也被用來做金簇合成的穩(wěn)定劑。以蛋白質為模板合成金簇是目前較為常用的金簇制備方法,其制備過程簡單,反應條件溫和。
2 AuNCs的性質
金納米團簇獨特的量子尺寸效應,導致了離散的電子態(tài)和類似分子的性質,使得它明顯不同于金納米粒子(表面等離子共振現象)和宏觀塊體,產生了尺寸依賴的光致發(fā)光(PL)、電致發(fā)光(ECL)和內在磁性、高度可極化、催化活性等性質[11,15,44-46]。也正是因此,金納米團簇“橋接”了單原子與納米粒子,甚至與大體積貴金屬間研究的缺失環(huán)節(jié)。金簇中最高分子占據軌道和最低分子非占據軌道間(HOMO-LUMO)的能量差異被認為是由于團簇中原子個數的不同造成的。因而,不同尺寸不同原子數的金納米團簇有著不同的發(fā)射波長[1,47,48]。熒光金納米團簇具有的尺寸小、生物相容性好、比表面積大、制備條件溫和、表面易于修飾、良好的光學穩(wěn)定性、Stokes位移大、發(fā)射光譜可調諧、較高的催化活性、無毒以及水溶性好等優(yōu)點,使得這類材料相比于傳統(tǒng)的有機染料、熒光蛋白和量子點具有更多優(yōu)勢,已經在環(huán)境金屬離子的檢測分析、生物標記活體成像等方面得到了廣泛的應用。
盡管前人對金簇結構做了大量的研究工作,但在結構與性質的研究中仍然有許多未知的空白。隨著X射線晶體學、質譜學、光學技術等研究取得的突破,對金簇原子精細結構的深入探討使得人們進一步理解了這類材料的諸多性質(圖4),并且已經達到能夠控制合成具有精確原子數的金簇[49]。已有諸多對其光、電、磁、催化等物理化學性質進行的理論研究與歸納[2,11,44,48]。貴金屬納米團簇最重要的一個性質是類似分子的光吸收和強熒光,這一性質在過去的十幾年中已經被廣泛的研究。金簇的熒光性質強烈依賴于尺寸、原子個數、溶劑、保護基團等,量子產率通常在10% 以下,極個別達到了70%[1]。AuNCs除了熒光特性外,還有其他特殊光學特性如紫外吸收特性和電化學發(fā)光特性。
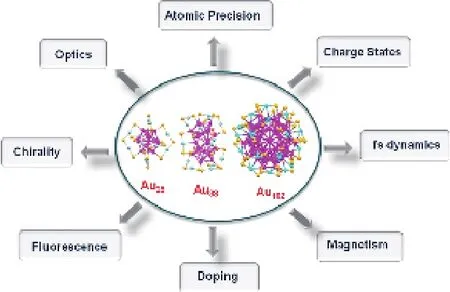
圖4 精確原子數金簇的各項性質[48]Fig. 4 properties of atomically precise gold nanoclusters[48]
通過調節(jié)粒徑的大小可以使金簇的熒光發(fā)射光譜在可見光到近紅外光區(qū)范圍內變化[1,2]。保護基團對AuNCs的熒光性質具有重要作用,特定的保護基團和合成方法可以合成出特定發(fā)射波長的AuNCs[50](圖 5)。
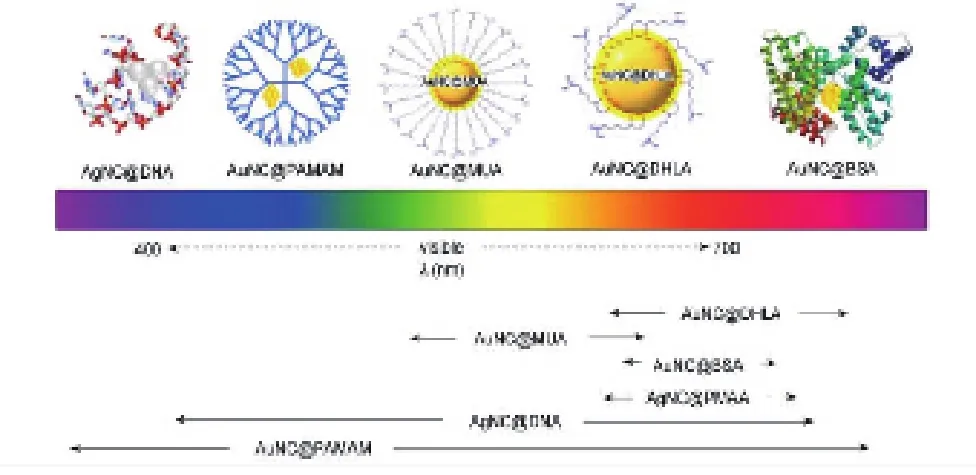
圖5 幾種熒光 NMNCs 的結構和發(fā)射波長范圍[50]Fig. 5 Structure and range of emission wavelength of some fluorescent noble-metal nanoclusters[50]
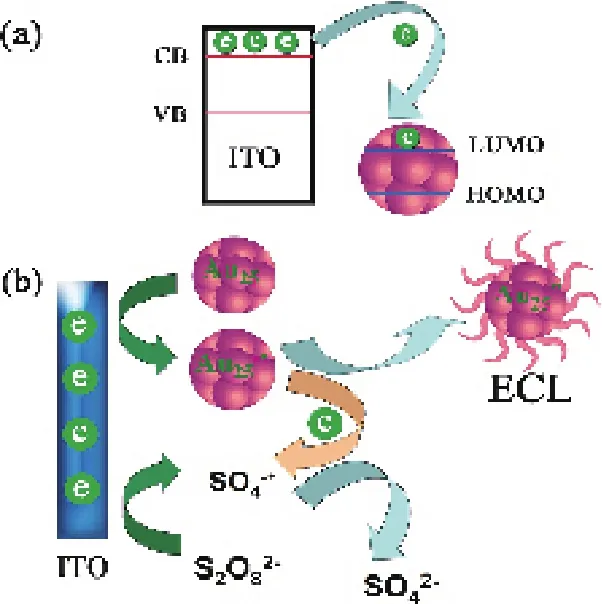
圖6 (a) ITO與AuNCs間的電子轉移 (b)AuNCs的ECL機理[45]Fig. 6 (a) electron transfer between ITO and Au NCs and (b) the ECL mechanisms of AuNCs.[45]
電致化學發(fā)光(ECL)有許多優(yōu)點,如簡單可控,低空白,較化學發(fā)光和熒光有更高的靈敏度等[51]。金簇的ECL現象首次被觀察到是以陽離子三乙胺(TEA)作為共反應劑,該體系較容易受到不同金屬離子不同程度的影響,并且有對Pb2+的檢測有潛在的應用價值[51]。Li等[45]闡述了一種固定在ITO(銦錫氧化物,Indium Tin Oxide)電極上的水溶性,低毒性的牛血清白蛋白保護的金簇(BSA-AuNCs),產生ECL現象的機理(圖 6),基于此性質建立了一種在陰離子共反應劑S2O82-存在的情況下檢測多巴胺的非標記方法。
熒光共振能量轉移(fluorescence resonance energy transfer, FRET)技術是研究生物分子相互作用的有力工具,也是納米熒光探針在應用中新興的一種方法。有機熒光染料吸收譜窄,有機熒光探針發(fā)射譜寬且?guī)в休^長的紅端拖尾,這兩者在這個體系的應用中都存在局限性。近來有報道半導體量子點與金納米粒子或者上轉換納米粒子等形成能量共振轉移對參與FRET過程[52-55]。最近,Long Qin[56]等設計了一種基于GSH-AuNCs和氨基修飾的AuNPs能量轉移對,這種“turn-on”型的熒光方法在近紅外區(qū)檢測谷胱甘肽-S-轉移酶(GST),檢測限達到1.5 nM(如圖 7)。
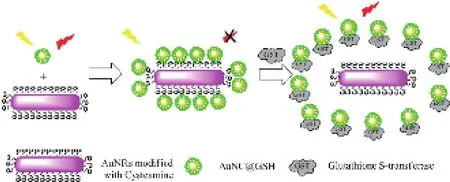
圖7 基于AuNCs和AuNPs間在紅外光區(qū)的FRET現象檢測GST的原理[56]Fig. 7 A novel turn-on fluorescence sensing system for the detection of GST based on the FRET between AuNCs and AuNRs in the NIR Region[56]
3 AuNCs在生命分析中的應用
3.1 生物活性小分子檢測
3.1.1過氧化氫
Chang等[57]基于11-MUA-AuNCs的熒光猝滅作用檢測H2O2。在100 nM-10 nM范圍內,11-MUAAuNCs的熒光猝滅程度與H2O2的加入量呈良好的線性關系,檢測限為30 nM,該檢測限與其他光學傳感器相當。Zhang等[14]開發(fā)了一種新型熒光傳感器,實現了對H2O2的高靈敏性檢測。他們以辣根過氧化物酶(horseradishperoxidase,HRP)為模板原位合成了雙功能型的HRP-AuNCs,該金納米團簇既保留了HPR的高催化活性,又具有金納米團簇的發(fā)光性質。H2O2能夠氧化模板HRP和AuNCs之間的Au-S產生二硫化物,使得AuNCs表面的保護劑(HRP)不足而導致熒光猝滅。該法檢測過氧化氫的檢測限為30 nM。
3.1.2葡萄糖
準確檢測葡萄糖的濃度在臨床診斷和食品分析中有著極其重要的意義。腦脊液中葡萄糖濃度的高靈敏、高準確監(jiān)測,對評估葡萄糖在病理生理過程中的作用十分關鍵。Qiao[43]等人設計了卵清蛋白(OVA)穩(wěn)定的金簇比率熒光探針,以茜素紅硼酸為相應信號特異性識別葡萄糖并可猝滅567 nm處的熒光信號,保留610 nm的熒光信號,以監(jiān)測大鼠腦缺血時腦中葡萄糖濃度水平。最近,Wang等[58]利用卵清蛋白(OVA)穩(wěn)定的金簇熒光能被過氧化氫猝滅的原理設計探針檢測葡萄糖。該探針有著很好的熱穩(wěn)定性、生物相容性,高靈敏度,高選擇性,檢測限為1.0μM。Molaabasi等[59]用過氧化氫敏感的血紅素包被的金簇(Hb-AuNCs)設計熒光探針用于葡萄糖的非標記檢測,檢測限達0.21μM。該探針有很好的水溶性、生物相容性、良好的穩(wěn)定性。
3.1.3 其他
熒光金納米團簇也有報道應用于膽固醇[60]、尿素[61]、氨基酸及其衍生物(如半胱氨酸[62]、谷胱甘肽[63]等)、多巴胺[64]、三磷酸腺苷[65]、維他命B12[66]、微生物[67,68]、蛋白質[69]、克侖特羅[70]、三聚氰胺[71]、戊二醛[72]、溶菌酶、環(huán)丙沙星、槲皮素等。
3.2 細胞標記及成像
熒光成像技術是現代生物醫(yī)學研究中一個非常重要的手段,在觀測細胞及亞細胞層面的過程和現象中起著關鍵作用。但是,該技術所使用的絕大部分熒光染料存在著光漂白[73]和光毒性等難以克服的缺點,使得長時間的活細胞觀測非常困難。由于AuNCs具有熒光染料、QDs等標記物所不具備的優(yōu)點如粒徑小、無毒、生物相容性好,使其成為一種理想的熒光探針,并逐漸應用于細胞標記、細胞成像、細胞分化和示蹤技術等領域。
由于紅光比藍光或綠光穿透組織更有效,并且能減少組織損傷,降低機體的自發(fā)熒光干擾等。因此,近紅外激發(fā)和發(fā)射熒光具有臨床應用價值。上轉換納米粒子(UCNP)可以通過一個非線性光學過程將較低能量的近紅外輻射轉化為較高能量的可見光。在成像方面發(fā)展非常迅速[74]。而AuNCs 可以受到可見光的激發(fā),發(fā)射近紅外光區(qū)熒光[75]。結合這兩種材料的優(yōu)勢設計能量轉移的熒光成像探針能很大程度地減少組織損傷。
3.2.1 體外細胞標記成像
細胞中鐵蛋白是生命體內的一類重要儲鐵機構,分布廣泛,在哺乳動物的肝和脾中含量最多。去鐵鐵蛋白(Apoferritin)是鐵蛋白(ferritin)不含鐵的存在形式,具有籠型結構,是天然的鐵儲存蛋白。已有研究表明,很多腫瘤細胞表面可以大量表達鐵蛋白特異性受體,可以通過鐵蛋白受體-鐵蛋白的結合介導對鐵蛋白(及去鐵鐵蛋白)的內吞作用。Cuiji Sun[21]等設計了一種在鐵蛋白重鏈(H鏈)的亞鐵氧化酶活性位點上組裝兩個金納米團簇,不僅保留了金簇本身的熒光,而且顯示發(fā)生峰紅移,并且由于這對金納米團簇間的耦合作用,發(fā)射光譜也可調節(jié)。由于H鏈上的亞鐵氧化酶活性中心的組氨酸殘基中的咪唑環(huán)能與Au3+發(fā)生強烈的結合,因此可以利用組氨酸作為控制點,制備金簇。這種方法能夠用于小鼠體內腎臟的靶向成像。此外,轉鐵蛋白也被用于合成金簇,并用于A549細胞成像和定位[76]。這種利用天然鐵蛋白作為模板合成金納米團簇進行器官或細胞的靶向成像,具有簡單、快捷、無毒以及良好的生物相容性,是一種體內外細胞成像的新思路。
腫瘤細胞中的葉酸受體表達上調,基于葉酸與葉酸受體結合的特異性而設計的腫瘤細胞熒光成像的金納米簇探針多有報道。Retnakumari等[77]制備了牛血清白蛋白(BSA)包被的金納米團簇,并通過氨基將葉酸(folic acid,FA)與BSA連接,特異地標記了口腔癌細胞(oral cancer KB cells)和乳腺癌細胞(breast adenocarcinoma MCF-7)。Chen[75]等人用一種近紅外熒光染料,親水性ICG 衍生物MPA標記葉酸修飾的金簇用于腫瘤的近紅外成像,隨后,他們又用阿霉素軛合葉酸修飾的金簇用于體內靶向的治療。實驗表明,這兩種材料在細胞水平和動物水平上都顯示了良好的治療效果。Qiao[78]等人用生物相容性良好的N-丙烯酸(ANAS)作為“Linker”將FA 與Ova-AuNCs結合作為探針用于HeLa細胞成像,該材料的熒光發(fā)射光譜在近紅外區(qū),有效地避免了生物體的自熒光干擾。Zhou[79]等人將葉酸共價固定于二氧化硅包被的AuNCs表面作為納米探針,用于裸鼠胃癌細胞(MGC803)的熒光成像和組織的X射線計算機斷層成像(CT)。
金納米團簇被設計成熒光探針用于細胞成像的研究中,所用的細胞多為貼壁細胞,常見的有HeLa 、A549、HepG-2、MGC803、MCF7等等。第一例將金簇探針用于懸浮細胞的熒光成像是將多齒聚合物合成的金納米團簇用于標記造血細胞癌的研究[80]。
Liu等[81]用胰島素成功合成了金納米團簇,合成后胰島素分子仍保留其生物活性。他們還發(fā)現通過觀察C2C12肌細胞對胰島素-金納米簇的攝取效率能夠區(qū)分分化與未分化的C2C12肌細胞。
雙量子成像能夠深入組織內部且能減少在紅外光區(qū)的光毒性[82]。因此,在活細胞成像方面有很大的應用前景。Chou等[83]用葡聚糖制備出了金納米團簇并將其應用于干細胞的雙量子成像。同樣,谷胱甘肽[84]與D-青霉胺[85]合成的金納米團簇也被成功應用于雙量子成像。
在病理學中,細胞核的染色和定位可以反映癌變細胞的增殖活性。Lin等在正常及癌細胞的標記方面做了較多的研究。他們將核定位信號肽(nuclear-localization signal,SV40 NLS)修飾的疏基十一烷酸-金納米簇(NLS-MUA-AuNCs)用于HeLa細胞的染色,結果顯示NLS-MUA-AuNCs在細胞質和核內均呈均勻分布,實現了細胞的核標記和細胞內成像[86]。該小組還將鏈菌親合素(streptavidin)修飾的硫辛酸-金納米團簇(DHLAAuNCs)成功用于人肝癌細胞(human hepatoma cells,HepG2)內源性生物素的特異性標記[24]。Muhammed等[87]利用谷胱甘肽作保護分子代替上述方法中的硫辛酸制備金納米團簇,也實現了HepG2內源性生物素的特異性標記。Wang等[88]把赫塞汀(herceptin)連接到BSA制備的金納米團簇上,然后將其應用于SK-BR3細胞核標記。
3.2.2 活體成像
癌癥一直是困擾人類的一大難題,癌癥的診斷及腫瘤細胞的標記尤為重要。利用有機染料作為標記物達到對腫瘤病灶的成像是最為傳統(tǒng)的方法。然而有機染料抗光漂白能力弱,不適于長時間分子成像[73]。此外,有機染料的細胞毒性也限制其在活體標記中的應用。雖然QDs抗光漂白能力強,并已成功實現了對動物及人類腫瘤的體內成像,然而QDs中的鎘(Cd)等重金屬的毒性也給活體應用帶來安全隱患[89]。此外,QDs的粒徑過大,體內應用時容易被網狀內皮系統(tǒng)(reticuloendothelialsystem,RES)發(fā)現并吞噬,造成標記效率大大降低[90]。金納米團簇的出現使這些問題迎刃而解。它憑借粒徑小、毒性弱、光穩(wěn)定性強和無冪率閃爍等優(yōu)勢正發(fā)展成為腫瘤標記診斷的主力軍。
2010年He和Wang等[91]首次將金納米團簇注入到小鼠體內,成功實現了活體內的腫瘤熒光成像。該小組以BSA-AuNCs為標記材料,通過背部皮下組織和肌肉分別注入患有腫瘤的BALB/c雌性裸鼠體內。通過實時成像,皮下組織注射后的小鼠全身淺表脈管系統(tǒng)具有很強的熒光信號,而通過肌肉注射后,其各臟器均能清晰可見(圖8)。該小組還探討了兩種腫瘤(MDA-MB-45和Hela)在體內的靶向研究(圖9)。Sun等[21]將鐵蛋白制備的金納米團簇通過側尾靜脈注射方式注入到小鼠體內進行活體成像。他們發(fā)現30分鐘后,注入金納米團簇的小鼠的脊椎兩側出現一個腎形熒光區(qū)域,并可保持至少7小時可見。電感耦合等離子體質譜測定結果表明鐵蛋白-金納米團簇主要靶點為肝、腎、脾等組織。Huang等[92]發(fā)現2 nm的硫普羅寧保護的金納米團簇通過單次靜脈注射后,其高度積累于腫瘤組織中。此外,硫普羅寧保護的金納米團簇廣泛分布于腫瘤細胞的細胞質與細胞核中,而直徑為15 nm的金納米粒子則僅僅只存在于細胞質中。Zhang等[93]以金納米團簇作為雙模態(tài)(dual-modality)成像造影劑用于熒光和X射線雙模態(tài)成像。
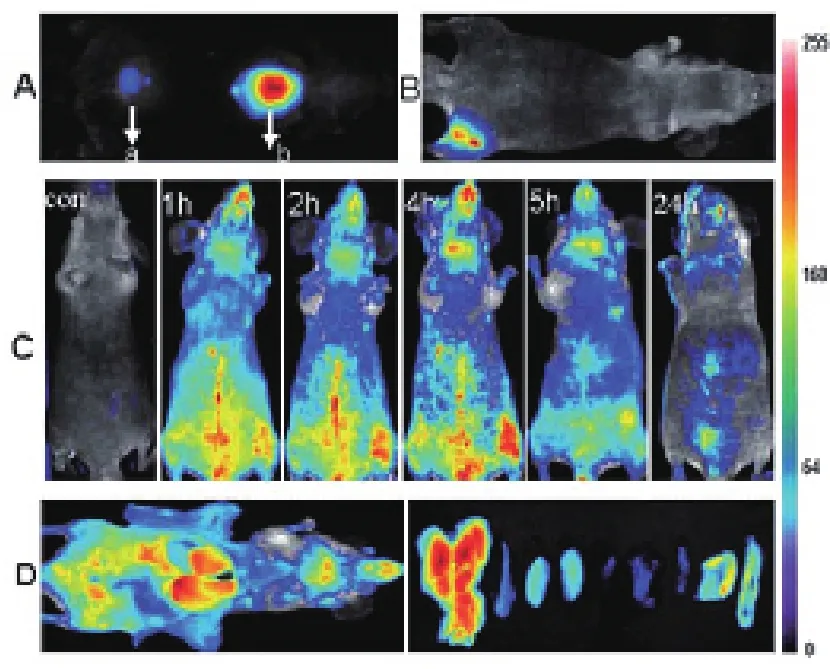
圖8 分別于皮下組織(A)和肌肉(B)注射100 mL AuNCs后的體內熒光成像(C)肌肉注射后的小鼠腹部實時成像(D)解剖后小鼠各器官的熒光成像[91]Fig. 8 In vivo fluorescence image of 100 ml AuNCs injected(A) subcutaneously and (B) intramuscularly into the mice (C) Realtime in vivo abdomen imaging of intravenously injected with 200 ml of AuNCs at different time points, post injection (D) Ex vivo optical imaging of anatomized mice with injection of 200 ml of AuNCs and some dissected organs during necropsy at 5 h pi[91]
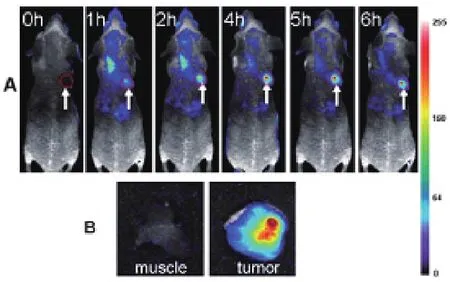
圖9 (A)MDA-MB-45腫瘤在小鼠體內的熒光成像 (B)腫瘤組織和周圍肌肉組織的體外熒光成像。AuNCs在腫瘤病灶(白色箭頭標記)中表現了很強的信號(紅色圓圈標記)[91]Fig. 9 (A) Fluorescence images of mice bearing an MDA-MB-45 tumor. Strong signal from AuNCs was observed in the tumor (marked by the red circle) The arrowheads indicated the tumor (B) Ex vivo fluorescence image of the tumor tissue and the muscle tissue around the tumor from the mice used in A[91]
4 結語與展望
(1)雖然金簇作用于生物系統(tǒng)的研究已經展開,并有了一些初步的進展。但隨著研究的不斷深入,更多嚴峻的挑戰(zhàn)也會伴隨而來。金簇本身的構成因素復雜(元素構成,尺寸、晶形,形態(tài)形貌,表面電性,配基等),外界條件的影響因素如溫度、pH值、溶劑、電勢等也需加以考量,如若加上更為精細復雜的生物體系統(tǒng)作為研究對象,會使研究體系的開展平添許多困難。我們需要思考:不同條件下制備的不同種類的金簇進入細胞的機理是否一致?如果整合納米探針的優(yōu)點到生物體結構中并且與生物體的親和性良好?在細胞內的這些金屬納米團簇分配路徑如何?怎么降解?非特異性自體干擾如何排除?納米材料在生物體內外環(huán)境的親水性疏水性如何把控?是否會影響生物體遺傳特性?是否會影響細胞生長周期,凋亡遷移等生物過程?這些問題需要更進一步的代謝動力學,生物安全性,毒理學研究,遺傳學等各方面更為深入的探討。同時,還需結合各個學科的優(yōu)勢,利用好最前沿的科研成果,儀器設備,推進金簇應用于生物醫(yī)學診斷,環(huán)境分析等新方法的產生與發(fā)展。
(2)合成方法有待進一步發(fā)展。現在報道的金納米團簇與量子點和有機熒光染料相比,量子產率仍很低(大多低于10%)。發(fā)展尺寸、粒徑、原子數可控的金納米團簇的制備工藝需要制定可靠的質量標準,控制批間的差異,建立起新的分析方法也要面臨方法學驗證的探討。此外,金納米團簇的表面修飾可賦予其更多的功能。建立多功能、強熒光性能,更綠色,穩(wěn)定,生物安全性良好的金納米團簇合成方法,也是當前的一個任務。
(3)金納米團簇合成機理和光學性質研究有待進一步深化。先前對于金納米團簇的合成機理的解釋很少,了解其合成機理和光學性質有利于合成高量子產率的金納米團簇。某些研究中,出現的化學峰位移的機理也不甚清晰,因此,深入研究金納米團簇的合成機理、影響因素和光學性質之間的關系也將成為未來金納米團簇研究的重點。此外還需進一步深入解析其結構晶型、催化性能、磁性等性質。
(4)金納米團簇的應用領域有待于進一步拓展。作為一種熒光標記納米材料,金納米團簇已在生物標記和生物成像研究中顯示出巨大的應用前景。此外,除研究金納米團簇與蛋白質、核酸等的響應外,人們還應加強金納米團簇與其他生物物質如糖類、脂類等的作用研究。這將有利于拓展金納米團簇在細胞轉運、生物過程調控等領域中的應用。因此,科研工作者應該進一步改善AuNCs的一些缺點,提高其在分析檢測方面的應用及拓寬其應用領域。
(References)
[1] Zheng J, Zhang C, Dickson R M. Highly fluorescent, watersoluble, size-tunable gold quantum dots [J]. Physical Review Letters, 2004, 93(7): 077402.
[2] Zheng J, Nicovich P R, Dickson R M.Highly fluorescent noble metal quantum dots [J]. Annual Review of Physical Chemistry, 2007, 58: 409.
[3] Michalet X, Pinaud F F, Bentolila L A, et al.Quantum dots for live cells in vivo imaging and diagnostics [J]. Science, 2005,307(5709): 538-544.
[4] Zhu S, Zhang J, Qiao C, et al.Strongly greenphotoluminescent graphene quantum dots for bioimaging applications [J]. Chemical Communications, 2011, 47(24):6858-6860.
[5] Yan J, Estévez M C, Smith J E, et al.Dye-doped nanoparticles for bioanalysis [J]. Nano Today, 2007, 2(3): 44-50.
[6] Xiao Y, Zeng L, Xia T, et al.Construction of an upconversion nanoprobe with few-atom silver nanoclusters as the energy acceptor [J]. Angewandte Chemie International Edition,2015, 54(18): 5323-5327.
[7] Ow H, Larson D R, Srivastava M, et al. Bright and stable core-shell fluorescent silica nanoparticles [J]. Nano Letters, 2005, 5(1): 113-117.
[8] Baker S N, Baker G A.Luminescent carbon nanodots:emergent nanolights [J]. Angewandte Chemie International Edition, 2010, 49(38): 6726-6744.
[9] 楊群峰, 劉建云, 陳華萍, 等.貴金屬納米團簇的制備及在生物檢測中的應用 [J].化學進展, 2011, 23(5): 880-892.
[10] Mooradian A.Photoluminescence of metals [J]. Physical Review Letters, 1969, 22(5): 185.
[11] Lu Y, Chen W.Sub-nanometre sized metal clusters: from synthetic challenges to the unique property discoveries [J]. Chemical Society Reviews, 2012, 41(9): 3594-3623.
[12] 崔瑪琳.金納米簇的合成, 表征及其在環(huán)境與生物分析中的應用 [D].福建: 閩南師范大學, 2013.
[13] Cui M, Zhao Y, Song Q.Synthesis, optical properties and applications of ultra-small luminescent gold nanoclusters [J]. TrAC Trends in Analytical Chemistry, 2014, 57: 73-82.
[14] Wen F, Dong Y, Feng L, et al.Horseradish peroxidase functionalized fluorescent gold nanoclusters for hydrogen peroxide sensing [J]. Analytical Chemistry, 2011, 83(4):1193-1196.
[15] Link S, Beeby A, FitzGerald S, et al., Visible to infraredluminescence from a 28-atom gold cluster [J]. The Journal of Physical Chemistry B, 2002, 106(13): 3410-3415.
[16] Xie J, Zheng Y, Ying J Y.Protein-directed synthesis of highly fluorescent gold nanoclusters [J]. Journal of the American Chemical Society, 2009, 131(3): 888-889.
[17] Duan H, Nie S.Etching colloidal gold nanocrystals with hyperbranched and multivalent polymers: a new route to fluorescent and water-soluble atomic clusters [J]. Journal of the American Chemical Society, 2007, 129(9): 2412-2413.
[18] Santiago González B, Rodríguez M J, Blanco C, et al.One step synthesis of the smallest photoluminescent and paramagnetic PVP-protected gold atomic clusters [J].Nano Letters, 2010, 10(10): 4217-4221.
[19] Liu G, Shao Y, Ma K, et al.Synthesis of DNA-templated fluorescent gold nanoclusters [J]. Gold Bulletin, 2012, 45(2):69-74.
[20] Wei H, Wang Z, Yang L, et al.Lysozyme-stabilized gold fluorescent cluster: synthesis and application as Hg2+ sensor[J]. Analyst, 2010, 135(6): 1406-1410.
[21] Sun C, Yang H, Yuan Y, et al.Controlling assembly of paired gold clusters within apoferritin nanoreactor for in vivo kidney targeting and biomedical imaging [J]. Journal of the American Chemical Society, 2011, 133(22): 8617-8624.
[22] Liu C L, Wu H T, Hsiao Y H, et al.Insulin-directed synthesis of fluorescent gold nanoclusters: preservation of insulin bioactivity and versatility in cell imaging [J].Angewandte Chemie International Edition, 2011, 50(31): 7056-7060.
[23] Xavier P L, Chaudhari K, Baksi A, et al.Protein-protected luminescent noble metal quantum clusters: an emerging trend in atomic cluster nanoscience [J].Nano Reviews, 2012, 3:14761-14767.
[24] Lin C A J, Yang T Y, Lee C H, et al.Synthesis,characterization, and bioconjugation of fluorescent gold nanoclusters toward biological labeling applications [J].ACS Nano, 2009, 3(2): 395-401.
[25] Gr?hn F, Bauer B J, Akpalu Y A, et al.Dendrimer templates for the formation of gold nanoclusters [J]. Macromolecules,2000, 33(16): 6042-6050.
[26] Chen Y, Wang Y, Wang C, et al.Papain-directed synthesis of luminescent gold nanoclusters and the sensitive detection of Cu2+ [J].Journal of Colloid and Interface Science, 2013,396: 63-68.
[27] Yu Y, Luo Z, Teo C S, et al.Tailoring the protein conformation to synthesize different-sized gold nanoclusters [J]. Chemical Communications, 2013, 49(84): 9740-9742.
[28] Kiely C, Fink J, Brust M, et al.Spontaneous ordering of bimodal ensembles of nanoscopic gold clusters [J]. Nature,1998, 396(6710): 444-446.
[29] Negishi Y, Tsukuda T.Visible photoluminescence from nearly monodispersed au 12 clusters protected by meso-2, 3-dimercaptosuccinic acid [J]. Chemical Physics Letters,2004, 383(1): 161-165.
[30] Shichibu Y, Negishi Y, Tsunoyama H, et al.Extremely high stability of glutathionate-protected Au25 clusters against core etching [J]. Small, 2007, 3(5): 835-839.
[31] Leontowich A F, Calver C F, Dasog M, et al.Surface properties of water-soluble glycine-cysteamine-protected gold clusters [J]. Langmuir, 2009, 26(2): 1285-1290.
[32] Shang L, Brandholt S, Stockmar F, et al.Effect of protein adsorption on the fluorescence of ultrasmall gold nanoclusters[J]. Small, 2012, 8(5): 661-665.
[33] Wu X J, Zhao P, Fang J M, et al.Simulation on the hydrogen storage properties of new doping porous aromatic frameworks [J]. Acta Physico-Chimica Sinica, 2014, 30(11):2043-2054.
[34] Ding H, Liang C, Sun K, et al.Dithiothreitol-capped fluorescent gold nanoclusters: an efficient probe for detection of copper (II) ions in aqueous solution [J]. Biosensors and Bioelectronics, 2014, 59: 216-220.
[35] Huang C C, Yang Z, Lee K H, et al.Synthesis of highly fluorescent gold nanoparticles for sensing mercury (II) [J]. Angewandte Chemie, 2007, 119(36): 6948-6952.
[36] Muhammed M A H, Ramesh S, Sinha S S, et al.Two distinct fluorescent quantum clusters of gold starting from metallic nanoparticles by pH-dependent ligand etching [J]. Nano Research, 2008, 1(4): 333-340.
[37] Yuan X, Zhang B, Luo Z, et al.Balancing the rate of cluster growth and etching for gram-scale synthesis of thiolateprotected Au25 nanoclusters with atomic precision [J]. Angewandte Chemie International Edition, 2014, 53(18):4623-4627.
[38] Zheng J, Petty J T, Dickson R M.High quantum yield blue emission from water-soluble Au8 nanodots [J]. Journal of the American Chemical Society, 2003, 125(26): 7780-7781.
[39] Schaeffer N, Tan B, Dickinson C, et al.Fluorescent or not?Size-dependent fluorescence switching for polymer-stabilized gold clusters in the 1.1-1.7 nm size range [J]. Chemical Communications, 2008(34): 3986-3988.
[40] Linnert T, Mulvaney P, Henglein A, et al.Long-lived nonmetallic silver clusters in aqueous solution: preparation and photolysis [J].Journal of the American Chemical Society,1990, 112(12): 4657-4664.
[41] Hatchett D W, Josowicz M, Janata J, et al.Electrochemical formation of au clusters in polyaniline [J].Chemistry of Materials, 1999, 11(10): 2989-2994.
[42] He D F, Xiang Y, Wang X, et al.Microwave-heating synthesis and sensing applications of bright gold nanoclusters [J]. Materials Research Bulletin, 2011, 46(12): 2418-2421.
[43] Wang L L, Qiao J, Liu H H, et al.Ratiometric fluorescent probe based on gold nanoclusters and alizarin red-boronic acid for monitoring glucose in brain microdialysate [J]. Analytical Chemistry, 2014, 86(19): 9758-9764.
[44] Jin R.Quantum sized, thiolate-protected gold nanoclusters [J]. Nanoscale, 2010, 2(3): 343-362.
[45] Li L, Liu H, Shen Y, et al.Electrogenerated chemiluminescence of Au nanoclusters for the detection of dopamine [J]. Analytical Chemistry, 2011, 83(3): 661-665.
[46] Gao Y, Shao N, Pei Y, et al.Catalytic activities of subnanometer gold clusters (Au16-Au18, Au20, and Au27-Au35) for CO oxidation [J]. ACS Nano, 2011, 5(10): 7818-7829.
[47] Yue Q, Sun L, Shen T, et al.Synthesis of fluorescent gold nanoclusters directed by bovine serum albumin and application for nitrite detection [J]. Journal of Fluorescence 2013, 23(6): 1313-1318.
[48] Qian H, Zhu M, Wu Z, et al.Quantum sized gold nanoclusters with atomic precision [J]. Accounts of Chemical Research 2012, 45(9): 1470-1479.
[49] Chen Y, Zeng C, Kauffman D R, et al.Tuning the magic size of atomically precise gold nanoclusters via isomeric methylbenzenethiols [J]. Nano Letters, 2015, 15(5):3603-3609.
[50] Lin C A J, Lee C H, Hsieh J T, et al.Synthesis of fluorescent metallic nanoclusters toward biomedical application: recent progress and present challenges [J]. Journal of Medical and Biological Engineering, 2009, 29(6): 276-283.
[51] Fang Y M, Song J, Li J, et al.Electrogenerated chemiluminescence from au nanoclusters [J]. Chemical Communications, 2011, 47(8): 2369-2371.
[52] Vannoy C H, Chong L, Le C, et al.A competitive displacement assay with quantum dots as fluorescence resonance energy transfer donors [J]. Analytica Chimica Acta, 2013, 759: 92-99.
[53] Li J, Li X, Shi X, et al.Highly sensitive detection of caspase-3 activities via a nonconjugated gold nanoparticle-quantum dot pair mediated by an inner-filter effect [J].ACS Applied Materials & Interfaces, 2013, 5(19): 9798-9802.
[54] Wang Y, Gao D, Zhang P, et al.A near infrared fluorescence resonance energy transfer based aptamer biosensor for insulin detection in human plasma [J]. Chemical Communications 2014, 50(7): 811-813.
[55] Doughan S, Uddayasankar U, Krull U J.A paper-based resonance energy transfer nucleic acid hybridization assay using upconversion nanoparticles as donors and quantum dots as acceptors [J]. Analytica Chimica Acta, 2015, 878: 1-8.
[56] Qin L, He X, Chen L, et al.Turn-on fluorescent sensing of glutathione S-transferase at near-infrared region based on FRET between gold nanoclusters and gold nanorods [J]. ACS Applied Materials & Interfaces, 2015, 7(10): 5965-5971.
[57] Shiang Y C, Huang C C, Chang H T.Gold nanodot-based luminescent sensor for the detection of hydrogen peroxide and glucose [J]. Chemical Communications, 2009(23): 3437-3439.
[58] Wang L L, Qiao J, Qi L, et al.Construction of OVA-stabilized fluorescent gold nanoclusters for sensing glucose [J]. Science China Chemistry, 2015: 1-7.
[59] Molaabasi F, Hosseinkhani S, Moosavi-Movahedi A A, et al.Hydrogen peroxide sensitive hemoglobin-capped gold nanoclusters as a fluorescence enhancing sensor for the label-free detection of glucose [J]. RSC Advances, 2015,5(42): 33123-33135.
[60] Chen X, Baker G A.Cholesterol determination using protein-templated fluorescent gold nanocluster probes [J]. Analyst, 2013, 138(24): 7299-7302.
[61] Nair L V, Philips D S, Jayasree R S, et al.A near-infrared fluorescent nanosensor (AuC@ urease) for the selective detection of blood urea [J]. Small, 2013, 9(16): 2673-2677.
[62] Cui M L, Liu J M, Wang X X, et al.Selective determination of cysteine using BSA-stabilized gold nanoclusters with red emission [J]. Analyst, 2012,137(22): 5346-5351.
[63] Habeeb Muhammed M A, Verma P K, Pal S K, et al.Luminescent quantum clusters of gold in bulk by albumin-induced core etching of nanoparticles: Metal ion sensing, metal-enhanced luminescence, and biolabeling [J]. Chemistry-A European Journal, 2010, 16(33): 10103-10112.
[64] Ban R, Abdel-Halim E, Zhang J, et al.β-cyclodextrin functionalised gold nanoclusters as luminescence probes for the ultrasensitive detection of dopamine [J]. Analyst,2015, 140(4): 1046-1053.
[65] Liu A, Wang K, Weng S, et al.Development of electrochemical DNA biosensors [J].TRAC Trends in Analytical Chemistry, 2012, 37(0): 101-111.
[66] Samari F, Hemmateenejad B, Rezaei Z, et al.A novel approach for rapid determination of vitamin B12 in pharmaceutical preparations using BSA-modified gold nanoclusters [J]. Analytical Methods, 2012, 4(12): 4155-4160.
[67] Chan P H, Wong S Y, Lin S H, et al.Lysozyme-encapsulated gold nanocluster-based affinity mass spectrometry for pathogenic bacteria [J].Rapid Communications in Mass Spectrometry, 2013, 27(19): 2143-2148.
[68] Chan P H, Chen Y C.Human serum albumin stabilized gold nanoclusters as selective luminescent probes for staphylococcus aureus and methicillin-resistant staphylococcus aureus [J]. Analytical chemistry, 2012,84(21): 8952-8956.
[69] Huang C C, Chiang C K, Lin Z H, et al. Bioconjugated gold nanodots and nanoparticles for protein assays based on photoluminescence quenching [J]. AnalyticalChemistry, 2008, 80(5): 1497-1504.
[70] Cao X, Li H, Lian L, et al.A dual-responsive fluorescence method for the detection of clenbuterol based on BSA-protected gold nanoclusters [J]. Analytica Chimica Acta,2015, 871: 43-50.
[71] Dai H, Shi Y, Wang Y, et al. Label-free turn-on fluorescent detection of melamine based on the anti-quenching ability of Hg2+ to gold nanoclusters [J]. Biosensors and Bioelectronics, 2014, 53: 76-81.
[72] Wang X, Wu P, Lv Y, et al.Ultrasensitive fluorescence detection of glutaraldehyde in water samples with bovine serum albumin-Au nanoclusters [J]. Microchemical Journal, 2011, 99(2): 327-331.
[73] Frangioni J V.In vivo near-infrared fluorescence imaging [J]. Current Opinion in Chemical Biology, 2003, 7(5): 626-634.
[74] Wang M, Abbineni G, Clevenger A, et al.Upconversion nanoparticles: synthesis, surface modification and biological applications [J].Nanomedicine: Nanotechnology, Biology and Medicine, 2011, 7(6): 710-729.
[75] Chen H, Li S, Li B, et al.Folate-modified gold nanoclusters as near-infrared fluorescent probes for tumor imaging and therapy [J]. Nanoscale, 2012, 4(19): 6050-6064.
[76] Le Guével X, Daum N, Schneider M.Synthesis and characterization of human transferrin-stabilized gold nanoclusters [J]. Nanotechnology, 2011, 22(27): 275103.
[77] Retnakumari A, Setua S, Menon D, et al.Molecularreceptor-specific, non-toxic, near-infrared-emitting Au cluster-protein nanoconjugates for targeted cancer imaging[J]. Nanotechnology, 2010, 21(5): 055103.
[78] Qiao J, Mu X, Qi L, et al.Folic acid-functionalized fluorescent gold nanoclusters with polymers as linkers for cancer cell imaging [J]. Chemical Communications, 2013,49(73): 8030-8032.
[79] Zhou Z, Zhang C, Qian Q, et al.Folic acid-conjugated silica capped gold nanoclusters for targeted fluorescence/ X-ray computed tomography imaging [J]. Journal of Nanobiotechnology, 2013, 11(1): 17.
[80] Huang X, Luo Y, Li Z, et al.Biolabeling hematopoietic system cells using near-infrared fluorescent gold nanoclusters [J].The Journal of Physical Chemistry C, 2011,115(34): 16753-16763.
[81] Kuang H, Chen W, Yan W J, et al.Crown ether assembly of gold nanoparticles: melamine sensor [J]. Biosensors and Bioelectronics, 2011, 26(5): 2032-2037.
[82] Diaspro A, Robello M.Two-photon excitation of fluorescence for three-dimensional optical imaging of biological structures [J]. Journal of Photochemistry and Photobiology B: Biology, 2000, 55(1): 1-8.
[83] Liu C L, Ho M L, Chen Y C, et al.Thiol-functionalized gold nanodots: two-photon absorption property and imaging in vitro [J].The Journal of Physical Chemistry C,2009, 113(50): 21082-21089.
[84] Polavarapu L, Manna M, Xu Q H.Biocompatible glutathione capped gold clusters as one-and two-photon excitation fluorescence contrast agents for live cells imaging [J]. Nanoscale, 2011, 3(2): 429-434.
[85] Shang L, Dong S.Facile preparation of water-soluble fluorescent silver nanoclusters using a polyelectrolyte template[J]. Chemical Communications, 2008(9): 1088-1090.
[86] Lin S Y, Chen N T, Sum S P, et al.Ligand exchanged photoluminescent gold quantum dots functionalized with leading peptides for nuclear targeting and intracellular imaging[J]. Chemical Communications, 2008(39): 4762-4764.
[87] Muhammed M A H, Verma P K, Pal S K, et al.Bright,NIR-emitting Au23 from Au25: characterization and applications including biolabeling [J].Chemistry-A European Journal, 2009, 15(39): 10110-10120.
[88] Wang Y, Chen J, Irudayaraj J.Nuclear targeting dynamics of gold nanoclusters for enhanced therapy of HER2+ breast cancer [J]. ACS nano, 2011, 5(12): 9718-9725.
[89] Zheng Y, Gao S, Ying J Y.Synthesis and cell-imaging applications of glutathione-capped CdTe quantum dots [J]. Advanced Materials, 2007, 19(3): 376-380.
[90] Schipper M L, Iyer G, Koh A L, et al.Particle size, surface coating, and pegylation influence the biodistribution of quantum dots in living mice [J]. Small, 2009, 5(1): 126-134.
[91] Wu X, He X, Wang K, et al.Ultrasmall near-infrared gold nanoclusters for tumor fluorescence imaging in vivo [J]. Nanoscale, 2010, 2(10): 2244-2249.
[92] Huang K, Ma H, Liu J, et al.Size-dependent localization and penetration of ultrasmall gold nanoparticles in cancer cells,multicellular spheroids, and tumors in vivo [J]. ACS Nano,2012, 6(5): 4483-4493.
[93] Zhang A, Tu Y, Qin S, et al.Gold nanoclusters as contrast agents for fluorescent and X-ray dual-modality imaging [J]. Journal of Colloid and Interface Science, 2012, 372(1): 239-244.
Fluorescent gold nanoclusters and their applications in biomedical analysis
SHI Xiaoqiong, DENG Haohua, WANG Feifei, CHEN Wei
Department of Pharmaceutical Analysis, Fujian Medical University, Fuzhou 350108
Gold nanoclusters (AuNCs), a new type of fluorescent nanomaterials, refer to the molecular species which consist of a few to a hundred atoms under the protection of the molecular layer. Their diameter are generally less than 2 nm and comparable to the Fermi wavelength of electrons, bring about molecule-like properties such as discrete electronic states and size-dependent fluorescence. Recently, AuNCs have become a hot topic owing to their perfect properties including ultrasmall size, good biocompatibility, excellent optical stability, large Stokes shift, tunable emission spectra as well as non-toxic, which make up some disadvantages of the traditional fluorescent labeling materials like organic fluorescent dyes, fluorescent protein, and quantum dots. With further research, fluorescence gold nanoclusters have shown broad application prospects in the fields of chemical analysis,biomedicine, optoelectronics. In this review, we highlight the properties, preparation of AuNCs and recent advances in fluorescene determination of biological organic molecules and cell imaging.
gold nanoclusters; fluorescence bioprobe; nanomaterials; fabrication; biomedical analysis
R493
A
10.11966/j.issn.2095-994X.2015.01.03.14
2015-07-02;
2015-08-12
國家自然科學基金(21175023)
陳偉(通信作者),教授,研究方向為納米生物醫(yī)藥技術,電子信箱:weichen@mail.fjmu.edu.cn
引用格式:施小瓊,鄧豪華 ,王菲菲,等.熒光金納米團簇及其在生命分析中的應用[J].世界復合醫(yī)學,2015,1(3):262-271

