5種化學品對麗斑麻蜥和日本鵪鶉的毒性研究
常靜,楊淞霖,戴欣,李濟彤,王會利,瞿唯鋼
1. 中國科學院生態環境研究中心環境生物技術重點實驗室,北京100085 2. 中國農業部農藥檢定所,北京100125
5種化學品對麗斑麻蜥和日本鵪鶉的毒性研究
常靜1,楊淞霖1,戴欣1,李濟彤1,王會利1,瞿唯鋼2,*
1. 中國科學院生態環境研究中心環境生物技術重點實驗室,北京100085 2. 中國農業部農藥檢定所,北京100125
目前,在化學品生態風險評價體系中對爬行動物的毒性效應研究較少。本研究參考鳥類急性經口毒性試驗建立了我國本土爬行動物——麗斑麻蜥(Eremias argus)的急性毒性測試方法,來評價化學品對爬行動物和鳥類的毒性效應之間的差異。選擇異氰酸酯、1,2-苯并異噻唑-3-酮、2,4-二氯苯酚、苯并噻唑和二苯甲酮5種化學品分別對麗斑麻蜥進行暴露實驗,并與鳥類模式物種——日本鵪鶉(Coturnix japonica)的急性毒性結果進行比較。結果發現異氰酸酯和苯并噻唑對麗斑麻蜥7 d的半數致死劑量(7 d-LD50)分別為125 mg·kg-1和500 mg·kg-1,而對日本鵪鶉的7 d-LD50值分別為27 mg·kg-1和37 mg·kg-1;1,2-苯并異噻唑-3-酮、2,4-二氯苯酚和二苯甲酮對麗斑麻蜥的7 d-LD50值分別為909 mg·kg-1、787 mg·kg-1和528 mg·kg-1,而對日本鵪鶉7 d-LD50值均大于劑量上限1 000 mg·kg-1。結果表明,麗斑麻蜥和日本鵪鶉對相同化學品的毒性敏感性是存在差異的,用鳥類來評價化學品對爬行動物的潛在風險可能不夠準確,應該重視化學品對爬行動物的毒性效應研究。同時,以本土爬行動物的代表物種麗斑麻蜥作為化學品環境風險評價的模式生物,對保護我國本土物種及其多樣性、維持生態平衡具有重要意義。
爬行動物;麗斑麻蜥(Eremias argus);日本鵪鶉(Coturnix japonica);急性毒性
爬行動物是脊椎動物的重要組成部分,其種類僅次于鳥類,是第二大類陸地脊椎動物。爬行動物在食物鏈中占據重要位置,對維護自然生態平衡起重要作用。而在脊椎動物環境毒理學研究中,很多學者以鳥類作為模式生物來評價化學品對陸生脊椎動物的風險[1],對爬行動物的研究相對較少,僅有不到1%的研究是關于爬行動物毒理學的[2-3]。近年來,爬行動物的種群數量呈現出嚴重下降的趨勢,引起了毒理學家對自然界中爬行動物受污染狀況的廣泛關注[4]。如研究污染物對鱷魚、海龜和蜥蜴的內分泌干擾作用[5]以及爆炸物[6]、有機磷酸酯類污染物[7]、農藥[8-9]和重金屬[10]在蜥蜴體內的富集與代謝。
據美國魚和野生動物保護協會統計,爬行動物種類共計7 150種,其中蜥蜴物種有5 066種[4]。蜥蜴作為爬行動物中最龐大的家族,是研究爬行動物毒理學較為理想的模式生物[11],對蜥蜴的研究就爬行動物而言具較強的代表性。近年來,對蜥蜴毒性的研究僅限于測定蜥蜴體內各種農藥及重金屬在不同組織中的殘留量[9-10,12-13],污染物暴露對蜥蜴活動能力、進食量和生長的影響[14-15],對體內酶活性的影響[16-17]以及毒物暴露之后對蜥蜴睪丸形態學的變化[18]。面對化學品對爬行動物的毒性數據還十分缺乏的現狀,環境風險評估人員在進行化學品對爬行動物的風險評價時經常用鳥類來替代[19]。而該建議必須滿足2個前提條件:第一,鳥類對化學品的敏感性高于爬行動物;第二,鳥類對化學品的吸收量大于爬行動物。但是由于蜥蜴獨特的生理特征和生活習性,它們對化學品的敏感度可能與鳥類不一致,甚至高于鳥類,因此亟待開展以蜥蜴作為模式生物的爬行動物毒性測試方法研究。
由于不同的國家和地區分布的蜥蜴物種不盡相同,各國學者多圍繞本土的蜥蜴物種展開毒理學研究。因為本土物種易受環境干擾,對環境變化更為敏感,能更好地反應當地的環境變化。選用本土物種進行毒理學研究對維護本地生態系統穩定、維持物種多樣性也具有重要意義。在亞洲,Trinchella等[20]和Alexander等[21]學者用麗斑麻蜥(Eremias argus)和白條草蜥(Takydromus wolteri)來評價污染物對爬行動物的影響;在歐洲,Amaral等[22]學者用意大利壁蜥(Podarcis sicula)做爬行動物毒理學研究;在北美地區,近年來由于圍欄蜥蜴(Sceloporus occidentalis)具有體型小、成熟所需時間較短、易在實驗室繁殖等特點,許多學者將它作為化學品環境風險評價的受試生物[16,23]。麗斑麻蜥是我國重要的蜥種,隸屬于蜥蜴目、麻蜥屬,以昆蟲為食,廣泛地分布于河北、山西、陜西、內蒙古等地區。選用中國本土爬行物種——麗斑麻蜥作為受試生物評價化學品對爬行動物的毒性,對于我國的化學品環境管理可能更有意義。
綜上所述,本研究選用我國本土爬行物種麗斑麻蜥為受試生物,在參考鳥類急性經口毒性試驗方法的基礎上,初步建立了基于麗斑麻蜥的化學品急性毒性測試方法。對異氰酸酯、1,2-苯并異噻唑-3-酮、2,4-二氯苯酚、苯并噻唑和二苯甲酮5種化學品進行麗斑麻蜥急性毒性試驗,并與鳥類模式物種——日本鵪鶉(Coturnix japonica)的毒性進行對比,為評價化學品對爬行動物的毒性提供了科學依據。
1 材料與方法 (Materials and methods)
1.1器材與試劑
主要器材為30(長) cm×30(寬) cm×20(高) cm和5(長) m×1.2(寬) m×0.4(高) m的玻璃缸;金屬網孔籠,規格為80(長) cm×50(寬) cm×50(高) cm。異氰酸酯(上海嵐克醫藥科技發展有限公司,分析純);1,2-苯并異噻唑-3-酮、2,4二氯苯酚、苯并噻唑(百靈威集團化學有限公司,分析純);二苯甲酮(阿拉丁試劑有限公司,分析純)。50 μL進樣針以及25 W UVB3.0太陽燈。
1.2實驗材料
麗斑麻蜥:種源來自于內蒙古阿巴嘎旗,經實驗室自行飼養與繁殖。在5 m×1.2 m×0.4 m室內玻璃缸中飼養,缸內鋪蓋10 cm的軟土。溫度控制在(27.5±2.5) ℃,相對濕度為(45%±15%)。使用6盞100 W的白熾燈提供光照并維持光照時較高的溫度,光暗比控制在14 h:10 h。每天分2次投喂黃粉蟲幼蟲(Tenebriomolitor L.),每2天提供1次水源,不定時噴水。每周清理1次脫皮、糞便及食物殘渣。麗斑麻蜥已在實驗室內飼養繁殖超過3年,可滿足實驗要求。
日本鵪鶉:購自北京密云興盛養殖場,經實驗室自行飼養與繁殖。日本鵪鶉在14 d齡之前容易出現死亡,在此期間,溫度控制在(35±3) ℃,相對濕度為(60%±10%)。14 d齡后,溫度每天降低1 ℃,最終控制在(25±2) ℃,濕度不變。對于10 d齡之前的幼體鵪鶉的飲用水為溫水,24 h光暗比為20 h :4 h,光照時間逐日遞減1 h,直至達到自然光照水平。在進入成熟期(30 d齡)后,將日本鵪鶉按雌雄比3:1進行分籠飼養。
1.3毒性試驗
實驗所用麗斑麻蜥來自同一種群,2年齡成熟蜥蜴,體重在(3.5±1.0) g。根據預試驗確定的濃度范圍按一定間距設置5個劑量組,每組隨機選擇10只蜥蜴(雌雄各半),并設空白對照組,分別放在30 cm×30 cm×20 cm的玻璃缸中。實驗條件與飼養條件一致。試驗開始24 h前停止喂食,僅供清水。試驗用蜥蜴以經口灌胃法一次性給藥5~10 μL·g-1體重,連續7 d觀察試驗用蜥蜴的死亡情況與中毒癥狀,試驗期間正常飼喂。記錄各處理組受試蜥蜴的死亡數,對試驗數據進行數理統計,求出LD50值。
日本鵪鶉急性經口毒性實驗參照GB/T 31270—2014《化學農藥安全評價試驗準則》[24]及OECD相關標準[25]。實驗選擇來自同一批次30 d齡的鵪鶉,體重在(100±10) g。根據預實驗設置5個劑量組,每組10只鵪鶉,雌雄各半,并設置空白對照組。各組鵪鶉分別放入金屬網孔籠中。試驗前一天停止喂食,僅供清水。供試鵪鶉以經口灌注法一次性給藥10 mL·kg-1體重,連續7 d觀察記錄鵪鶉的死亡情況以及中毒癥狀,求出LD50。
1.4數據處理
使用SPSS數據處理軟件進行Probit線性回歸分析,得到其LD50值。
2 結果(Results)
對麗斑麻蜥和日本鵪鶉進行了5種化學品的急性經口毒性試驗,7 d-LD50值的比較結果如表1所示。
在麗斑麻蜥的急性經口毒性實驗中,經口灌胃苯并噻唑、二苯甲酮、1,2-苯并異噻唑-3-酮和2,4-二氯苯酚后,處理組中觀察到麗斑麻蜥出現眼睛緊閉、活動能力減弱的現象,幾個小時之后逐漸恢復。但是發現蜥蜴進食量逐日減少,體重也隨之下降。麗斑麻蜥暴露于500 mg·kg-1的異氰酸酯后,與對照組相比,隨著時間的延長蜥蜴活動量日益減少,出現嗜睡、精神恍惚、皮膚皺起等現象,有些蜥蜴腹部出現淤青甚至死亡。將死亡的蜥蜴進行解剖,發現部分蜥蜴體內出現組織潰爛現象。由實驗結果可以看出,隨著濃度的升高死亡率不斷增加,二者呈良好的S型劑量-效應關系。由SPSS軟件計算得出異氰酸酯和苯并噻唑的7 d-LD50值分別為125 mg·kg-1和500 mg·kg-1。而二苯甲酮、1,2-苯并異噻唑-3-酮、2,4-二氯苯酚的7 d-LD50值分別為528 mg·kg-1、909 mg·kg-1和787 mg·kg-1。
對日本鵪鶉進行了以上5種化學品的急性經口毒性實驗,實驗中觀察到,與對照組相比鵪鶉在用異氰酸酯和苯并噻唑灌胃后低劑量組沒有明顯的中毒癥狀,但是在高劑量組幾分鐘內就出現肌肉震顫、羽毛聳立、頭部下垂等現象,日飲食量也有明顯的減少,體重在不斷下降。實驗結果表明,異氰酸酯和苯并噻唑的LD50值分別為27.4 mg·kg-1和36.8 mg·kg-1,參考《化學農藥安全評價實驗準則》的毒性分級標準[24],異氰酸酯和苯并噻唑對日本鵪鶉的急性經口毒性為高毒。二苯甲酮、1,2-苯并異噻唑-3-酮、2,4-二氯苯酚在上限劑量1 000 mg·kg-1時,日本鵪鶉都沒有出現死亡現象,屬于低毒性。
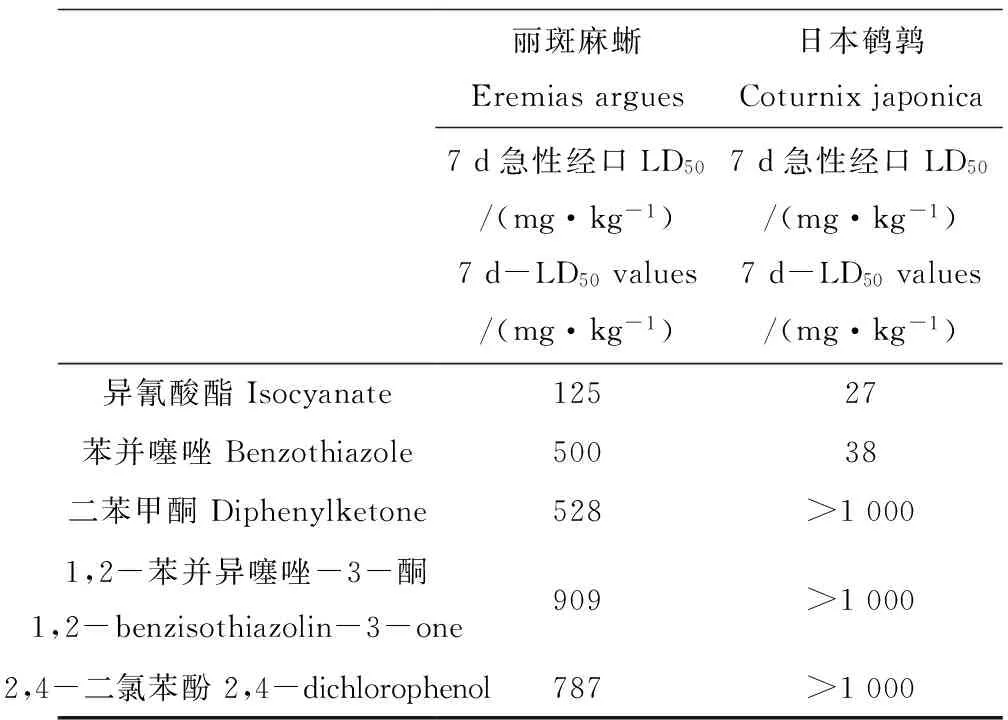
表1 5種化學品對麗斑麻蜥和日本鵪鶉的7 d-LD50值比較
3 討論(Discussion)
在陸生脊椎動物中,鳥類是重要的受試生物,在目前的化學品環境風險評價中仍以日本鵪鶉作為陸生脊椎動物的代表物種。然而,由于生物學特征存在種屬差異,化學品對于不同近緣種的毒性可能也存在差異,所以化學品對鳥類的毒性并不一定能夠真實地反映其對爬行動物造成的影響。近年來,隨著環境污染的加重,爬行動物數量在不斷減少,而化學品對爬行動物的影響卻遭到很多學者的忽視。目前,環境污染物對爬行動物的毒性測試還沒有建立標準方法。現在用于毒性研究的爬行動物主要有蛇、龜和蜥蜴等。但由于蛇和龜的體型較大、不易獲得和飼養等特點,不太適合作為毒性測試的模式生物。與之相比蜥蜴被認為是理想的受試生物來研究化學品對爬行動物的毒性。對蜥蜴進行毒物暴露的方式主要有經皮、經口灌胃和經口飼喂3種,根據定量的需要,以經口灌胃方式最為常用。本研究采用經口灌胃的暴露方式初步建立了麗斑麻蜥的急性毒性測試方法。
本研究對5種化學品進行了麗斑麻蜥和日本鵪鶉的急性毒性試驗。結果表明,日本鵪鶉對異氰酸酯和苯并噻唑的毒性反應敏感性明顯高于麗斑麻蜥,但是二苯甲酮、1,2-苯并異噻唑-3-酮和2,4-二氯苯酚對麗斑麻蜥的毒性明顯高于日本鵪鶉。同時有研究表明,菊酯類農藥作為一種神經毒性殺蟲劑對蜥蜴的急性毒性是鵪鶉的374.6倍[26]。環三亞基三硝胺(RDX)作為一種軍用高能炸藥,對美洲鶉的14 d-LD50為187 mg·kg-1是蜥蜴14 d-LD50的2.6倍[27-28]。蜥蜴對菊酯類農藥以及爆炸物RDX表現出更加明顯的敏感性。馬拉硫磷殺蟲劑對鵪鶉的半數致死劑量LD50為466.5 mg·kg-1,造成20%西部圍欄蜥蜴死亡的劑量為200 mg·kg-1,說明鵪鶉和蜥蜴對馬拉硫磷殺蟲劑的敏感性相當[29-30]。已有研究表明,苯并噻唑對小鼠的急性經口毒性為900 mg·kg-1,屬于中毒,該化學品對麗斑麻蜥的毒性反應敏感性高于小鼠。對水生生物來說,2,4-二氯苯酚對黑頭呆魚的96 h半致死濃度為8.3 mg·L-1,屬于中毒[31];對溞狀鉤蝦的半致死效應濃度為2.48 mg·L-1[32],屬于中毒。對于2,4-二氯苯酚的毒性效應,水生生物比日本鵪鶉更敏感。上述研究結果表明,對于相同的化學品,它們對不同的生物表現出不同的急性毒性效應。麗斑麻蜥和日本鵪鶉對相同化學品的毒性敏感性是存在差異的,由于爬行動物特殊的代謝系統和生理特征使得它們可能對化學品敏感性更強,因而更容易受到影響[21]。本研究進一步證明目前用化學品對鳥類的毒性來評價其對爬行動物的危害是不準確的,忽略了對爬行動物這一重大類群的毒性研究。因此,亟待開展化學品對爬行動物的環境風險評價研究。
面對化學品對爬行動物毒性數據較為缺乏的現狀,近幾年國內外選用本土蜥蜴物種進行爬行動物毒理學研究。對于我國而言,麗斑麻蜥作為本土爬行動物,已實現實驗室的規模化飼養,是爬行動物毒理學研究中的理想模式生物。在今后的研究中,我們需要繼續建立和完善麗斑麻蜥毒性測試方法,積累化學品對爬行動物的毒性數據,將爬行動物逐漸引入到化學品的毒性評價體系中。這是服務于化學品貿易中“綠色”技術壁壘的客觀要求,同時也對維持生態平衡以及保護物種多樣性具有重要意義。
通訊作者簡介:瞿唯鋼(1958),男,農藝師,主要從事農藥環境毒理研究與農藥登記管理。
[1]Vyas N B, Spann J W, Hulse C S, et al. Dermal insecticide residues from birds inhabiting an orchard [J]. Environmental Monitoring and Assessment, 2007, 133(1-3): 209-214
[2]Sparling D W, Linder G, Bishop C A, et al. Recent Advancements in Amphibian and Reptile Ecotoxicology [M]. Ecotoxicology of Amphibians and Reptiles, 2010: 1-11
[3]王瀛寰, 王會利, 張艷峰, 等. 爬行動物應用于毒理學研究的現狀[J]. 生態毒理學報, 2012, 7(6): 585-592
Wang Y H, Wang H L, Zhang Y F, et al. Appication of reptiles in toxicology research: A review [J]. Asian Journal of Ecotoxicology, 2012, 7(6): 585-592 (in Chinese)
[4]Gibbons J W, Scott D E, Ryan T J, et al. The global decline of reptiles, Deja Vu amphibians [J]. Bioscience, 2000, 50(8): 653-666
[5]Willingham E. Developmental and reproductive Effects [M]// Gardner S C, Oberd?rster E. eds. Toxicology of Reptiles. Taylor & Francis Group, LIC, 2006: 149-171
[6]McFarland C A, Quinn M J, Bazar M A, et al. Toxicity of oral exposure to 2,4,6-trinitrotoluene in the western fence lizard (Sceloporus occidentalis) [J]. Environmental Toxicology and Chemistry, 2008, 27(5): 1102-1111
[7]Bain D, Buttemer W A, Astheimer L, et al. Effects of sublethal fenitrothion ingestion on cholinesterase inhibition, standard metabolism, thermal preference, and prey-capture ability in the Australian central bearded dragon (Pogona vitticeps, Agamidae) [J]. Environmental Toxicology and Chemistry, 2004, 23(1): 109-116
[8]Wang Y H, Guo B Y, Gao Y X, et al. Stereoselective degradation and toxic effects of benalaxyl on blood and liver of the Chinese lizard Eremias argus [J]. Pesticide Biochemistry and Physiology, 2014, 108: 34-41
[9]Wang Y H, Yu D Y, Xu P, et al. Stereoselective metabolism, distribution, and bioaccumulation brof triadimefon and triadimenol in lizards [J]. Ecotoxicology and Environmental Safety, 2014, 107: 276-283
[10]Salice C J, Suski J G, Bazar M A, et al. Effects of inorganic lead on western fence lizards (Sceloporus occidentalis) [J]. Environmental Pollution, 2009, 157(12): 3457-3464
[11]Amaral M J, Bicho R C, Carretero M A, et al. The use of a lacertid lizard as a model for reptile ecotoxicology studies: Part 2-Biomarkers of exposure and toxicity among pesticide exposed lizards [J]. Chemosphere, 2012, 87(7): 765-774
[12]Rich C N, Talent L G. Soil ingestion may be an important route for the uptake of contaminants by some reptiles [J]. Environmental Toxicology and Chemistry, 2009, 28(2):311-315
[13]王瀛寰, 王會利, 張艷峰, 等. 全氟辛烷磺酸鹽PFOS替代品對中國白羽鵪鶉的毒性[J]. 生態毒理學報, 2012, 7(5): 537-541
Wang Y H, Wang H L, Zhang Y F, et al. Toxicity of alternatives of perfluorooctane sulfonate( PFOS) to Chinese recessive white feather quail [J]. Asian Journal of Ecotoxicology, 2012, 7(5): 537-541 (in Chinese)
[14]DuRant S E, Hopkins W A, Talent L G. Impaired terrestrial and arboreal locomotor performance in the western fence lizard (Sceloporus occidentalis) after exposure to an AChE-inhibiting pesticide [J]. Environmental Pollution, 2007, 149(1): 18-24
[15]Coppen G D A, Jepson P C. Comparative laboratory evaluation of the acute and chronic toxicology of diflubenzuron, hexaflumuron and teflubenzuron against II instar desert locust, (Schistocerca gregaria) (Orthoptera Acrididae) [J]. Pesticide Science, 1996, 46(2):183-190
[16]Aguilera C, del Pliego P G, Alfaro R M, et al. Pollution biomarkers in the spiny lizard (Sceloporus spp.) from two suburban populations of Monterrey, Mexico [J]. Ecotoxicology, 2012, 21(8): 2103-2112
[17]Wack C L, Fox S F, Hellgren E C, et al. Effects of sex, age, and season on plasma steroids in free-ranging Texas horned lizards (Phrynosoma cornutum) [J]. General and Comparative Endocrinology, 2008, 155(3): 589-596
[18]Cardone A, Comitato R, Angelini F. Spermatogenesis, epididymis morphology and plasma sex steroid secretion in the male lizard Podarcis sicula exposed to diuron [J]. Environmental Research, 2008, 108(2): 214-223
[19]Sample B E, Aplin M S, Efroymson R A, et al. Methods and Tools for Estimation of the Exposure of Terrestrial Wildlife to Contaminants [R]. Oak Ridge, Tennessee USA: Oak Ridge National Laboratory, 1997
[20]Trinchella F, Riggio M, Filosa S, et al. Cadmium distribution and metallothionein expression in lizard tissues following acute and chronic cadmium intoxication [J]. Comparative Biochemistry and Physiology C-Toxicology & Pharmacology, 2006, 144(3): 272-278
[21]Alexander G J, Horne D, Hanrahan S A. An evaluation of the effects of deltamethrin on two non-target lizard species in the Karoo, South Africa [J]. Journal of Arid Environments, 2002, 50(1): 121-133
[22]Amaral M J, Carretero M A, Bicho R C, et al. The use of a lacertid lizard as a model for reptile ecotoxicology studies - Part 1 Field demographics and morphology [J]. Chemosphere, 2012, 87(7): 757-764
[23]Weir S M, Talent L G, Anderson T A, et al. Unraveling the relative importance of oral and dermal contaminant exposure in reptiles: Insights from studies using the western fence lizard (Sceloporus occidentalis) [J]. Plos One, 2014, 9(6): e99666
[24]中華人民共和國國家質量監督檢查檢疫總局. GB31270—2014化學農藥環境安全評價試驗準則[S].北京: 中國標準出版社, 2015
[25]OECD. No.223, OECD Guidelines for the Testing of Chemicals: Avian Acute Oral Toxicity Test [S]. Paris, France: OECD, 2010: 24
[26]Weir S M, Suski J G, Salice C J. Ecological risk of anthropogenic pollutants to reptiles: Evaluating assumptions of sensitivity and exposure [J]. Environmental Pollution, 2010, 158(12): 3596-3606
[27]McFarland C A, Quinn M J, Bazar M A, et al. Toxic effects of oral hexahydo-1,3,5-trinitro-1,3,5-triazine in the western fence lizard (Sceloporus occidentalis) [J]. Environmental Toxicology and Chemistry, 2009, 28(5): 1043-1050
[28]Gogal R M, Johnson M S, Larsen C T, et al. Dietary oral exposure to 1,3,5-trinitro-1,3,5-triazine in the northern bobwhite (Colinus virginianus) [J]. Environmental Toxicology and Chemistry, 2003, 22(2): 381-387
[29]Mineau P, Baril A, Collins B T, et al. Pesticide acute toxicity reference values for birds [J]. Reviews of Environmental Contamination and Toxicology, 2001, 170: 13-74
[30]Holem R R, Hopkins W A, Talent L G. Effect of acute exposure to malathion and lead on sprint performance of the western fence lizard (Sceloporus occidentalis) [J]. Archives of Environmental Contamination and Toxicology, 2006, 51(1): 111-6
[31]Phipps G L, Holcombe G W, Fiandt J T. Acute toxicity of phenol and substituted phenols to the fathead minnow [J]. Bulletin of Environmental Contamination and Toxicology, 1981, 26(5): 585-593
[32]Ashauer R, Hintermeister A, Potthoff E, et al. Acute toxicity of organic chemicals to Gammarus pulex correlates with sensitivity of Daphnia magna across most modes of action [J]. Aquatic Toxicology, 2011, 103(1-2): 38-45
◆
Toxicity Assessment of Five Chemicals onEremiasargusandCoturnixjaponica
Chang Jing1, Yang Songlin1, Dai Xin1, Li Jitong1, Wang Huili1, Qu Weigang2,*
1. Research Center for Eco-Environmental Science, Chinese Academy of Sciences, Beijing 100085, China 2. Institute for Control of Agrochemicals, Ministry of Agriculture, Beijing 100125, China
1 February 2015accepted 3 June 2015
Toxicity effects of chemicals have rarely been evaluated in reptiles. In this study, the acute toxicity test method of native reptile-Eremias argus was established in order to evaluate the toxicity of chemicals to reptiles. Eremias argus were exposed to isocyanate, 1,2-benzisothiazolin-3-one, 2,4-dichlorophenol, benzothiazole and diphenylketone respectively in acute oral toxicity test. 7 d-LD50values of lizard were compared with avian model species-Coturnix japonica. According to the results, 7 d-LD50values of isocyanate and benzothiazole to E. argus were 125 mg·kg-1and 500 mg·kg-1while to C. japonica the values were 27 mg·kg-1and 37 mg·kg-1; 7 d-LD50value of 1,2-benzisothiazolin-3-one, 2,4-dichlorophenol and diphenylketone to E. argus were all greater than 1 000 mg·kg-1while to C. japonica the values were 909 mg·kg-1, 787 mg·kg-1and 528 mg·kg-1. The results showed that avian could not be used as surrogate species to reflect the chemical toxicity to reptiles exactly. The toxicity of chemicals to reptiles should be paid more attention. Using native lizard as model animal for reptile ecotoxicology studies will benefit the protection of native reptile species and maintain the ecological balance.
reptile; Eremias argus; Coturnix japonica; acute toxicity
國家自然科學基金(21477152, 21277163)
常靜(1990-),女,學士,研究方向為毒理學,E-mail: changjingforever@163.com;
Corresponding author), E-mail: quweigang111@163.com
10.7524/AJE.1673-5897.20150201001
2015-02-01錄用日期:2015-06-03
1673-5897(2015)6-276-05
X171.5
A
常靜, 楊淞霖, 戴欣, 等. 5種化學品對麗斑麻蜥和日本鵪鶉的毒性研究[J]. 生態毒理學報,2015, 10(6): 276-280
Chang J,Yang S L, Dai X, et al. Toxicity assessment of five chemicals on Eremias argus and Coturnix japonica [J]. Asian Journal of Ecotoxicology, 2015, 10(6): 276-280 (in Chinese)

