動態高壓微射流制備β-乳球蛋白納米乳液
蘇佳琪,何曉葉,高彥祥,袁 芳*
(中國農業大學食品科學與營養工程學院,教育部功能乳品重點實驗室,北京100083)
動態高壓微射流制備β-乳球蛋白納米乳液
蘇佳琪,何曉葉,高彥祥,袁芳*
(中國農業大學食品科學與營養工程學院,教育部功能乳品重點實驗室,北京100083)
該實驗以β-乳球蛋白為原料,利用動態高壓技術制備β-乳球蛋白納米乳液。以乳液粒度及其分布、電位為評價指標,確定最佳工藝條件(蛋白濃度、均質壓力、均質次數),并研究pH、溫度、離子強度、防腐劑等環境因素對乳液體系穩定性的影響。結果表明:β-乳球蛋白質量濃度1.0 g/100 mL、120 MPa高壓微射流均質3次為乳液制備的最適條件;乳液的粒徑普遍在200 nm左右,且粒徑分布較為集中,說明通過該法制備的乳液的均一性較高;該乳液對弱酸性及堿性、鹽離子濃度、熱及防腐劑均有較好的穩定性,表明β-乳球蛋白乳液具有較高的研究應用價值。
β-乳球蛋白;動態超高壓微射流;納米乳液;乳液穩定性
β-乳球蛋白(β-lactoglobulin,β-Lg)是由牛或其他哺乳動物的乳腺上皮細胞合成分泌的一種特殊的乳清蛋白,約占乳清蛋白總含量的50%[1]。天然的β-乳球蛋白是一種由162個氨基酸殘基組成、分子質量約為18.4 ku的球形蛋白[2],由9條反平行的β-折疊和一條α-螺旋組成[3],具有相對較大的、有序的二級結構和緊密的三級結構。獨特的空間結構賦予其特殊的理化特性,其等電點近似于5[4]。在中性的環境條件中,β-乳球蛋白帶負電荷,并且能夠通過非共價相互作用相結合以二聚體形式存在。β-乳球蛋白具有表面活性,能夠吸附在油-水界面形成單一界面層(厚度約為3 nm)[5],賦予乳液良好的穩定性。然而,β-乳球蛋白易受熱處理、堿性條件、高壓處理或金屬離子的影響而發生變性,其在食品工業中的應用受到嚴格限制[6]。
動態高壓微射流均質技術(dynamic high-pressure microfluidization,DHPM)是一種新興的物理改性技術。集輸送、混合、濕法粉碎、均質等多單元操作于一體[7],其原理是利用高速剪切、高頻振動、對流撞擊、瞬時壓力下降、空穴作用、短時超高壓處理和連續運轉的結合作用實現納米乳液的制備[8]。與傳統的高壓均質方式相比,微射流均質能夠使蛋白的結構和功能特性明顯變化,有效改善乳液的界面吸附特性,從而提高乳液的穩定性。
蛋白乳狀液可用于封裝、保護、傳送和釋放食品功能因子,且是當前研究的熱點[9]。本實驗以β-乳球蛋白為研究對象,利用動態高壓微射流技術探究乳液制備過程中的工藝條件以及pH值、溫度、鹽離子濃度、防腐劑等因素對乳狀液體系穩定性的影響,為β-乳球蛋白在乳狀液中的研究與應用提供理論依據。
1 材料與方法
1.1材料與試劑
β-乳球蛋白(純度>95%):美國DACISCO有限公司;芥花籽油:加拿大Harwell公司;苯甲酸鈉(食用級):北京華揚致成科技有限公司;氫氧化鈉、鹽酸、氯化鈉、磷酸二氫鈉、十二水合磷酸氫二鈉等試劑均為分析純:北京化工廠。
1.2儀器與設備
Ultra-turraxT25高速乳化剪切儀:德國IKA公司;M-110EH高壓微射流納米均質機:美國Microfluidics公司;Zetasizer Nano-ZS90激光粒度儀:英國Malvern公司。
1.3試驗方法
1.3.1β-乳球蛋白溶液制備
將β-乳球蛋白(β-Lg)以一定比例溶解于磷酸鹽緩沖液中,置于磁力攪拌器上攪拌4h,溶脹過夜,于4℃冰箱中儲存。
1.3.2β-乳球蛋白粗乳液制備
在高速乳化剪切儀的攪拌下將芥花籽油緩慢加入到上述溶液中,10 000 r/min剪切6 min,形成粗乳液。
1.3.3β-乳球蛋白納米乳液制備
將以上制備的粗乳液樣品通過動態高壓微射流納米均質機在不同均質條件下進一步處理,得到納米乳液。
1.3.4β-乳球蛋白納米乳液粒徑分析
將納米乳液用蒸餾水稀釋500倍,利用Zetasizer Nano-ZS90激光粒度儀在室溫條件下對乳液的粒徑大小及其分布狀況進行分析,經過120 s的平衡時間后采集測量數據,每個樣品進行3次平行測量,最終結果以平均粒徑(nm)和多分散系數(polydispersity index,PdI)表示。
1.3.5統計分析
實驗數據為3次平行測定的平均值。采用SPSS16.0軟件的One-Way ANOVA對數據在α=0.05水平下進行顯著性分析。
2 結果與分析
乳化過程分為兩個步驟:(1)液滴的變性和破壞,使乳液液滴的比表面積增加;(2)通過乳化劑防止液滴的重新聚集,穩定新界面。換而言之,最終的平均粒徑取決于液滴的破壞和再聚集行為[10]。利用動態高壓微射流制備的乳液是一種非熱力學穩定性體系,因此乳液液滴的尺寸在評價乳液的穩定性、外觀、質地、流變性和貨架期等特性方面意義重大[11]。平均粒徑能夠表征乳液液滴粒度大小的平均水平,多分散系數(PdI)則體現了乳液液滴粒徑的集中分布程度,PdI越小,表明粒徑分布越集中。
2.1不同蛋白質量濃度對納米乳液粒徑的影響
制備不同質量濃度β-乳球蛋白乳液,通過液滴平均粒徑的變化確定β-乳球蛋白作用的最適質量濃度,試驗結果如圖1所示。由圖1可知,隨著乳液中β-乳球蛋白質量濃度的增加(0.5~3.0 g/100 mL),乳液液滴的平均粒徑先降低后緩慢升高。當蛋白質量濃度為0.5 g/100 mL時,乳液液滴的平均粒徑最大,分析認為此時乳液中的蛋白質量濃度過低,即使全部吸附在油-水界面仍未能達到飽和,溶液中的小液滴因而發生聚合現象,形成粒徑較大的液滴。當質量濃度為1.0 g/100 mL時,液滴平均粒徑與多分散系數(PdI)同時達到最小值,表明在此條件下蛋白在液滴表面形成緊密的界面膜[12],乳液液滴粒徑相對較小(約為200nm)且其分布較為集中,此時乳液處于相對均一、穩定的狀態。當質量濃度從1.0 g/100 mL增加到3.0 g/100 mL時,液滴的平均粒徑具有緩慢上升的趨勢。說明隨著蛋白分子的不斷吸附,液滴間相對平衡的狀態被破壞,在此條件下,平均粒徑主要受均質條件而非乳化劑性能的影響[13],吸附在不同液滴上的蛋白分子的結合可能造成液滴之間的聚合從而導致總體系中平均粒徑的增大。綜合以上實驗結果,選擇質量濃度為1.0 g/100 mL的β-乳球蛋白乳液進行后續研究。
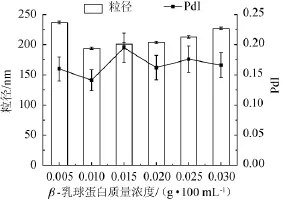
圖1 不同β-乳球蛋白質量濃度對納米乳液粒徑及多分散系數PdI的影響Fig.1 Effect of β-lactoglobulin concentration on the particle size and polydispersity PdI of nano-emulsion
2.2不同均質次數對納米乳液粒徑的影響
為了最大程度排除均質壓力的影響,針對不同均質次數對乳液影響的研究中選取了3個不同的壓力,實驗結果見圖2。結果表明:當壓力分別為60 MPa、100 MPa、140 MPa時,隨著均質次數的增加,乳液平均粒徑均呈現先下降后上升的現象,平均粒徑最小值均出現于第3次均質的過程中。而經過3次均質過程產生的乳液具有較低的PdI,表明經此條件制備的乳液穩定性最好。因此確定3次為乳液均質的最佳次數。當均質進行至第4次時,乳液的粒徑及相應PdI略有增加,推測可能由于均質過程中提供大量能量導致新液滴的快速重聚集,即“過處理現象”[14]。高頻的聚集現象和極高的能量密度是產生“過處理現象”發生的主要原因之一[15-16]。因此,在本實驗的后續研究中,對β-乳球蛋白乳液進行3次高壓微射流均質處理。
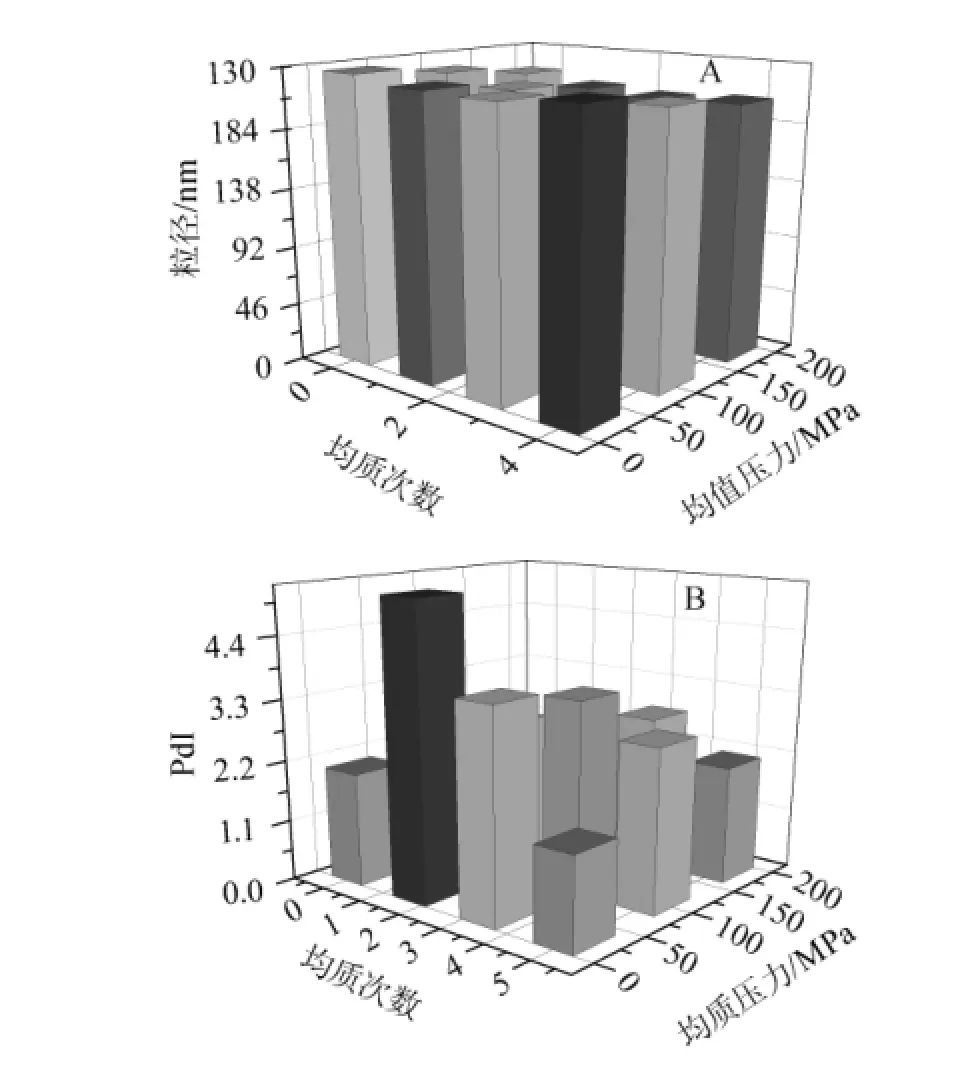
圖2 不同均質次數對納米乳液粒徑(A)及多分散系數PdI(B)的影響Fig.2 Effect of homogenization cycles on the particle size(A)and polydispersity PdI(B)of nano-emulsion
2.3不同均質壓力對納米乳液粒徑的影響
調節乳狀液的均質壓力分別為40 MPa、60 MPa、80 MPa、100 MPa、120 MPa、140 MPa,不同均質壓力對納米乳液粒徑的影響見圖3。
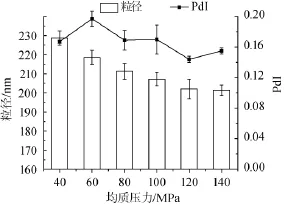
圖3 不同均質壓力對納米乳液粒徑及多分散系數PdI的影響Fig.3 Effect of homogenization pressure on the particle size and polydispersity PdI of nano-emulsion
由圖3可以看出,隨著均質壓力的升高,平均粒徑依次降低且逐漸趨于穩定。該現象表明一定范圍內提高均質壓力能夠有效提高均質效率。當均質壓力較小時,乳液雖然經過均質處理,但對油滴的破碎并不完全,因此無法達到較為理想的均質狀態;經過120 MPa均質處理后的乳液液滴平均粒徑達到最小值,說明在此壓力下,均質效果達到最佳;當壓力值超出該范圍時繼續提高壓力,不考慮乳化劑的添加量即β-乳球蛋白的濃度或其在均質室內乳化特性變化時[17],能夠觀察粒徑的持續降低現象,徑降低速度變緩,且維持在一個相對平衡的數值區域間(200~202 nm)。這與CHENG Q等[18]的研究結果一致:隨著處理壓力的增加,β-乳球蛋白的粒徑逐漸減小最終趨于平衡,這種現象可以歸因于均質室內對乳液液滴破壞性力量的增加。因此,本實驗選取120 MPa作為均質壓力條件進行后續研究中乳液的制備。
2.4不同pH環境對納米乳液粒徑的影響
存在于不同食品中的功能因子在加工過程中往往需要經歷不同的pH條件,人體胃腸道環境對功能因子的生物轉化率和吸收率也具有深遠的影響。因此,乳液穩定存在pH范圍的確定意義重大。根據上述實驗結果確定β-乳球蛋白乳液的最佳制備工藝為:蛋白質量濃度1.0 g/100 mL,120 MPa下均質3次。將制備好的乳狀液樣品分別調節pH至3、5、7、9、11,樣品在室溫條件下靜置過夜,利用激光粒度儀對乳液的粒徑及其多分散系數進行分析,結果如圖4所示。

圖4 不同pH環境對納米乳液粒徑及多分散系數PdI的影響Fig.4 Effect of pH conditions on the particle size and polydispersity PdI of nano-emulsion
由圖4可知,乳液粒徑在pH 5即β-乳球蛋白等電點時達到最大值,分析原因為在等電點時,蛋白質以兩性離子的形式存在,溶液中的總凈電荷為0,此時液滴間的電荷排斥作用達到最小,易發生聚集現象而形成較大的聚合體,因而平均粒徑達到最大值。液滴的多分散系數(PdI)也可佐證。PdI值為0.876,表明乳液中液滴粒徑分布極不均勻,大小不一,有的多個小液滴通過結合形成大液滴,有的仍以小液滴的形式存在,因此,在酸性食品體系中該乳液的穩定性較差。隨著環境pH的升高(7~11),乳液液滴的平均粒徑重新維持在200~210nm之間,且具有較低的PdI值,表明堿性條件對于高壓微射流制備的乳液幾乎沒有破壞能力。而隨著環境pH不斷擴大(3~11),Zeta-電位也可以提供乳液界面的組成信息[19]。對不同pH乳液的Zeta-電位進行分析,結果如圖5所示。
由圖5可知,發現乳液液滴帶有負電荷,且電位保持緩慢降低,然而并未觀察到沉淀或乳析現象,由此可見,通過本法制備的乳液在堿性條件下具有較高的熱力學穩定性。
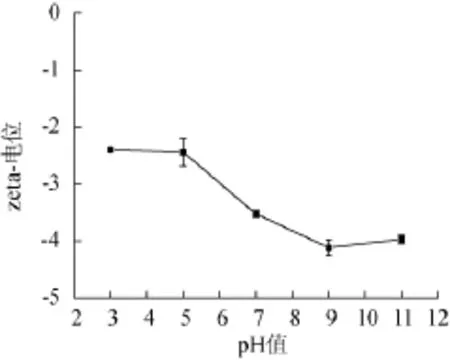
圖5 不同pH環境對納米乳液Zeta-電位的影響Fig.5 Effect of pH conditions on the Zeta-potential of nano-emulsion
2.5不同離子強度對納米乳液粒徑的影響
功能因子可能存在于具有不同鹽離子濃度的食品體系中。將制備好的乳液樣品分別調節體系離子強度至0.1 mol/L、0.15 mol/L、0.2 mol/L,室溫下靜置12 h。測定其粒徑及PdI,結果如圖6所示。
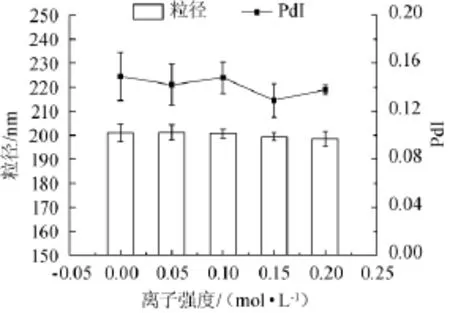
圖6 不同離子強度對納米乳液粒徑及多分散系數PdI的影響Fig.6 Effect of ionic strength on the particle size and polydispersity PdI of nano-emulsion
通常情況下,體系中的高離子強度會破壞蛋白質周圍的雙電層,導致蛋白質劇烈聚集,平均粒徑明顯升高[20]。由圖6可知,由β-乳球蛋白制備的乳狀液在一定離子強度范圍內,隨著離子強度的升高,粒徑及PdI基本保持不變。說明該乳液能夠在一個較為廣闊的鹽離子濃度范圍內保持相對穩定性。因此,該乳液能夠適用于不同離子強度的食品體系。
2.6不同溫度及防腐劑濃度對納米乳液粒徑的影響
將制備好的乳液樣品分別恒溫存放于20℃、40℃、60℃的條件下保持2 h,自然冷卻至室溫,靜止12 h后測量其粒徑及PdI的變化,結果如圖7所示。
由圖7可知,隨著處理溫度的升高,乳液的粒徑及PdI均無明顯變化,表明β-乳球蛋白乳液的熱穩定性較好,能夠耐受一定程度高溫的加工貯藏過程。
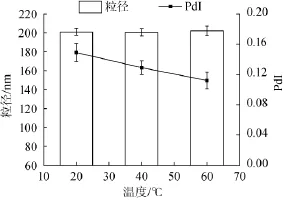
圖7 不同貯存溫度對納米乳液粒徑及多分散系數PdI的影響Fig.7 Effect of storage temperature on the particle size and polydispersity PdI of nano-emulsion
向制備好的乳液中添加不同濃度(0.01 mol/L和0.1 mol/L)的苯甲酸鈉,室溫存放12 h,通過激光粒度儀探究不同濃度的防腐劑的存在對于β-乳球蛋白體系穩定性的影響,結果如圖8所示。
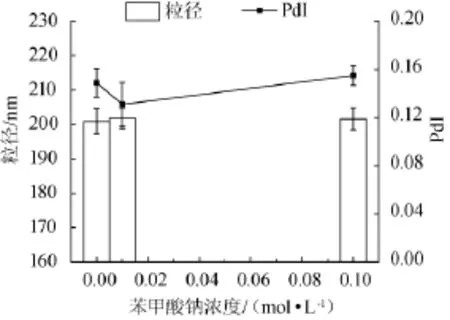
圖8 不同防腐劑濃度對納米乳液粒徑及多分散系數PdI的影響Fig.8 Effect of antiseptic concentration on the particle size and polydispersity PdI of nano-emulsion
由圖8可知,苯甲酸鈉的添加對β-乳球蛋白乳液的粒徑及PdI幾乎無影響。由此得出,該乳液對防腐劑的穩定性較好。
3 結論
采用動態高壓微射流方法制備β-乳球蛋白乳液,通過研究其粒徑及多分散系數(PdI)變化,確定β-乳球蛋白乳液的最佳制備工藝為:蛋白質量濃度1.0 g/100 mL;120 MPa下均質3次。乳液的粒徑普遍處于在200 nm左右,且粒徑分布較為集中,說明通過該法制備的乳液的具有較高的均一性;該乳液對弱酸性及堿性、鹽離子濃度、熱及防腐劑均有較好的穩定性,能夠滿足食品介質特性多樣化的需求。本實驗為β-乳球蛋白在乳狀液中的研究與應用奠定基礎;為實現功能因子穩態化及控制釋放提供思路;為推動天然食品乳化劑的發展貢獻力量。
[1]高學飛,王志耕.β-乳球蛋白應用研究進展[J].乳品工業,2005(5):41-44.
[2]BRAUTNIZER G,CHEN R,SCHRANK B,et al.Die sequenzanalyse des β-lactoglobulins[J].Biol Chem,1973,2:867-878.
[3]JIANG Z M,BRODKORB A.Structure and antioxidant activity of Maillard reaction products from alpha-lactalbumin and beta-lactoglobulin with ribose in an aqueous model system[J].Food Chem,2012,133(3): 960-968.
[4]YE A,SINGH H.Electrostatic interactions between lactoferrin and betalactoglobulin in oil-in-water emulsions[J].Food Colloids,2007,302: 167-175.
[5]LIVNEY Y D.Milk proteins as vehicles for bioactives[J].Curr Opin Colloid In,2010,15(1-2):73-83.
[6]TOBIAS S,URI L,JOCHEN W et al.Modulation of physicochemical properties of lipid droplets using β-lactoglobulin and/or lactoferrin interfacial coatings[J].Food Hydrocolloid,2011,25(5):1181-1189.
[7]鐘俊楨,劉成梅,劉偉,等.動態高壓微射流技術對乳清蛋白性質的影響[J].食品科學,2009,30(7):106-108.
[8]LIU W,LIU J H,XIE M Y,et al.Characterization and high-pressure microfluidization-induced activation of polyphenoloxidase from Chinese Pear(Pyrus pyrifoliaNakai)[J].J Agr Food Chem,2009,57(12):5376-5380.
[9]XU D X,YUAN F,GAO Y X,et al.Influence of whey protein-beet pectin conjugate on the properties and digestibility of β-carotene emulsion duringin vitrodigestion[J].Food Chem,2014,156:374-379.
[10]FLOURY J,DESRUMAUX A,AXELOS M.A.V et al.Effect of high pressure homogenisation on methylcellulose as food emulsifier[J].J Food Eng,2003,58(3):227-238.
[11]DAVID J C.Food emulsions,principles,practice,and techniques[M]. Boca Raton:CRC Press,2005.
[12]ESRA I.Rheological behavior of whey protein stabilized emulsions in the presence of gum arabic[J].J Food Eng,2002,52(3):273-277.
[13]JAFARI S M,ASSADPOOR E,HE Y H,et al.Re-coalescence of emulsion droplets during high-energyemulsification[J].Food Hydrocolloid,2008,22(7):1191-1202.
[14]SCHULZ M B,DANIELS R.Hydroxypropylmethylcellulose(HPMC)as emulsifier for submicron emulsions:Influence of molecular weight and substitution type on the droplet size after high-pressure homogenization[J].Eur J Pharm Biopharm,2009,49(3):231-236.
[15]JAFARI S M,HE Y,BHANDARI B.Effectiveness of encapsulating biopolymers to produce sub-micron emulsions by high energy emulsification techniques[J].Food Res Int,2007,40(7):862-873.
[16]JAFARI S M,HE Y,BHANDARI B.Optimization of nano-emulsions production by microfluidization[J].Eur Food Res Technol,2007,225(5):733-741.
[17]TCHOLAKOVA S,DENKOV N D,SIDZHAKOVA D et al.Interrelation between drop size and protein adsorption at various emulsification conditions[J].Langmuir,2003,19(14):5640-5649.
[18]CHENG Q,MCCLEMENTS D J.Formation of nanoemulsions stabilized by model food-grade emulsifiers using high-pressure homogenization:Factors affecting particle size[J].Food Hydrocolloid,2011,25: 1001-1008.
[19]XU D X,YUAN F,WANG X Y.The effect of whey protein isolate-dextran conjugates on the freeze-thaw stability of oil-in-water emulsions[J]. J Disper Sci Technol,2010,32(1):77-83.
[20]THEPKUNYA H,RUNGNAPHAR P,DAVID J C.Influence of pH and ionic strength on formation and stability of emulsions containing oil droplets coated by α-lactoglobulin-alginate interfaces[J].Biomacromolecules,2006,7(6):2052-2058.
Fabrication of β-lactoglobulin nanoemulsions by dynamic high-pressure microfluidization
SU Jiaqi,HE Xiaoye,GAO Yanxiang,YUAN Fang*
(College of Food Science&Nutritional Engineering,Key Laboratory of Functional Dairy,China Agricultural University,Beijing 100083,China)
Using β-lactoglobulin as material,nano-emulsion was prepared through dynamic high-pressure mucrofludization.Choosing emulsion particle size and its distribution,as well as zeta-potential as evaluation indexes,the optimal technological conditions(protein concentration,pressure and homogenization times)were determined,and the effect of pH,temperature,ionic strength and antiseptic on emulsion stability was studied.Results revealed that 1.0 g/100 ml of β-lactoglobulin,homogenized three times under the pressure of 120 MPa were the optimum conditions for emulsion formation.The particle sizes of emulsion were around 200 nm,and the distribution was relatively concentrated,which illuminated that emulsion formatted by this method had higher homogeneity.Besides,emulsion formatted by this process was provided with a good stability.The emulsion also showed good stability under weak acidity and alkalinity,high or low ionic strength,through heating,or adding antiseptic,which indicated that the β-lactoglobulin emulsion had high research and application value.
β-lactoglobulin;dynamic high-pressure microfluidization;nano-emulsions;emulsion stability
TS201.7
A
0254-5071(2015)10-0098-05
10.11882/j.issn.0254-5071.2015.10.022
2015-09-21
國家自然科學基金(31371836)
蘇佳琪(1993-),女,本科生,研究方向為食品添加劑。
袁芳(1967-),女,副教授,博士,研究方向為天然產物與功能食品。

