大孔樹脂法分離純化鎖陽總黃酮
張喜峰,羅光宏,王春暉*
(1.河西學院農業與生物技術學院,甘肅張掖734000;2.河西學院凱源生物技術開發中心,甘肅省微藻工程技術研究中心,甘肅張掖734000)
大孔樹脂法分離純化鎖陽總黃酮
張喜峰1,羅光宏2,王春暉1*
(1.河西學院農業與生物技術學院,甘肅張掖734000;2.河西學院凱源生物技術開發中心,甘肅省微藻工程技術研究中心,甘肅張掖734000)
為了分離、純化鎖陽總黃酮,比較了5種大孔樹脂的靜態吸附過程,篩選出了適合分離鎖陽總黃酮的樹脂。結果表明,AB-8樹脂對鎖陽總黃酮有較好的分離純化效果,其吸附過程可用Langmuir和Freundlich吸附等溫式來描述;吸附條件:溶液質量濃度3.9 mg/mL,pH值為5,吸附體積5 BV,流速2 BV/h,溫度25℃;洗脫條件:體積分數為60%乙醇洗脫體積5 BV,體積分數為70%乙醇洗脫體積10 BV,流速2 BV/h,鎖陽總黃酮純度由9.83%升高至67.8%,其回收率為84.02%。因此,AB-8大孔樹脂較適合分離純化鎖陽總黃酮。
總黃酮;大孔樹脂;鎖陽;分離純化
鎖陽(Cynomorium songaricumRupr.)是鎖陽科鎖陽屬的單科單屬單種植物,多寄生于蒺藜科(Zygophyllaceae)白刺屬(NatrariaL.)植物根部,是全寄生種子植物[1]。主要產于甘肅、新疆、青海、內蒙古等干旱沙漠地帶[2]。研究表明,鎖陽在防癌、抗癌、免疫調節、延緩衰老、防治心血管疾病、治療白細胞減少等方面也具有重要醫療價值[3]。近年來,鎖陽系列產品的研究開發已取得突破性進展,涉及到醫藥、食品、發酵等各個方面:鎖陽沖劑、鎖陽膠囊、鎖陽精、鎖陽茶、鎖陽飲片等,尤其是鎖陽保健酒、鎖陽啤酒、鎖陽保健飲料和鎖陽口服液的生產已實現了產業化。鎖陽黃酮類化合物主要為兒茶素(catechin)、柑桔素4′-0-吡喃葡萄糖及一種以柑桔素為苷元的配糖體。研究表明,黃酮類化合物有明顯的抗潰瘍、抗菌、抗炎、降血脂等藥用保健功能,能有效地清除自由基和脂質過氧化物,是一種具有廣泛開發前景的天然抗氧化劑[4-6]。黃酮的分離純化大多采用固-液萃取[7]、液-液萃取[8]、柱層析和高速逆流色譜等[9-11],這些方法存在效率低、周期長、無法用于工業大批量生產等問題。大孔樹脂利用樹脂與生物物質分子之間相互作用力,實現生化物質與大量雜質分離,采用適當洗脫劑進行洗脫過程[12],大孔樹脂可重復利用,成本較低。
本實驗是在篩選適宜的大孔樹脂基礎上,采用靜態和動態實驗摸索鎖陽黃酮分離純化的最適條件,為鎖陽深加工提取理論依據。
1 材料與方法
1.1材料與試劑
鎖陽由甘肅省微藻技術研發中心提供;選用鎖陽(Cynomorium songaricum)的干燥肉質莖,樣品于50℃干燥至質量恒定,粉碎,過40目篩,密封保存備用。
蘆丁對照品(純度≥98%),No.100080-200306:國藥集團化學試劑有限公司。所有試劑均為分析純。NKA-9、NKA、D101、AB-8、HPD-750型大孔樹脂5種樹脂型號與特性見表1。

表1 大孔樹脂的物理特性Table 1 Physical properties of macroporous resins
1.2儀器與設備
SP-721分光光度計:上海光譜儀器有限公司;RE-2000A旋轉真空蒸發器:河南鞏義金華儀器有限公司;GM-0.33A隔膜真空泵:深圳市瑞鑫達化玻儀器有限公司;BSD-YF2200立式雙層智能精密型搖床:上海西箭儀器設備有限公司。
1.3方法
1.3.1黃酮粗提物制備
稱取一定量鎖陽粉末,按照1∶50(g∶mL)料液比加入體積分數95%的乙醇,在60℃浸提2 h,3 000 r/min離心5 min,將上清液減壓濃縮、干燥后備用。
1.3.2總黃酮含量的測定
總黃酮含量的測定采用分光光度法。
蘆丁標準曲線的制備:稱取一定量蘆丁標準品,用體積分數50%乙醇溶液配制成黃酮質量濃度為1 mg/mL的乙醇溶液。分別精確吸0.1mL、0.2mL、0.3mL、0.4mL、0.5mL、0.6 mL于6個10 mL于棕色容量瓶中,加入質量分數5%亞硝酸鈉溶液0.3mL,混勻靜置6min,再加入10%硝酸鋁0.3mL,搖勻,靜置6 min,再加入4 mL質量分數為4%氫氧化鈉溶液,用水定容至刻度,靜置15 min,以試劑空白作參照,在波長510 nm處測吸光度值[13],以蘆丁含量(x)為橫坐標,吸光度值(y)為縱坐標,繪制蘆丁標準曲線,得回歸方程為:y=1.245x-0.002 4,相關系數R2=0.999 2。按照標準曲線回歸方程計算樣品中總黃酮含量。
1.3.3樹脂的預處理
用體積分數95%乙醇浸泡5種樹脂(NKA-9、NKA、D101、AB-8、HPD-750),傾去上浮的雜質,先用1 mol/L HCl浸泡12 h,用蒸餾水去酸,然后用1 mol/L NaOH溶液浸泡12 h,用蒸餾水去堿,抽濾,得抽干樹脂。
1.3.4不同樹脂靜態吸附量、解吸量和解吸率的測定
準確稱取抽干的5種樹脂各1 g。分別加入5.37 mg/mL鎖陽黃酮水溶液50 mL,置于25℃恒溫搖床以150 r/min振蕩24 h,測定鎖陽黃酮含量,分別按式(1)計算各種樹脂室溫條件下的靜態吸附量。再向已吸附完全的5種樹脂分別加入體積分數為70%乙醇溶液進行洗脫,以150 r/min搖床解吸12 h后,測定鎖陽總黃酮質量濃度,再根據式(2)、(3)計算解吸量和解吸率。最后選擇適合吸附鎖陽黃酮的樹脂。

式中:Qe為吸附量,mg/g;C0為初始質量濃度,mg/mL;Ce為平衡質量濃度,mg/mL;Vi為加入的原液體積,mL;W為樹脂用量,g;Qd為解吸量,%;D為解吸率,%;Cd為洗脫液質量濃度,mg/mL;Vd為洗脫液體積,mL。
1.3.5吸附液pH值的選擇
準確稱取抽干的樹脂1g于三角瓶中,分別加入不同pH值的鎖陽黃酮溶液,測定鎖陽總黃酮的靜態吸附量,選擇適合上樣的pH值。
1.3.6靜態動力學試驗
將篩選的1 g樹脂于三角瓶中,加入30 mL 5.37 mg/mL鎖陽黃酮水溶液,置于25℃恒溫搖床150 r/min振蕩12 h,每隔1 h測其總黃酮含量,利用式(4)計算吸附量,繪制靜態吸附動力學曲線。
1.3.7大孔樹脂吸附等溫線的制作
分別稱取預處理后樹脂1 g于三角瓶中,依次加入不同質量濃度的鎖陽黃酮溶液,分別在不同溫度(25℃、30℃、35℃)搖床振蕩150 r/min。待吸附飽和后,測其鎖陽總黃酮的質量濃度,計算其靜態吸附量;以樹脂吸附量和吸附平衡液相總黃酮質量濃度作圖,繪制不同溫度條件下吸附等溫線。用Langmuir公式和Freundlich[14]公式對鎖陽總黃酮的吸附等溫線進行擬合。
Langmuir等溫方程:

Freundlich等溫方程:

式中:Qe為吸附量,mg/g;Ce為平衡質量濃度,mg/mL;Qm為每克濕樹脂的最大吸附量,mg/g;KL為吸附平衡常數;KF、n為常數。
1.3.8大孔樹脂對鎖陽總黃酮的動態吸附、解吸實驗
取所選樹脂濕法裝柱(17mm×120mm),樹脂的柱體積(bed volume,BV)為10 mL,鎖陽總黃酮提取液以2.0 BV/h流速通過吸附柱,每隔1 BV測定流出液中總黃酮的質量濃度,繪制泄露曲線。上樣結束后用蒸餾水沖洗,以便洗下樹脂中未結合的的雜質。然后采用不同質量濃度的乙醇溶液以2.0 BV/h的速度洗脫層析柱,收集洗脫液,測定洗脫液中總黃酮純度,計算回收率。計算公式如下:

2 結果與分析
2.1樹脂靜態吸附試驗結果
2.1.1不同樹脂吸附量、解吸量和解吸率的測定

表2 不同樹脂的靜態吸附與解吸特性比較Table 2 Comparison of static adsorption and desorption characteristics of different resins
由表2可知,D101、AB-8和HPD-750型樹脂的吸附效果較好,吸附量分別96.9 mg/g、98.6 mg/g和84.3 mg/g。但D101、HPD-750的解吸量和解吸率較低,說明樹脂與鎖陽總黃酮結合能力較強,不利于總黃酮的洗脫;因此,選用AB-8大孔吸附樹脂來進行后續試驗。
2.1.2pH值對吸附的影響

圖1 鎖陽黃酮溶液pH值對吸附量的影響Fig.1 Effect of pH on the adsorption capacity
由圖1可知,酸性條件易于鎖陽黃酮的吸附。其原因可能是黃酮類化合物酚羥基在酸性條件下未解離,主要以范德華力與樹脂進行物理吸附。而在堿性條件下,以黃酮類化合物可能以解離形式存在,與樹脂吸附較難,因此選擇黃酮溶液pH值為5。
2.1.3AB-8大孔吸附樹脂的靜態吸附動力學過程
由圖2可知,隨著時間逐漸增加,AB-8樹脂對鎖陽黃酮吸附量逐漸上升,當吸附時間為6 h時,吸附達到最大值[15],隨后鎖陽黃酮吸附量趨于平衡。因此AB-8大孔吸附樹脂的靜態平衡吸附時間為6 h。
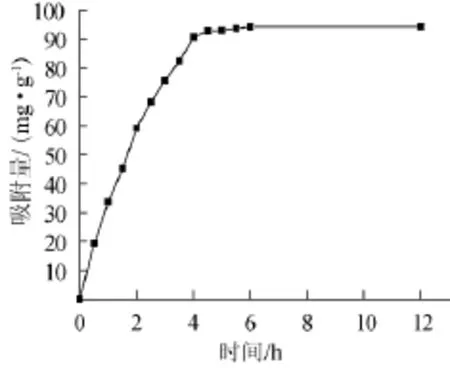
圖2 AB-8大孔吸附樹脂的靜態吸附黃酮動力學曲線Fig.2 Adsorption kinetics curve for the total flavonoids on AB-8 resin
2.1.4AB-8大孔吸附樹脂吸附等溫線的測定
分別在3種不同溫度下測量AB-8樹脂在不同質量濃度鎖陽黃酮溶液中(2.2 mg/mL、2.6 mg/mL、3.2 mg/mL、3.9 mg/mL、4.5 mg/mL)的吸附量,結果見圖3。由圖3可知,在質量濃度恒定條件下,溫度升高,吸附量反而降低,說明低溫條件利于進行吸附;因此,在實驗條件范圍內室溫更有利于吸附的進行。當鎖陽黃酮質量濃度為3.9 mg/mL時,AB-8樹脂對鎖陽黃酮吸附效果較好。所以后續試驗選擇鎖陽黃酮質量濃度為3.9 mg/mL上樣。

圖3 不同溫度下AB-8吸附水溶液中鎖陽總黃酮的吸附等溫線Fig.3 Adsorption isotherms of the total flavonoids fromC.songaricum in AB-8 resin aqueous solution at different temperature
吸附等溫線是表征不同物質吸附的特征曲線,Langmuir方程建立在單分子吸附基礎上,而Freundlich方程可闡述單層和多層吸附行為[16]。將不同溫度條件下測量AB-8樹脂在不同質量濃度鎖陽黃酮溶液中的吸附量,采用Langmuir和Freundlich方程擬合曲線,得到的方程參數見表3。
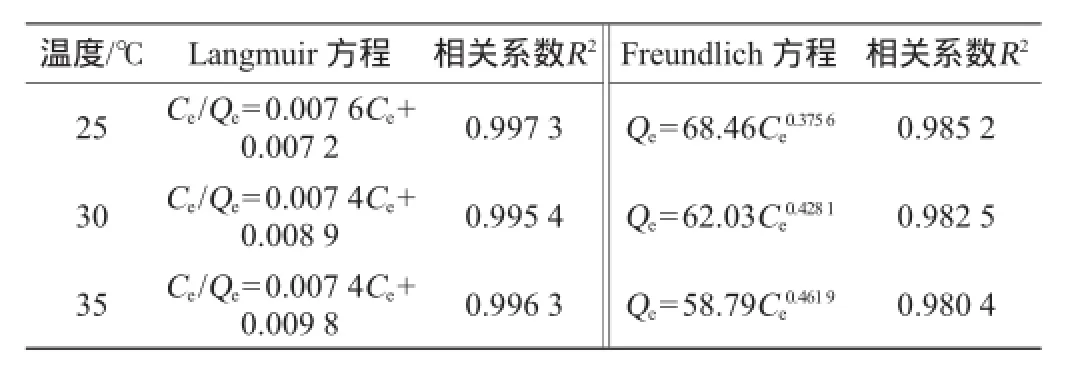
表3 兩種模型方程擬合結果及參數Table 3 The fitting results and parameters of two model equation
由表3可知,Langmuir相關系數R2比Freundlich相關系數要高,并且在25℃達到0.997 3,說明Langmuir模型更適用于分析AB-8樹脂吸附鎖陽黃酮。在Freundlich方程中1/n的值在0.1~0.5范圍內時,吸附較易進行,從表3可知,AB-8樹脂吸附鎖陽黃酮時的1/n值為0.3~0.5之間,說明該吸附反應較易進行。
2.2樹脂動態泄露曲線的測定
檢測了AB-8大孔樹脂的動態泄露曲線,每1 BV檢測一次流出液中的黃酮含量。由圖4可知,當流出液在6 BV之內,流出液中無黃酮露出,當流出液為8 BV時,流出液中黃酮含量快速增加。所以選擇最佳上樣體積為5 BV。

圖4 AB-8吸附鎖陽黃酮的動態泄露曲線Fig.4 Dynamic breakthrough curves of total flavonoids from C.songaricumby AB-8 resin
2.3AB-8樹脂動態解吸的測定
AB-8樹脂濕法裝柱,在最佳條件下上柱,先用5 BV蒸餾水以2 BV/h的體積流量除雜至流出液為無色,再依次用5 BV和10 BV一定體積分數的乙醇以2 BV/h的體積流量上柱洗脫,收集各洗脫液,檢測其中總黃酮含量,計算回收率,結果見表4。由表4可知,當體積分數為30%乙醇洗脫液上柱洗脫時,總浸膏量較多,但總黃酮不存在,說明總黃酮與樹脂之間吸附能力較強,當體積分數為60%~70%乙醇洗脫時,總黃酮純度較高。因此采用蒸餾水沖洗后,收集60%~70%的乙醇洗脫部分。

表4 不同洗脫劑對總黃酮解吸的影響Table 4 Effect of different eluent on the desorption of total flavonoids
2.4最佳工藝穩定性試驗
取3.9 mg/mL的鎖陽黃酮粗提液,以2 BV/h流速上樣,后續采用5 BV蒸餾水和體積分數為30%乙醇沖洗雜質,采用體積分數為60%乙醇5 BV洗脫,再用體積分數為70%乙醇10 BV洗脫,測定洗脫液中總黃酮含量,濃縮干燥,計算浸膏中總黃酮回收率。結果顯示鎖陽總黃酮純度由9.83%升高至67.8%,其回收率為84.02%。
3 結論
本實驗考察5種大孔吸附樹脂對鎖陽總黃酮進行靜態吸附、解吸篩選,結果表明AB-8樹脂具有較好靜態吸附及解吸效果。純化條件為取質量濃度為3.9 mg/mL的鎖陽黃酮粗提水溶液150 mL,2 BV/h流速上樣,體積5 BV;吸附平衡后,5 BV蒸餾水和5 BV體積分數為30%乙醇沖洗雜質;采用體積分數為60%乙醇5 BV洗脫,再用體積分數為70%乙醇10 BV洗脫,收集洗脫液濃縮、干燥,鎖陽黃酮提取液中總黃酮的純度由9.83%升高至67.8%,其回收率為84.02%。而張庭瑞等[17]采用AB-8樹脂純化鎖陽總黃酮時僅用體積分數為70%乙醇洗脫,回收率為64.88%。研究結果表明了AB-8大孔樹脂對鎖陽總黃酮是實際可行的,可為鎖陽總黃酮大規模純化提供理論依據。
[1]LIU G D,CHEN G L,LI W,et al.Genetic and phytochemical diversities ofCynomorium songaricumRupr.in northwest China indicated by ISSR markersandHPLC-fingerprinting[J].Biochem Sys Ecol,2013,48:34-41.
[2]ZHAO Z,DONG L,WU Y,et al.Preliminary separation and purification of rutin and querce Siebold extracts by macroporous resins[J].Food Bioprod Process,2011,89(4):266-272.
[3]JIN S W,CHEN G L,DU J J M,et al.Antioxidant properties and principal phenolic compositions ofCynomorium songaricumRupr[J].Int J Food Prop,2014,17(1):13-25.
[4]MA C M,NAKAMURA N,MIYASHIRO H,et al.Inhibitory effects of constituents fromCynomorium songaricumand related triterpene derivatives on HIV-1 protease[J].Chem Pharm Bull,1999,47(2):141-145.
[5]MA L J,CHEN G L,NIE L S,et al.Effect ofCynomorium songaricum polysaccharide on telomere length in blood and brain of D-galactose-induced senescence mice[J].Chin J Polym Chin Mater Med,2009,34(10):1257-1260.
[6]MA L J,CHEN G L,JIN S W,et al.The anti-aging effect and the chemical consttuents ofCynomorium songaricumRupr[J].Acta Hortic,2006,765:23-30.
[7]ZHENG L L,WANG D,LI Y Y,et al.Ultrasound-assisted extraction of total flavonoids fromAconitum gymnandrum[J].Pharmacogn Mag,2014,10(S1):S141-S146.
[8]SRINIVAS K,KING J W,MONRAD J K,et al.Pressurized solvent extraction of flavonoids from grape pomace utilizing organic acid additives[J].Ital J Food Sci,2011,23(1):90-105.
[9]YIN H,ZHANG S,LONG L,et al.The separation of flavonoids from Pongamia pinnatausing combination columns in high-speed counter-currentchromatographywithathree-phase solvent system[J].J Chromatogr A,2013,1315:80-85.
[10]GON?ALVES M S,VIEIRA I J C,OLIVEIRA R R,et al.Applicationof preparative high-speed counter-current chromatography for the separation of two alkaloids from the roots ofTabernaemontana catharinensis(Apocynaceae)[J].Molecules,2011,16(9):7480-7487.
[11]JIANG Z G,DU Q Z,SHENG L Y.Separation and purification of lentinan by preparative high speed counter current chromatography[J].Chin J Anal Chem,2009,37(3):412-416.
[12]YIN L,XU Y,QI Y,et al.A green and efficient protocol for industrial-scale preparation of dioscin fromDioscorea nipponicaMakino by two-step macroporous resin column chromatography[J].Chem Eng J,2010,165(1):281-289.
[13]KIM E J,LEE H J,KIM H J,et al.Comparison of colorimetric methods for the determination of flavonoid in propolis extract products[J].Korean J Food Sci Technol,2005,37(6):918-921.
[14]AFSAR M Z,HOQUE S,OSMAN K T.A Comparison of the Langmuir,Freundlich and Temkin equations to describe phosphate sorption characteristics of some representative soils of Bangladesh[J].Int J Soil Sci,2012,7(3):91-99.
[15]ZHANG Y,LI S F,WU X W,et al.Macroporous resin adsorption for purification of flavonoids inHouttuynia cordatathunb[J].Chin J Chem Eng,2007,15(6):872-876.
[16]FREUNDLICHHMF.Overtheadsorptioninsolution[J].J Phys Chem,1906,57(385):385-470.
[17]張庭瑞,李志忠.大孔吸附樹脂分離純化鎖陽總黃酮效果初探[J].草業科學,2011,28(8):1427-1429.
Separation and purification of total flavones fromCynomorium songaricumby macroporous resins macroporous resins
ZHANG Xifeng1,LUO Guanghong2,WANG Chunhui1*
(1.College of Agriculture and Biotechnology,Hexi University,Zhangye 734000,China;2.Microalgae Engineering Research Center of Gansu Province,Kaiyuan Bio-Tech Development Center,Hexi University,Zhangye 734000,China)
In order to isolate and purify the total flavonoids fromCynomorium songaricum,comparing with static adsorption process of 5 kinds of macroporous resins,and the suitable resin was determined.The results showed that AB-8 resin was the optimal due to its highest separation and purification of the total flavonoids fromC.songaricumand its adsorption process could be described by the Langmuir and Freundlich isotherms.The optimum adsorption conditions were solution concentration 3.9 mg/ml,pH 5.0,adsorbed volume 5 BV,flow velocity 2 BV/h,temperature 25℃.The optimum elution conditions were 60%ethanol 5 BV,70%ethanol 10 BV,flow velocity 2 BV/h.Under this condition,the content ofC.songaricum total flavonoids increased from 9.83%to 67.8%,and the recovery rate was 84.02%.AB-8 resin was suitable for the separation and purification of the total flavonoids fromC.songaricum.
total flavonoids;macroporous resins;Cynomorium songaricum;separation and purification
S567.9
A
0254-5071(2015)10-0106-05
10.11882/j.issn.0254-5071.2015.10.024
2015-09-02
河西學院科研創新與應用校長基金項目(No.XZ2014-29);甘肅省中小企業創新基金項目(1047GCCG001)
張喜峰(1982-),男,講師,碩士,研究方向為天然產物分離純化。
王春暉(1977-),男,講師,本科,研究方向為食品化學。

