作物脂肪氧化酶的研究進展
扎 桑 卓 嘎 徐東東 張利莎, 董國清 袁興淼 張 京 郭剛剛*
(1.西藏大學農牧學院,西藏林芝860000;2.農業部作物種質資源與生物技術重點開放實驗室/國家農作物基因資源與基因改良重大科學工程/中國農業科學院作物科學研究所,北京100081;3.武漢輕工大學生物與制藥工程學院,湖北武漢430023)
作物脂肪氧化酶的研究進展
扎桑1,2卓嘎1*徐東東2張利莎2,3董國清3袁興淼2張京2郭剛剛2*
(1.西藏大學農牧學院,西藏林芝860000;2.農業部作物種質資源與生物技術重點開放實驗室/國家農作物基因資源與基因改良重大科學工程/中國農業科學院作物科學研究所,北京100081;3.武漢輕工大學生物與制藥工程學院,湖北武漢430023)
脂肪氧化酶及其代謝產物參與作物生長發育的多個階段,同時還參與介導損傷反應及病原菌防御性反應。此外,作物脂肪氧化酶作為影響食品風味和商品品質的關鍵因素,直接影響作物食品的生產加工工藝和貨架壽命。然而由于不同脂肪氧化酶家族成員在脂質代謝中所起作用有所不同,使得育種家針對特定育種目標開展定向遺傳改良成為可能。因此,本文對脂肪氧化酶參與的生化途徑、脂質代謝主要產物的生理功能及其對作物品質性狀的影響,以及作物脂肪氧化酶性狀改良的育種實踐、研究進展等進行了綜述。
作物脂肪氧化酶;LOX途徑;品質;抗逆性;遺傳改良
脂肪氧化酶(lipoxygenase,LOX;EC1.13.11.12)在植物[1-5]、動物[6-7]以及微生物[8-10]中普遍存在,是一類含非血紅素鐵的蛋白酶家族,主要通過催化多元不飽和脂肪酸發生雙加氧反應生成脂肪酸氫過氧化物,再經一系列不同酶的作用,最終生成具有一定生理功能的小分子醛、醇和酮等代謝產物,從而在農作物產品風味形成、營養生長、損傷反應、防御反應和抗逆性等諸多方面產生重要影響。本文對脂肪氧化酶及其代謝產物參與的生化途徑、生理功能、對作物品質性狀的影響,以及農作物相關性狀改良的利用實踐等方面的研究進展進行了綜述。
1 脂肪氧化酶的生化途徑
早在1932年,Andre和Hou首次在大豆中發現了脂肪氧化酶[11],隨著植物中越來越多的脂肪氧化酶成員的發現和深入研究[12-16],目前對于脂肪氧化酶途徑(簡稱LOX途徑)已有明確認識。LOX途徑是指脂肪氧化酶專一性催化含有(Z,Z)-1,4-戊二烯結構的多不飽和脂肪酸(Polyunsaturated fatty acid, PUFA)生成氫過氧化物,再經一系列不同酶的作用,最終生成具有一定生理功能的化合物的過程。在高等植物體內,LOX途徑主要是以亞油酸(linoleic acid,18∶2)和亞麻酸(α-linolenic acid,18∶3)等非飽和十八碳酸為初始底物[17],因此又稱十八碳酸途徑。由于亞油酸等初始底物是由甘油酸經脂酶或水解酶水解而來,因此廣義上的LOX途徑還包括甘油酸的水解過程,而狹義上的LOX途徑則是從脂肪酸氧化開始。此外,由于脂肪氧化酶催化的加氧反應可發生在戊二烯結構的任一端,根據專一性催化PUFA碳鏈骨架位置的不同(C-9/C-13),可將脂肪氧化酶分為9-LOX和13-LOX,而一些脂肪氧化酶能夠同時地催化兩個位點的氧化反應,分別產生9-和13-氫過氧化物(HPOD/HPOT)。目前作物中已研究明確的脂肪氧化酶中,大豆和水稻的L-1、大麥的LOX2/LoxC、玉米的ZmLOX10/11以及豌豆的LOX1∶Ps∶1等都屬于13-LOX;水稻的L-3、大麥的LOX1/LoxA以及玉米的ZmLOX1/3/4/5等則屬于9-LOX;而大豆的L-2/L-3和水稻的L-2等則屬于具有雙位點催化活性的9-/13-LOX(表1)[18-20]。
PUFA經9-LOX和13-LOX催化產生的氫過氧化物在下游過氧化物裂解酶(Hydroperoxide Lyase,HPL)、乙醇脫氫酶(Alcohol dehydrogenase,ADH)、異構酶(Isomerase,ISO)和醇酰基轉移酶(Alcohol acyltransferase,AAT)等一系列酶作用下進一步轉化為各種烯醛和烯醇類化合物。另一方面,13-HPOT在AOS(Allene oxide synthase)和丙二烯氧化物環化酶AOC(Allene oxide cyclase)等酶以及多步β-氧化(β-oxidation)作用下生成植物內源性激素茉莉酸(Jasmonic acid)(圖1)[15,21-22]。
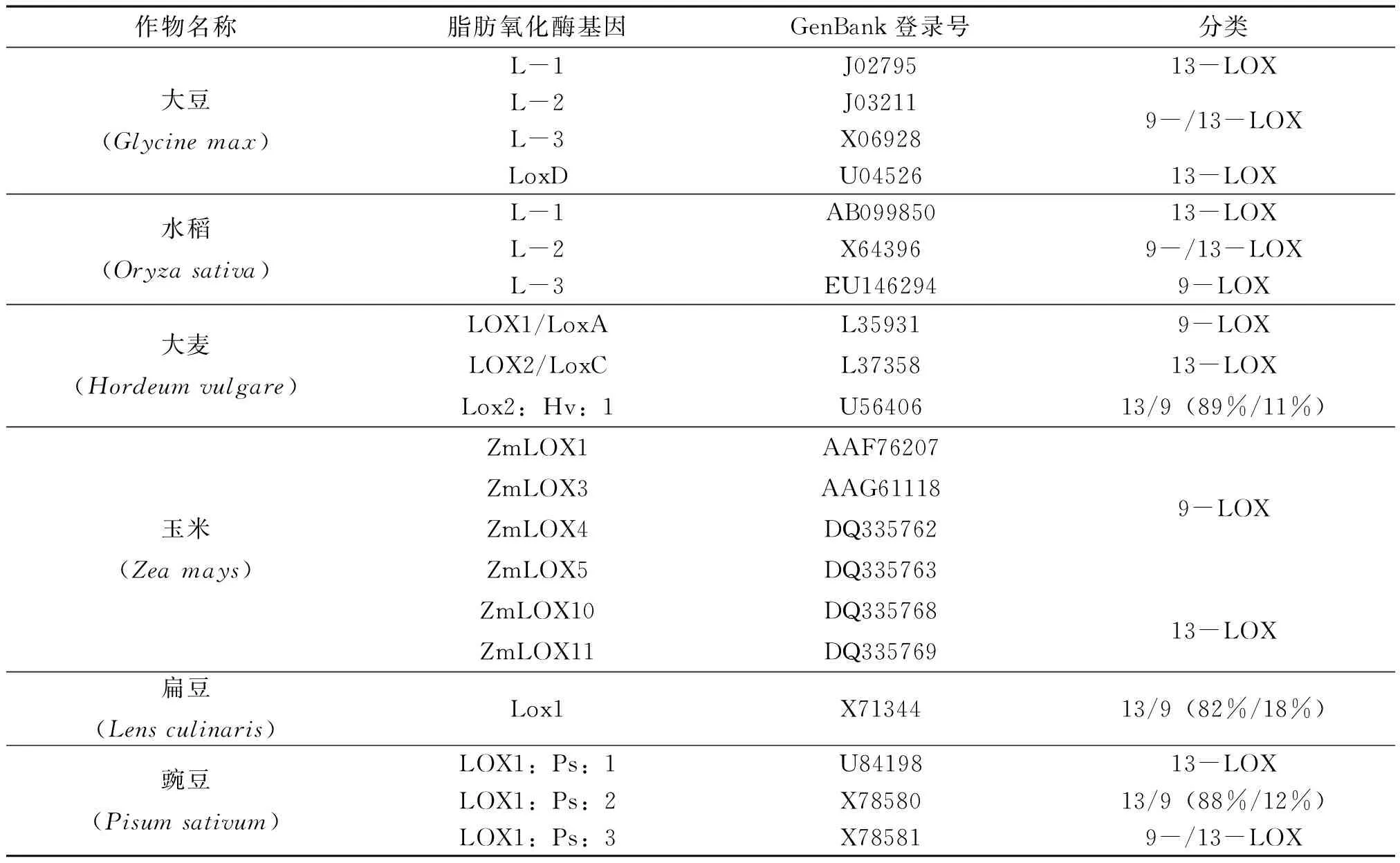
表1 作物脂肪氧化酶及其分類
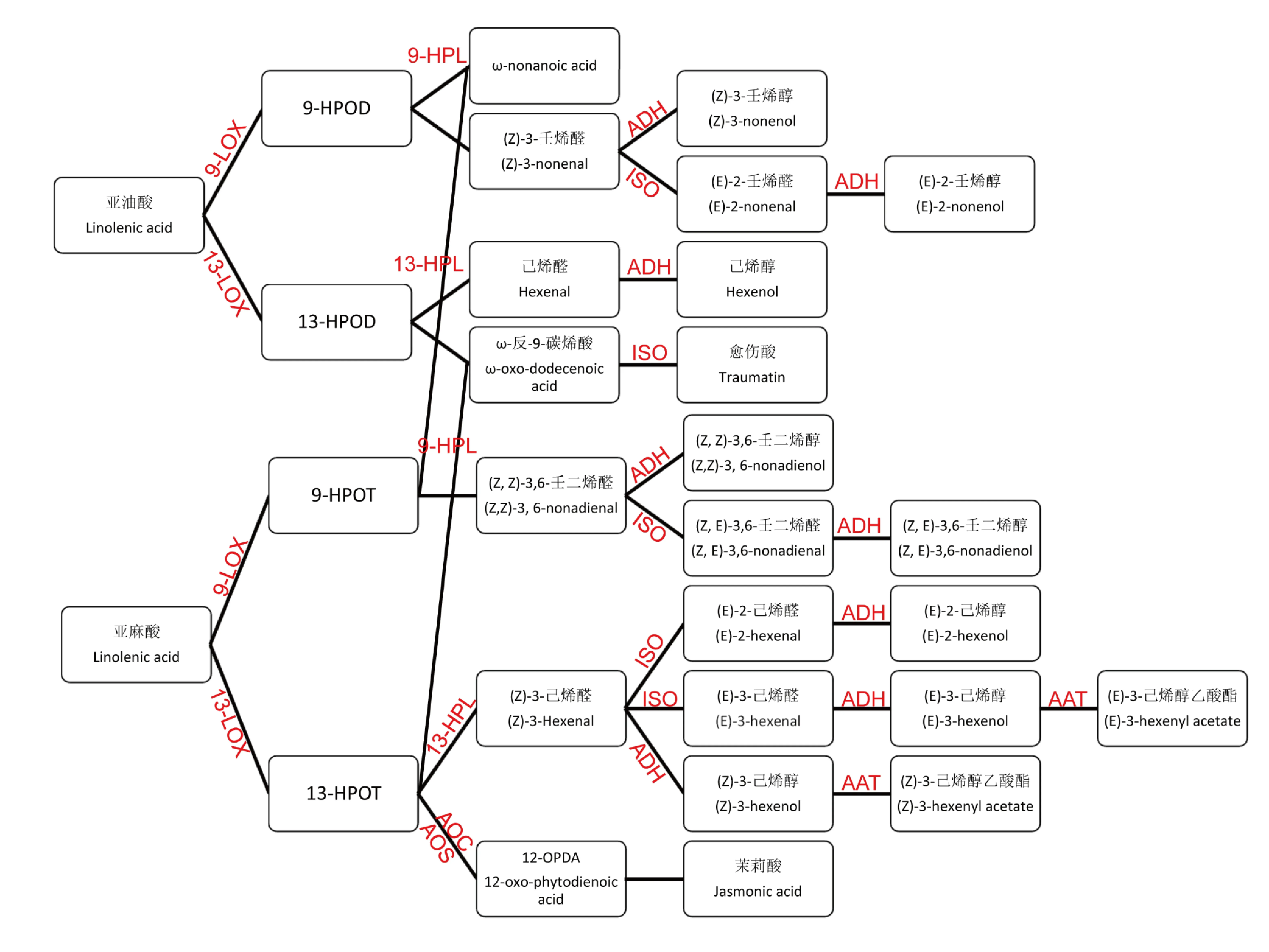
圖1 脂肪氧化酶(LOX)代謝生化途徑
注:LOX: Lipoxygenase; HPL: Hydroperoxide Lyase;AOS: Allene oxide synthase;AOC: Allene oxide cyclase;ISO: Isomerase;ADH: Alcohol dehydrogenase;AAT: Alcohol acyltransferase.
2 脂肪氧化酶及其代謝產物的生理功能
作物中的LOX不僅可作為營養器官貯藏蛋白(Vegetative storage protein, VSP)參與脂類遷移,以及調節“源”與“庫”的分配[23-24],而且LOX生化途徑所產生的代謝產物(統稱為脂氧化物,Oxylipin)參與作物生長發育的各個階段,參與的生理過程涉及植株生長發育和成熟衰老[17, 25]、機械損傷反應[26- 27]、介導病原菌防御性反應,并在影響食品風味及品質等方面起著非常重要的作用[16](表2)。

表2 LOX途徑脂氧化物的主要生理功能
2.1影響植株生長發育和成熟衰老
在作物種子尤其是含油種子萌動過程中,LOX啟動脂肪體中儲藏的脂肪酸氧化,且高活性脂肪氧化酶加速細胞膜的破壞,使得氧化的脂肪酸很容易地從脂肪體解離,進而釋放到胞液中以實現營養分配。因此,在植株幼嫩部位和快速生長的組織中脂肪氧化酶的活力一般較高,促進貯藏養分向正在發育的幼胚運輸[28]。另一方面,LOX途徑產生的茉莉酸能夠通過反饋抑制脂肪氧化酶的活性和脂質降解等來抑制種子萌發,這對于保障作物種子避開不利的環境條件,在適宜條件下萌動可能起著至關重要的作用[29-31]。
另外,在植物生長發育過程中,脂肪酸的過氧化物可以使蛋白質失活、葉綠體的光化學反應失活并破壞細胞膜的結構,這樣促進了植物的衰老過程。茉莉酸促進乙烯合成、葉片衰老、葉片脫落、氣孔關閉、呼吸作用。
2.2參與機械損傷反應
植物葉片受到昆蟲取食以及機械損傷時,脂肪氧化酶轉錄水平和蛋白活性均會迅速增強,從而促進損傷誘導的脂氧化物生成。研究表明,13-LOX途徑的代謝產物與植物對蟲害的趨避反應有密切關系[32-33]。其中過氧化物和己醛等還對害蟲有驅除作用[34];愈傷酸(12-oxo-10(E)-dodecenoic acid, Traumatin)能夠促進損傷傷口的愈合,促進茉莉酸和12-氧-植物二烯酸(12-oxo-phytodienoil acid,12- OPDA)等損傷信號分子的含量增加,以及誘導防御性綠葉揮發物(Green leaf volatiles,GLVs)的大量產生[35-36],如Hildebrand 等發現 (Z)-3-己烯醇對蚜蟲有趨避作用[37]。反-2-己烯醛的釋放則能夠誘導HMGR和LOX 等防御基因的表達[38];而缺乏茉莉酸合成或感知的擬南芥植株對損傷和昆蟲的侵害反應遲鈍[39- 40]。由此可見,損傷反應誘導的LOX途徑能夠通過產生脂氧化物等損傷相關信號分子,促進傷口愈合以及吸引植食性昆蟲的捕食性天敵和寄生性天敵,從而幫助植物直接或間接抵御包括昆蟲取食在內的機械損傷[41-43]。
2.3介導病原菌防御性反應
許多植物的LOX 基因在病原微生物(如細菌、真菌、病毒等)的傷害誘導下表達,且LOX活性增加與細胞的物理傷害伴隨發生,導致局部細胞死亡,使植物抗性增強[44- 45]。例如,煙草病原菌Phytopathoraparasitica可以誘導LOX 在煙草葉片表達并產生過敏性細胞死亡[46];水稻稻瘟病菌侵染可以誘導LOX 的表達[47];小麥非親和性銹病病原菌侵染后28h也能夠檢測到LOX活性增加[48]。在病原菌感染后,擬南芥中LOX1 mRNA水平增加了約6倍[49]。此外,在抗病性和敏感性的植物品系中,LOX對病原菌入侵反應產生的反應并不相同。如在抗病性的燕麥品系中,冠銹病菌Pucciniacoronata的侵入會伴隨出現LOX活性的增加,但在敏感型品系中LOX活性則無變化[50]。
2.4對食品風味和品質的影響
大量研究表明,作物中的LOX途徑所產生的醛類和醇類等揮發性代謝產物不僅在參與損傷反應和昆蟲趨避方面起作用,而且在食品風味形成、加工儲藏過程中的品質變化以及最終形成的商品品質和貨架壽命等方面有著更為關鍵的作用。在食品風味形成過程中,脂肪氧化酶途徑依賴LOX和HPL通過降解PUFA所產生的揮發性代謝產物賦予了果實成熟所特有的風味。青葉醇(Z)-3-己烯醇)和青葉醛(E)-2-己烯醛)等是植物葉片呈現強烈青草香氣的主要物質,13-HPL是這一生化途徑中的關鍵酶。
在油料作物和糧食作物的貯藏和加工過程中,豆制品的豆腥味,稻米的哈喇味以及人們常說的“陳芝麻爛谷子”等酸敗氣味等都是脂質代謝產物作用的結果,不僅如此,PUFA的氧化還導致食品的營養品質和商品品質降低。
研究發現,LOX在大豆成熟種子中的含量占種子蛋白質含量的1%~2%,所催化產生的過氧化氫衍生物直接與食品中的蛋白質和氨基酸結合,不僅破壞了人體必需脂肪酸,還產生豆腥味和苦澀味,降低了大豆食品的營養價值和商品品質[51-52]。與大豆類似,花生、玉米在儲藏過程中品質下降主要包括脂質體的溶合、細胞膜完整性下降、透性增加、細胞溶質功能喪失、貯藏物質和維生素等主要成分的改變以及種子活力和發芽力的降低,關鍵原因之一也是由于脂肪氧化酶參與了所貯藏的脂肪酸的氧化代謝[53- 54]。
不僅如此,脂質降解還是導致谷物貯藏期間產生陳味、品質變劣的主要原因。與油料作物相比,盡管水稻、大麥和小麥等糧食作物種子中的脂質含量僅占2%~3%,但脂肪氧化酶活性與這些谷物的耐儲藏性密切相關。在水稻中,脂質代謝不僅產生了揮發性的己醛、戊醛和戊醇等與稻米陳化變質有關的陳米味,而且由于脂氧化物、活性氧和自由基等具有高度的氧化活性,還可能直接參與稻谷中的貯藏蛋白的分子內和分子間二硫鍵氧化交聯,影響其結構和功能,同時也可能與氨基酸和維生素相結合,不僅導致大米酸度增加食味變差,食用和營養價值降低甚至不能食用,而且導致陳化稻谷表現出發芽率下降或喪失[55-57]。
大麥麥芽是生產啤酒的主要原料,脂肪氧化酶活性也是影響大麥儲藏啤酒風味特性的重要因素之一。通過降低脂肪氧化酶活性可以延長大麥的儲藏期及其啤酒風味穩定性。在啤酒加工儲藏過程中,LOX作用于亞油酸所產生和積累的9-HPOD在HvHPL等酶的進一步作用下轉化為T2N(E)-2-壬烯醛)和三羥基十八碳酸(THODs),其中T2N已明確為啤酒老化物質,是啤酒產生“硬紙板味”的關鍵性脂質代謝產物,而三羥基十八碳酸能夠對泡沫穩定性和啤酒風味產生不良影響。
在小麥中,LOX低活性或缺失品種中,脂質氧化反應有效減輕,從而減輕了小麥籽粒的氧化變質,延長其儲藏期,減少糧食浪費[58]。同時,LOX活性與普通小麥食品的風味和外觀品質也有著密切關系。硬粒小麥的LOX活性與意大利面條的亮黃色呈顯著負相關[59-60],而普通小麥中提高脂肪氧化酶活性有助于提高小麥結構中麥谷蛋白交聯和氧化作用,從而改善中國食品的面粉顏色和面團流變學特性;新磨制的小麥面粉因含類胡蘿卜素而呈淡黃色,利用摻入適量的LOX活性高的大豆粉能偶聯氧化類胡蘿卜素進行漂白的特點來漂白面團,可作為生物增白劑的主要來源替代化學漂白劑,不僅提高了食品的安全性,同時也提高了其商品及加工品質[61- 62]。
3 作物脂肪氧化酶性狀改良及育種應用
從LOX途徑催化反應的特異性中我們也可以看出,作物中多個脂肪氧化酶基因之間存在功能分化。如玉米[63]和水稻[64]中LOX1和LOX2的缺失對延緩種子陳化變質、保持種子活力等方面起著重要作用,而LOX3的缺失則能夠減輕倉儲害蟲危害。在大麥中發現的3個LOX基因中[65-68],僅有LOX1參與的9-HPOD代謝被確認是影響啤酒品質的關鍵因素[69]。
對不同作物而言,脂肪氧化酶活性的影響因素也有所不同。LOX活性與基因型[70]、底物、酶抑制劑[71]、還原劑、金屬離子、溫度、酸堿度等反應條件以及各種生理生化因素關系密切[72],同時還與種子發育成熟度、含水量、儲藏條件以及加工工藝[73]等有關,但不同基因型間差異尤為顯著,說明遺傳因素是決定作物LOX結構和活性的首要因素[74]。因此通過遺傳改良,提高儲藏種子的活力和保證作物的商品品質成為作物品質育種的重要目標之一。目前主要通過篩選特定的脂肪氧化酶活性差異的種質,并通過遺傳和生化分析發掘功能性分子標記開展輔助育種,此外還通過基因工程手段直接開展作物脂肪氧化酶的性狀改良。
3.1脂肪氧化酶活性差異的種質資源篩選
鑒于脂肪氧化酶對于作物品質和儲藏特性的影響,過去30多年中,世界上眾多科研團隊在各主要作物中開展了脂肪氧化酶活性差異種質的篩選,對相關種質中發掘出的具有商業價值的基因資源進行了專利保護,并在生產上廣泛用于育種實踐。
大豆中,Hildebrand和Hyowitz等[75]從6499份大豆資源中篩選出2份LOX1缺失的種質;隨后, LOX3[76-77]和LOX2[78-79]缺失的種質也相繼被發掘;在此基礎上一批LOX活性全缺失的種質被相繼創制出來,與普通大豆品種相比,3個LOX功能全部缺失的大豆產量并未降低,蛋白質和氨基酸等營養成分沒有損失;但豆腥味降低甚至消失,不僅不再需要進行脫腥處理,而且VE含量提高,口感和風味更好[80-83]。此外,LOX活性缺失的水稻種質[64,74, 84]、大麥種質也相繼從種質資源[85-86]以及人工誘變產生的突變體中(專利US7420105 B2)篩選出來,其中Guo等[87]從1083份中國大麥種質中篩選出4份源于黃河中下游地區的LOX1活性缺失的種質,發現該基因第二內含子中的一個SNP變異導致內含子轉錄剪接位點改變是引起其活性喪失的根本原因。
3.2功能標記發掘及分子輔助育種
隨著遺傳學研究的深入和分子標記技術的發展,確定導致基因功能改變的基因座以及相應的功能位點,根據不同的育種目標,開發特異性分子標記,并將其用于與常規雜交選育相結合的分子輔助育種,已經成為當前育種的新常態。段紅梅等[88]利用SSR 標記進行遺傳背景分析,明確了大豆SSR標記輔助背景選擇時適宜的標記數目和選擇方式,獲得進一步回交的魯豆4 號的缺失株系,從而加速培育魯豆4號脂肪氧化酶活性缺失近等基因系。孫君明等[89]以大豆脂肪氧化酶缺失近等基因系Century為材料,篩選出數個與大豆LOX1 缺失基因連鎖的RAPD 標記,提供了以Century近等基因系為遺傳背景的大豆脂肪氧化酶育種的可靠標記。在水稻中,與LOX 缺失同功酶 LOX1、LOX2和LOX3連鎖的RAPD分子標記被用于耐儲藏水稻品種的分子標記輔助選擇[ 90-91]。小麥中,LOX活性相關功能標記也被開發用于分子輔助育種[58]。在大麥中,針對脂肪氧化酶突變位點的共顯性分子標記被開發出來,并用于分子標記輔助的高品質啤酒大麥新品種育種[85, 87]。對育成的LOX1活性缺失啤酒大麥的釀造實驗結果表明,其風味穩定性更好、老化物質含量更低,而且貨架期顯著延長。
3.3遺傳轉化與轉基因育種
利用轉基因技術對控制作物品質形成關鍵基因進行定向操作,可大大加速作物育種進程。目前,在作物脂肪氧化酶基因的遺傳轉化方面也取得了相關研究進展。Sharma等[92]通過粒子轟擊的方法將編碼大麥LOX100(Lox2:Hv:1)蛋白基因轉入大麥幼胚中,再生植株中葉綠體和細胞質中均有LOX表達,并發現了LOX衍生物含量較高的轉基因植物。隨后,又通過基因槍法首次獲得過表達13-LOX的轉基因大麥,并研究了LOX蛋白與植物衰老之間的聯系[93]。馬建等[94]通過花粉管通道法將脂肪氧化酶基因RNAi表達載體導入大豆,抑制了大豆籽粒中脂肪氧化酶基因表達,其脂肪氧化酶含量比對照平均降低55%~77%,而轉基因植株脂肪含量得到提升,最高達到24.76%。在水稻中,為獲得耐儲藏的水稻轉基因株系,李俊卿等[95]用農桿菌介導法將脂肪氧化酶基因的RNAi表達載體轉化到水稻愈傷組織中,得到可抑制LOX基因正常表達的陽性轉基因水稻幼苗。許惠濱等[96]通過農桿菌介導法,將反義lox-3基因導入秈型恢復系“航1號”中,從轉基因植株中篩選出脂肪氧化酶低表達的株系。劉振華等[97]對轉入小麥中的脂氧合酶基因的外源RNAi序列的轉基因株系中外源基因拷貝數及其種子脂氧合酶活性進行測定分析,成功獲得含有不同外源Loxi片段拷貝數的脂氧合酶活性顯著降低的轉基因小麥株系。
4 結論與展望
鑒于脂肪氧化酶所參與的脂質代謝對作物的病蟲害防御反應、耐儲藏性、風味形成、產品品質以及產品保質期和貨架壽命等的影響,使得脂肪氧化酶的性狀改良成為作物遺傳改良的重要目標之一。
在作物脂肪氧化酶途徑中,對于同一反應底物,不同的LOX蛋白所催化成的產物各異,因此,作物中各LOX成員及其代謝通路的功能解析、不同LOX活性差異種質資源的篩選,以及LOX途徑相關基因的功能性分子標記的開發應用,使得針對不同需求的育種目標開展分子輔助育種成為現實。
LOX途徑代謝產物在參與植物生長發育、損傷反應和抗病蟲害等方面的深入研究,將有助于實現對作物生長發育的精確調控、預防性生物農藥以及新型植保素的開發等。隨著未來代謝組學研究手段的發展,作物脂類代謝產物的生理生化功能將獲得更深層次的認知。
[1]Feussner I,Wasternack C.The lipoxygenase pathway[J].Annual Review of Plant Biology,2002,53(1):275-297
[2]Start W G,Ma Y,Polacco J C,et al.Two soybean seed lipoxygenase nulls accumulate reduced levels of lipoxygenase transcripts[J].Plant Molecular Biology,1986,7(1):11-23
[3]Brash A R.Lipoxygenases:occurrence,functions,catalysis,and acquisition of substrate[J].Journal of Biological Chemistry,1999,274(34):23679-23682
[4]Chen G,Hackett R,Walker D,et al.Identification of a specific isoform of tomato lipoxygenase (TomloxC) involved in the generation of fatty acid-derived flavor compounds[J].Plant Physiology,2004,136(1):2641-2651
[5]Liavonchanka A,Feussner I.Lipoxygenases:occurrence,functions and catalysis[J].Journal of Plant Physiology,2006,163(3):348-357
[6]Nugteren D H.Arachidonate lipoxygenase in blood platelets[J].Biochimica et Biophysica Acta,1975,380(2):299-307
[7]Schewe T,Halangk W,Hiebsch C,et al.A lipoxygenase in rabbit reticulocytes which attacks phospholipids and intact mitochondria[J].FEBS Letters,1975,60(1):149-152
[8]Zimmerman D C,Vick B A.Lipoxygenase inChlorellapyrenoidosa[J].Lipids,1973,8(5):264-266
[9]Hamberg M.Isolation and structures of lipoxygenase products fromSaprolegniaparasitica[J].Biochimica et Biophysica Acta,1986,876(3):688-692
[10]Beneytout J L,Andrianarison R H,Rakotoarisoa Z,et al.Properties of a lipoxygenase in green algae (Oscillatoriasp.)[J].Plant Physiology,1989,91(1):367-372
[11]Andre E,Hou K W.The presence of a lipid oxidase in soybeanGlycinesoya[J].CR Acad Sci (Paris),1932,194:645-648
[12]Theorell H,Holman R T,Akeson A.Crystalline lipoxidase[J].Acta Chemica Scandinavica,1947,1(6):571-576
[13]Christopher J,Pistorius E,Axelrod B.Isolation of an isozyme of soybean lipoxygenase[J].Biochimica et Biophysica Acta,1970,198(1):12-19
[14]Christopher J P,Pistorius E K,Axelrod B.Isolation of a third isoenzyme of soybean lipoxygenase[J].Biochimica et Biophysica Acta,1972,284(1):54-62
[15]Gigot C,Ongena M,Fauconnier M L,et al.The lipoxygenase metabolic pathway in plants: potential for industrial production of natural green leaf volatiles[J].Biotechnologie Agronomie Societe et Environnement,2010,14(3):451-460
[16]Porta H,Rocha-Sosa M.Plant lipoxygenases.Physiological and molecular features[J].Plant Physiology,2002,130(1):15-21
[17]Siedow J N.Plant lipoxygenase:structure and function[J].Annual Review of Plant Biology,1991,42(1):145-188
[18]Axelrod B,Cheesbrough T M,Laakso S.Lipoxygenase from soybeans:EC 1.13.11.12 Linoleate:oxygen oxidoreductase[J].Methods in Enzymology,1981,71:441-451
[19]Holtman WL,Vre denbreg·Heistek JC Schmitt NF,et al.Lipoxygenase-2 oxygenates storage lipids in embryos of germinating barley[J].European Journal of Biochemistry,1997,248(2):452-458
[20]Nemchenko A,Kunze S,Feussner I,et al.Duplicate maize 13-lipoxygenase genes are differentially regulated by circadian rhythm,cold stress,wounding,pathogen infection,and hormonal treatments[J].Journal of Experimental Botany,2006,57(14):3767-3779
[21]Gardner H W.Biological roles and biochemistry of the lipoxygenase pathway [J].HortScience,1995,30(4):197-205
[22]Shibata D,Axelrod B.Plant lipoxygenases[J].Journal of Lipid Mediators and Cell Signalling,1995,12(2):213-228
[23]Fischer A M,Dubbs W E,Baker R A,et al.Protein dynamics,activity and cellular localization of soybean lipoxygenases indicate distinct functional roles for individual isoforms[J].The Plant Journal,1999,19(5):543-554
[24]Stephenson L C,Bunker T W,Dubbs W E,et al. Specific soybean lipoxygenases localize to discrete subcellular compartments and their mRNAs are differentially regulated by source-sink status[J].Plant Physiology,1998,116(3):923-933
[25]Suzuki Y,Matsukura U.Lipoxygenase activity in maturing and germinating rice seeds with and without lipoxygenase-3 in mature seeds[J].Plant Science,1997,125(2):119-126
[26]Saravitz D M,Siedow J N.The differential expression of wound-inducible lipoxygenase genes in soybean leaves[J].Plant Physiology,1996,110(1):287-299
[27]Hildebrand D F,Rodriguez J G,Brown G C,et al.Peroxidative responses of leaves in two soybean genotypes injured by twospotted spider mites (Acari:Tetranychidae)[J].Journal of Economic Entomology,1986,79(6):1459-1465
[28]Feussner I,Kühn H,Wasternack C.Lipoxygenase-dependent degradation of storage lipids[J].Trends in Plant Science,2001,6(6):268-273
[29]賓金華,潘瑞熾.甲基茉莉酸酯對花生種子萌發和貯藏物質降解的影響[J].熱帶亞熱帶植物學報,1998,6(3):239-244
[30]楊藝,常丹,王艷,等.茉莉酸與茉莉酸甲酯預處理對干旱脅迫下棉花種子萌發和種苗生理特性的影響[J].西北植物學報,2015,35(2):302-308
[31]李榮沖,沈亮余,梁晶龍,等.高溫高濕脅迫下茉莉酸甲酯對紫蘇種子萌發及生理特性的影響[J].西北植物學報,2012,32(2):312-317
[32]Shiojiri K,Kishimoto K,Ozawa R,et al.Changing green leaf volatile biosynthesis in plants:an approach for improving plant resistance against both herbivores and pathogens[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(45):16672-16676
[33]Chehab E W,Kaspi R,Savchenko T,et al.Distinct roles of jasmonates and aldehydes in plant-defense responses[J].PLOS ONE,2008,3(4):e1904
[34]Mohri S,Endo Y,Matsuda K,et al.Physiological effects of soybean seed lipoxygenases on insects[J].Agricultural and Biological Chemistry,1990,54(9):2265-2270
[35]Creelman R A,Mullet J E.Biosynthesis and action of jasmonates in plants[J].Annual Review of Plant Biology,1997,48(1):355-381
[36]Parchmann S,Gundlach H,Mueller M J.Induction of 12-oxo-phytodienoic acid in wounded plants and elicited plant cell cultures[J].Plant Physiology,1997,115(3):1057
[37]Hildebrand D F,Brown G C,Jackson D M,et al.Effects of some leaf-emitted volatile compounds on aphid population increase[J].Journal of Chemical Ecology,1993,19(9):1875-1887
[38]Bate N J,Rothstein S J.C6-volatiles derived from the lipoxygenase pathway induce a subset of defense-related genes[J].The Plant Journal,1998,16(5):561-569
[39]McConn M,Creelman R A,Bell E,et al.Jasmonate is essential for insect defense in Arabidopsis[J].Proceedings of the National Academy of Sciences of the United States of America,1997,94(10):5473-5477
[40]Xie D X,Feys B F,James S,et al.COI1:an Arabidopsis gene required for jasmonate-regulated defense and fertility[J].Science,1998,280(5366):1091-1094
[41]Thaler J S.Jasmonate-inducible plant defences cause increased parasitism of herbivores[J].Nature,1999,399(6737):686-688
[42]Alborn H T,Turlings T C J,Jones T H,et al.An elicitor of plant volatiles from beet armyworm oral secretion[J].Science,1997,276(5314):945-949
[43]Agrawal A A.Mechanisms,ecological consequences and agricultural implications of tri-trophic interactions[J].Current Opinion in Plant Biology,2000,3(4):329-335
[44]Dixon R A,Lamb C J.Molecular communication in interactions between plants and microbial pathogens[J].Annual Review of Plant Biology,1990,41(1):339-367
[45]Ponz F,Bruening G.Mechanisms of resistance to plant viruses[J].Annual Review of Phytopathology,1986,24(1):355-381
[46]Véronési C,Rickauer M,Fournier J,et al.Lipoxygenase gene expression in the tobacco-Phytophthora parasitica nicotianae interaction[J].Plant Physiology,1996,112(3):997-1004
[47]Peng Y L,Shirano Y,Ohta H,et al.A novel lipoxygenase from rice.Primary structure and specific expression upon incompatible infection with rice blast fungus[J].Journal of Biological Chemistry,1994,269(5):3755-3761
[48]Ocampo C A,Moerschbacher B,Grambow H J.Increase lipoxygenase activity is involved in the hypersensitive response of wheat leaf cells infected with avirulent rust fungi or treated with fungal elicitor[J].Zeitschrift fuer Naturforschung,C,1986,41(5-6):558-563
[49]Melan M A,Dong X,Endara M E,et al.AnArabidopsisthalianalipoxygenase gene can be induced by pathogens,abscisic acid,and methyl jasmonate[J].Plant Physiology,1993,101(2):441-450
[50]張榮平.脂氧合酶在植物體內的生理功能[J].萊陽農學院學報,1993,10(1):47-51
[51]李里特,王海.功能性大豆食品[M].北京:中國輕工業出版社,2002
[52]孫星邈,李明姝,顏秀娟,等.脂肪氧化酶缺失大豆研究進展[J].農業與技術,2008,28(6):43-44
[53]高奇.花生脂肪酶和脂肪氧化酶活力檢測技術優化及其對儲藏特性的影響[D].合肥:安徽農業大學,2012
[54]程昕昕,王榮海,劉正.脂肪氧化酶缺失體對玉米種子劣變的影響[J].中國種業,2009(6):44-45
[55]王海濱.植物的脂肪氧化酶[J].植物生理學通訊,1990(2):63-67
[56]Gardner H W.Lipoxygenase pathway in cereals[M].In Advances in Cereal Science and Technology,edited by Y. Pomeranz,American Association of Cereal Chemists,St Paul,MN,1988(9):161-215
[57]Hildebrand D F.Lipoxygenases[J].Physiologia Plantarum,1989,76(2):249-253
[58]吳萍.小麥籽粒脂肪氧化酶活性功能標記的開發與應用[D].合肥:安徽農業大學,2013
[60]Zhang W,Chao S,Manthey F,et al.QTL analysis of pasta quality using a composite microsatellite and SNP map of durum wheat[J].Theoretical and Applied Genetics,2008,117(8):1361-1377
[61]Parker G D,Chalmers K J,Rathjen A J,et al.Mapping loci associated with flour colour in wheat (TriticumaestivumL.)[J].Theoretical and Applied Genetics,1998,97(1/2):238-245
[62]Carrera A,Echenique V,Zhang W,et al.A deletion at the Lpx-B1 locus is associated with low lipoxygenase activity and improved pasta color in durum wheat (Triticumturgidumssp.durum)[J].Journal of Cereal Science,2007,45(1):67-77
[63]程昕昕,耿廣漢,李志成,等.玉米種子脂肪氧化酶 LOX-3 缺失與耐貯性研究[J].作物雜志,2011(3):34-37
[64]吳躍進,盧義宣,吳敬德,等.耐儲藏專用型水稻選育及相關技術研究[J].中國稻米,2004,10(3):6-7
[65]Rouster J,Leah R,Mundy J,et al.Identification of a methyl jasmonate-responsive region in the promoter of a lipoxygenase 1 gene expressed in barley grain[J].The Plant Journal,1997,11(3):513-523
[66]Rouster J,van Mechelen J,Cameron-Mills V.The untranslated leader sequence of the barleylipoxygenase 1 (Lox1) gene confers embryo-specific expression[J].The Plant Journal,1998,15(3):435-440
[67]van Mechelen J R,Schuurink R C,Smits M,et al.Molecular characterization of two lipoxygenases from barley[J].Plant Molecular Biology,1999,39(6):1283-1298
[68]van Mechelen J R,Smits M,Douma A C,et al.Primary structure of a lipoxygenase from barley grain as deduced from its cDNA sequence[J].Biochimica et Biophysica Acta (BBA)-Lipids and Lipid Metabolism,1995,1254(2):221-225
[69]Doderer A,Kokkelink I,van der Veen S,et al.Purification and characterization of two lipoxygenase isoenzymes from germinating barley[J].Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology,1992,1120(1):97-104
[70]韓春雨,常汝鎮,邱麗娟.大豆脂肪氧化酶研究歷史與進展[C]//作物科學研究理論與實踐——'2000 作物科學學術研討會文集.北京:中國作物學會,2001:235-243
[71]Borrelli G M,Troccoli A,Di Fonzo N,et al.Durum wheat lipoxygenase activity and other quality parameters that affect pasta color[J].Cereal Chemistry,1999,76(3):335-340
[72]Ohta H,Ida S,Mikami B,et al.Purification and characterization of rice lipoxygenase component 3 from embryos[J].Agricultural and Biological Chemistry,1986,50(12):3165-3171
[73]劉明麗,余俊紅,婁曉紅,等.脂肪氧合酶及其對啤酒風味穩定性的影響[J].釀酒科技,2011(5):98-102
[74]柳武革,王豐,劉振榮,等.水稻耐儲藏特性研究進展[J].生物技術通報,2006(S1):50-52
[75]Hildebrand D F,Hymowitz T.Role of β-amylase in starch metabolism during soybean seed development and germination[J].Physiologia Plantarum,1981,53(4):429-434
[76]Kitamura K,Davies C S,Kaizuma N,et al.Genetic analysis of a null-allele for lipoxygenase-3 in soybean seeds[J].Crop Science,1983,23(5):924-927
[77]韓粉霞,丁安林,孫君明,等.大豆脂肪氧化酶同工酶全缺失種質的創新[J].遺傳學報:英文版,2005,32(2):197-202
[78]Davies C S,Nielsen N C.Genetic analysis of a null-allele for lipoxygenase-2 in soybean[J].Crop Science,1986,26(3):460-463
[79]丁安林,張艷,常汝鎮,等.大豆脂肪氧化酶研究進展[J].大豆科學,1995,14(1):67-73
[80]Narvel J M,Fehr W R,Welke G A.Agronomic and seed traits of soybean lines lacking seed lipoxygenases[J].Crop Science,1998,38(4):926-928
[81]張太平,朱星陶.貴州大豆脂肪氧化酶缺失體的農藝和品質性狀分析[J].大豆科學,2000,19(2):131-139
[82]Suda I,Nishiba Y,Furuta S.Vitamin E content and radical scavenging activity of soymilk made from lipoxygenas e-lacking (Triple-Null) soybean[C]//Third International Symposium on the Role of Soy in Preventing and Treating Chronic Disease,Washington,DC,USA,2000,132(3):702
[83]韓粉霞,丁安林,孫君明,等.大豆脂肪氧化酶及 Kunitz 胰蛋白酶抑制劑缺失種質的創新[J].遺傳學報,2005,32(4):417-423
[84]Suzuki Y,Ise K,Li C,et al.Volatile components in stored rice [Oryzasativa(L.)]of varieties with and without lipoxygenase-3 in seeds[J].Journal of Agricultural and Food Chemistry,1999,47(3):1119-1124
[85]Hirota N,Kaneko T,Kuroda H,et al.Characterization of lipoxygenase-1 null mutants in barley[J].Theoretical and Applied Genetics,2005,111(8):1580-1584
[86]Oozeki M,Nagamine T,Ikeda T M,et al.Genetic variation in lipoxygenase activity among Japanese malting barley cultivars and identification of a new lipoxygenase-1 deficient mutant[J].Breeding Research,2007,9(2):55-61
[87]Guo G,Dondup D,Yuan X,et al.Rare allele of HvLOX1 associated with lipoxygenase activity in barley (HordeumvulgareL.)[J].Theoretical and Applied Genetics,2014,127(10):2095-2103
[88]段紅梅,王文秀,常汝鎮,等.大豆 SSR 標記輔助遺傳背景選擇的效果分析[J].植物遺傳資源學報,2003,4(1):36-42
[89]孫君明,伍樹明,陶文靜,等.大豆脂肪氧化酶-1 缺失基因 (lx1) 的 RAPD 標記[J].中國農業科學,2004,37(2):170-174.
[90]宋美,張瑛,吳敬德,等.水稻脂質氧化酶同工酶種質儲藏特性的研究[J].中國農學通報,2005,21(2):65-68
[91]曾大力.水稻耐貯藏種質的篩選及遺傳育種研究[D].北京:中國農業科學院,2002
[92]Sharma V K,Monostori T,Hause B,et al.Genetic transformation of barley to modify expression of a 13-lipoxygenase[J].Acta Biologica Szegediensis,2005,49(1-2):33-34
[93]Sharma V K,Monostori T,G?bel C,et al.Transgenic barley plants overexpressing a 13-lipoxygenase to modify oxylipin signature[J].Phytochemistry,2006,67(3):264-276
[94]馬建.大豆脂肪氧化酶基因 RNAi 表達載體的構建及表達調控的研究[D].長春:吉林農業大學,2008
[95]李俊卿.水稻脂肪氧化酶 RNA 干擾載體的構建及轉化水稻進行耐儲藏的研究[D].重慶:重慶大學,2008
[96]許惠濱.反義 Lox-3 基因轉化秈稻的遺傳體系研究[D].福州:福建農林大學,2010
[97]劉振華,劉香利,李冰冰,等.小麥轉基因株系中外源脂氧合酶抑制基因 (Loxi) 拷貝數分析[J].農業生物技術學報,2014,22(8):949-957
2015-04-12
“十二五”農村領域國家科技計劃(2013BAD01B05-2、2012BAD03B01-2);科技部國際合作項目(2013DFR30890-1);現代農業產業技術體系建設專項(CARS-05)。
扎桑(1988-),女,碩士研究生,主要從事高原作物栽培生理與生態研究。
卓嘎(1971-),女,副研究員,主要從事高原作物栽培生理與生態研究。
郭剛剛(1983-),男,副研究員,主要從事大麥種質資源與新基因發掘研究。

