紅曲霉-人參雙向固體發酵產物成分變化的初步分析
厙守權, 劉 剛, 李 妍, 金美松, 孫衛平, 康東周
(延邊大學藥學院,吉林 延吉 133002)
紅曲霉-人參雙向固體發酵產物成分變化的初步分析
厙守權, 劉 剛, 李 妍, 金美松, 孫衛平, 康東周*
(延邊大學藥學院,吉林延吉133002)
目的 利用TLC和HPLC定性分析紅曲霉-人參粉末雙向固體發酵產物主要成分的變化。方法 紅曲霉接種于以人參為發酵基質的固體培養基。取人參和人參發酵產物的甲醇提取液,TLC測定它們的酸式monacolin K,HPLC法測定其人參皂苷Rg1、Re、Rb1和Rg3。結果 人參經過紅曲霉發酵后,TLC檢測出活性成分酸式monacolin K,HPLC證實了人參皂苷Rg1、Re、Rb1的含有量降低,但發酵液中出現人參皂苷Rg3。結論 紅曲霉-人參粉末雙向固體發酵使人參皂苷轉化成稀有的人參皂苷Rg3,并保存紅曲霉中的酸式monacolin K.
紅曲霉;人參;發酵;TLC;HPLC;酸式monacolin K;人參皂苷Rg1;人參皂苷Re;人參皂苷Rb1;人參Rg3
紅曲霉是藥食兩用真菌,在我國的應用已有千年的歷史[1-2]。紅曲霉擁有強大的酶系[3],在生長過程中能夠產生次級代謝產物monacolin K,1979年日本學者遠藤章從紅曲酶發酵液中分離得到[4-5],并發現其為HMG-CoA還原酶的抑制劑,能夠抑制膽固醇的生物合成[6]。科學家們經過大量試驗證明monacolin K在降低膽固醇方面具有高效、低毒、安全等特點。
人參享有“中藥之王”的美稱,被人類應用于藥物治療方面已有上千年的歷史。人參皂苷是人參的主要藥用活性成分之一[7-8],尤其是人參皂苷Rg3和Rh2具有很強的促進腫瘤細胞凋亡、抑制腫瘤細胞增殖、保肝、增強免疫力和保護心血管的作用。但是Rg3和Rh2這種稀有人參皂苷在人參中含有量極低[9]。
現階段,微生物發酵轉化中藥的研究成為熱點,其具有改變藥性,提高療效,降低毒副作用,擴大適應癥等特點[10]。二十世紀80年代末,“藥用真菌新型(雙向性)固體發酵工程”簡稱“雙向發酵”正式問世[11]。機理是采用不同的中藥材組成不同的“藥性基質”的底物,在現代生物技術嚴密控制下,通過接種不同的單株藥用真菌,發生一系列復雜的生理活動與生化反應。這樣的組合既提供了真菌生長所需的營養,也能使藥性基質的成分和組織分解、變化,并產生新的成分,得到的發酵終產物兼具藥用真菌和中藥材的功效,最終使發酵作用演變成雙向性[12-14]。本實驗利用藥用真菌紅曲霉菌固體發酵人參,為紅曲霉-中藥材雙向發酵體系藥用價值的深層次挖掘和開發奠定基礎,同時為中草藥的二次開發提供一定的理論基礎。
1 材料與方法
1.1材料與試劑
1.1.1供試材料 人參,購于延邊參茸總公司,由延邊大學藥學院呂慧子副教授鑒定為人參Panaxginseng C.A.Mey的根部;紅曲酶菌株,由韓國KCCM提供。
1.1.2藥品試劑 Monacolin K對照品(中國藥品生物制品檢定所提供,批號100600-201102),人參皂苷對照品Rg1(批號110703-200726),Re(編號110804),Rb1(批號110704-200420)由中國藥品生物制品檢定所提供,Rg3(中國食品藥品檢定研究院提供,批號110754-201123);甲醇、乙腈(色譜級,Fisher Scientific);正丁醇、三氯甲烷、石油醚、苯、濃硫酸、無水乙醇、甲酸均為分析純。
1.2儀器與設備 HITACHI-2000型高效液相色譜儀(日本日立公司);FA604型電子分析天平(上海精天電子儀器有限公司);YQ-620B型超聲波清洗機(上海易凈超聲波儀器有限公司);HZQ-F100型振蕩培養箱(哈爾濱市東聯電子技術開發有限公司);DNP-9162BS-III型電熱恒溫培養箱(上海新苗醫療器械制造有限公司);SW-CJ-IC型凈化工作臺(上海新苗醫療器械制造有限公司);DSX-280B型不銹鋼手提式滅菌器(上海申安醫療器械廠)。
1.3方法
1.3.1紅曲霉發酵人參 在超凈工作臺上,將紅曲菌種轉接于斜面培養基上,30℃下培養7 d。將培養好的斜面菌種轉接于搖瓶種子培養液中,放入搖床培養箱中,在一定溫度和轉數下培養48 h。取一定量的搖瓶種子液,接種于以人參為發酵基質的固體培養基上,置于恒溫培養箱中,一定溫度下培養若干天。
1.3.2TLC法檢測發酵產物中的monacolin K 取適量monacolin K對照品2份,用甲醇配制成0.1%的溶液,為內酯式monacolin K對照品溶液,加入適量0.1 mol/LNaOH-75%乙醇[15],60℃水浴2 h,得酸式monacolin K對照品溶液。再取適量發酵產品,按固液比1∶10加蒸餾水,放入振蕩培養箱中,30℃,150 r/min振蕩3 h。振蕩結束后離心10 min,棄上清液,得殘渣。干燥殘渣再按固液比1∶20加入石油醚,70℃回流提取90 min,之后離心10 min,棄上清液,得殘渣。干燥殘渣再按固液比1∶20加入甲醇,70℃回流提取4 h,之后提取液離心,取上清液,濃縮至適量,得供試品溶液。取TLC板,105℃活化45 min,待冷卻后,取供試液與對照品溶液在TLC板上同時展開,展開劑為苯-甲醇-三氯甲烷-甲酸(24∶2∶2∶0.5),展開結束后吹干,用10%硫酸-乙醇顯色,觀察效果。
1.3.3TLC法檢測發酵產物中人參皂苷的成分變化 分別取人參皂苷Rg1、Rg3對照品1 mg加入1 mL甲醇溶解,配制成對照品溶液。再分別取干人參和人參發酵產物適量,加入適量甲醇,超聲提取3 h,之后離心,取上清液。蒸干上清液,殘渣用適量蒸餾水溶解,并加入等體積的水飽和正丁醇進行萃取,取上層液體與對照品溶液同時在TLC板上展開,展開劑為三氯甲烷-乙酸乙酯-甲醇-水(15∶40∶22∶10),10℃下放置分層的下層液體[16]。展開結束后吹干,用10%硫酸-乙醇顯色,觀察效果。
1.3.4HPLC法測定發酵產物中人參皂苷的成分變化
1.3.4.1色譜條件 色譜柱為Diamonsil C18(5 μm,250 mm×4.6 mm),流動相為乙腈-1.3%磷酸水溶液,梯度洗脫(0~30 min,乙腈19%;30~35 min,乙腈19%~24%;35~80 min,乙腈24%~50%),體積流量為0.8 mL/min,柱溫為30℃,檢測波長為203 nm,進樣量為20μL。
1.3.4.2對照品的制備 將人參皂苷Rg1、Re、Rb1、Rg3對照品分別用甲醇配制成1 mg/mL的對照品溶液,0.45μm微孔濾膜過濾,用于HPLC檢測。
1.3.4.3供試液的制備 分別取干人參和人參發酵產物適量,加入適量甲醇,超聲提取3 h,之后離心,取上清液。蒸干上清液,殘渣用適量蒸餾水溶解,并加入等體積的水飽和正丁醇進行萃取,萃取后取上層液體,將所取上層液體蒸干后溶于適量的色譜級甲醇中,0.45μm微孔濾膜過濾,用于HPLC檢測。
2 結果與分析
2.1方法學考察
2.1.1精密度試驗 精密吸取Rg3對照品溶液20 μL,按照色譜條件進行HPLC測定,連續進樣6次,記錄峰面積,人參皂苷Rg3的峰面積RSD值為0.8%,小于5.0%,表明所用儀器的精密度良好。
2.1.2穩定性試驗 精密吸取Rg3對照品溶液20 μL,按照色譜條件進行HPLC測定,分別在0、4、8、12、24、48 h后連續進樣,記錄峰面積,人參皂苷Rg3的峰面積RSD值為1.1%,表明供試品溶液在48 h內基本穩定。
2.1.3重復性試驗 分別精密吸取20μL Rg3對照品溶液6份,按照色譜條件分別進樣,進行HPLC測定,記錄峰面積,人參皂苷Rg3的峰面積RSD值為1.8%,小于5.0%,表明該方法重復性良好。
2.2TLC法對發酵產物中monacolin K的定性分析結果 如圖1所示,發酵樣品與內酯式和酸式monacolin K對照品相比較,酸式monacolin K對照品的斑點明顯可見,說明紅曲酶-人參發酵產物中含有酸式monacolin K。
2.3TLC法對發酵產物中人參皂苷的定性分析結果 如圖2所示,發酵人參樣品與Rg3在相同的Rf值處有斑點出現,而未發酵人參則沒有斑點出現,初步證明發酵人參當中含有人參皂苷Rg3。
2.4HPLC法對發酵產物中人參皂苷的定性分析結果 根據圖3,色譜峰1、2分別為人參皂苷Rg1、Re色譜峰,色譜峰5為人參皂苷Rb1色譜峰,色譜峰Rg3為色譜峰9。人參皂苷Rg1、Re、Rb1在發酵中發生轉化,含有量降低,人參經過發酵得到人參皂苷Rg3,其轉化機制尚待研究。從HPLC圖還可看出其他色譜峰高略有變化,具體化學成分有待進一步研究。

圖1 紅曲樣品的TLC圖譜Fig.1 TLC chromatogram of Monascus product
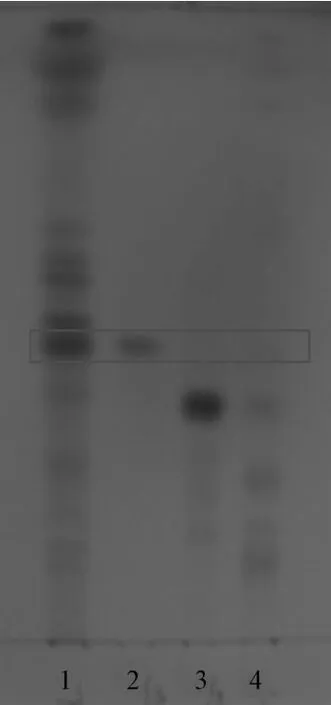
圖2 人參樣品TLC圖Fig.2 TLC chromatogram of Ginseng
3 討論
對紅曲霉所產生的monacolin K定性分析檢測。由于monacolin K在酸性條件下以酸式和內酯式兩種形式存在,他們處于一種相互轉化的動態平衡中[17],兩者的結構只是在母核上兩處支鏈結構有微小區別,而且兩者的極性極其相近,利用高效液相色譜法對monacolin K進行檢測時,兩者在相同波長處的峰在同一處不易分開,這就為其定性造成了一定的困難。所以利用薄層色譜法對monacolin K定性,但對色譜系統的要求也很高,需要找出合適的展開劑種類及展開比例,以達到內酯式mona-colin K和酸式monacolin K的良好分離。
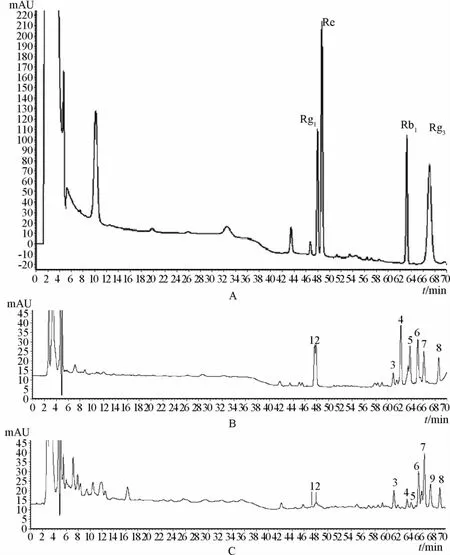
圖3 人參HPLC圖譜Fig.3 HPLC chromatograph map of Ginseng
人參皂苷的變化是由于微生物在生長過程中產生的酶對人參皂苷的某一部位或某幾個部位的特定轉化而獲得一定的產物[18]。本實驗中利用紅曲霉發酵人參,根據TLC和HPLC圖譜可知人參皂苷發生了轉化,并成功轉化出人參稀有皂苷Rg3,轉化機理可能為人參皂苷Rb1經過酶的水解作用在C20位脫去一個葡萄糖苷生成人參皂苷Rd,再經進一步水解生成人參皂苷Rg3[19]如圖4所示。或者人參皂苷Rb2和Rc在不同的酶的作用下改變了C3和C20上的糖鏈結構最終轉化成人參皂苷Rg3[20],如圖5所示。具體的轉化路線還有待于進一步的研究考證。
從結果中可以得出,發酵產物中檢測出活性成分酸式monacolin K和人參稀有皂苷Rg3,發酵產物兼具紅曲霉和人參主要活性成分,紅曲霉具有一定的轉化人參皂苷的能力,人參皂苷成分發生變化,并轉化出人參皂苷Rg3,使發酵具有雙向性。
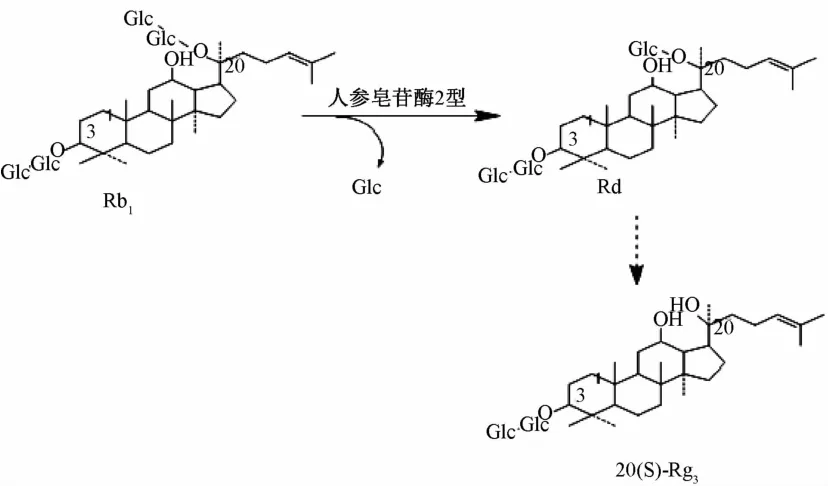
圖4 人參皂苷Rb1轉化為人參皂苷Rg3反應機理圖Fig.4 Reaction mechanism of ginsenoside Rb1converted into Rg3
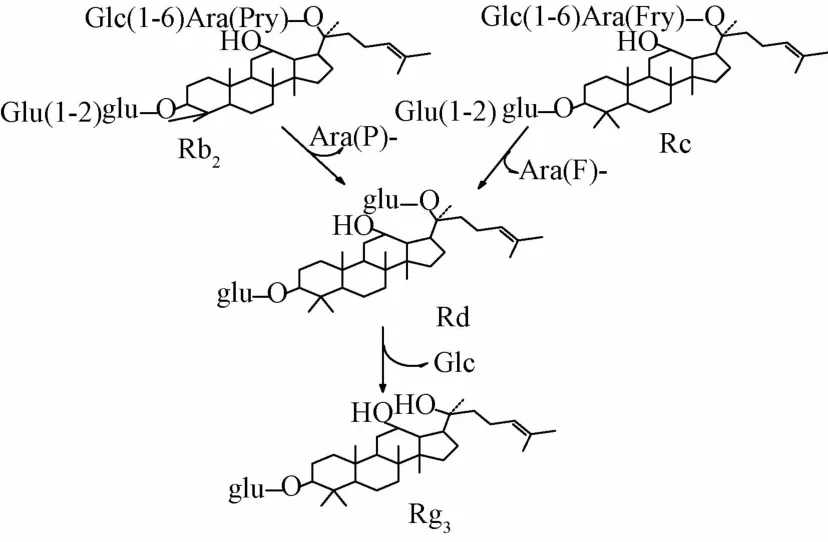
圖5 人參皂苷Rb2和Rc轉化為人參皂苷Rg3的反應機理圖Fig.5 Reaction mechanism of ginsenoside Rb2and Rc converted into Rg3
[1] 傅金泉.中國古代紅曲文化及現代新技術[J].釀酒科技,2001(1):79-80.
[2] 邢旺興,宓鶴鳴,賀 祥.紅曲考證[J].中藥材,2000,23(3):175-177.
[3] 荊雯雯.紅曲霉雙向發酵體系的初步研究[D].貴陽:貴州大學,2011:6.
[4] Endo A.Monacolin K-A new hypocholesterolemic agent produced by a Monascus species[J].JANTIBIOT,1979,32(8):852-854.
[5] Endo A.Monacolin K-A new hypocholesterolemic agent that specifically inhibits3-hydroxy-3-methylglu-laryl coenzyme A reductase[J].JANTIBIOT,1980,33(3):334-336.
[6] 王 玲,吳軍林,吳清平.紅曲降血脂功能的研究及應用概況[J].食品工業科技,2014,35(8):387-389.
[7] 郭秀麗,高淑蓮.人參化學成分和藥理研究進展[J].中醫臨床研究,2012,4(14):26-27.
[8] 黎 陽,張鐵軍,劉素香,等.人參化學成分和藥理研究進展[J].中草藥,2009,40(1):164-附2.
[9] Yu H S,Liu QM,Zhang C Z,etal.A new ginsenosidase from Aspergillus strain hydrolyzing 20-O-multi-glycoside of PPD ginsenoside[J].Process.Biochemistry,2009,(7):772-775.
[10] 鄔吉野.槐耳大黃雙向發酵研究[D].北京:北京中醫藥大學,2013:10-11.
[11] 莊 毅,潘 揚,謝小梅,等.藥用真菌雙向發酵的起源、發展及其優勢和潛力[J].中國食用菌,2007,26(2):3-6.
[12] 魏 龍,贠建民,艾對元,等.提高靈芝-當歸雙向固態發酵基質抗氧化活性的條件優化研究[J].食品工業科技,2014:1-8.
[13] 崔培梧,吳紅娟,譚朝陽,等.植物藥-茯苓菌雙向發酵代謝特征初探[J].湖南中醫藥大學學報,2013,33(7):37-40.
[14] 張 婧,郭明曄,程亦雄,等.響應面法優化槐耳/板藍根雙向發酵條件[J].中國實驗方劑學雜志,2013,19(22):34-37.
[15] 楊 麗,張水華,王啟軍.TLC薄層色譜法同步檢測功能紅曲中酸性和內酯型莫那呵啉K(Monacolin K)[J].食品研究與開發,2006,27(2):113-114.
[16] 國家藥典委員會.中華人民共和國藥典:2010年版一部[S].北京:中國醫藥科技出版社,2010:8.
[17] Wang Q J,Zhang SH,Sung C K,et al.Simultaneous detection of lactone form and acid form monacolin K by sensitive TLC method[J].Journal of South China Uniυersity of Technology(Natural Science Edition),2003,31(9):71-74.
[18] 宋學洲,高文斌,鄭毅男.人參皂苷生物轉化研究最新進展[J].人參研究,2012,24(1):34-38.
[19] 王洪峰,朱 凱,田 健,等.人參雙向固體發酵過程中化學成分的變化[J].吉林農業大學學報,2013,35(3):312-316.
[20] 白龍律.人參皂苷微生物轉化研究[D].北京:延邊大學化學院,2011:10-11.
Chem ical changes in M onascus-Ginseng product after bi-directional solid fermentation
SHE Shou-quan, LIU Gang, LIYan, JIN Mei-song, SUNWei-ping, KANG Dong-zhou*
(College of Pharmacy,Yanbian Uniυersity,Yanji133002,China)
AIM To analyze the constituent changes in the products ofmedicinal fungi Monascus and Ginseng powder after the bi-directional solid fermentation by TLC and HPLC.METHODS By inoculating Ginseng powder with Monascus,TLC was used tomeasure the acid form monacolin K content and the contents of ginsenoside Rg1,Re,Rb1,and Rg3ofmethanolic extracts were determined from Ginseng and Ginseng fermented broth by HPLC. RESULTS The TLC showed that therewas acid form monacolin K contained in Monascus-Gnseng fermented product.HPLCmethod proved thata slight decrease in contents of ginsenosides Rg1,Re and Rb1,but ginsenoside Rg3appeared in Ginseng fermented broth.CONCLUSION Monascus-Ginseng bi-directional solid fermentationmakes ginsenosides convert to ginsenoside Rg3which is rare in Ginseng and does not destroy acid form monacolin K from Monascus in fermented broth.
Monascus;Ginseng;fermentation;TLC;HPLC;acid form monacolin K;ginsenoside Rg1;ginsenoside Re;ginsenoside Rb1;ginsenoside Rg3
10.3969/j.issn.1001-1528.2015.03.030
2014-04-12
厙守權(1986—),男,碩士生,研究方向為功能保健食品。Tel:13199540256,E-mail:327719006@qq.com
康東周,男,博士,副教授,碩士生導師,研究方向為功能保健食品。Tel:(0433)2436012
R284.1
A
1001-1528(2015)03-0599-05

