新型多胺羧甲基殼聚糖的合成及對Ni(Ⅱ)的吸附特性
桂珊,劉貢鋼,姜珩,戴燕妮,葉紅齊
?
新型多胺羧甲基殼聚糖的合成及對Ni(Ⅱ)的吸附特性
桂珊,劉貢鋼,姜珩,戴燕妮,葉紅齊
(中南大學化學化工學院,湖南長沙 410083)
為了提高殼聚糖(CS)吸附重金屬的能力,對表面含有氨基乙酸基團的新型多胺羧甲基殼聚糖(CTGCS)進行了合成研究。其合成過程為:以CS為原料,通過戊二醛交聯得到殼聚糖樹脂(GCS),再經四乙烯五胺改性,得到多胺殼聚糖樹脂(TGCS),最后采用一氯乙酸進行修飾,得到了目標產物(CTGCS)。通過對CS、GCS、TGCS和CTGCS進行紅外光譜和XPS分析,對合成過程進行了分析。吸附結果表明,CTGCS對Ni2+的吸附規律符合Freundlich 等溫式模型,吸附過程符合擬二級動力學模型,最大平衡吸附量為533.8 mg·g-1,比TGCS的吸附量增加了1.5倍。
殼聚糖;修飾;吸附;Ni2+;吸附動力學
引 言
有害重金屬是當今環境的主要污染源之一,嚴重威脅了人類的健康生活。而目前對有害重金屬污染的處理,主要有沉淀、絮凝、吸附等處理方法。其中,吸附法由于具有高效率、低成本等特點,被廣泛應用于水環境中有害重金屬污染的處理[1]。所采用的吸附劑有殼聚糖樹脂及其衍生物[2]、碳納米管[3]、天然沸石[4]等。由于殼聚糖(CS)具有羧基、氨基活性基團,無毒無害,生物相容性好,不會造成二次污染,且具有較好的可修飾性等優點,因此,已有不少關于殼聚糖及其衍生物吸附重金屬的文獻報道[3-8]。Rijith等[5]研究了戊二醛交聯的多胺殼聚糖樹脂用于吸附Cu2+,飽和吸附量達到207.36 mg·g-1。丁靜亞等[6]合成的致孔氨基化殼聚糖樹 脂吸附劑對Cd2+進行吸附,吸附容量達到315 mg·g-1。為了進一步提高殼聚糖吸附重金屬的能力,本文合成了表面含氨基乙酸螯合結構的新型多胺羧甲基殼聚糖(CTGCS),以殼聚糖為原料,先將殼聚糖進行交聯合成殼聚糖樹脂(GCS),再用四乙烯五胺進行胺化合成多胺殼聚糖樹脂(TGCS),在此基礎上進一步通過一氯乙酸修飾,合成多胺羧甲基殼聚糖(CTGCS)。采用FTIR對新型吸附劑表征的同時,考察了新型吸附劑對Ni2+的吸附性能,并研究了其對Ni2+的吸附熱力學及吸附動力學。
1 實驗材料和方法
1.1 主要儀器與試劑
主要儀器:傅里葉紅外光譜儀,Nicolet 6700,美國賽默飛世爾科技公司;X射線光電子譜(XPS),Thermo Fisher Scientific America;恒溫振蕩器,SHA-CA,金壇市江南儀器廠;紫外可見分光光度儀,752N,上海精密科學儀器有限公司。
主要試劑:殼聚糖,國藥集團,生化試劑,脫乙酰度>80%;戊二醛,25%,生化試劑;四乙烯五胺,化學純;環氧氯丙烷、丙酮、乙醇、一氯乙酸、碳酸鈉、丁二酮肟、氨水、Na2-EDTA、氫氧化鈉等均為分析純。
1.2 多胺羧甲基殼聚糖吸附劑的合成
2 g殼聚糖(CS)溶解于100 ml 2%的乙酸溶液中,40℃時緩慢滴加10 ml 10%戊二醛的溶液,反應l h后,再升溫至60℃,用1 mol·L-1的NaOH溶液將pH調至9~10,繼續反應3.5 h,得到的交聯產物GCS依次用丙酮、乙醇、去離子水充分洗滌抽濾,得到的產物50℃真空干燥。
于100 ml三口燒瓶中加入1 g GCS和70 ml異丙醇,混合均勻后加0.025 g過硫酸鉀做引發劑,于65℃時向燒瓶中加入2.5 ml環氧氯丙烷[溶于40 ml丙酮/水混合液(體積比1:1)中],反應2 h。抽濾,固體產物轉入50 ml乙醇/水混合液中(體積比1:1),加入3 ml四乙烯五胺,攪拌反應8 h,得到多胺殼聚糖(TGCS)經過濾后,用丙酮、無水乙醇、去離子水洗至中性,50℃真空干燥。
稱取12 g氯乙酸溶于30 ml水中,取一定量的氫氧化鈉溶液緩慢滴加入氯乙酸溶液中,并調混合溶液至pH8左右,將1 g TGCS放入100 ml三口燒瓶中,90℃時加入配置好的混合溶液攪拌5.5 h,每隔30 min用10%的Na2CO3溶液中和反應過程中生成的鹽酸,保持pH8左右的弱堿性環境,用丙酮、無水乙醇、去離子水洗滌,50℃真空干燥箱烘干得產品多胺羧甲基殼聚糖(CTGCS)。CTGCS吸附劑的合成路線如圖1所示。
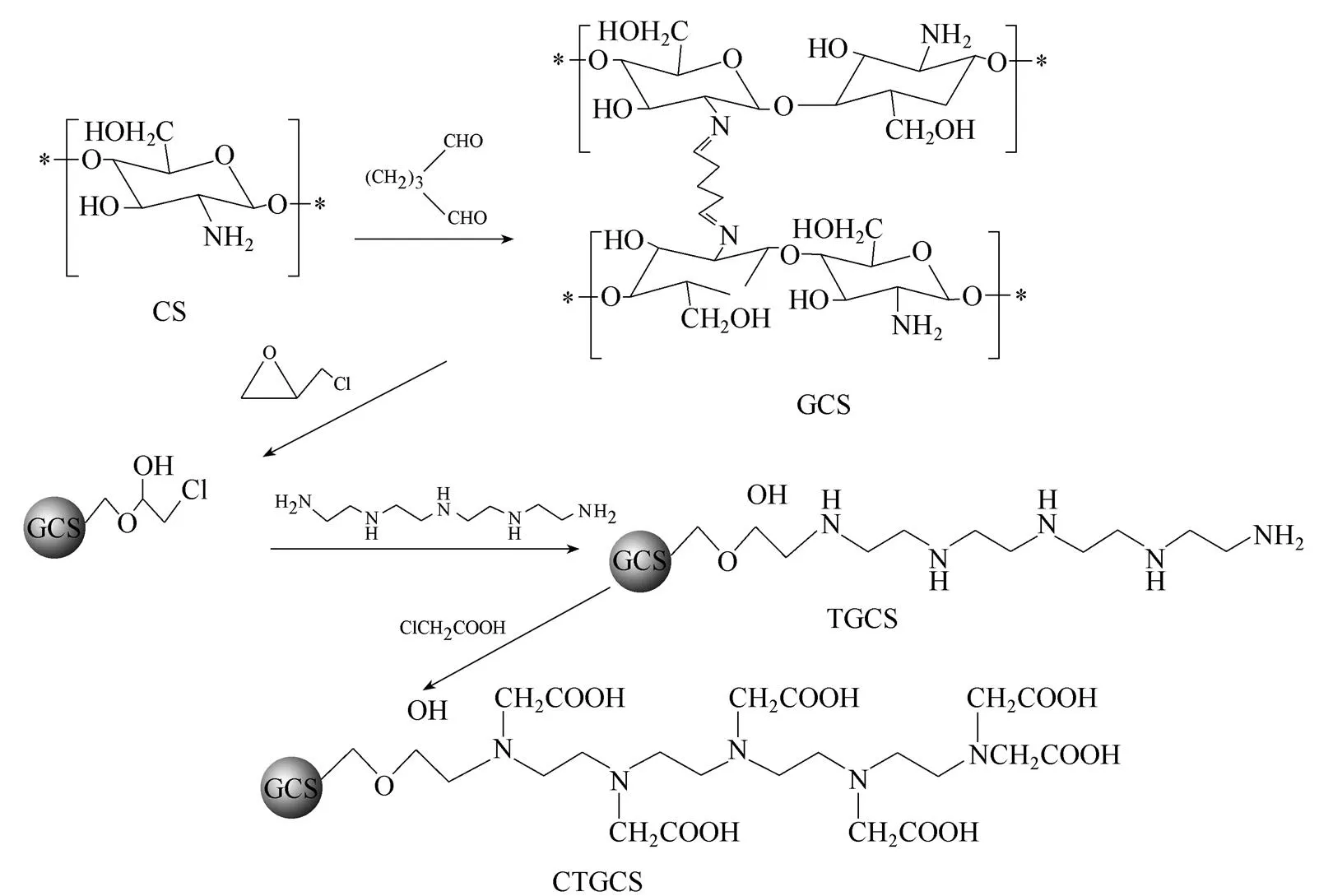
圖1 CTGCS的合成路線圖
1.3 吸附實驗
稱取一定量的吸附劑,加到一定濃度的六水合硝酸鎳溶液中,在一定溫度、pH下,振蕩,過濾,稀釋,用紫外分光光度計測Ni2+的吸光度,計算吸附后的溶液濃度,并按照式(1)計算吸附劑對Ni2+的吸附量[7]
2 結果與分析
2.1 聚合物的IR和XPS表征
CS (a),GCS (b),TGCS (c),CTGCS (d)的紅外數據圖如圖2所示,對比譜線b與a,可以看出在1550 cm-1處為NH的彎曲振動減弱,說明殼聚糖分子中的氨基發生反應[8],殼聚糖成功地進行交聯。4條譜線在3400 cm-1附近出現的寬峰為氨基及羥基吸收峰;譜線c與b相比,在1033 cm-1處CN峰明顯增強,說明四乙烯五胺成功地對殼聚糖進行了胺化。譜線d與c相比,在1640 cm-1左右出現CO伸縮振動引起中強吸收峰,表明羧甲基基團已接枝到多胺殼聚糖上[9]。紅外光譜證實了圖1的合成過程是可行的。
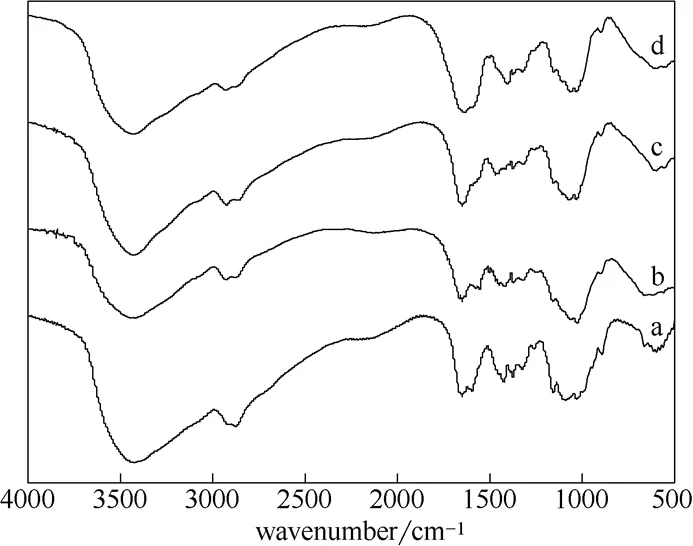
圖2 CS (a)、GCS (b)、TGCS (c)、CTGCS (d)的紅外光譜圖
為了進一步驗證反應機理,對原料及各階段產物進行了XPS分析,同時對聚合物的N譜和C譜進行了擬合,結果如圖3、圖4和表1所示。對比圖3 (b)與(a),CS在399 eV[10-11]處有N1s峰,經戊二醛交聯后在402 eV處出現新的N結合能,說明戊二醛進行了交聯;對比圖4 (b)與(a),284 eV處的CC鍵的比例增加,同時由表1可知,GCS中C的原子百分比相對CS有所增加,進一步說明戊二醛交聯成功。圖3 (c)與(b)相比,399 eV 處的N1s結合能峰百分含量明顯升高,同時表1中TGCS的N原子百分比較GCS約增加一倍,由此可見,四乙烯五胺對GCS成功地進行了胺化;對比圖4 (d)與(c),288 eV處CO峰百分含量增加,同時表1中CTGCS的O原子百分比與TGCS相比,明顯增大,表明羧甲基基團已接枝到TGCS上。XPS分析與紅外分析相吻合,進一步驗證了合成路線。
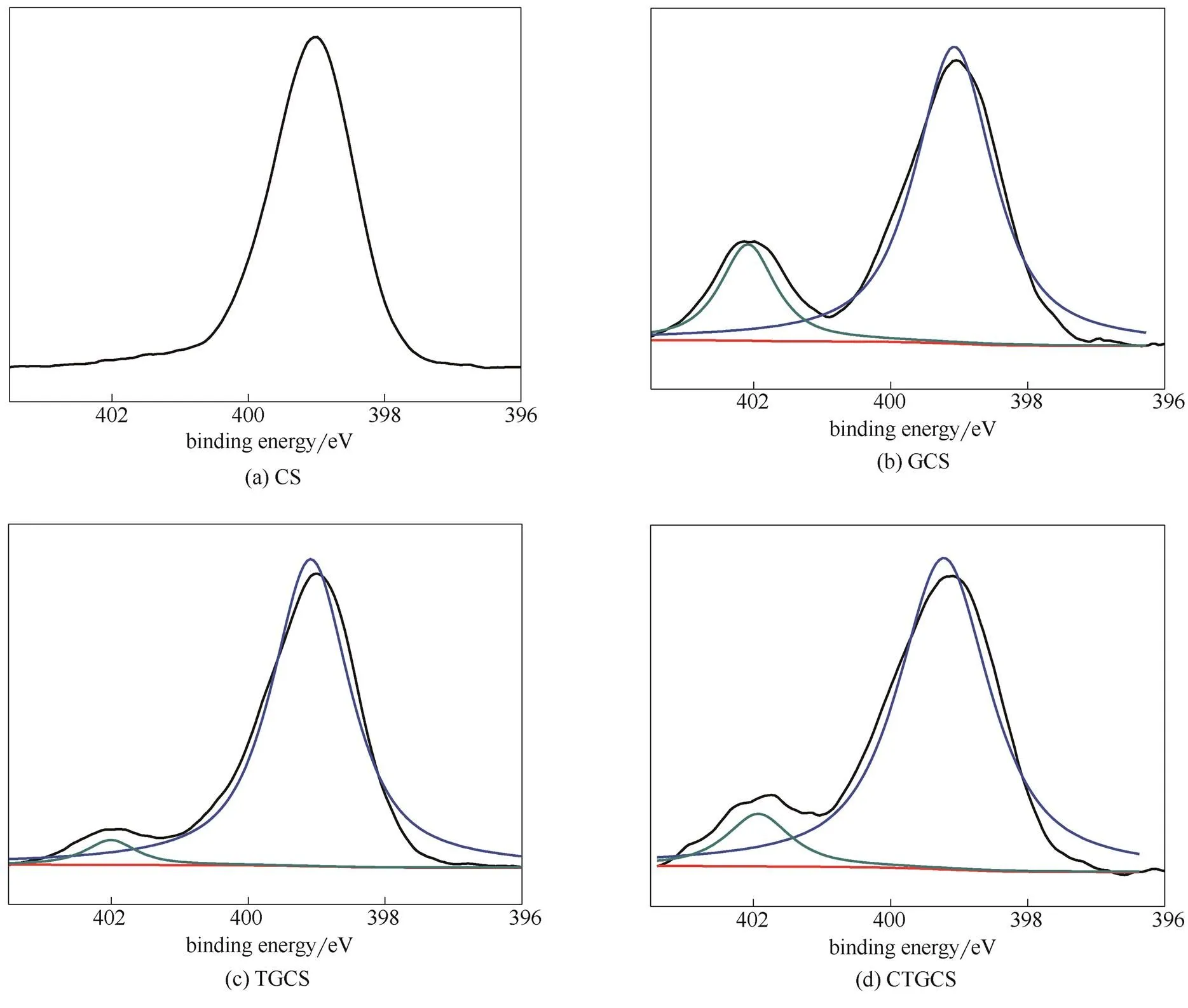
圖3 CS、GCS、TGCS、CTGCS的N譜圖
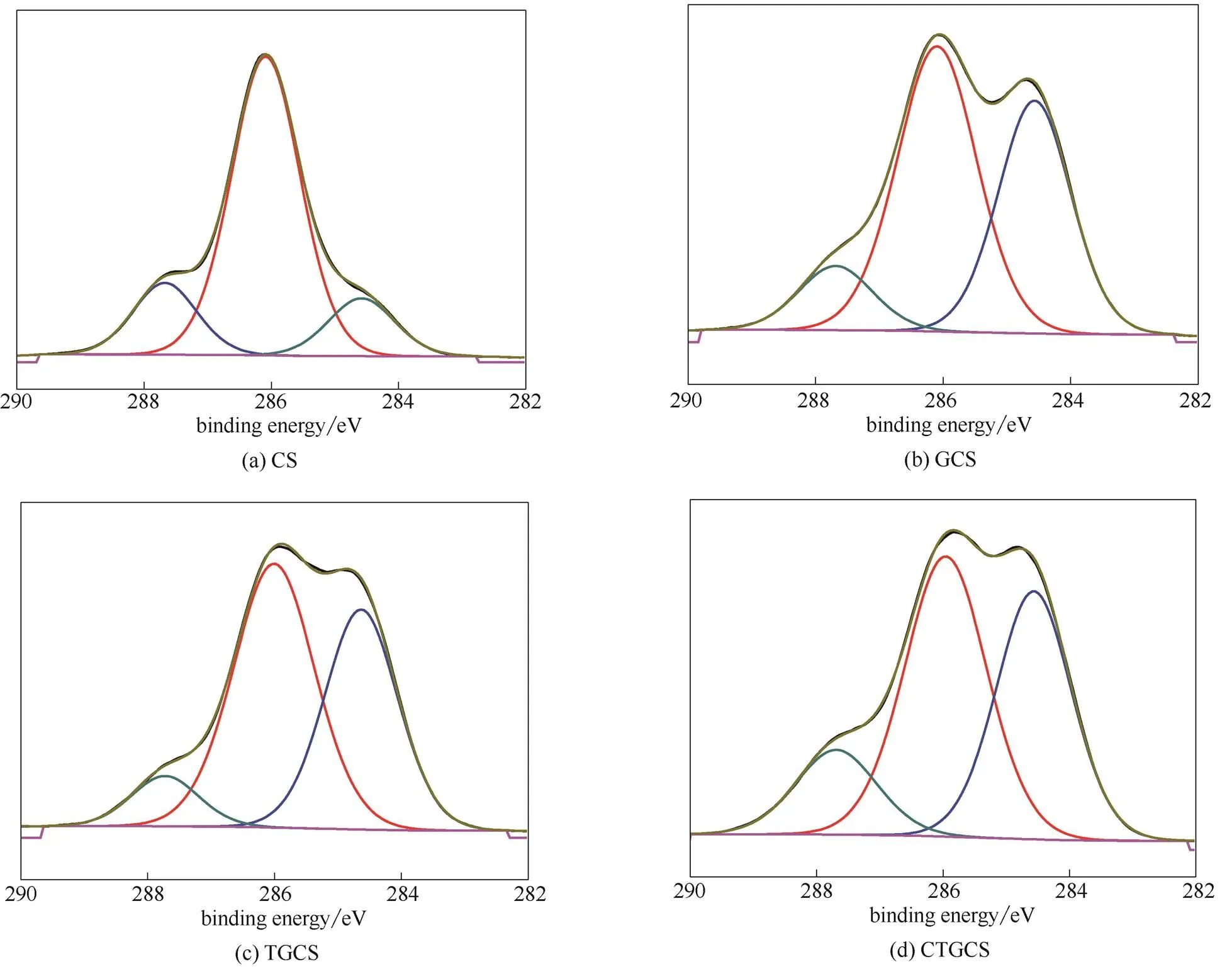
圖4 CS、GCS、TGCS、CTGCS的C譜圖
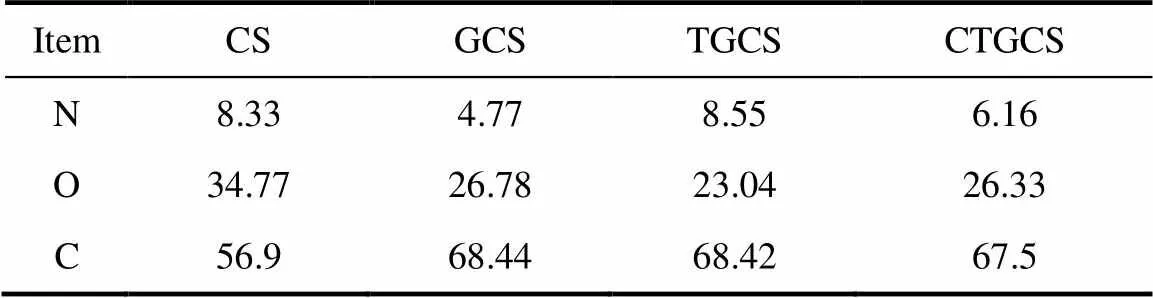
表1 CS、GCS、TGCS和CTGCS的N、O、C的原子百分比
2.2 殼聚糖吸附劑對Ni2+的吸附性能
為了比較原料CS、中間產物TGCS和終產物CTGCS的性能,考察了溫度為25℃時CS、TGCS和CTGCS在不同Ni2+濃度下的吸附行為,結果如圖5所示。由圖5可以看出,CTGCS吸附量遠大于原料CS、中間產物TGCS的吸附量,尤其在Ni2+濃度大于1500 mg·L-1的情況下更為明顯,CTGCS吸附劑的最大平衡吸附量為533.8 mg·g-1,比未羧甲基化的TGCS最大吸附量增加了1.5倍。可能是因為,加入羧甲基后的CTGCS在表面形成大量的氨基乙酸基團,大大增加了吸附活性位點,提高吸附劑的吸附重金屬能力。
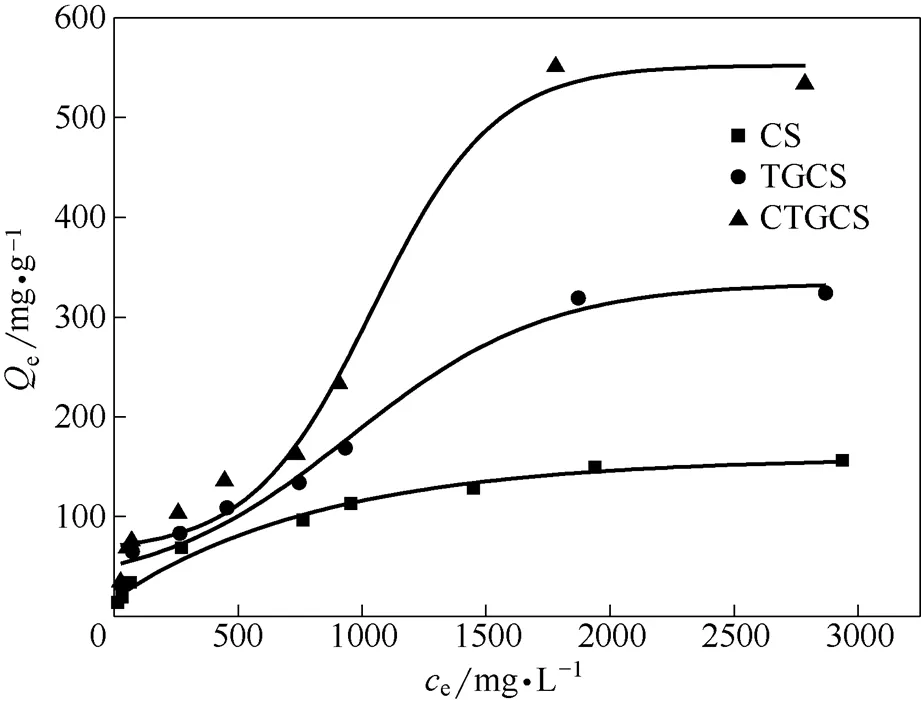
圖5 Ni2+濃度對CS、TGCS、CTGCS性能的影響
2.2.1 pH對多胺羧甲基殼聚糖吸附Ni2+的影響 根據Ni(OH)2的sp值,當pH>8時,Ni2+會生成Ni(OH)2沉淀[12]。為了探究pH對CTGCS吸附劑吸附能力的影響,配制pH為2~8的溶液,在溫度為25℃時恒溫振蕩吸附2 h。如圖6所示,pH對吸附劑的吸附量有很大影響,當pH較小時,溶液顯酸性,H+的濃度較高,會將吸附劑中NH2質子化變成,占據吸附點,導致H+與Ni2+存在競爭吸附,使吸附劑對Ni2+的吸附量下降,從而影響吸附劑吸附金屬[13-15]。隨著pH的增大,H+的濃度變小,H+與Ni2+競爭吸附減小,吸附劑對Ni2+的吸附量也越來越大,當pH為6~8時達到最大吸附量,吸附效果最好。
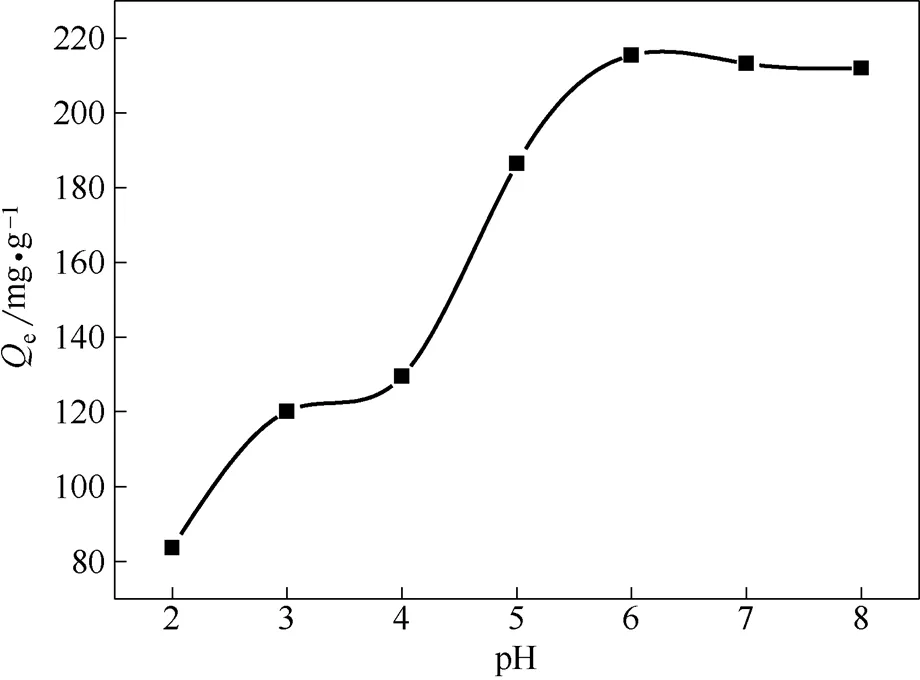
圖6 pH對吸附劑性能的影響
2.2.2 振蕩時間對多胺羧甲基殼聚糖吸附Ni2+的影響 配制濃度為1000 mg·L-1的Ni2+溶液,稱取0.1 g吸附劑進行恒溫振蕩。實驗數據如圖7所示,在吸附初始,吸附量隨時間的增大而快速上升,隨著時間的延長,吸附量的增加量也相對減小,當時間為120 min左右時趨于吸附平衡。出現這種現象是因為,在初始階段,Ni2+在吸附劑表面的氨基乙酸結構的吸附位點上進行吸附,一段時間后,向吸附劑內部進行擴散[16-18],金屬溶液的濃度有所減小,吸附速率隨之也變小,直至達到平衡。
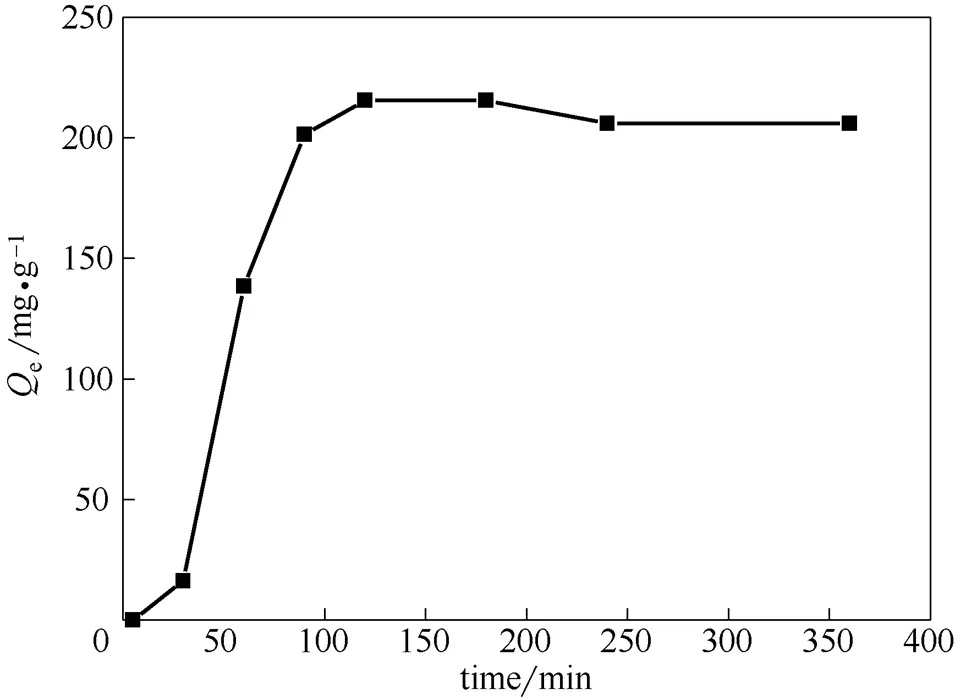
圖7 振蕩時間對吸附劑性能的影響
2.2.3 溫度對多胺羧甲基殼聚糖吸附Ni2+的影響 由圖8可知,在不同溫度下,吸附劑對Ni2+的吸附量有所不同,最佳溫度為35℃。吸附劑的吸附量開始時隨溫度的增加而增加,這是因為,溫度增加,溶液重金屬離子活動劇烈,有利于吸附。到達一定溫度后,隨著溫度的增加,吸附量反而有所減小,可能是因為此吸附試驗屬于放熱過程,溫度升高不利于吸附進行[19],因此吸附總量會有所減小。
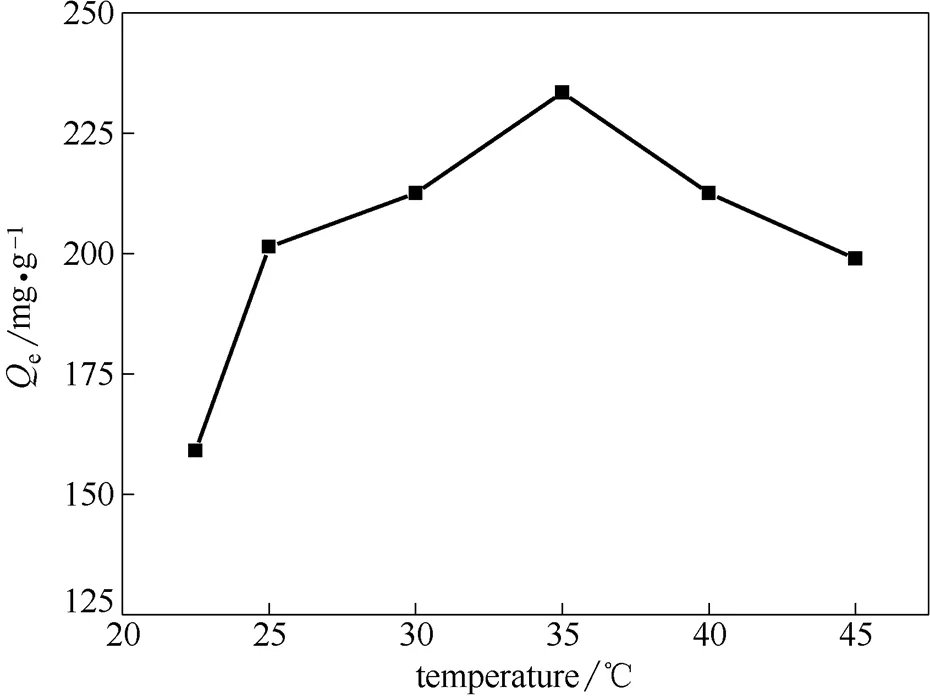
圖8 溫度對吸附劑性能的影響
2.2.4 多胺羧甲基殼聚糖吸附等溫線研究 研究表明,絕大部分固體表面的性質是不均勻的。在不均勻表面上的吸附,特別是在低的平衡壓力下,Langmuir吸附等溫線方程不能描述實驗結果[20]。而Freundlich方程適用于非均勻表面的等溫吸附情況[21],其理論公式的表達式為
式中,e為吸附平衡濃度,mg·L-1;e為平衡吸附量,mg·g-1;常數f表示吸附能力的相對大小;常數表示吸附強度。
由于合成的吸附劑是類似于EDTA的螯合結構,重金屬首先與吸附位點表面結合力較強的結合,然后再與表面結合力較弱的吸附位點結合,即重金屬不是均勻地存在于吸附劑表面,因此更加確定,多胺羧甲基殼聚糖樹脂吸附重金屬更加符合Freundlich 吸附等溫線模型(20.991),擬合結果如圖9所示,得到的吸附等溫模型的表達式為
2.2.5 吸附動力學 研究傳質、化學反應等吸附過程的控制機制,常用一級、二級和內部擴散方程來測定實驗參數。本文采用二級動力學模型對吸附過程進行擬合,準二級動力學方程是應用比較廣的吸附動力學方程,其吸附動力學為[22]
式中,e和Q分別為平衡時和時的吸附量,mg·g-1;為二級動力學方程的速率常數,g·mg-1·min-1。/Q對作圖,由直線方程可計算出e和。
CTGCS對Ni2+的吸附擬合結果如圖10所示,得到的二級動力學曲線為
依據相關系數(20.984),用二級方程表示Ni2+的吸附行為較好,可得二級速率常數分別為0.00536 g·mg-1·min-1。許多研究表明,二級動力學模型假設化學吸附為速控步驟,在多數情況下,二級方程與吸附研究吻合得較好[23]。
2.2.6 再生性能的研究 將吸附后的多胺羧甲基殼聚糖吸附劑加入1 mol·L-1的HCl溶液,恒溫振蕩4 h靜態吸附,再用0.4 mol·L-1的NaOH溶液振蕩吸附1 h,洗滌至中性,烘干。脫附后再將吸附劑用于吸附,重復使用7次,發現在吸附7次后吸附量僅降低了11%,說明氨基乙酸螯合結構沒有被破壞,性能穩定,易于循環利用。結果如圖11所示。
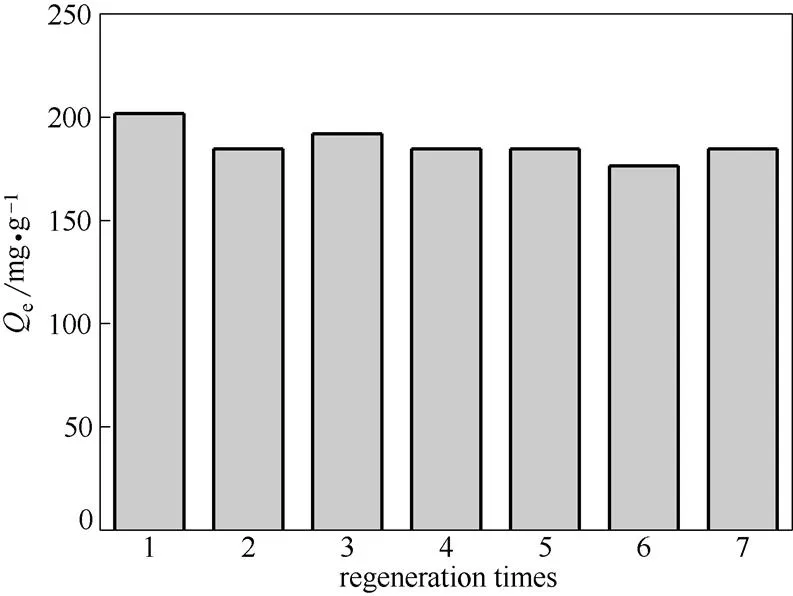
圖11 再生次數對吸附劑性能的影響
3 結 論
(1)原料CS經過一系列修飾改性后合成CTGCS,從FTIR表征可知,多胺羧甲基已成功修飾殼聚糖。
(2)經過羧甲基化的殼聚糖樹脂吸附劑的吸附量比未羧甲基化前的吸附量提高1.5倍,吸附劑對Ni2+的最大吸附量為533.8 mg·g-1。吸附條件表明,吸附最佳時間為2 h;吸附劑在pH 6~8時吸附效果最好;最佳吸附溫度為35℃。
(3)通過吸附實驗,Freundlich模型能更好地描述吸附劑的吸附過程(2>0.99),對吸附過程進行動力學擬合,擬合結果符合擬二級動力學模型(2>0.98),說明吸附劑吸附Ni2+是不均勻的多分子層吸附過程。吸附劑經過吸附-脫附-再吸附過程,吸附劑在重復使用7次后吸附量僅降低11%,說明多胺羧甲基殼聚糖吸附劑的再生性能較好。
符 號 說 明
0,e——分別為溶液的初始濃度和吸附后的溶液濃度,mg·L-1
——二級動力學方程的速率常數,g·mg-1·min-1
f——常數,表示吸附能力的相對大小
——吸附劑的質量,g
——吸附強度,eV
e——平衡吸附量,mg·g-1
——時間的吸附量,mg·g-1
——溶液體積,L
References
[1] Hu Huiyuan (胡惠媛), Zhu Hong (朱虹). Adsorption of heavy metal ions by chitosan and its derivatives [J].(化學進展), 2012 (11): 15
[2] Tang Xuejiao (唐雪嬌), Yang Li (楊麗), Wu Fengpeng (吳豐鵬),. Adsorption behavior of Ni2+onto new chitosan derivative sorbent[J].(天津大學學報), 2011, 44 (11): 979-983
[3] Wang Bin (王彬), Gong Jilai (龔繼來), Yang Chunping (楊春平). Removal of Rhodamine B from aqueous solution by magnetic multi-walled carbon nanotubes [J].(中國環境科學), 2009, 28 (11): 1009-1013
[4] Hu Xiquan (胡細全), Hu Zhicao (胡志操), Wang Chunxiu (王春秀). Research on adsorption of phosphorus and ammonia nitrogen by natural zeolite [J].(環境科學與管理), 2009, 34 (4): 72-74
[5] Anirudhan T S, Rijith S. Glutaraldehyde cross-linked epoxyaminated chitosan as an adsorbent for the removal and recovery of copper (Ⅱ): from aqueous media [J].:, 2009, 351 (1): 52-59
[6] Ding Jingya (丁靜亞), Zhu Fudong (朱復東), Lu Yu (陸玉). Preparation of chitosan derivatives containing macroporous resin and Cd (Ⅱ) adsorption [J].:(鹽城工學院學報:自然科學版), 2012, 25 (1): 25-28
[7] Huang Guolin (黃國林), Chen Zhongsheng (陳中勝), Liang Xizhen (梁喜珍). Adsorption behavior of uranium (Ⅵ) ions from aqueous solution on novel cross-linked magnetic chitosan beags [J].(化工學報), 2012, 63 (3): 834-840
[8] Feng Changgen (馮長根), Bai Linshan (白林山), Ren Qisheng (任啟生). Synthesis and infrared spectra of glutaraldehyde cross-linked chitosan resin amine compound modifier [J].(光譜學與光譜分析), 2004, 24 (11): 1315-1318
[9] Zhu Kun (朱琨), Deng Haiwei (鄧海威), Chang Le (常樂). Preparation of carboxymethyl chitosan [J].:(江蘇教育學院學報: 自然科學版), 2012, 27 (5): 40-42
[10] Mo Shaobo (莫少波), Xiao Mei (肖玫), Weng Yue (翁玥). Research of crosslinked chitosan on vanadium (Ⅴ) adsorption mechanism of XPS [J].(分析科學學報), 2004, 20 (5): 534-536
[11] Amaral I F, Granja P L, Barbosa M A. Chemical modification of chitosan by phosphorylation: an XPS, FT-IR and SEM study [J].:, 2005, 16 (12): 1575-1593
[12] Fan L, Luo C, Sun M,. Highly selective adsorption of lead ions by water-dispersible magnetic chitosan/graphene oxide composites [J].:, 2013, 103: 523-529
[13] Ding Ping (丁萍), Huang Kelong (黃可龍), Li Guiyin (李桂銀). Adsorption behavior of Zn(Ⅱ) ion onto chitosan derivatives [J].() (化工學報), 2006, 57 (11): 2652-2656
[14] Elwakeel K Z. Removal of Cr (Ⅵ) from alkaline aqueous solutions using chemically modified magnetic chitosan resins [J]., 2010, 250 (1): 105-112
[15] Dang Mingyan (黨明巖), Jia Xiuhong (賈秀紅), Zhao Chunying (趙春英). Adsorption performance of crosslinked chitosan resin for nickle (Ⅱ) ions [J].(電鍍與精飾), 2010, 32 (5): 8-11
[16] Monier M, El-Sokkary A M A. Preparation of molecularly imprinted cross-linked chitosan/glutaraldehyde resin for enantioselective separation of L-glutamic acid [J]., 2010, 47 (2): 207-213
[17] Tang Xuejiao (唐雪嬌), Cao Meng (曹夢), Bi Chengliang (畢成良). Study on the synthesis and characterization of a novel adsorbent and its adsorption property to Ni(Ⅱ) [J].(化學學報), 2007, 65 (23): 2771-2775
[18] Rajiv Gandhi M, Meenakshi S. Preparation of amino terminated polyamidoamine functionalized chitosan beads and its Cr (Ⅵ) uptake studies [J]., 2013, 91 (2): 631-637
[19] Tirtom V N, Din?er A, Becerik S,. Comparative adsorption of Ni (Ⅱ) and Cd (Ⅱ) ions on epichlorohydrin crosslinked chitosan-clay composite beads in aqueous solution [J]., 2012, 197: 379-386
[20] Sabaa M W, Mohamed R R, Eltaweel S H. Crosslinked poly (vinyl alcohol)/carboxymethyl chitosan hydrogels for removal of metal ions and dyestuff from aqueous solutions [J]., 2012, 123 (6): 3459-3469
[21] Chen C Y, Yang C Y, Chen A H. Biosorption of Cu (Ⅱ), Zn (Ⅱ), Ni (Ⅱ) and Pb (Ⅱ) ions by cross-linked metal-imprinted chitosans with epichlorohydrin [J]., 2011, 92 (3): 796-802
[22] Feng Z, Shao Z, Yao J. Protein adsorption and separation on amphoteric chitosan/ carboxymethylcellulose membranes [J]., 2008, 86 (3): 694-700
[23] Laus R, Costa T G, Szpoganicz B. Adsorption and desorption of Cu (Ⅱ), Cd (Ⅱ) and Pb (Ⅱ) ions using chitosan cross-linked with epichlorohydrin-triphosphate as the adsorbent [J]., 2010, 183 (1): 233-241
Synthesis of carboxymethyl polyamines chitosan and its adsorptionproperties for Ni(Ⅱ)
GUI Shan, LIU Gonggang, JIANG Heng, DAI Yanni, YE Hongqi
(School of Chemistry and Chemical Engineering, Central South University, Changsha 410083, Hunan, China)
A novel amino acid functionalized polyamine carboxymethyl chitosan (CTGCS) was designed to improve adsorption ability of chitosan (CS) for heavy metals. Chitosan resin (GCS) was firstly obtainedcross-link reaction of chitosan and glutaraldehyde. After following modification by tetraethylenepentamine and chloroacetic acid, CTGCS was successfully synthesized. The samples at different reaction steps were characterized by using FTIR and XPS to understand reaction mechanism. Moreover, the adsorption ability of as-synthesized CTGCS for Ni2+from aqueous solutions was investigated. The adsorption process conformed with the Freundlich isotherm model and could be fitted by the pseudo-second order kinetics model. The maximum adsorption capacity of CTGCS for Ni2+was significantly improved up to 533.8 mg·g-1, about 1.5 times more than that of TGCS, indicating that CTGCS was a promising adsorbent for heavy metals.
chitosan; modification; adsorption; Ni2+; adsorption kinetics
10.11949/j.issn.0438-1157.20141197
TQ 2; TQ 31
A
0438—1157(2015)05—1785—07
2014-08-11收到初稿,2015-02-11收到修改稿。
聯系人:葉紅齊。第一作者:桂珊(1991—),女,碩士研究生。
國家自然科學基金項目(21006129,21276284,21146008)。
2014-08-11.
Prof.YE Honqi, yeslab@mail.csu.edu.cn
supported by the National Natural Science Foundation of China (21006129, 21276284, 21146008).

