GMI治療糖尿病性周圍神經病的臨床觀察
樓百層
GMI治療糖尿病性周圍神經病的臨床觀察
樓百層
目的 探討單唾液酸四己糖神經節苷脂鈉(GM1)對糖尿病性周圍神經病(DPN)的療效。方法 將126例DPN患者隨機分為觀察組和對照組,各63例。對照組予甲鈷胺+α-硫辛酸治療,觀察組在對照組基礎上加用GM1。治療后比較兩組的療效、TCSS、MNCV和SNCV的改善情況。結果 觀察組總有效率為92.1%高于對照組的79.4%(P<0.05);治療后兩組TCSS、MNCV和SNCV均較治療前有改善(P<0.05),且觀察組改善更顯著(P<0.05)。結論 GM1聯合甲鈷胺及α-硫辛酸治療DPN療效顯著。
單唾液酸四己糖神經節苷脂鈉 糖尿病性周圍神經病 甲鈷胺 α-硫辛酸 神經傳導速度
糖尿病性周圍神經病(DPN)是糖尿病(DM)最常見的慢性并發癥之一,臨床上>30%的DM患者合并有DPN,其不僅嚴重影響DM患者的生活質量,而且增加DM患者的死亡風險[1]。DPN為多因素共同作用所致,其臨床癥狀出現早,累及廣泛,尚缺乏特效的治療方法[2]。本文就單唾液酸四己糖神經節苷脂鈉(GM1) 應用于DPN的臨床治療做初步探討,報道如下。
1 臨床資料
1.1一般資料 選取2012年1月至2014年6月期間本院收治的2型DM合并DPN患者126例。按照隨機數字表分為觀察組和對照組,每組各63例。觀察組男31例,女32例;平均年齡(54.8±5.3)歲。對照組男33例,女30例;平均年齡(562±5.1)歲。納入標準[3,4]:(1)肢體有麻木感、蟻走感、燒灼感、異樣感、感覺減退、自發性疼痛、冷熱感覺異常及肢體肌無力。(2)膝關節腱反射減弱或消失。(3)肌電圖提示運動神經傳導速度(MNCV)<45m/s,感覺神經傳導速度(SNCV)<40m/s。(4)排除其他疾病所致的周圍神經病變。排除標準:(1)生命體征不穩定,或合并有其他嚴重疾病。(2)近1個月內曾發生糖尿病酮癥、酮癥酸中毒、高滲性昏迷者。(3)不愿意參加者。所有入選患者均知情,自愿參加并簽署知情同意書。兩組的性別、年齡、糖化血紅蛋白(HbA1c)、病程等參數均具有可比性(P>0.05)。
1.2治療方法 所有患者均予以健康教育、合理飲食指導、科學運動、戒煙限酒、降低體重指數、補充維生素等綜合性治療,同時進行口服降糖藥或注射胰島素等有效控制血糖治療。根據每個患者的具體病情,分別給予降血壓、降血脂、抗凝、改善微循環等綜合性治療。在此基礎上,對照組予甲鈷胺注射液500μg,肌肉注射,3次/周;α-硫辛酸注射液600mg加入生理鹽水250ml中避光靜脈滴注,1次/d。觀察組在對照組基礎上加用GM1注射液40mg加入生理鹽水250ml中靜脈滴注,1次/d。兩組均治療2周。
1.3療效評價 顯效:臨床癥狀消失,肢體異常感覺消失或基本消失,感覺障礙恢復,膝關節腱反射恢復正常,肌電圖提示神經傳導速度(NCV)較治療前提升5m/s或恢復正常。有效:臨床癥狀緩解,肢體感覺異常好轉,感覺障礙部分恢復,膝關節腱反射部分恢復,NCV較治療前提升2~5m/s。無效:臨床癥狀未見改善,肢體感覺障礙如前或加重,膝關節腱反射未見恢復,NCV較治療前無提升。總有效率=(顯效數+有效數)/總數×100%。
1.4觀察指標 由經過培訓的專職醫師對所觀察對象進行治療前后的神經癥狀、神經反射、感覺功能等采用多倫多臨床評分系統(TCSS)進行量化評分,包括3個部分:(1)神經癥狀:主要是指下肢發生疼痛、麻木、針刺感、無力、共濟失調及上肢發生類似的癥狀,每發生1項各記1分,未發生記0分,本項記滿分為6分。(2)神經反射:指雙側踝反射及雙側膝反射,反射完全消失記2分,反射減弱記1分,反射正常記0分,本項記滿分為8分。(3)感覺功能:指右側拇趾的針刺覺、溫度覺、輕觸覺、位置覺及振動覺,任意1項發生異常記1分,正常記0分,本項記滿分共5分。TCSS總評分為以上3項評分之和,在0~19分之間。
1.5統計學方法 采用SPSS 17.0統計軟件。計量資料以(x±s)表示,組間比較采用t檢驗,計數資料比較采用χ2檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1治療后兩組臨床療效的比較 治療后觀察組顯效34例(54.0%)、有效24例(38.1%)、無效5例(7.9%)。對照組顯效26例(41.3%),有效24例(38.1%)、無效13例(20.6%)。觀察組總有效率為92.1%高于對照組的79.4%,差異有統計學意義(P<0.05)。
2.2兩組患者治療前后TCSS評分的比較 見表1。

表1 治療前后兩組TCSS評分的比較[分,(x±s)]
2.3治療前后兩組MNCV和SNCV的比較 見表2。
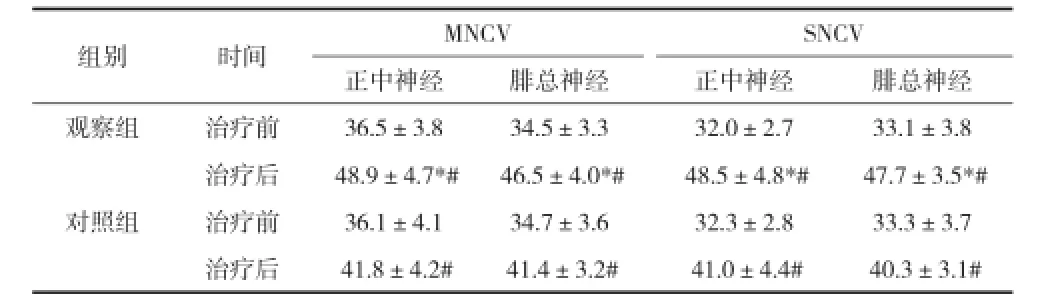
表2 治療前后兩組MNCV和SNCV的比較[m/s,(x±s)]
3 討論
DPN是在糖代謝紊亂基礎上由多種致病因素共同作用的結果,可能與高糖毒性導致的代謝紊亂、氧化-抗氧化系統失衡、神經營養障礙、細胞因子異常及自身免疫等因素相關。高血糖及由其所誘導的氧化應激反應,可引起周圍神經的滋養血管基底膜增厚并發生透明變性,滋養血管內皮細胞發生腫脹和增生,引起管壁增厚及管腔狹窄,進而周圍神經營養發生障礙,導致神經細胞發生變性和凋亡。再則氧化應激還引起神經營養因子分泌減少,阻礙受損神經細胞的修復和再生。鑒于以上認識,目前臨床上對DPN的治療主要集中在有效控制血糖基礎上調節氧化-抗氧化系統平衡及改善神經營養障礙。
α-硫辛酸是一種同時具有脂溶性和水溶性的超強抗氧化劑,其分子內獨特的雙硫鍵結構具有較強的抗氧化作用,尤其是對脂質的過氧化作用尤為明顯。其可改善周圍神經滋養血管的結構和功能、增加滋養血管血流量、促使受損神經細胞修復和再生,而減少周圍神經細胞發生變性和凋亡[5]。DPN基本病理改變是節段性脫髓鞘病變和軸突變性。甲鈷胺是一種生物學活性較強的維生素B12衍生物,其可改善神經細胞內核酸、蛋白質及脂類的代謝,促進神經細胞內RNA和DNA的合成代謝,從而提高卵磷脂和乙酰膽堿的生物合成作用。神經節苷脂可以幫助受損的神經細胞進行修復,全程參與神經細胞的分化、識別、黏附、信號轉導及凋亡等生理生化演變過程,對胰島β細胞信號肽途徑有改善作用,對胰島β細胞的分泌作用及細胞凋亡有調節作用,其還可以增加胰島β細胞對胰島素的胞吐作用及增加胰島素結晶體的穩定性。
在本文中對照組患者使用α-硫辛酸及甲鈷胺治療,總有效率接近80%,臨床癥狀明顯緩解,神經傳導速度加快,說明治療有效。觀察組加用GM1后,臨床療效進一步提高、癥狀緩解更顯著、神經傳導速度更快,說明聯合用藥療效更確切,值得臨床推廣使用。
1 Ziegler D,Rathmann W,Dickhaus T,et al.Prevalence of polyneuropathy in pre-diabetes and diabetes is associated with abdominal obesity and macroangiopathy: the MONICA/KORA Augsburg Surveys S2 and S3. Diabetes Care,2008,31(3):464~469.
2 Singh R, Kishore L, Kaur N. Diabetic peripheral neuropathy: current perspective and future directions . Pharmacol Res,2014,80:21~35.
3 中華醫學會糖尿病學分會.中國2型糖尿病防治指南.北京:北京大學醫學出版社,2011.5.
4 朱禧星.現代糖尿病學.上海,復旦大學出版社,2000.333.
5 Liu F,Zhang Y,Yang M,et al.Curative effect of alpha-lipoic acid on peripheral neuropathy in type 2 diabetes:a clinical study .Zhonghua Yi Xue Za Zhi,2007,87(38):2706~2709.
321017 浙江中醫藥大學附屬金華市中醫醫院內分泌科

