術中熒光引導技術在泌尿外科應用的現狀
楊曉峰
山西醫科大學生物醫學工程研究中心,太原 030001
*論著——生物醫學影像*
術中熒光引導技術在泌尿外科應用的現狀
楊曉峰
山西醫科大學生物醫學工程研究中心,太原 030001
本文根據微創泌尿外科發展的趨勢,結合文獻深入研究了術中熒光成像引導外科手術的理論和技術體系,闡述了術中熒光成像引導技術的工作原理,明確了臨床可以使用或臨床前期使用的熒光示蹤劑,同時全面分析了國內外術中熒光成像設備的技術性能和應用范圍,以及在泌尿外科手術中應用的現狀,提出了進一步深入研究的科學問題。
熒光成像;熒光示蹤劑;熒光成像設備;腫瘤;泌尿外科
內窺鏡診療技術高度發展的今天,泌尿系統各種腫瘤都可以采用內窺鏡或機器人微創切除。手術過程中,醫生主要根據組織的色澤、形態識別腫瘤和正常組織,判斷切除范圍和切緣陽性率與醫生的臨床經驗密切相關,所以需要研究定性、定量和靶向識別腫瘤的新技術,以提高手術治療效果。目前醫生可以借助術中內窺鏡超聲[1]、γ射線探測[2]和術中熒光成像引導識別,其中熒光成像技術(Fluorescence Imaging)由于其分辨率高,對人體無輻射損傷等優點[3],近年來發展十分迅猛,術中熒光成像引導外科手術(Intraoperative Fluorescence -Guided Surgery)將進入臨床[4.5],成為未來泌尿外科常用的診療技術。現就有關術中熒光成像引導外科的理論和技術,及其在泌尿外科的應用綜述如下:
1 術中熒光成像引導技術及其工作原理[5,6]
術中熒光成像引導技術是指在外科手術前或術中將外源性靶向或非靶向熒光示蹤劑通過靜脈注射、局部注射或器官腔內灌注,使熒光示蹤劑在手術時聚集到腫瘤組織、回流到淋巴管和淋巴結或進入血液時,熒光成像系統發射特定波長激發光,激發體內熒光示蹤劑發射熒光,同時被體外熒光成像系統攝取,將光信號換化為電信號,視頻顯示腫瘤組織、淋巴結、淋巴管、血管或神經組織結構的功能影像,引導醫生進行外科手術的臨床技術。
2 熒光示蹤劑
早在1924年Policard首先發現腫瘤組織能夠發射自體熒光,1948年Figge等發現惡性腫瘤組織中有熒光物質,1961年Lipson等首次采用熒光內窺鏡成功識別腫瘤組織。然而自體熒光十分微弱,外源性熒光示蹤劑能夠增加腫瘤細胞內熒光物質的聚集,增強腫瘤的熒光強度,實現外科手術的熒光引導。目前美國FDA批準臨床應用的熒光示蹤劑主要是原卟啉Ⅸ(PpIX)的前體物質 — 5-氨基酮戊酸(5-Aminolevulinic Acid,5-ALA)及其酯類衍生物氨基酮戊酸己酯(Hexaminolevulinate,HAL),熒光素鈉(Fluorescein Sodium)和吲哚青綠(Indocyanine green,ICG) 。其他FDA沒有批準,但在泌尿外科進行研究的示蹤劑還有金絲桃素(hypericin)和多模態示蹤劑ICG-99mTc-納米膠原等[7],其熒光特性和臨床應用如下。
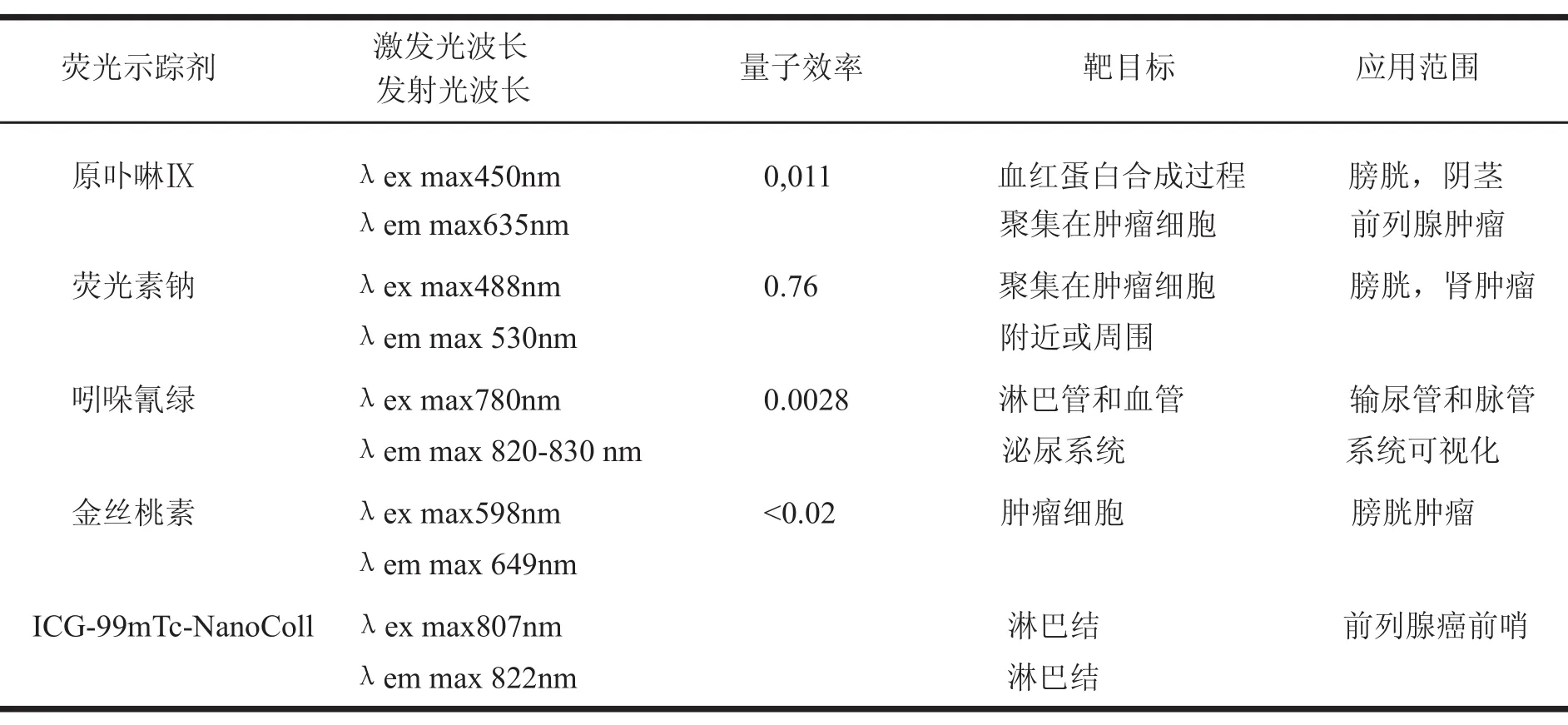
表1 泌尿外科熒光成像引導術中常用的熒光示蹤劑及其特性
2.1原卟啉Ⅸ
5-ALA及其HAL本身不產生熒光,僅是細胞內血紅素生物合成的起始物資,在細胞線粒體呼吸鏈中,甘氨酸由琥珀酸單酰輔酶A催化合成5-ALA,5-ALA在胞漿中經由卟膽原、尿卟啉原川、糞卟啉原川,再回到線粒體中由原卟啉原Ⅸ合成原卟啉Ⅸ(PpIX),在亞鐵螯合酶的作用下合成血紅素。血紅素的聚集又負反饋抑制5-ALA合成。在此通路中,只有原卟啉Ⅸ是具有熒光特性的物質,在正常情況下細胞中的原卟啉Ⅸ是中間產物,通常不會聚集。當外源性5-ALA增加時,PpIX在腫瘤細胞聚集[8],具備產生熒光的條件。5-ALA誘導內生的PpIX可以選擇性的吸收波長為375~440nm的光躍遷為激發態,激發態的PpIX分子釋放熱能和新光子,新光子能量較低,形成波長為635~700nm的紅色熒光,利用內窺鏡可以看到發射紅色熒光的腫瘤[9]。
2.2熒光素鈉
熒光素鈉是一種合成熒光染料,激發光是488nm,發射光是530nm的綠色熒光,非常明亮,量子效率為0.76。由于和粉紅色的膀胱粘膜相比有很大差異,所以熒光素鈉是一種很好的熒光示蹤劑。激光共聚焦內窺鏡檢查膀胱時使用熒光素鈉成像,與白光結合能夠在顯微水平識別膀胱腫瘤和良性膀胱粘膜上皮細胞。熒光素鈉的使用有靜脈注射和膀胱灌注2種方式,但在泌尿系統檢查時常采用膀胱灌注的方法,這種方法全身毒副作用最低,熒光素鈉能快速著色于細胞外基質[10]。
2.3吲哚青綠
目前術中熒光成像引導使用最為廣泛的是近紅外熒光示蹤劑吲哚青綠,其發射光是820~830nm,激發光是780nm,水溶液中的量子產率是0.0028。靜脈注射后立刻與血漿蛋白結合,結合率達95%,導致ICG熒光性能增強(量子效率0.012),激發光峰值紅移位25nm。ICG 為非靶向熒光示蹤劑,具有血管池效應,不與腫瘤細胞特異性結合,而是聚集于血管豐富的組織,半衰期為3~4min,可以重復使用,最大劑量為2mg//kg。ICG的發射光肉眼看不見,近紅外CCD成像形成白色圖像[11],但為了和手術野血色的組織結構有明顯的區別,一些熒光成像設備中,通過計算機軟件處理使ICG圖像添加了偽色,顏色為黃綠色,與手術野的顏色有明顯的區別[6]。同時ICG具有良好的安全性,過敏性反應的發生率﹤0.05%。
2.4金絲桃素
金絲桃素能夠激發649 nm的紅色熒光,激發光峰值波長598nm,量子效率0.02,全身毒性小,在惡性腫瘤組織中累積,然而金絲桃素不溶于水,僅溶解乙醇和1%血漿蛋白溶液中。最近研究表明與ALA和HAL相比金絲桃素診斷膀胱腫瘤的敏感性是82~94%,特異性是91~94%[12]。Kubin等[13]報道采用聚乙烯吡咯烷酮包裹金絲桃素后,使金絲桃素具有了水溶性。
2.5其他熒光示蹤劑
按照Nguyen等[4]的研究分析外源性熒光示蹤劑還可以分為非靶向熒光示蹤劑類、氨基酸和多肽類、以及人工合成的大分子等,但腫瘤靶向特異的熒光示蹤劑將是今后研究的一個熱點。
3 術中熒光成像設備[14]
2002年美國波士頓Beth Israel Deaconess醫學中心首先介紹了第一代外科成像系統,當時主要用于外科手術的動物研究,近年來逐漸進入臨床。目前美國波士頓Frangioni實驗室、日本濱松光電、法國Fluoptics公司、加拿大和荷蘭等研究機構正在從事相關研發。美國FDA批準臨床應用的有SPY。同時我國第一臺多光譜分光融合外科手術引導系統開始臨床應用。
表2中列出15種成像設備,分為開放手術系統、腹腔鏡系統和顯微成像系統三大類,雖然硬件和軟件配置上有一定差異,但工作原理基本一致。
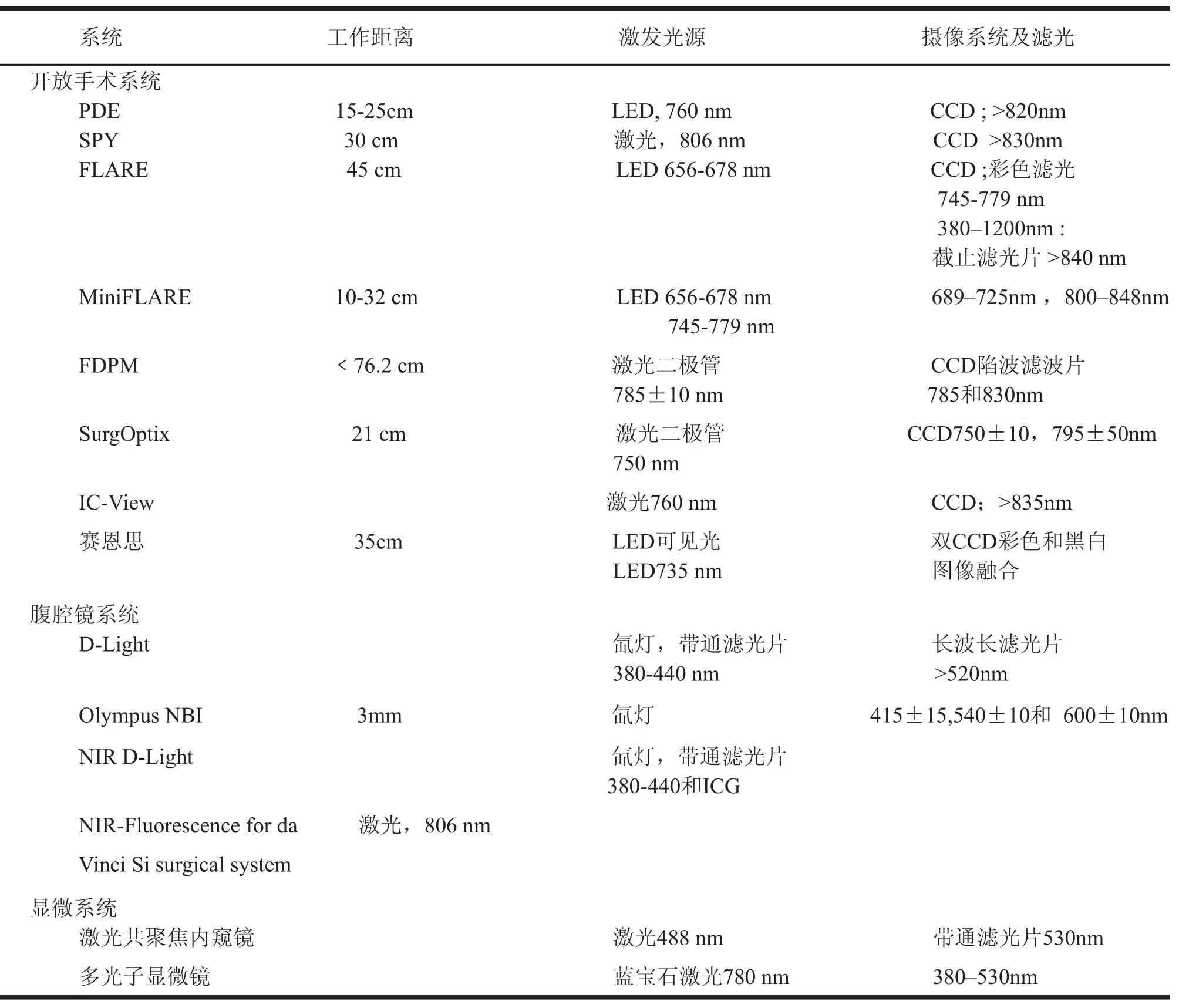
表2 熒光成像設備及其技術性能
3.1術中熒光成像系統的基本結構
術中熒光成像系統主要包括特定波長激發光源、濾光片、高靈敏熒光攝像機、計算機及其圖像處理軟件等。
3.2術中熒光成像系統技術性能
(1)FLARE?攝像系統由美國波士頓Beth Israel Deaconess醫學中心和喬治亞州立大學在2002年研制成功,FLARE是 Fluorescence - Assisted Resection and Eexploration的縮寫,即熒光輔助切除和探測。FLARE?能夠在外科手術時,顯示外科手術野的解剖結構,還能顯示肉眼看不到的近紅外熒光,同時兩者可以圖像重疊。FLARE?系統有400~650nm、656~678 nm和745~779 nm 3種光源,成像系統包括400~650 nm,689~725 nm和800~848 nm 三種波長響應的CCD。主要適用于各種開放手術。
(2)Fluobeam?是法國Fluoptics公司研制,是一種手持式成像系統,有一個花冠狀LED發射近紅外光,能夠在白光下直接檢測。Fluobeam?分為Fluobeam? 700和Fluobeam? 800 兩2種型號[15]。
(3)Artemis?手持式成像系統是彩色和熒光雙重CCD手持式攝像系統,實現全彩實時熒光成像,也具有700nm和800nm 2種成像功能,適用于腹腔鏡和開放手術。
(4)The Photodynamic Eye是有日本濱松光電研制,主要進行非損傷床旁定量評估組織灌注量,發射光源是波長為760 nm的 LED ,單色CCD,也是手持式。主要用于開放手術,使用熒光示蹤劑為ICG。
(5)SPY是由加拿大 Novadaq Technologies Inc.研制,是第一個,也是目前唯一一個被FDA許可進行心臟冠狀動脈搭橋術后評估通暢度的設備,整個系統被放置在一臺移動車上,激光輸出功率2.0 W,攝像機是30幀頻/秒的CCD,照射心臟的面積是56 cm2 (7.5 cm×7.5 cm) ,工作距離30cm[16,17]。同時也是評估游離皮瓣血運的重要工具[18,19]。還可應用于器官移植,小兒外科和泌尿外科等領域。
(6)多光譜分光融合外科手術引導系統是我國自行研制設計的新一代熒光成像引導系統,可將手術野同一部位、同一時刻組織表面的解剖學圖像和組織內的近紅外熒光功能圖像分光攝像和圖像融合,實現同一部位多光譜、多種影像的圖像融合和影像識別,在外科手術中進行精密定位和手術導航,準確顯示殘余腫瘤、淋巴管和血管,實現術中靶向識別。將主要應用于人體各部位腫瘤外科切除術中殘余腫瘤的探查和識別、腫瘤前哨淋巴結定位、以及術中血管、淋巴管和淋巴結的探測[20]。
4 泌尿外科的應用
4.1原卟啉Ⅸ熒光引導膀胱鏡檢查
目前研究明確認為膀胱內灌注5-ALA或HAL,進行PpIX熒光引導膀胱鏡檢查的靈敏度是95%,而白光膀胱鏡是70%[21,22]。5-ALA和HAL灌注行經尿道膀胱腫瘤切除術后腫瘤的復發率是一致的,兩者沒有差異[7]。PpIX熒光引導膀胱鏡檢查的主要缺點是特異性相對較低,5-ALA 的假陽性率達38%[23],假陽性率與膀胱炎癥、化療和近期經尿道腫瘤切除術有關,同時與泌尿外科醫生的學習曲線和經驗密切相關[24],同時隨著檢查時間的延長,熒光強度也逐漸下降。為了克服 5-ALA或HAL特異性較低的缺點,阻止PpIX 的降解,Fran?ois等[25]制備了ALA樹枝狀大分子復合物,發現這種復合物使ALA的水解速度減慢,體內存留時間延長,能夠持續合成PpIX,使熒光持續時間>24小時,而且使PpIX的組織滲透深度增加,沒有全身重吸收,可以替代ALA成為一種新的熒光示蹤劑。Yan等[26]應用納米沉淀技術制備載有5-ALA的納米粒子,研究表明5-ALA納米粒子對膀胱腫瘤細胞有光動力殺傷效應。
4.2原卟啉Ⅸ熒光引導激光治療陰莖腫瘤
陰莖腫瘤治療的常規方法是陰莖部分切除術或陰莖全切術,對于年輕患者保留陰莖外觀和性功能更加重要,但由于腫瘤的浸潤性,切除和保留之間選擇十分困難,保留陰莖生活質量提高,又有腫瘤局部復發的潛在危險,而保留陰莖的局部治療復發率達3.1%~48%。德國采取保留陰莖的激光治療已經有30年的經驗,2002年Frimberger等[27]開展了熒光引導診斷陰莖腫瘤的初步研究,最近Schlenker等[28]研究1999年到 2005年的26例病人,其中原位癌前期病變(Tis)11 例,浸潤性陰莖腫瘤15例,采用熒光引導的激光治療,隨訪 71.1 月( 41-104月).復發率是4 例(15.4%),研究認為熒光引導激光治療陰莖腫瘤保留陰莖外形和功能的方法能夠降低復發率,但仍然需要多中心大規模的臨床驗證。
4.3 原卟啉Ⅸ熒光引導根治性前列腺切除術
2008年Zaak等[29]首先報告了根治性前列腺切除術中,5-ALA誘導識別手術切緣的研究結果,18例前列腺癌患者(Gleason評分4-8,PSA 1-20 ng/mL),其中16例在前列腺根治術前2小時口服5-ALA (20 mg/kg),2例為對照組,所有標本都進行熒光顯微鏡和光譜分析,16例中有10例病人進行手術切緣的研究,研究認為前列腺癌細胞中有PpIX聚集,而良性上皮細胞和間質中僅有微弱的PpIX熒光。還有認為在手術前3小時應用5-ALA,對于確定陽性切緣仍然有效[30]。日本學者研究確定根治性前列腺切除術中采用PpIX-熒光引導識別,陽性切緣的特異性和敏感性是82% 和69%[31]。
4.4ICG熒光成像引導腎部分切除術
ICG是近紅外熒光血管成像最主要的近紅外熒光示蹤劑。Tobis等[32]使用SPY內窺鏡成像系統進行腹腔鏡和機器人輔助腎部分切除術術中腎腫瘤邊緣的識別,認為該技術進一步完善將有助于減少術中并發癥的發生,同時發現即使是ICG重復注射也不會超過最大使用劑量。
4.5ICG熒光成像評估移植腎血流灌注
Hoffmann等[33]設計了激光輔助吲哚青綠熒光攝像系統評估腎移植術中移植腎的血流灌注,認為該技術簡易,安全、敏感性高。
4.6ICG和多模態ICG-(99m)Tc-納米粒子引導前列腺
癌前哨淋巴結示蹤
Yuen等在66例前列腺癌根治性術中經直腸注射ICG進行近紅外成像,其中65例(98%)成功看到淋巴管,65例(97%)找到淋巴結,認為該技術安全、有效、縮短了手術時間[34]。van der Poel等[35]應用多模態ICG-(99m) Tc-納米粒子,術前注射到前列腺進行淋巴結閃爍成像和SPECT/CT成像確定淋巴結的位置,術中采用熒光腹腔鏡識別術前確定的結節,結果表明多模態ICG-(99m)Tc-納米粒子和熒光腹腔鏡結合將有助于前列腺根治術中前哨淋巴結的識別。
4.7膀胱癌前哨淋巴結示蹤
浸潤性膀胱癌有20~25%的病人有淋巴結轉移,在進行膀胱全切術時要進行淋巴結清掃。Knapp等采用IRDye? 800CW、HSA800、近紅外熒光量子點三種近紅外熒光淋巴結示蹤劑,其中HSA800的激發光峰值是784 nm, 發射光峰值是802 nm;近紅外熒光量子點的激發光峰值是775 nm, 發射光峰值是820nm。使用第一代近紅外熒光成像系統,在家犬和豬上進行試驗研究,發現注射近紅外熒光淋巴結示蹤劑后膀胱壁立刻出現明亮的熒光,10秒淋巴管熒光顯示,30秒到3分鐘前哨淋巴結顯影,在注射后2小時注射部位和前哨淋巴結仍然熒光顯影。其中25%的淋巴結全部明亮熒光顯影;45%的淋巴結部分顯影;30%的淋巴結邊緣斑點顯影。同時研究發現,膀胱內壓力影響淋巴結示蹤劑的移動,大于 50 cm H20和小于 10 cm H2O都沒有淋巴結示蹤劑的移動,膀胱內壓力是影響膀胱光學效果的重要因素[36]。
4.8輸尿管損傷的診斷
在輸尿管損傷或某些外科手術時,輸尿管尋找十分困難,Tanaka等使用0.5 mW/cm2 400~700 nm的白光,和5mW/cm2 725~775 nm的近紅外光,光斑直徑是15厘米的近紅外成像系統研究發現,在豬模型中注射7.5 μg/ kg CW800-CA,能夠在不可見光下看到輸尿管,看到輸尿管內直徑小于2.5 mm的異物,逆行注射10 μM ICG能夠精確定位輸尿管損傷的漏尿點[37]。
5 展 望
泌尿外科無論是開發手術還是內窺鏡手術,都離不開光學照明或光學成像,其中內窺鏡手術更多,這就為熒光成像在泌尿外科的廣泛應用奠定了一定基礎,今后研究的重點將是開發腫瘤靶向特異性的熒光示蹤劑以及成像性能良好的光學分子影像設備。
(References)
[1] Nadu A, Goldberg H, Lubin M,et al. Laparoscopic partial nephrectomy (LPN) for totally intrarenal tumours[J]. BJU Int, 2013,112(2): E82-86.
[2] Rousseau T, Lacoste J, Pallardy A. Laparoscopic sentinel lymph node (SLN) dissection for clinically localized prostate carcinoma: results obtained in the first 70 patients[J]. Prog Urol,2012, 22(1): 30-37.
[3] Polom W, Markuszewski M, Rho YS, Matuszewski M.Usage of invisible near infrared light (NIR) fluorescence with indocyanine green (ICG) and methylene blue (MB) in urological oncology. Part 1[J]. Cent European J Urol, 2014, 67(2):142-148.
[4] Schols R M, Connell N J, Stassen L P. Near-Infrared Fluorescence Imaging for Real-Time Intraoperative Anatomical Guidance in Minimally Invasive Surgery: A Systematic Review of the Literature[J]. World J Surg, 2014 Dec 19. [Epub ahead of print]
[5] De B E, Harlaar N J, Taruttis A,er al.Optical innovations in surgery[J]. Br J Surg, 2015 ,102(2): e56-72.
[6] De G A , Frangioni J V. An operational near infrared fluorescence imaging system prototype for large animal surgery[J]. Technol Cancer Res Treat, 2003, 2(6): 553-562.
[7] Van D B, Van Leeuwen F W, Van D P. Fluorescence guidance in urologic surgery[J]. Curr Opin Urol, 2012, 22(2): 109-120.
[8] Wachowska M, Muchowicz A, Firczuk M, et al. Aminolevulinic acid (ALA) as a product in photodynamic therapy of cancer[J]. Molecules, 2011, 16: 4140-4164.
[9] Celli J P, Spring B Q, Rizvi I, et al. Imaging and photodynamic therapy: mechanisms, monitoring, and optimization[J]. Chem Rev, 2010, 110: 2795-2838.
[10] Chang T C, Liu J J, Liao J C. Probe-based confocal laser endomicroscopy of the urinary tract: the technique[J]. J Vis Exp, 2013,(71): e4409.
[11] Verbeek F P, Troyan S L, Mieog J S, et al. Near-infrared fluorescence sentinel lymph node mapping in breast cancer: a multicenter experience[J]. Breast Cancer Res Treat, 2014, 143(2):333-342.
[12] Sim H G, Lau W K, Olivo M, et al. Is photodynamic diagnosis using hypericin better than white-lightcystoscopy for detecting superficial bladder carcinoma? [J]. BJU Int, 2005, 95:1215-1218.
[13] Kubin A, Meissner P, Wierrani F, et al. Fluorescence diagnosis of bladder cancer with new water soluble hypericin bound to polyvinylpyrrolidone: PVPhypericin[J]. Photochem Photobiol, 2008, 84:1560-1563.
[14] Keereweer S, Kerrebijn J D, Van Driel P B, et al. Optical Image-guided Surgery-Where Do We Stand? [J]. Mol Imaging Biol, 2011, 13(2): 199-207.
[15] Stockdale A, Oketokoun R, Gioux S, Frangioni JV (2010) Mini- FLARE: a compact and ergonomic dual-channel near-infrared fluorescence image-guided surgery system (Abstract).
[16] Vogt P R, Bauer E P, Graves K. Novadaq Spy Intraoperative Imaging System-current status[J].Thorac Cardiovasc Surg, 2003, 51(1): 49-51.
[17] Taggart D P, Balacumaraswami L, Venkatapathy A. Radial artery jump graft from anterior to posterior descending coronary artery[J]. Asian Cardiovasc Thorac Ann, 2009, 17(2): 143-146.
[18] Kawashima T, Naraoka S, Kakizaki T. Intraoperative graft assessment using fluorescent imaging system (SPY) [J]. Kyobu Geka, 2009, 62(7): 519-522.
[19] Pestana I A, Coan B, Erdmann D, et al. Early experience with fluorescent angiography in free-tissue transfer reconstruction[J]. Plast Reconstr Surg, 2009, 123(4): 1239-1244.
[20] 楊曉峰, 武未, 王國安. 可見光和近紅外光分光融合外科手術導航系統的研制. 生物醫學工程學雜志, 2015, 4: 待發表.
[21] Rink M, Babjuk M, Catto J W, et al. Hexyl aminolevulinate guided fluorescence cystoscopy in the diagnosis and follow-up of patients with non-muscle-invasive bladder cancer: A Critical review of the current literature[J]. Eur Urol, 2013, 64(4): 624-638.
[22] Witjes J A, Redorta J P, Jacqmin D, et al. Hexaminolevulinate -guided fluorescence cystoscopy in the diagnosis and follow-up of patients with non-muscle-invasive bladder cancer: review of the evidence and recommendations[J]. Eur Urol, 2010, 57: 607-614.
[23] Hungerhuber E, Stepp H, Kriegmair M, et al. Seven years’ experience with 5-aminolevulinic acid in detection of transitional cell carcinoma of the bladder. Urology, 2007, 69: 260-264.
[24] Draga R O, Grimbergen M C, Kok E T, et al. The quality of 5-aminolevulinic acid-induced photo-dynamic diagnosis and transurethral resection of bladdertumors: does the urologist play a role? [J]. Urol Int, 2012, 89(3): 326-331.
[25] Fran?ois A, Battah S, MacRobert A J, et al. Fluorescence diagnosis of bladder cancer: a novel in vivo approach using 5-aminolevulinic acid (ALA) dendrimers[J]. BJU Int, 2012, 110(11 Pt C): E1155-1162.
[26] Yan X, Al H S, Huang H, et al. Photodynamic effect of 5-aminolevulinic acid- loaded nanoparticles on bladder cancer cells: a preliminaryinvestigation[J]. Scand J Urol, 2013, 47(2) : 145-151.
[27] Frimberger D, Schneede P, Hungerhuber E, et al. Autofluorescence and 5-aminolevulinic acid induced fluorescence diagnosis of penile carcinoma: new techniques to monitor Nd:YAG laser therapy[J]. Urol Res, 2002, 30: 295-300.
[28] Schlenker B, Gratzke C, Seitz M, et al. Fluorescenceguided laser therapy for penile carcinoma and precancerous lesions: long-term follow-up[J]. Urol Oncol, 2011, 29: 788-793.
[29] Zaak D, Sroka R, Khoder W, et al. Photodynamic diagnosis of prostate cancer using 5-aminolevulinic acid-fi rst clinical experiences[J]. Urology, 2008, 72(2): 345-348.
[30] Blute M L, Bergstralh E J, Iocca A, et al. Use of Gleason score, prostate specific antigen, seminal vesicle and margin status to predict biochemical failure after radical prostatectomy[J]. J Urol, 2001,165: 119-125.
[31] Kupelian P, Katcher J, Levin H, et al. External beam radiotherapy versus radical prostatectomy for clinical stage T1-2 prostate cancer: therapeutic implications of stratification by pretreatment PSA levels and biopsy Gleason scores[J]. Cancer J Sci Am, 1997, 3: 78-87.
[32] Tobis S, Knopf JK, Silvers C, et al. Robot-assisted and laparoscopic partial nephrectomy with near infrared fl uorescence imaging[J]. J Endourol, 2012, 26(7): 797-802.
[33] Hoffmann C, Compton F, Sch?fer J H, et al. Intraoperative assessment of kidney allograft perfusion by laser-assisted indocyanine green fl uorescence videography[J]. Transplant Proc, 2010, 42(5):1526-1530.
[34] Yuen K, Miura T, Sakai I, Kiyosue A, Yamashita M.Intraoperative Fluorescence Imaging for Detection of Sentinel Lymph Nodes and Lymphatic Vessels during Open Prostatectomy using Indocyanine Green[J]. J Urol. 2015 Jan 10. pii: S0022-5347(15)00013-0. [Epub ahead of print]
[35] Van D P, Buckle T, Brouwer O R, et al. Intraoperative laparoscopic fl uorescence guidance to the sentinel lymph node in prostate cancer patients: clinical proof of concept of an integrated functional imaging approach using a multimodal tracer[J]. Eur Urol, 2011, 60(4): 826-833.
[36] Tanaka E, Choi H S, Humblet V, et al. Real-time intraoperative assessment of the extrahepatic bile ducts in rats and pigs using invisible near-infrared fluorescent light[J]. Surgery, 2008, 144(1): 39-48.
[37] Tanaka E, Ohnishi S, Laurence R G, et al. Real-time intraoperative ureteral guidance using invisible nearinfrared fl uorescence[J]. J Urol, 2007, 178(5): 2197-2202.
Intraoperative Fluorescence Guidance in Urology
YANG Xiaofeng
Biomedical Engineering Research Center, Shanxi Medical University, Taiyuan 030001
According to the development of minimally invasive surgery, we researched the theory and technical system of intraoperative fl uorescence imaging guided urology. The operational principle of fl uorescence imaging guided surgery and fl uorescent tracer were described. The technical performance and application scope of fl uorescence imaging device at home and abroad were analysed comprehensively in urology. We put forward the scientifi c problems for further research.
fl uorescence imaging; fl uorescent tracer; fl uorescence imaging device; tumor; Urology
R651.1
A doi 10.11966/j.issn.2095-994X.2015.01.01.14
2015-02-28;
2015-03-10
國家自然科學基金資助(編號81172444 )
楊曉峰,教授,研究方向為泌尿系統腫瘤診治,Email:yxfylq@163.com
引用格式:楊曉峰. 術中熒光引導技術在泌尿外科應用的現狀 [J].世界復合醫學, 2015,1(1):79-84.