大蒜素及其前藥對食管癌細胞生長的影響
楊金部常全娥茍萍魏鴻雁
(1.新疆大學生命科學與技術學院,烏魯木齊 830046;2.新疆維吾爾自治區中藥民族藥研究所,烏魯木齊 830002)
大蒜素及其前藥對食管癌細胞生長的影響
楊金部1常全娥1茍萍1魏鴻雁2
(1.新疆大學生命科學與技術學院,烏魯木齊 830046;2.新疆維吾爾自治區中藥民族藥研究所,烏魯木齊 830002)
通過大蒜素及大蒜素前藥處理食管癌Eca9706細胞,觀察細胞形態,測定乳酸脫氫酶(LDH)活性和DNA降解。結果表明,癌細胞變圓、變小,活細胞數目減少,脫壁細胞和細胞碎片增多。DNA-Ladder試驗結果顯示,出現了DNA梯狀條帶,表明DNA分子發生降解。大蒜素及其前藥處理的Eca9706細胞LDH活性顯著高于對照組,隨處理濃度增加和時間延長,LDH活性依次升高,表現出時間和劑量的依賴性。大蒜素前藥處理Eca9706細胞的LDH活性明顯高于大蒜素,表明大蒜素前藥對細胞膜的損傷程度較大。
大蒜素;大蒜素前藥;食管癌;細胞形態;DNA降解
惡性腫瘤已成為人類主要死亡因素,并有進一步增高的趨勢。食管癌是食管鱗狀上皮的消化道惡性腫瘤,嚴重危害人類的身體健康,我國是世界上食管癌高發地區[1-4],每年平均病死約15萬人,位居惡性腫瘤死亡率的第4位[5]。目前,應用于腫瘤治療的大多數藥物存在毒副作用較大、敏感性低、療效不穩定、易復發等問題。因此,從傳統中藥和天然藥物中尋找防治腫瘤的有效成分已成為治療腫瘤的新途徑。
大蒜是亞洲地區人們食用的一種常見調味品,流行病學研究表明長期食用大蒜的人群其癌癥發生率低于對照人群,并可以減少胃癌的發生率與死亡率[6,7]。大蒜素(Allicin)是以大蒜鱗莖原料提取的生物活性成分的總稱,其主要成分為二烯丙基三硫化物(DATS),是傳統用于抗病毒、細菌、真菌等常用藥物。近年來發現大蒜素可通過直接殺傷腫瘤細胞及調節機體免疫功能等方式干擾腫瘤生長,在體外能夠抑制結腸癌、肺癌、前列腺癌等細胞的增殖,在動物體內對食管癌、乳腺癌、胃癌、肺癌等也具有明顯抑制作用[8-11],且對正常細胞無毒副作用。大蒜素遇到光、熱等條件時都會加速水解反應,導致分子中的二硫鍵斷裂,降解成阿藿烯類(ajoenes)、乙烯基二硫雜苯類(vinyldithiins)和硫醚類(sulfides)等有機硫化合物,導致其生物活性大幅度地降低,嚴重影響藥理作用及療效[12,13]。大蒜素的前體物質蒜氨酸在蒜氨酸酶催化下生成大蒜素(蒜氨酸和蒜氨酸酶稱之為大蒜素前藥),大蒜素前藥化學性質較穩定,但對其藥理活性是否等同于大蒜素還不清楚。本研究用大蒜素及大蒜素前藥處理食管癌Eca9706細胞,通過癌細胞形態觀察,測定乳酸脫氫酶(LDH)活性和DNA降解,探討大蒜素前藥對食管癌細胞生長的影響,旨在為尋求理化性質穩定、藥理活性高的大蒜素替代物提供理論依據。
1 材料與方法
1.1 材料
1.1.1 試驗材料 新鮮大蒜(本地購買);人食管癌Eca9706細胞株由鄭州大學基礎醫學院董子明教授饋贈,新疆生物資源基因工程重點實驗室保存。
1.1.2 主要儀器 組織搗碎機、真空冷凍干燥機、臺式冷凍離心機、水浴鍋、旋轉蒸發儀、UV-1000掃描型紫外可見分光光度計、電子分析天平、全自動高壓滅菌鍋、CO2細胞培養箱(Heal Force HF240型,China)、倒置顯微鏡(江南XD-101型,China)、酶標儀(Feic Benchmark Plus型,USA)、細胞培養瓶、離心管、細胞培養板和加樣槍等。
1.1.3 主要試劑 (NH4)2·SO4、NaCl、NaH2PO4、Na2HPO4、HCl、KCl、NaOH、DTNB、Hepes、巰基乙醇、2,4-二硝基苯肼、L-半胱氨酸、乙二胺四乙酸(EDTA)、丙三醇等均為國產分析純。
RPMI 1640培養基、0.25%胰酶消化液、10%胎牛血清(均為鼎國公司產品)、青霉素和鏈霉素(ICN Biomedicals公司)、LDH試劑盒(南京建成生物技術工程研究所)、DNA-Ladder試劑盒(碧云天生物技術研究所)、蒜氨酸(Sigma公司)。
大蒜素提取緩沖液:NaH2PO4-K2HPO4緩沖液(pH6.4)。
蒜氨酸酶提取液:50 mmol/L Na/K磷酸緩沖液(含10%甘油,5 mmol/L EDTA,5% NaCl,0.05%巰基乙醇,pH7.0)。
1.2 方法
1.2.1 主要試劑的配制
1.2.1.1 0.01 mmol/L PBS(pH7.2) 0.01 mol NaH2PO4、0.01 mol Na2HPO4、0.2 mmol/L NaCl,溶于800 mL蒸餾水,用濃HCl或NaOH調pH值至7.2后,定容至1 000 mL。
1.2.1.2 RPMI 1640培養基 1640培養基干粉一袋溶于500 mL滅菌后的去離子水中,攪拌均勻后定容至900 mL中,用0.45 μm和0.22 μm濾器過濾除菌,4℃分裝備用,-20℃長期保存。
1.2.1.3 0.25%胰酶-0.02% EDTA溶液 0.125 g 胰酶、0.015 g EDTA-2Na、0.4 g NaCl、0.02 g KCl和0.05 g葡萄糖粉完全溶解于PBS后,調pH至7.2,定容至50 mL后,用0.22 μm濾器過濾除菌,4℃分裝備用。
1.2.2 大蒜素和蒜氨酸酶的提取
1.2.2.1 大蒜素的提取 參照曾哲靈[14]方法,選取完好無損的新鮮大蒜,去皮、洗凈、瀝干,稱蒜瓣100 g,按料液比1∶1(W/V)加入4℃預冷的pH6.4磷酸緩沖液100 mL,用組織搗碎機搗碎,每次10 s,連續3次。取出勻漿液置40℃水浴充分酶解0.5 h,加入95%乙醇,在30℃水浴中提取1.5 h,抽濾,濾液在35℃減壓濃縮至10 mL左右,冷凍干燥得到大蒜素干粉。大蒜素含量的測定采用分光光度法[15],測得大蒜素干粉的得率為2.41 g/kg。置-20℃保存備用。
1.2.2.2 蒜氨酸酶的提取 選取完好無損的新鮮大蒜,去皮、洗凈、瀝干。稱蒜瓣200 g,4℃預冷,按料液比1∶1(W/V)加入預冷的pH7.0磷酸緩沖液200 mL,組織搗碎機中勻漿。勻漿液于4 000 r/min冷凍離心20 min,棄殘渣。上清液加入硫酸銨,使飽和度達到20%,4℃靜置2 h,8 000 r/min冷凍離心20 min,棄沉淀。上清液繼續加入硫酸銨,使飽和度達到50%,4℃靜置過夜,8 000 r/min冷凍離心20 min,沉淀冷凍干燥得到蒜氨酸酶。蒜氨酸酶活力的測定采用丙酮酸法[16],測得酶活力單位為24 720 U/mg。置-20℃保存備用。
1.2.3 樣品的預處理
1.2.3.1 大蒜素培養液的制備 稱取大蒜素45 mg溶于5 mL RPMI1640培養液,配置成9 mg/mL濃度,過濾除菌。臨用前,大蒜素液用RPMI 1640培養液分別稀釋至10、15、20、30和 40 μg/mL。
1.2.3.2 大蒜素前藥培養液的制備 將30 mg蒜氨酸和15 mg蒜氨酸酶混合,溶于5 mL RPMI 1640培養液,配置成9 mg/mL濃度,過濾除菌。使用前用RPMI1640培養液稀釋,稀釋濃度同上。
1.2.4 Eca9706細胞培養 Eca9706細胞復蘇后,用0.25%胰蛋白酶消化,收集細胞,加入新鮮的RPMI 1640培養液稀釋至2×104/mL,按100 μL/孔接種于96孔板(1.0×105個/孔),于37℃、5% CO2、飽和濕度條件下靜置培養12 h。傳代3次,取對數生長期細胞進行試驗。
1.2.5 形態學觀察 將制備好不同濃度(15、20和30 μg/mL)大蒜素、大蒜素前藥按每孔100 μL的量加到培養好的Eca9706細胞中,對照組加等體積的細胞培養液,各組設3個重復孔,于37℃、5% CO2的培養箱孵育48 h,倒置顯微鏡下觀察細胞形態。
1.2.6 乳酸脫氫酶(LDH)活性測定 處于對數生長期的Eca9706細胞按1.0×105個/孔接種于24孔培養板,培養1 d后,分別用低、中、高濃度(10、20和40 μg/mL)大蒜素及其前藥在細胞培養箱中處理24、48和72 h,以只加培養基的細胞為空白對照,培養結束時直接收集Eca9706細胞培養液上清,按照LDH試劑盒說明書檢測其活性。
1.2.7 DNA-Ladder試驗 將處于對數生長期的Eca9706細胞接種于6孔培養板(2.0×106個/孔),培養1 d后分別加入100 μL低、中、高濃度(10、20和40 μg/mL)大蒜素及前藥,以只加培養基的細胞為空白對照,48 h后收集細胞,PBS洗滌2次。參照DNA Ladder試劑盒說明書提取DNA,進行2%瓊脂糖凝電泳,拍照。
1.2.8 統計學分析 每組試驗重復3次,采用Prism統計軟件對數據進行兩因素方差分析和顯著性檢驗,P<0.05為差異顯著。
2 結果
2.1 大蒜素及其前藥對Eca9706細胞形態的影響
對照組Eca9706細胞平鋪貼壁生長,細胞之間排列緊密,多呈橢圓形或棒狀,生長狀態良好,幾乎無脫壁細胞。經不同濃度大蒜素和大蒜素前藥處理48 h后,細胞變圓、體積變小,活細胞數目減少,細胞形態呈現不規則形狀,脫壁細胞和細胞碎片增多(圖1,圖2)。
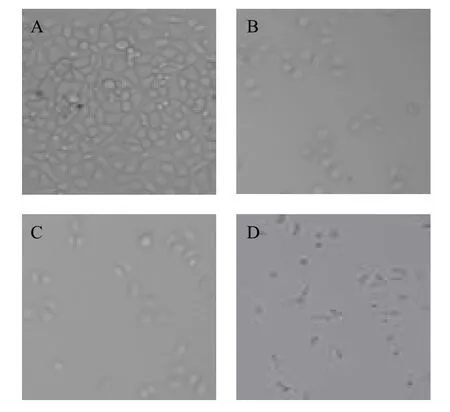
圖1 大蒜素處理Eca 9706細胞48 h細胞形態(100×)
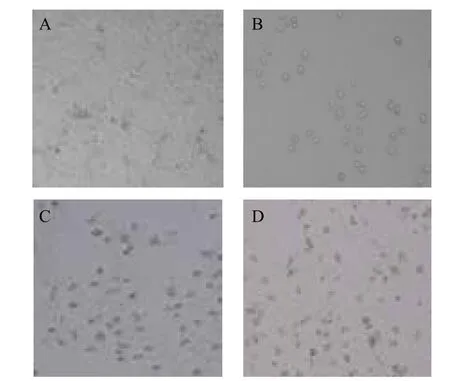
圖2 大蒜素前藥處理Eca 9706細胞48 h的細胞形態(100×)
2.2 大蒜素及其前藥對乳酸脫氫酶(LDH)的影響
在正常情況下,細胞內大分子物質LDH 不能通過細胞膜,但在細胞膜受損傷導致通透性增加時,LDH 從細胞膜釋放出來,因此LDH 能較好地反映細胞膜損傷程度。在本試驗中,低、中、高濃度的大蒜素及其前藥處理Eca9706細胞,LDH活性均高于對照組,并具有時間和劑量的依賴性(圖3)。除了低濃度大蒜素處理組(24 h)外,其他各處理組與對照組比較LDH活力均有顯著差異(P<0.05)。高濃度大蒜素及前藥處理Eca9706細胞(48 h),LDH活性為對照組的3.06和3.77倍。在相同的處理濃度和處理時間,大蒜素前藥的LDH活性均大于大蒜素,說明大蒜素前藥對細胞膜的損傷更為嚴重。

圖3 大蒜素(A)及前藥(B)對Eca9706 LDH活性的影響
2.3 大蒜素及其前藥對Eca9706細胞DNA降解的影響
細胞凋亡的特征之一是染色質DNA降解成180-200 bp左右的寡聚核苷酸片段,在瓊脂糖凝膠電泳中產生特異的梯型的條帶[17,18]。大蒜素及其前藥處理Eca9706細胞48 h后進行DNA瓊脂糖電泳,出現DNA梯狀條帶(圖4),表明Eca9706細胞的DNA分子發生降解,細胞出現凋亡現象。
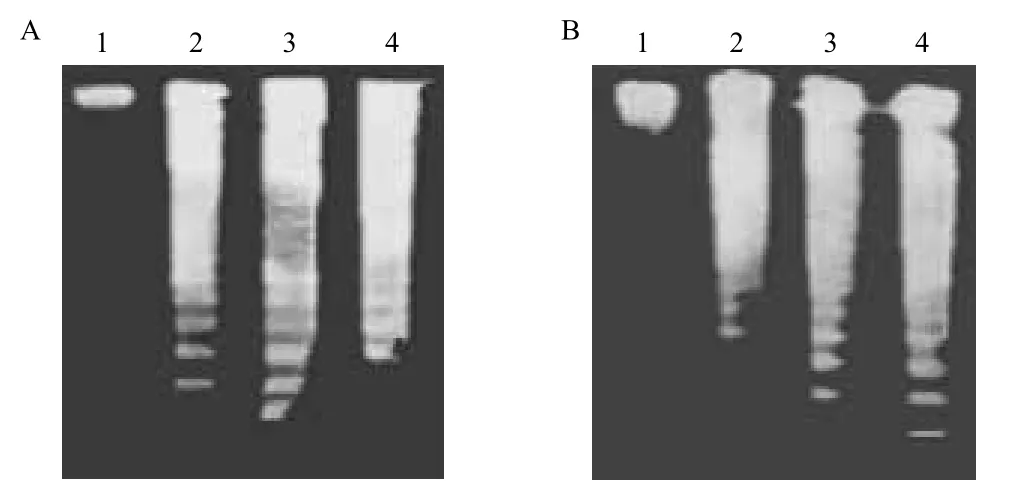
圖4 大蒜素(A)及前藥(B)對Eca9706細胞 DNA降解的影響
3 討論
大蒜制劑具有多方面、多環節的抗腫瘤綜合效應,能抑制多種癌細胞生長。大蒜素作為一種高效低毒的天然化合物,目前認為其抗癌作用與抗氧化、誘導腫瘤細胞凋亡、影響細胞周期、免疫調節、阻斷致癌物合成、增強腫瘤細胞對抗癌藥物的敏感性等有關[19,20]。大蒜素前藥化學性質較穩定,但對其前藥功效是否與大蒜素相當,目前的報道較少。我們前期的試驗已證明大蒜素及其前藥對食管癌Eca9706細胞具有顯著的增殖抑制作用,并且大蒜素前藥的抑制率高于大蒜素[21]。在本試驗中經大蒜素和大蒜素前藥處理,Eca9706細胞的形態發生顯著的變化,活細胞數目減少。DNA-Ladder試驗表明Eca9706細胞的DNA分子發生降解,細胞出現凋亡。乳酸脫氫酶活性測定表明,大蒜素前藥對細胞膜的損傷程度大于大蒜素。這些結果說明大蒜素前藥在抑制食管癌Eca9706細胞增殖的功效優于大蒜素。大蒜素前藥比大蒜素化學性質穩定,因此蒜氨酸和蒜氨酸酶有望成為控制腫瘤生長的天然理想藥物。
4 結論
大蒜素及其前藥能夠抑制食管癌Eca9706細胞的增值,誘導Eca9706細胞凋亡。不同濃度的大蒜素及其前藥處理Eca9706細胞,LDH活性均高于對照組,并在一定范圍內具有時間和劑量的依賴性,而且大蒜素前藥對細胞膜的損傷更為嚴重。
[1]張思維, 張敏, 李光琳, 等.2003~2007年中國食管癌發病與死亡分析[J].中國腫瘤, 2012, 21(4):241-247.
[2]鐘釧, 譚家駒, 徐致祥.食管癌流行病學病因學研究進展[J].河南預防醫學雜志, 2011, 22(1):1-10.
[3]李顥, 李會慶.食管癌的流行病學研究進展[J].中華胃癌外科雜志, 2009, 1(1):96-97.
[4]Kamangar F, Dores GM, Anderson WF. Patterns of cancer incidence,mortality, and prevalence across five continents:defining priorities to reduce cancer disparities in different geographic regions of the world [J]. J Clin Oncol, 2006, 24(14):2137-2150.
[5]孫燕.內科腫瘤學[M].北京:人民衛生出版社, 2001:102.
[6]王海燕, 許才紱, 王慶莉.大蒜素對胃癌細胞株及裸鼠移植瘤的抑制作用[J].腫瘤防治研究, 2001, 28(2):94-97.
[7]Takezaki T, Gao CM, Wu JZ, et al. Dietary protective and risk factors for esophageal and stomach cancers in a low-epidemic area for stomach cancer in Jiangsu Province, China:comparison with those in a high-epidemic area [J]. Jpn J Cancer Res, 2001, 92(11):1157-1165.
[8]Sun L, Wang X. Effects of allicin on both telomerase activity and apoptosis in gastric cancer SGC-7901 cells [J]. World J Gastroenterol, 2003, 9(9):1930-1934.
[9]Jakubikova J, Sedlak J. Garlic-derived organosulfides induce cytotoxicity, apoptosis, cell cycle arrest and oxidative stress in human colon carcinoma cell lines [J]. Neoplasma, 2006, 53(3):191-199.
[10]Sengupta A, Ghosh S, Bhattacharjee S. Allium vegetables in cancer prevention:an overview [J]. Asian Pac J Cancer Prev, 2004, 5(3):237-245.
[11]Arunkumar A, Vijayababu MR, Gunadharini N, et al. Induction of apoptosis and histone hyperacetylation by diallyl disulfide in prostate cancer cell line PC-3 [J]. Cancer Letters, 2007, 251(1):59-67.
[12]Jane EL, Collin HA. Presence of alliinase in isolated valcuoles and of alkyl cysteine sulphoxides in the cytoplasm of bulbs of onion(Allium Cepa) [J]. Plant Science Letters, 1981, 22(2):169-176.
[13]Fujisawa H, Suma K, Origuchi K, et al. Biological and chemical stability of garlic-derived allicin [J]. Agric Food Chem, 2008, 56(11):4229-4235.
[14]曾哲靈, 熊偉, 熊濤, 等.大蒜素的提取工藝研究[J].食品與發酵工業, 2006, 32(2):121-123.
[15]Han J, Lawson L, Han G, et al. A spectrophotometric method for quantitative determination of allicin and total garlic thiosulfinates[J]. Anal Biochem, 1995, 225(1):157-160.
[16]王秀奇.基礎生物化學實驗[M].北京:高等教育出版社,2003:219-222.
[17]Coheng M, Sun XM, Snowden RT, et al. Key apoptosis may occur in the absence of internucleaomal DNA fragmentation [J]. Biochem J,1992, 286(2):331-334.
[18]秦永德, 陳堅, 王顥, 等.蒜氨酸+蒜酶誘導人胃腺癌細胞凋亡及其分子機制的研究[J].新疆醫科大學學報, 2003, 26(4):321-323.
[19] 孔春芳, 丁江華, 陳國安.大蒜素抗癌作用與信號傳導通路[J].重慶醫學, 2013, 42(10):1175-1177.
[20]孫萍, 于維萍, 段云霞.大蒜提取物抗腫瘤作用研究進展[J].齊魯藥事, 2005, 23(3):159-161.
[21]常全娥.大蒜素和大蒜素前藥對食管癌細胞的抑制作用及誘其凋亡的分子機制[D].烏魯木齊:新疆大學, 2012.
(責任編輯 馬鑫)
Growth Influence of Allicin and Its Prodrug on Esophageal Cancer Cells
Yang Jinbu1Chang Quan’e1Gou Ping1Wei Hongyan2
(1. College of Life Science and Technology,Xinjiang University,Urumqi 830046;2. Xinjiang Institute of Chinese Medicine and Medicine of National Minorities,Urumqi 830002)
We observed the cancer cell morphology, determined lactate dehydrogenase(LDH) activity and DNA degradation after allicin and its prodrug(alliin + alliinase) treated human esophageal cancer Eca9706 cells. The results showed that the cancer cells became more circular and smaller, the number of living cells decreased, the non-adherent cells and cell debris increased. DNA-Ladder revealed to exist DNA ladder line, which indicated DNA molecule degraded. Cancer cells’ LDH activity treated with allicin and its prodrug was significantly higher than the control group. LDH activity had a time and dose dependent manner with treated concentration increased and time extended. Eca9706 cells’ LDH activity by the prodrug treated was higher than allicin, this confirmed prodrug could cause great damage on cell membrane.
allicin;allicin prodrug;human esophageal cancer;cell morphology;DNA degradation
10.13560/j.cnki.biotech.bull.1985.2015.02.034
2014-06-27
新疆自治區高校科研計劃(XJEDU02010I13)
楊金部,女,碩士研究生,研究方向:食品工程;E-mail:yangjinbu2010@126.com
茍萍,女,教授,研究方向:生物化學;E-mai:gou__ping@sina.com

