斯達油脂酵母中自噬與油脂積累的關聯性分析
韓冰 楊琴 崔清華
(云南大學生命科學學院,昆明 650091)
斯達油脂酵母中自噬與油脂積累的關聯性分析
韓冰 楊琴 崔清華
(云南大學生命科學學院,昆明 650091)
旨在證明斯達油脂酵母中自噬參與油脂積累過程。在不同油脂積累水平下,檢測相關自噬基因的表達,觀察自噬與油脂積累是否有潛在相關性;用自噬促進劑促進自噬后,觀察酵母油脂積累水平是否有差異。結果表明,與油脂低積累水平相比,在油脂高積累條件下,斯達油脂酵母自噬水平較低;用自噬促進劑處理后,酵母油脂積累降低。在斯達油脂酵母中,自噬與油脂積累成負相關性,自噬水平的提高會使酵母中油脂積累降低。
自噬;斯達油脂酵母;油脂積累;泛素樣共軛體系
細胞自噬(autophagy)是真核細胞中高度保守的細胞內自身降解的代謝過程[1],通常細胞自噬的發生主要是將部分胞漿和壞死或衰老的細胞器隔離在具有雙層膜結構的囊狀自噬體中,通過自噬體運輸,將這些細胞成分運送到降解性的細胞器(如動物細胞的溶酶體和植物細胞的液泡)中進行分解,分解產生的大分子物質進一步回收利用。自噬是細胞內自我更新的重要途徑,對細胞的生命維持和細胞繁殖具有重要的意義。在真核細胞中,主要存在3種類型的自噬,即大自噬、小自噬和分子伴侶介導的自噬(chaperone-mediated autophagy,CMA)。這些自噬過程不僅有明顯的功能分工,而且它們的作用機理顯著不同[2]。由于在小自噬和分子伴侶介導的自噬的研究進展一直比較緩慢,一般所說的自噬通常指的是大自噬。大自噬的發生主要是通過自噬相關蛋白Atg(Autophagy-related genes)來實現的。
一般來說,大自噬主要涉及兩個過程:自噬的誘導(圖1-A)和自噬體的形成(圖1-B)。在自噬體的形成和成熟過程中起關鍵作用的是兩個自噬泛素樣共軛體系:Atg8-PE(磷脂酰乙醇胺)和Atg12-Atg5-Atg16系統[3]。細胞自噬水平一般通過共軛體系的表達量來衡量。Atg8-PE體系的形成是通過新合成的Atg8蛋白的C末端甘氨酸殘基在半胱氨酸蛋白酶Atg4的作用下暴露出來,隨后在泛素活化樣酶(E1)Atg7和泛素結合樣酶(E2) Atg3的作用下激活Atg8,并通過甘氨酸與PE結合[4]。此外,新合成的Atg12蛋白在E1樣酶Atg7和E2樣酶Atg10的作用下與Atg5結合,最終Atg12-Atg5綴合物與Atg16結合形成Atg12-Atg5-Atg16體系。
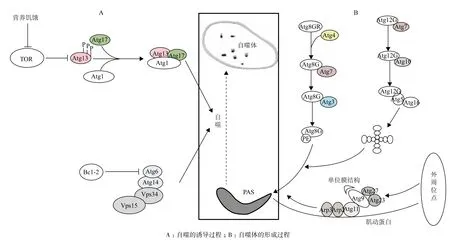
圖1 自噬過程
真核細胞自噬的發生通常是程序化的調控過程,特別是由絲氨酸/蘇氨酸蛋白激酶TOR(Target of rapamycin)介導的信號調控通路,在自噬的發生過程中經常起著主導作用。在正常營養條件下,TOR處于激活狀態,細胞自噬受到抑制;當細胞處于營養饑餓的條件下,TOR被抑制,使得Atg13與Atg1、 Atg17的親和力上升,形成大量的Atg1-Atg13-Atg17激酶復合物,這些激酶復合物進一步誘導細胞自噬增強[5]。除了TOR信號通路,磷脂酰肌醇-3-激酶(PtdIns3K)復合物I也對細胞自噬起著非常重要的調控作用。PtdIns3K復合物I是一種脂質激酶,包含4種組分,即Vps34、Vps15、Vps30/Atg6和Atg14[6]。PtdIns3K復合物I定位到PAS(Preautophagosomal structure/Phagophore assembly site)位點(自噬體形成的位點)并形成磷脂酰肌醇-3-磷酸(PtdIns(3)P)進而通過PtdIns(3)P募集自噬體形成必須的Atg蛋白。PtdIns(3)P主要的下游蛋白是Atg18和Atg21,Atg2-Atg18復合體在自噬體膜的轉運中發揮著重要作用。
自噬通常參與細胞的發育和分化、維護細胞的生命以及調節生命的延長等重要的生理過程。最近的研究發現自噬可能與油脂代謝有緊密的聯系。Lapierre等[7]在線蟲中發現,自噬作用參與了線蟲油脂代謝,通過清理細胞內多余脂肪,促進了能量的重新利用,最終延長了機體的壽命;Heaton和Randall[8]研究發現登革病毒能夠通過調控寄主自噬來提高油脂代謝水平,進而產生大量ATP提供病毒復制的能量;Vescovo等[9]的研究發現,自噬可以抵消由丙型肝炎病毒引起的油脂代謝改變,自噬的中斷會促進攜帶丙型肝炎病毒病人脂肪肝的發展;特別是Singh等[10]在小鼠的肝細胞中發現,自噬參與了脂滴中油脂的降解,并且提出了一個“脂類自噬”的模型,在調控通路的作用下自噬泛素樣共軛體系會在脂滴外膜上聚集并包裹著一部分脂滴形成“脂類自噬體”,脂類自噬體包裹著含有三酰甘油的脂滴與溶酶體融合并被溶酶體內的水解酶水解形成脂肪酸,隨后脂肪酸在線粒體內通過β-氧化為細胞提供能量。這些在動物細胞中的研究都預示著自噬在油脂代謝中的主要作用是通過降解脂肪來實現的。然而,Zhang等[11]的研究發現在產油酵母-圓紅冬孢酵母(Rhodosporidium toruloides)中,在細胞增殖和油脂累積過程中自噬相關基因,如Atg1、Atg2、Atg8和Atg20,表達水平顯著上調,強烈預示了這些自噬相關基因可能參與了油脂的生物合成過程。但是對自噬相關基因參與油脂累積的代謝機理至今知之甚少。在酵母中,自噬相關基因是否參與調控了油脂的生物合成還不清楚。
斯達油脂酵母(Lipomyces starkeyi)是一種重要的產油酵母,由于細胞能夠利用多樣的碳源,高效累積儲存油脂(單細胞油脂累積能夠達到干重65%),斯達油脂酵母在工業上利用微生物工程化產油的生產實踐中受到高度關注[12]。本研究通過調查斯達油脂酵母在油脂累積過程中自噬泛素樣共軛體系基因的表達規律,揭示酵母中細胞自噬與油脂積累的內在聯系,不僅有助于探討在酵母中自噬相關基因參與調控油類代謝的分子機理,而且對提高產油效率的斯達油脂酵母菌株工程化改良具有參考意義。
1 材料與方法
1.1 材料
1.1.1 菌株 斯達油脂酵母AS 2.1560,由中國普通微生物菌種保藏管理中心(CGMCC)提供,保藏于-80℃中。
1.1.2 培養基 YPD培養基成分包括:酵母膏10 g/L;蛋白胨20 g/L;葡萄糖20 g/L;瓊脂15 g/L(固體培養基)。基礎發酵培養基[13]成分包括:KH2PO412.5 g/L;Na2HPO41 g/L;(NH4)2SO40.5 g/L;MgSO4·7H2O 2.5 g/L;CaCl2·2H2O 0.25 g/L;酵母浸粉 1.9 g/L;葡萄糖 36 g/L;微量元素溶液 0.625 mL;pH5.0。其中微量元素溶液的成分:FeSO4·7H2O 16 g/L;MnSO4·H2O 4 g/L;Al2(SO4)3·18H2O 5.52 g/L;CoCl2·6H2O 2.92 g/L;ZnSO4·7H2O 0.8 g/L;Na2MoO4·2H2O 0.8 g/L;CuCl2·2H2O 0.4 g/L;H3BO30.2 g/L;KI 1.6 g/L,所有成分溶于5 mol/L的鹽酸中。基礎發酵培養基各成分溶解于去離子水中,高壓滅菌。
1.2 方法
1.2.1 培養方法 用接種針蘸取少量菌液,在YPD平板上劃線培養直至出現單克隆(約5 d),挑取單克隆于裝有30 mL YPD液體培養基的三角瓶(100 mL)中,30℃,200 r/min培養2 d。吸取500 μL菌液于新的YPD液體培養基中,30℃,200 r/min培養2 d,在600 nm處檢測菌液OD值并根據OD值吸取一定量的菌液于2 mL EP管中,離心收集并用滅菌水洗2遍,然后分別轉移到裝有30 mL碳氮比30和150發酵培養基的三角瓶(100 mL)中,使菌液起始OD值為0.4,30℃,200 r/min培養,每24 h收集菌液進行后續檢測。不同碳氮比培養基是在基礎發酵培養基的基礎上配制的,在其他成分不變的前提下,改變基礎發酵培養中氮源(酵母浸粉和硫酸銨)的含量使得碳元素和氮元素的比值為30和150(硫酸銨和酵母浸粉同比例增加或減少)。
1.2.2 Atg蛋白的鑒定與序列分析 以釀酒酵母數據庫(http://www.yeastgenome.org/)和擬南芥數據庫(http://www.arabidopsis.org/)里已知的Atg蛋白序列作為探針,在斯達油脂酵母數據庫(http://genome. jgi.doe.gov/pages/blast.jsf?db=Lipst1_1)中進行blastp比對,對于具有顯著E值(<10-5)的蛋白被認為是潛在的斯達油脂酵母Atg蛋白。同樣的方法用于鑒定畢赤酵母(Pichia pastoris)潛在的Atg蛋白。在在線服務器GSDS(http://gsds.cbi.pku.edu.cn/)中,通過比對釀酒酵母、畢赤酵母和斯達油脂酵母共軛體系中自噬相關基因的基因組和cDNA序列,檢測這些基因的外顯子和內含子的分布。
1.2.3 油脂含量的檢測 采用磷酸-香草醛法檢測油脂含量[14]。取2 mL菌液,12 000 r/min離心10 min,蒸餾水洗2次。定容至2 mL,取50 μL(對照取蒸餾水),加入一帶塞試管中,加入18 mol/L H2SO41 mL,沸水浴中孵化10 min,常溫水浴5 min,加入2.5 mL磷酸-香草醛試劑,37℃保溫1 h,常溫水浴10 min,于530 nm測其OD值。剩余的1.95 mL菌液烘干,測量干重。油脂含量=(0.10718+3.63×吸光度)/干重。
1.2.4 自噬共軛系統的表達檢測 采取液氮研磨法提取RNA。離心收集一定量的酵母菌液,用蒸餾水洗滌3遍,離心收集菌體并放入液氮預冷的研缽中,加入液氮研磨將研磨后的菌體轉移到裝有1 mL Trizol的試管中,在渦旋儀上震蕩30 s,室溫靜置5 min,4℃,12 000 r/min離心15 min;取上清加入0.2 mL氯仿,震蕩15 s,靜置5 min;4℃,12 000 r/min離心15 min,取上清,加入等量的異丙醇,輕輕混勻,室溫靜置10 min;4℃,12 000 r/min離心10 min,棄上清;加入1 mL 75%乙醇,輕輕洗滌沉淀,4℃,7 500 r/min離心5 min,棄上清;待乙醇揮發完全,加入適量RNase free水溶解。吸取少量提取的RNA通過1%瓊脂糖凝膠進行檢測,確定提取的RNA無明顯降解(有3個明亮條帶),通過Thermo Scientific NanoDrop 2000進行濃度和純度的檢測,A260/A280值在1.8-2.0之間說明RNA純度較好。提取的RNA通過寶生物公司的PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)試劑盒進行逆轉錄,逆轉錄體系中加入1 μg的RNA模板,逆轉錄后通過Thermo Scientific NanoDrop 2000檢測體系中cDNA濃度,并將所有樣品的cDNA濃度稀釋到100 ng/μL。通過Real-time PCR的方法檢測自噬共軛體系轉錄水平的表達,使用的儀器為Applied Biosystems7300,使用的熒光染料為寶生物的SYBR Premix Ex Taq II(Tli RNaseH Plus),PCR體系為20 μL,cDNA模板量加入200 ng。共軛體系所涉及到的基因引物序列如表1所示,引物擴增片段為80-150 bp之間,Tm值為60℃左右。
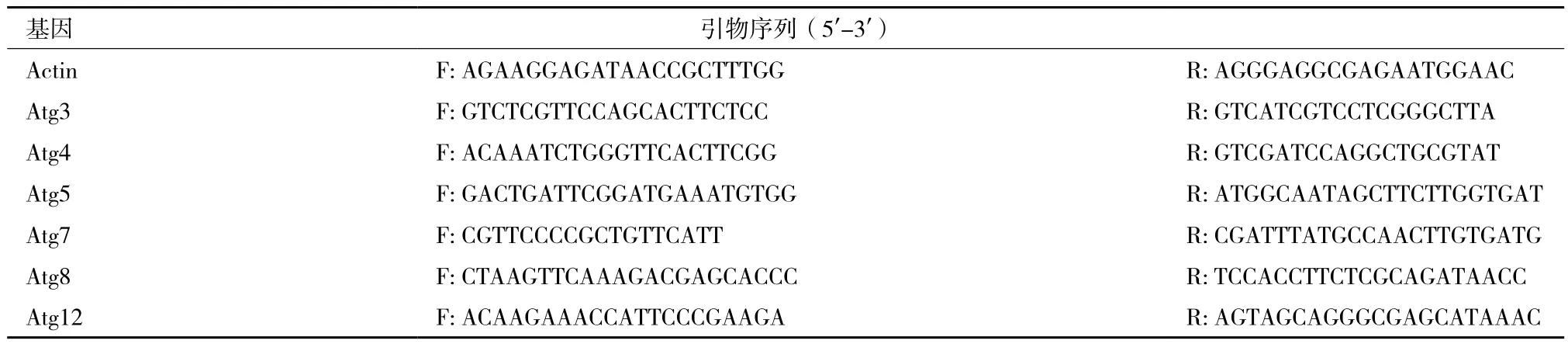
表1 Real-time PCR引物
1.2.5 自噬誘導劑-雷帕霉素處理對油脂累積的影響 為了檢測自噬活性增加后對油脂累積的影響,在斯達油脂酵母培養基中增加了細胞自噬誘導劑-雷帕霉素。首先將雷帕霉素溶解于DMSO中(使其儲存濃度為10 000 μmol/L),再分別加入到碳氮比30和150培養基中,使雷帕霉素在培養基中的濃度為0 nmol/L、1 nmol/L、10 nmol/L、100 nmol/L、1 μmol/L和10 μmol/L(不同濃度的雷帕霉素溶解于相同體積的DMSO中),揺菌培養4 d后,檢測細胞的油脂含量。
2 結果
2.1 斯達油脂酵母中自噬相關基因的鑒定與序列分析
基于斯達油脂酵母全基因組序列,以釀酒酵母和擬南芥中已知的Atg基因氨基酸序列為搜索探針,以序列相似性E值<10-5閾值為標準,共鑒別了13個潛在的斯達油脂酵母Atg基因(表2),根據這些基因在釀酒酵母和擬南芥自噬過程中的作用,13個潛在的斯達油脂酵母Atg基因作用于不同自噬過程,包括Atg3、Atg4、Atg5、Atg7、Atg8、Atg12參與形成以Atg8和Atg12為主體的自噬泛素樣共軛體系,Atg1、Atg6、Atg13、Atg20和Vps15、Vps34參與到上游的自噬調控通路中,Atg2、Atg9和Atg18參與到Atg9循環系統中。
通常,自噬泛素樣共軛體系在自噬過程中發揮著極其重要的作用。參與這些過程的Atg基因結構,尤其是外顯子(exon)和內含子(intron)在基因組中的分布規律,包括數量和發生位置,能夠反映基因的產生和進化過程[15]。為了進一步檢查酵母自噬泛素樣共軛體系在基因結構上的保守性,我們根據畢赤酵母的基因組序列,鑒別了畢赤酵母泛素樣共軛體系相關的基因,比較分析了釀酒酵母、畢赤酵母和斯達油脂酵母泛素樣共軛體系基因的結構,包括內含子的數目和位置、特征性位點。如圖2所示,釀酒酵母6個基因都沒有內含子,畢赤酵母的Atg8和Atg12各有1個內含子,而斯達油脂酵母的每個Atg基因都有內含子,其中Atg3和Atg12的內含子數為1個,Atg4、Atg5和Atg8的內含子數均為3個,Atg7的內含子數為5個。比較斯達油脂酵母和畢赤酵母內含子發生的位置發現,盡管畢赤酵母的Atg8和Atg12各只有一個內含子,但他們發生的位置和斯達油脂酵母相似。通過比對在釀酒酵母中每個基因已經鑒別到的特征位點發現,斯達油脂酵母和畢赤酵母都具有相似的位點,包括Atg3和Atg7中的半胱氨酸位點(C),Atg5中的賴氨酸受體位點(K),Atg8和Atg12上參與共價結合的保守甘氨酸位點(G)(畢赤酵母未檢出保守甘氨酸位點),以及Atg4蛋白水解活性的半胱氨酸位點(C)。這些結果說明酵母共軛體系蛋白的保守性很強,可能與Atg蛋白相似的功能有關。然而,這些基因序列的長度以及特征位點的位置在3個酵母中有很大的變異,特別是斯達油脂酵母在基因結構上和其它兩個酵母有更大的差異,反映了在系統發生上斯達油脂酵母和其它兩種酵母的關系較遠。
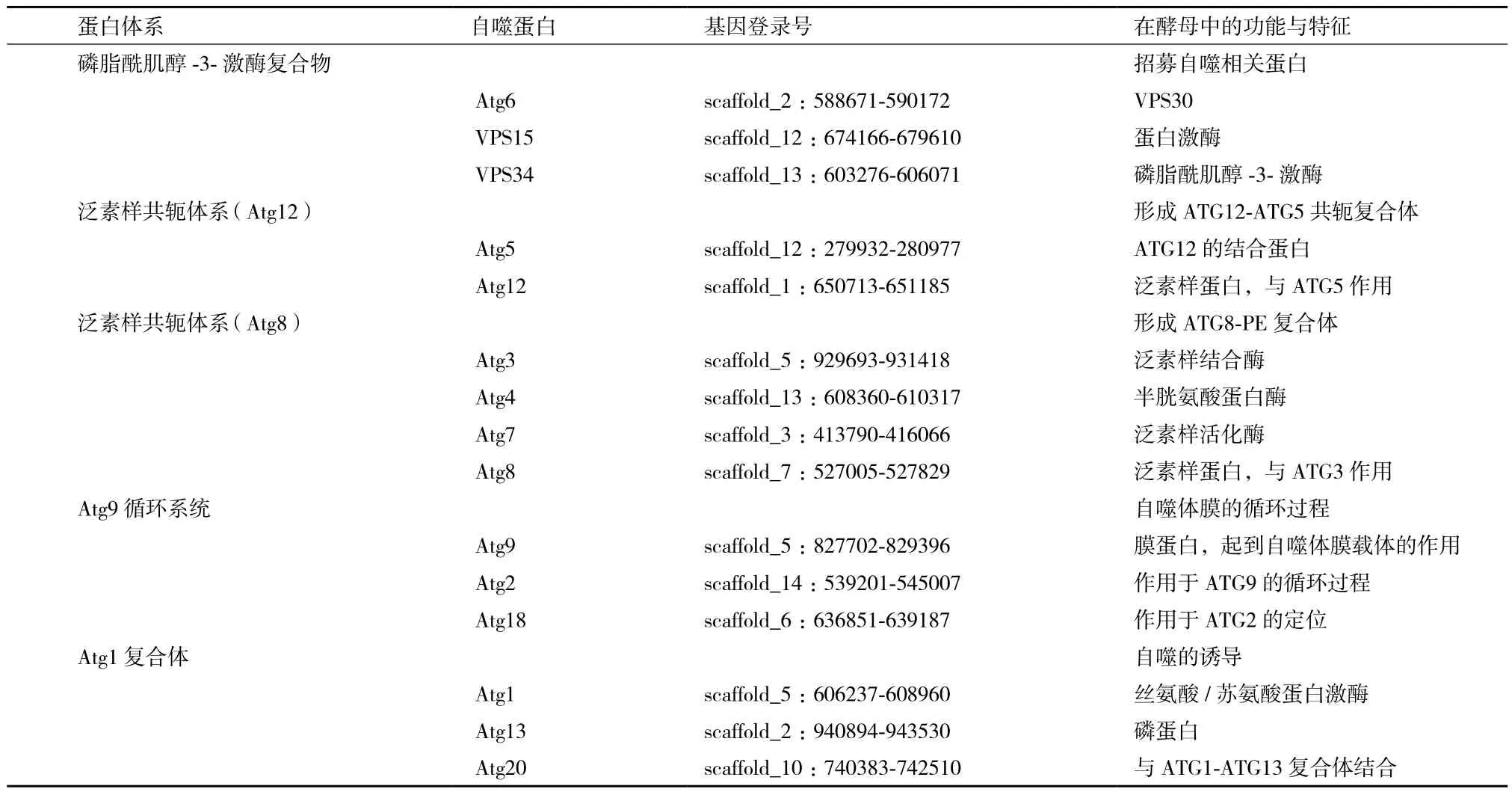
表2 斯達油脂酵母自噬相關蛋白
2.2 斯達油脂酵母油脂積累過程中泛素樣共軛體系基因的表達分析
研究已經發現酵母細胞油脂累積通常受到培養基中的碳氮比的強烈誘導[16]。在我們前期的研究發現,斯達油脂酵母在碳氮比為30和150的培養條件下,細胞生長良好、且累積油脂呈現了很大的差異。因此,本研究進一步檢測了斯達油脂酵母分別在碳氮比為30和150的培養條件下,不同時期油脂的累積規律(圖3)顯示,油脂快速累積主要發生在細胞培養的前4 d,在培養第4天時細胞干重的油脂含量相差很大,在碳氮比為30和150的培養條件下油脂累積分別為31.2%和49.4%。
為探討斯達油脂酵母油脂的累積是否與自噬相關,我們同時檢測了在細胞生長過程中,泛素樣自噬共軛體系相關基因(包括Atg3、Atg4、Atg5、Atg7、Atg8和Atg12)隨著油脂的積累在轉錄水平上基因的表達變化。由于油脂快速累積主要發生在細胞培養的前4 d,因此我們集中檢查了斯達油脂酵母細胞在前4 d的表達規律。將碳氮比150條件下培養1 d的細胞中自噬相關基因的表達量設為1,其它時期基因的表達量和培養1 d的比較,獲得基因的相對表達量。如圖4所示,在碳氮比為30培養下條件6個Atg基因的表達均高于碳氮比為150培養條件下基因的表達,說明斯達油脂酵母在高的碳氮比培養下Atg基因的表達降低。在碳氮比為30 的培養條件下,隨著培養時間的增加,Atg3、Atg4、Atg5和Atg7的基因表達均呈下降趨勢,而Atg8呈上升趨勢,Atg12在開始階段呈上升趨勢,隨后開始下降;在碳氮比為150的培養條件下,隨著培養時間的增加,6個基因的表達量變化不大。
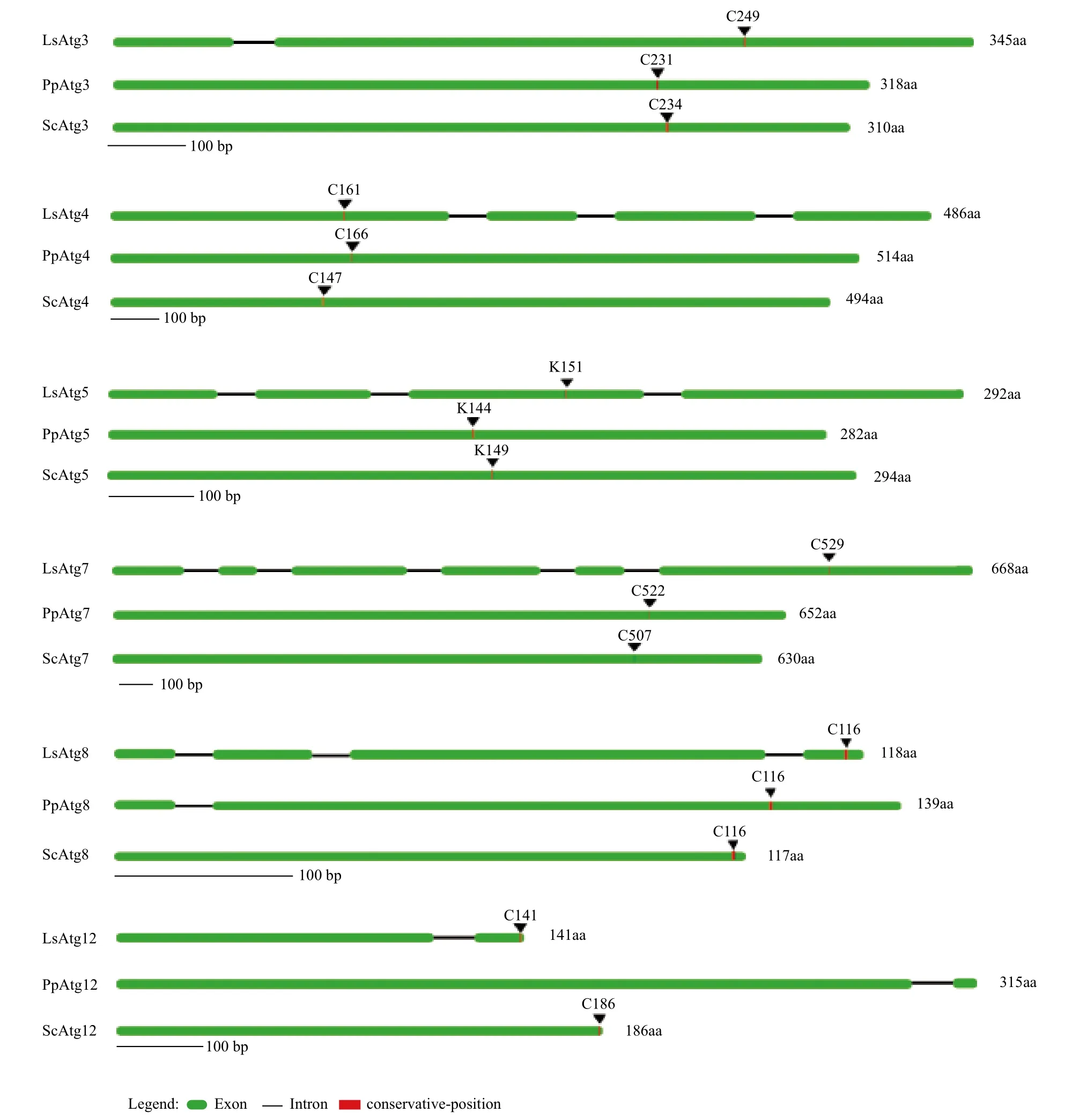
圖2 斯達油脂酵母(Ls)、畢赤酵母(Pp) 和釀酒酵母(Sc)自噬共軛體系基因結構圖
2.3 促進自噬可降低油脂積累
雷帕霉素(rapamicin)作為TOR的抑制劑,有助于Atg13的去磷酸化,進而促進Atg1-Atg13-Atg17激酶復合物的形成并誘導自噬。為了檢測細胞自噬對油脂累積的影響,我們利用自噬誘導劑雷帕霉素,分別在碳氮比30和碳氮比150培養條件下促進酵母的自噬活動,培養4 d后檢測不同雷帕霉素處理濃度的酵母生物量(通過檢測OD值),發現酵母生物量變化不大,說明不同濃度的自噬誘導劑對細胞生長的影響非常有限。進一步檢測細胞的油脂含量,結果(圖5)顯示,在碳氮比30和碳氮比150的培養條件下,隨著雷帕霉素處理濃度的增加斯達油脂酵母的油脂含量呈下降趨勢,在低濃度(如1和10 nmol/L)的雷帕霉素處理下,斯達油脂酵母細胞油脂累積沒有顯著變化,而在高濃度(如100-10 000 nmol/L)的雷帕霉素處理下,油脂累積顯著降低,特別是在碳氮比150條件下,高濃度的雷帕霉素處理大幅度降低了斯達油脂酵母細胞的含油量。這個結果說明在斯達油脂酵母中細胞自噬活性增加確實能夠減少細胞儲存油脂的累積。
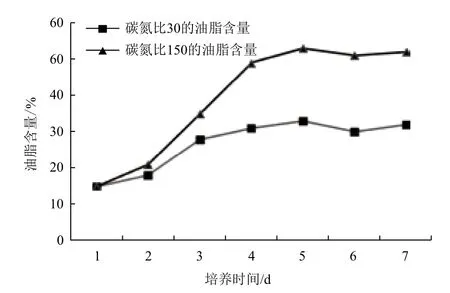
圖3 不同碳氮比條件下的油脂累積曲線
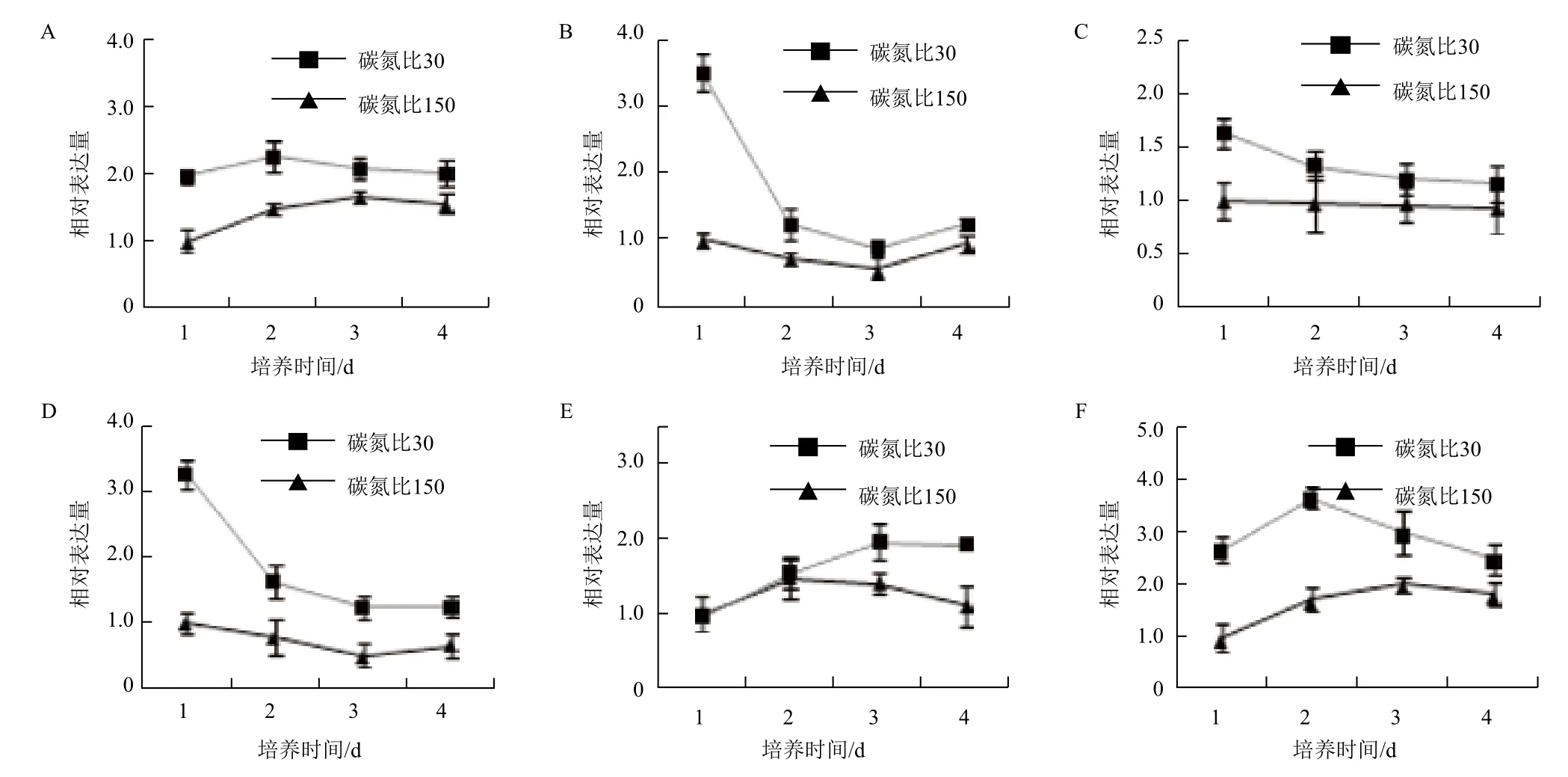
圖4 自噬共軛體系相關基因的表達
3 討論
本研究基于斯達油脂酵母的基因組序列,利用生物信息學方法鑒別了參與細胞自噬的13個Atg基因,集中分析了斯達油脂酵母泛素樣共軛體系基因的結構特征,通過與釀酒酵母、擬南芥Atg基因進行序列比對發現,斯達油脂酵母不僅存在自噬過程中所涉及到的關鍵Atg基因,而且自噬泛素樣共軛體系基因的保守位點與釀酒酵母完全相同,這說明真核生物中自噬是一個高度保守的過程。然而基因結構的顯著差異,說明斯達油脂酵母自噬共軛體系基因在系統發生上與畢赤酵母和釀酒酵母關系較遠。
研究已經發現在產油酵母的培養過程中碳氮比能夠顯著影響細胞的油脂累積,增加碳源或減少氮源都能促進產油酵母的油脂累積。本研究利用減少氮源的方式來調節碳氮比,在高碳氮比的條件下(碳氮比為150)斯達油脂酵母細胞累積油脂顯著增加。在高碳氮比培養條件下,隨著細胞油脂的累積,參與自噬相關基因的表達均顯著低于低碳氮比條件下的細胞培養,可能預示著隨著細胞自噬活動降低確實減少了油體的降解,從而增加了油脂的累積。然而,在高碳氮比條件下,實際上相當于減少了培養基中的氮源,使細胞處于缺氮的逆境中,由于氮源是蛋白質合成的主要成份,而細胞自噬活動主要是依靠Atg蛋白的相互作用來實現的,因此,本研究在高碳氮比條件下Atg基因的表達降低也可能是由于氮源的缺乏而引起的。
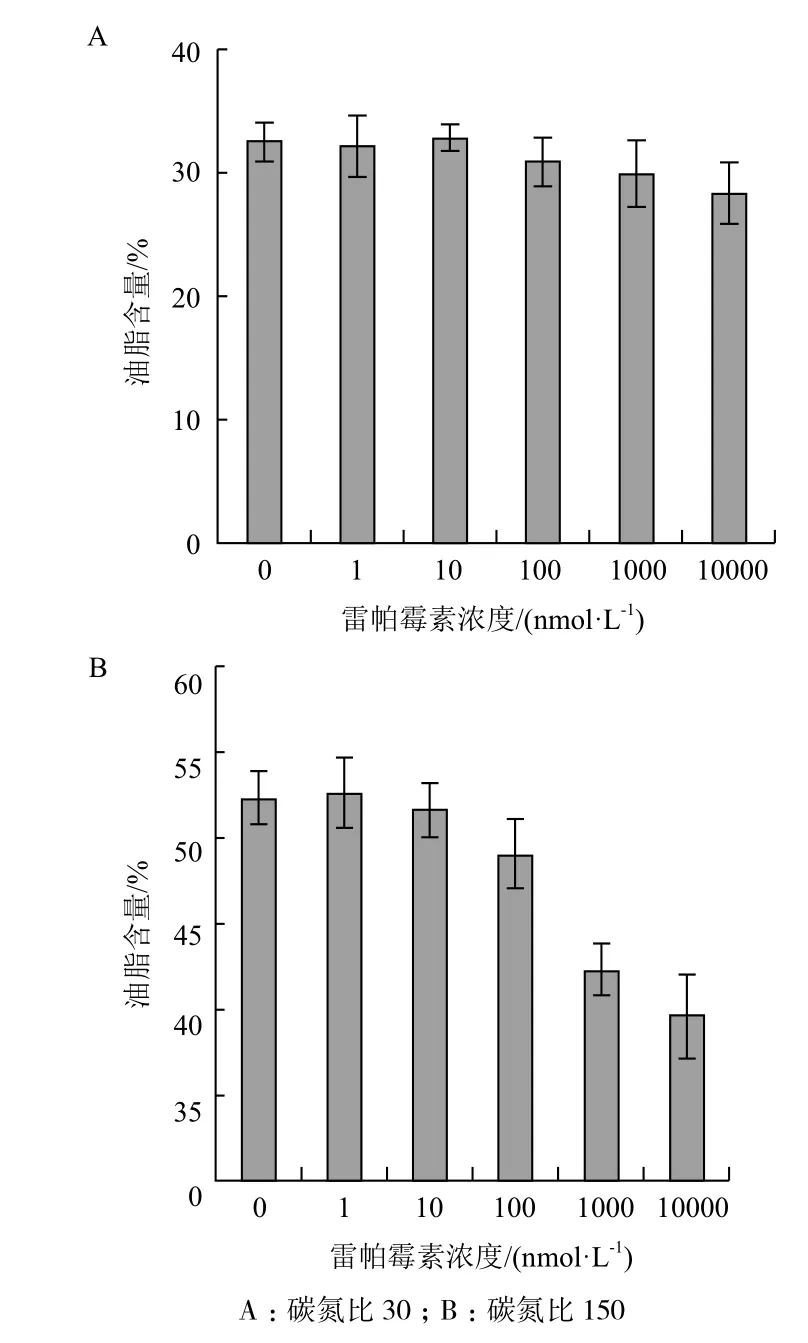
圖5 雷帕霉素處理對斯達油脂酵母的油脂含量影響
在利用酵母細胞自噬誘導劑增加Atg活性的試驗中,結果顯示了在一定濃度范圍內自噬誘導劑雷帕霉素不影響斯達油脂酵母的細胞生長,但隨著雷帕霉素的增加細胞油脂的累積顯著降低,說明酵母細胞自噬活動可能直接降解細胞內油體,而減少細胞油脂累積。從本研究結果來看,在產油酵母油脂累積過程中,細胞自噬的活動和油脂累積呈負相關,暗示了細胞自噬相關基因確是通過降解活動參與了產油酵母的油脂代謝活動。然而,自噬活動在酵母細胞繁殖和生長過程中參與和調控了廣泛的代謝和生理過程,且生理調控機制通常是復雜的[17],而且本研究也缺乏在蛋白水平上引起自噬活動變化的證據,自噬相關基因對油脂累積的調控是通過調節油脂合成通路中的關鍵酶,從而減弱了油脂累積,還是直接參與油體的降解減少油脂的累積,這些問題尚不清楚,有待深入研究。
4 結論
本研究基于斯達油脂酵母的全基因組鑒別了13個參與細胞自噬過程的Atg基因,針對泛素樣共軛體系的自噬基因,結合其它酵母自噬基因的序列結構,集中分析、比較了斯達油脂酵母泛素樣共軛體系基因的結構特征,發現雖然酵母自噬基因的功能位點很保守,但在物種間基因的結構變異較大。在不同碳氮比的培養條件下,斯達油脂酵母細胞油脂累積和泛素樣共軛體系基因的表達呈負相關,通過人為調節細胞自噬水平,進一步驗證了細胞油脂累積和自噬活性呈負相關的規律,強烈地預示著酵母細胞自噬活動參與(或影響)了油脂累積過程。
[1]Reggiori F, Klionsky DJ. Autophagy in the eukaryotic cell[J]. Eukaryotic Cell, 2002, 1(1):11-21.
[2]Klionsky DJ, Meijer AJ, Codogno P, et al. Views and commentaries autophagy and p70S6 kinase[J]. Autophagy, 2005, 1(1):59-61.
[3] Tanida I, Ueno T, Kominami E. LC3 conjugation system in mammalian autophagy[J]. The International Journal of Biochemistry & Cell Biology, 2004, 36(12):2503-2518.
[4] Kirisako T, Ichimura Y, Okada H, et al. The reversible modification regulates the membrane-binding state of Apg8/Aut7 essential for autophagy and the cytoplasm to vacuole targeting pathway[J]. The Journal of Cell Biology, 2000, 151(2):263-276.
[5] Cheong H, Nair U, Geng J, et al. The Atg1 kinase complex is involved in the regulation of protein recruitment to initiate sequestering vesicle formation for nonspecific autophagy in Saccharomyces cerevisiae[J]. Molecular Biology of the Cell, 2008, 19(2):668-681.
[6]Kihara A, Noda T, Ishihara N, et al. Two distinct Vps34 phosphatidylinositol 3-kinase complexes function in autophagy and carboxypeptidase Y sorting in Saccharomyces cerevisiae[J]. The Journal of Cell Biology, 2001, 152(3):519-530.
[7] Lapierre LR, Gelino S, Meléndez A, et al. Autophagy and lipid metabolism coordinately modulate life span in germline-less C. elegans[J]. Current Biology, 2011, 21(18):1507-1514.
[8]Heaton NS, Randall G. Dengue virus-induced autophagy regulates lipid metabolism[J]. Cell Host & Microbe, 2010, 8(5):422-432.
[9]Vescovo T, Romagnoli A, Perdomo AB, et al. Autophagy protects cells from HCV-induced defects in lipid metabolism[J]. Gastroenterology, 2012, 142(3):644-653.
[10]Singh R, Kaushik S, Wang Y, et al. Autophagy regulates lipid metabolism[J]. Nature, 2009, 458(7242):1131-1135.
[11]Zhu Z, Zhang S, Liu H, et al. A multi-omic map of the lipid-producing yeast Rhodosporidium toruloides[J]. Nature Communications, 2012, 3:1112.
[12]郭書賢, 王振偉, 劉歡, 等. 斯達油脂酵母發酵食品生產廢水產油脂的研究[J]. 中國食品學報, 2010 (4):245-252.
[13]Angerbauer C, Siebenhofer M, Mittelbach M, et al. Conversion of sewage sludge into lipids by Lipomyces starkeyi for biodiesel production[J]. Bioresource Technology, 2008, 99(8):3051-3056.
[14]李仁民, 王菊芳, 馬爽, 等.利用脂肪酸合成酶抑制劑和磷酸香草醛反應篩選高產油脂酵母菌[J]. 微生物學通報, 2008,35(4):545-549.
[15]Betts MJ, Guigó R, Agarwal P, et al. Exon structure conservation despite low sequence similarity:a relic of dramatic events in evolution?[J]. The EMBO Journal, 2001, 20(19):5354-5360.
[16] Holdsworth JE, Veenhuis M, Ratledge C. Enzyme activities in oleaginous yeasts accumulating and utilizing exogenous or endogenous lipids[J]. Journal of General Microbiology, 1988,134(11):2907-2915.
[17] Komatsu M, Ueno T, Waguri S, et al. Constitutive autophagy:vital role in clearance of unfavorable proteins in neurons[J]. Cell Death & Differentiation, 2007, 14(5):887-894.
(責任編輯 馬鑫)
An Investigation of Cellular Autophagy and Oil Accumulation in the Oleaginous Yeast Lipomyces starkeyi
Han Bing Yang Qin Cui Qinghua
(The School of Life Sciences,Yunnan University,Kunming 650091)
It was to prove autophagy is involved in the accumulation of lipid in Lipomyces starkeyi. Detecting the expression of autophagyrelated gene in different lipid accumulation level to determine whether autophagy is potentially involved in lipid accumulation; promoting autophagy by autophagy accelerator to observe whether there are differences in yeast lipid accumulation level. Results showed that the level of autophagy is low in high lipid accumulation condition compare with low condition. After treatment with autophagy accelerator, the lipid accumulation in yeast is reducing. In Lipomyces starkeyi, autophagy is negatively related to lipid accumulation, the improving of autophagy level will reduce the lipid accumulation in yeast.
autuphagy;Lipomyces starkeyi;oil accumulation;autophagy ubiquitin-like conjugated system
10.13560/j.cnki.biotech.bull.1985.2015.02.031
2014-07-14
云南省創新團隊基金項目(2011C1123),國家自然科學基金項目(31160237)
韓冰,男,碩士研究生,研究方向:自噬與油脂代謝關系的研究;E-mail:1017830953@qq.com
崔清華,女,教授,研究方向:自噬與腫瘤關系研究;E-mail:cuiqinghua@ynu.edu.cn

