甲基對硫磷水解酶的釀酒酵母表面展示及在甲基對硫磷降解中的應用
王星星池哲
(1.甘肅省科學技術情報研究所,蘭州 730000;2.中國海洋大學,青島 266000)
甲基對硫磷水解酶的釀酒酵母表面展示及在甲基對硫磷降解中的應用
王星星1池哲2
(1.甘肅省科學技術情報研究所,蘭州 730000;2.中國海洋大學,青島 266000)
PCR擴增假單胞菌WBC-3的甲基對硫磷水解酶基因,插入表面展示質粒pYD1的多克隆位點,構建pYD1-MPH重組質粒。重組質粒轉化釀酒酵母EBY100,2%半乳糖誘導甲基對硫磷水解酶表達,并利用免疫熒光檢測甲基對硫磷水解酶在釀酒酵母細胞表面的表達展示。研究了表面展示甲基對硫磷水解酶的酶學性質和酵母工程菌對水體中甲基對硫磷的降解效果。結果表明成功構建具有全細胞甲基對硫磷水解酶催化活性的酵母工程菌,經2%半乳糖誘導48 h,表面展示甲基對硫磷水解酶比酶活力為18.2 U/mg細胞干重。表面展示甲基對硫磷水解酶的最適作用pH為9.5,最適作用溫度為30℃,在pH4.0-10.5之間和45℃以下穩定性較好,Mn2+、Co2+、Zn2+、Ca2+、Hg2+、K+、Ni2+對表面展示甲基對硫磷水解酶活性有激活作用,Na+、Fe3+、Ag+對展示酶活力有抑制作用。工程菌在1 h內對淡水中20 mg/L的甲基對硫磷的降解率在80%以上。
甲基對硫磷水解酶;表面展示;釀酒酵母;甲基對硫磷降解
甲基對硫磷是一種高毒的有機磷農藥,使用后殘留期長,是一種持久性有機污染物[1],在國內水源和食物中時有檢出[2,3]。甲基對硫磷作為一種神經毒劑,可通過抑制生物體內乙酰膽堿酯酶的活性而造成乙酰膽堿累積,引起神經功能紊亂,嚴重時導致個體死亡,對生物體有較大的毒害作用[4]。
甲基對硫磷水解酶(Methyl parathion hydrolase,MPH)是由甲基對硫磷水解酶基因編碼的酯酶,可破壞甲基對硫磷中的磷酯鍵,使甲基對硫磷的毒性下降約120倍[5]。因此,利用基因工程技術生產高效、廉價的甲基對硫磷水解酶制劑是解決環境中甲基對硫磷殘留的一種非常具有潛力的方法。目前國內外已分離得到許多甲基對硫磷降解菌,克隆了編碼甲基對硫磷水解酶的基因并且進行了異源表達[6-11]。但是分離純化甲基對硫磷水解酶操作繁瑣,成本較高,而且會造成酶活性的損失;而直接利用全細胞進行甲基對硫磷的降解,卻因細胞內表達的酶受到細胞膜的阻隔不能與胞外底物充分接觸而限制了酶活性的發揮[12]。
微生物表面展示技術是近年來發展較快的一種基因工程技術,其通過將外源蛋白與特定的載體蛋白(錨定蛋白)基因序列融合,使外源蛋白表達錨定在微生物細胞表面[13],在全細胞催化、蛋白分離純化、環保領域具有良好的應用前景。因此,利用表面展示技術將甲基對硫磷水解酶分泌并錨定在微生物細胞表面,無需酶的純化,并且突破細胞膜的阻礙使酶和底物充分接觸,成為開發高效、簡便的全細胞甲基對硫磷水解酶的有效手段。
目前,國內外研究者利用大腸桿菌表面展示系統和假單胞菌表面展示系統進行包括甲基對硫磷水解酶在內的有機磷水解酶的表面展示[14-17],酵母表面展示系統在有機磷水解酶表達展示中的研究較少。酵母表面展示系統是一種常見的展示系統,其錨定蛋白為酵母細胞壁中存在的一類甘露糖蛋白,稱為細胞壁蛋白,其中包括釀酒酵母的α和a凝集素。這類蛋白通過共價鍵與酵母細胞壁的葡聚糖相連接[13]。相較于細菌表面展示系統,酵母表面展示系統具有較完善的蛋白質分泌機制和翻譯后修飾,以及安全無毒等優點,利用酵母表面展示系統構建安全、高效的有機磷農藥降解工程菌株用于有機磷農藥污染治理具有廣闊的研究空間。釀酒酵母是酵母表面展示的宿主細胞之一,為食品級微生物,遺傳操作方便,安全、容易培養,適合大規模工業生產,適用于開發安全、經濟的全細胞甲基對硫磷水解酶。本研究將來源于假單胞菌Pseudomonas sp. WBC-3的甲基對硫磷水解酶表達展示于釀酒酵母細胞表面,檢測全細胞酶的活性,并且進行展示酶的酶學性質研究以及全細胞酶對水體中甲基對硫磷的降解研究,為開發新型、高效的全細胞甲基對硫磷水解酶奠定基礎,為甲基對硫磷的生物降解提供理論依據和技術支撐。
1 材料與方法
1.1 材料
1.1.1 菌種與質粒 質粒pYD1和其受體菌釀酒酵母EBY100購自美國Invitrogen公司;質粒pET20b帶有假單胞菌WBC-3的甲基對硫磷水解酶基因(GenBank accession No.AY251554),由武漢病毒所張先恩研究員提供;E.coli DH5α,購自北京TIANGEN生物公司;pMD19-T simple vector購自寶生物(大連)有限公司(TaKaRa)。
1.1.2 分子生物學酶及試劑 限制性內切酶EcoR I和Xho I、T4 DNA連接酶購自FERMENTAS(MBI)公司;質粒提取試劑盒購自北京TIANGEN生物公司;LA Taq DNA聚合酶、DNA瓊脂糖凝膠回收試劑盒、DNA Marker購自寶生物(大連)有限公司(TaKa-Ra);甲基對硫磷純品(Dr. Ehrenstorfer GmbH,Germany)購自青島艾科寶生物技術有限公司,純度為99.5%,配制為10 mg/mL的母液(溶于甲醇);小鼠抗6×His單克隆抗體購于美國Clontech公司;異硫氰酸熒光素(FITC)標記的羊抗鼠IgG抗體購自北京TIANGEN生物公司;其他試劑均為國產分析純。
1.2 方法
1.2.1 甲基對硫磷水解酶基因的克隆及鑒定 根據假單胞菌WBC-3的甲基對硫磷水解酶基因序列和表面展示質粒pYD1多克隆位點設計引物mphpyd1-se和mphpyd1-an,在上下游引物中分別引入EcoR I和Xho I限制性內切酶位點,引物序列分別 為:mphpyd1-se:GAATTCGCCGCACCGCAGGTG(下劃線處為EcoR I酶切位點,mphpyd1-an:CTCGAGCTTGGGGTTGACGACCG(下劃線處為Xho I酶切位點)。以質粒pET20b為模板,mphpyd1-se和mphpyd1-an為引物進行擴增。
PCR擴增體系為:2×GC buffer 25.0 μL,2.5 mmol/L dNTP 8.0 μL;20 μmol/L引物(mphpyd1-se、mphpyd1-an)各1.0 μL,質粒pET20b 1.0 μL,LA Taq DNA聚合酶 0.5 μL,ddH2O 13.5 μL。PCR反應參數:94℃預變性3 min;94℃變性30 s,63℃退火30 s,72℃延伸1 min,共30個循環;72℃延伸10 min。膠回收PCR擴增條帶,與pMD19-T simple Vector連接,轉化E.coli DH5α。挑取白斑克隆培養,提取質粒,用EcoR I、Xho I雙酶切驗證。選取酶切驗證正確的質粒,送博尚生物技術(上海)有限公司測序、比對。將測序正確的質粒命名為pMD19-T simple-MPH。
1.2.2 pYD1-MPH重組質粒的構建及鑒定 將質粒pMD19-T simple-MPH和pYD1進行EcoR I和Xho I雙酶切,將酶切回收后的甲基對硫磷水解酶基因片段和質粒pYD1連接、轉化E.coli DH5α,再對重組質粒進行EcoR I和Xho I雙酶切鑒定,將驗證正確的重組質粒命名為pYD1-MPH。
1.2.3 釀酒酵母EBY100轉化及MPH的誘導表達 按照Invitrogen公司說明書方法將重組質粒pYD1-MPH轉化釀酒酵母EBY100,同時以轉入不含MPH基因片段的pYD1作為陽性對照,在添加了亮氨酸的選擇培養基平板上篩選陽性轉化子。挑取轉化子接種于2.0%葡萄糖的YNB-CAA的培養基中30℃振蕩培養過夜,菌體用PBS緩沖液洗滌后,重懸于含2.0% D-半乳糖的YNB-CAA液體培養基中25℃振蕩培養,誘導目的蛋白表達。每隔12 h取樣測定展示表達的酶活,以含pYD1空質粒的轉化子作對照。
1.2.4 表面展示甲基對硫磷水解酶活性測定 表面展示甲基對硫磷水解酶活力測定參照Yu等[10]的方法進行。反應體系為1 000.0 μL,其中含6.0 μL 10.0 mg/mL甲基對硫磷母液、929.0 μL 40.0 mmol/L 甘氨酸-氫氧化鈉緩沖液(pH9.5)和65.0 μL菌體濃度為1.6×108個細胞/mL的菌懸液。30℃反應10 min,加入200.0 μL 10% HNO3終止反應。離心反應液后取 500.0 μL上清液,加入5.0 mL 0.5 mol/L甘氨酸-氫氧化鈉緩沖液(pH10.0)混勻,405 nm下測定吸光值。OD405值反映了甲基對硫磷水解產物對硝基苯酚的生成量。表面展示甲基對硫磷水解酶酶活力單位定義為:在30℃、pH9.5的條件下,每分鐘水解1.0 μmol底物即產生1.0 μmol對硝基苯酚所需要的表面展示甲基對硫磷水解酶酶量。比活力為每毫克菌體干重具有的甲基對硫磷水解酶活力,單位為U/mg細胞干重。
1.2.5 細胞免疫熒光檢測 取誘導表達48 h相當于含OD600值為2.0的菌液,以轉入空載體pYD1的轉化子和EBY100分別作為陽性對照和陰性對照,分別以小鼠抗6×His單克隆抗體和異硫氰酸熒光素(FITC)標記的羊抗鼠IgG抗體作為抗體進行免疫熒光檢測。具體試驗操作方法參照Yue等[18]的方法進行。
1.2.6 表面展示甲基對硫磷水解酶的酶學性質研究 分別用pH值為3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5、11.0的酶反應緩沖液取代酶活測定方法中的緩沖液,按照1.2.4的方法測定酶活,確定酶的最適反應pH。將細胞懸液分別置于上述pH值的緩沖液,4℃保溫24 h,測定剩余酶活力,確定酶的pH穩定性。
按照1.2.4的方法,分別在20、25、30、35、40、45、50、55、60、65、70℃水浴反應10 min,測定展示酶活性,確定酶的最適反應溫度。將細胞懸液分別在上述溫度保溫1 h,按照1.2.4的方法,測定剩余酶活,以放置于4℃的酵母細胞的酶活力作為對照(100%),確定酶的溫度穩定性。
1.2.7 金屬離子對表面展示甲基對硫磷水解酶活性的影響 將表面展示甲基對硫磷水解酶的酵母細胞懸液與不同金屬離子混合,金屬離子終濃度為5.0 mmol/L。混合液于4.0℃下保溫1 h,然后按照1.2.4的方法,測定剩余酶活。對照為加同等體積蒸餾水的細胞酶活,根據剩余酶活判斷金屬離子對展示酶活性的影響。
1.2.8 水體中甲基對硫磷降解研究 在1 000.0 mL的三角瓶中加入500.0 mL甲基對硫磷濃度為20.0 mg/L的淡水,水體的pH為其自然pH和全細胞酶作用的最適pH,再加入適量的全細胞酶,使菌體終濃度為3×107個細胞/mL。充分混勻,30℃、180 r/min振蕩反應1 h,檢測對硝基苯酚的生成量,計算甲基對硫磷的降解率。反應結束后離心收集菌體用于下一次降解試驗,并測定每輪反應后全細胞酶的剩余活力,以第一次反應前全細胞酶活力作為對照(100%)。
2 結果
2.1 甲基對硫磷水解酶基因片段的擴增和重組質粒pYD1-MPH的構建
PCR擴增后得到903 bp的特異性條帶(圖1),克隆入pMD19-T-simple Vector,EcoR I、Xho I酶切驗證正確后測序分析,結果與假單胞菌WBC-3的甲基對硫磷水解酶基因序列(GenBank accession No.AY251554)相一致。質粒pMD19-T simple-MPH與質粒pYD1雙酶切,回收MPH基因片段和pYD1載體片段,連接、轉化E.coli DH5α,陽性轉化子質粒EcoR I、Xho I雙酶切驗證結果見圖2,質粒pYD1-MPH被切為兩個片段,小片段為MPH基因片段,大片段為pYD1片段,表明重組質粒pYD1-MPH構建成功。
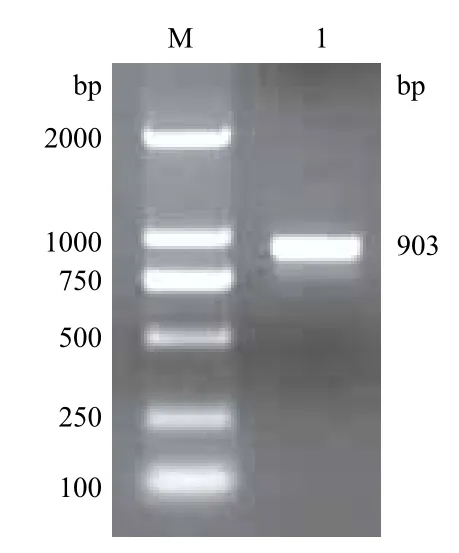
圖1 甲基對硫磷水解酶基因PCR擴增產物電泳圖
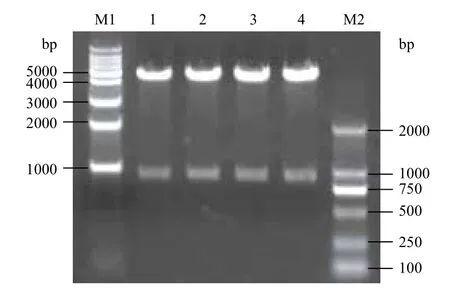
圖2 重組質粒pYD1-MPH EcoR I、Xho I雙酶切鑒定
2.2 表面展示甲基對硫磷水解酶活力的測定
挑取驗證正確的轉化子培養測定展示酶活力,以含pYD1空質粒的轉化子進行對照。結果表明陽性轉化子在誘導培養48 h時酶活最高,為(18.2±1.1)U/mg細胞干重。而轉化入空表面展示質粒pYD1的釀酒酵母EBY100沒有甲基對硫磷水解酶活力。
2.3 細胞免疫熒光檢測
質粒pYD1含有6×His標簽,可以利用鼠抗6×His單克隆抗體作為一抗,異硫氰酸熒光素(FITC)標記的羊抗鼠IgG抗體作為二抗,對重組酵母細胞進行免疫熒光檢測。從圖3中可以看到,轉入質粒pYD1-MPH和空載體pYD1的轉化子細胞表面可以觀察到熒光,而未轉化菌株EBY100則檢測不到熒光。說明目的蛋白展示到了釀酒酵母EBY100的表面,達到了表面展示的目的。
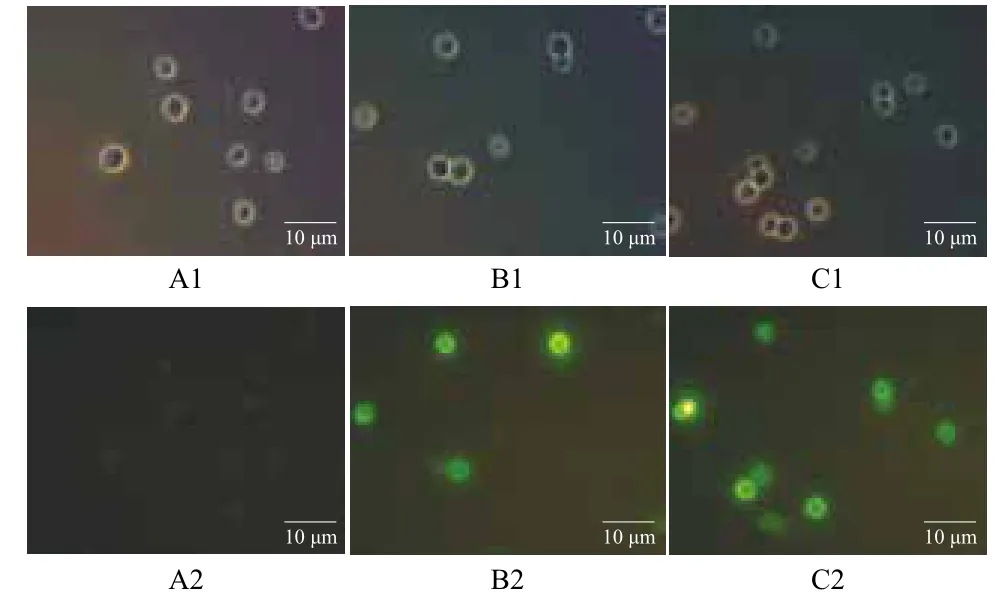
圖3 免疫熒光檢測表面展示的甲基對硫磷水解酶
2.4 表面展示甲基對硫磷水解酶最適反應pH值和pH值穩定性
從圖4可以看出,表面展示甲基對硫磷水解酶的最適作用pH為9.5,在pH4.0-10.5之間酶的穩定性較好,在pH4.0-10.5的緩沖液中4℃下處理24 h后,其仍能保持80%以上的活性。
2.5 表面展示甲基對硫磷水解酶最適反應溫度和溫度穩定性
圖5的結果表明,表面展示甲基對硫磷水解酶的最適作用溫度為30℃。在45℃以下穩定性較好,在45℃保溫1 h仍能保留80.0%的活性,但在高于45℃時活性下降很快,在55℃保溫1 h后表面展示甲基對硫磷水解酶幾乎完全失活。
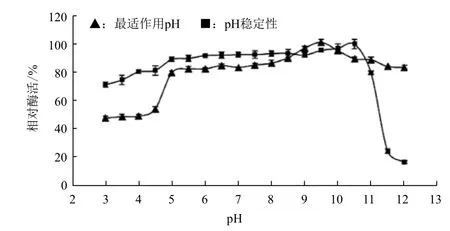
圖4 pH對表面展示甲基對硫磷水解酶的活性和穩定性的影響

圖5 溫度對表面展示甲基對硫磷水解酶的活性和穩定性的影響
2.6 金屬離子對表面展示甲基對硫磷水解酶活力的影響
如表1所示,5.0 mmol/L的Mn2+對表面展示甲基對硫磷水解酶的激活作用最顯著,使展示酶的活力提高將近3倍,Co2+對展示酶也有顯著的激活作用,酶活力提高兩倍多。Zn2+、Ca2+、Hg2+、K+、Ni2+對表面展示甲基對硫磷水解酶也有激活作用,但是Na+、Fe3+、Ag+對展示酶活力有抑制作用。Mg2+、Cu2+、Fe2+、Ba2+、Li+對展示酶活力沒有明顯的影響。
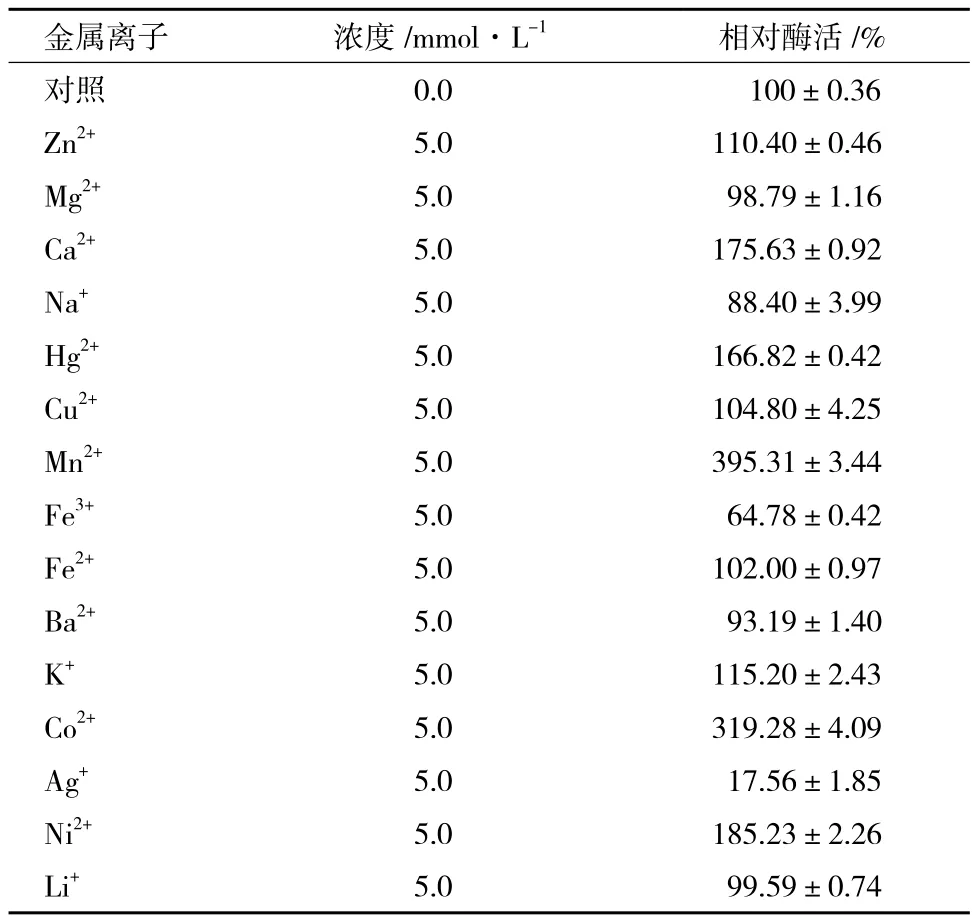
表1 金屬離子對表面展示甲基對硫磷水解酶活力的影響
2.7 水體中甲基對硫磷降解研究
全細胞酶在1 h內對不同pH淡水中20.0 mg/L甲基對硫磷的降解率均可達到80%以上,受水體pH的影響較小(圖6)。全細胞酶重復使用3次后,仍能保持70%以上的活性(表2)。
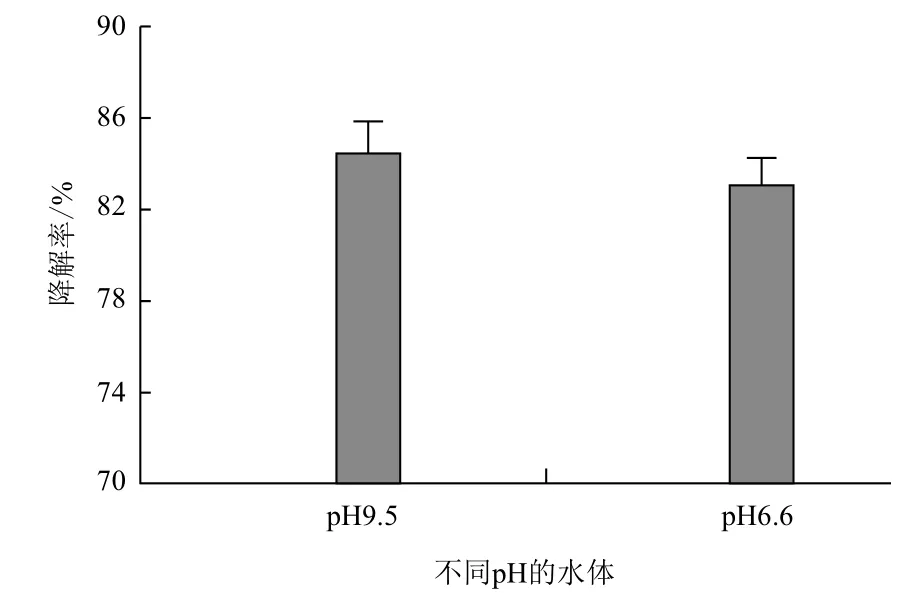
圖6 不同pH的淡水中甲基對硫磷的降解率

表2 全細胞酶的重復利用性
3 討論
由于表面展示技術將外源蛋白錨定在微生物細胞表面,可直接利用全細胞進行催化反應,避免了酶的分離純化,并且酶與底物充分接觸,不受細胞膜的阻隔,因此近年來,表面展示技術在有機磷農藥降解的研究應用中發展迅速。目前國內用于包括甲基對硫磷水解酶在內的有機磷水解酶表面展示的宿主細胞多集中于大腸桿菌、假單胞菌[14-17],酵母表面展示系統在有機磷水解酶表達展示中的研究很少,甲基對硫磷水解酶在釀酒酵母中的表面展示尚未有報道。本研究成功將假單胞菌WBC-3的甲基對硫磷水解酶展示在釀酒酵母EBY100細胞表面,構建了表面展示甲基對硫磷水解酶的酵母工程菌株,其甲基對硫磷水解酶比酶活為18.2 U/mg細胞干重。
本研究中的表面展示甲基對硫磷水解酶最適作用pH值為9.5,最適作用溫度為30℃,而假單胞菌WBC-3所產甲基對硫磷水解酶的最適作用pH和最適作用溫度值為11.0、40℃[19],這可能是由于表面展示重組表達的甲基對硫磷水解酶與錨定蛋白融合表達以及在表達時發生N-糖基化造成的[20]。Yang等[11]在大腸桿菌BL21中重組表達的甲基對硫磷水解酶在25-35℃和pH7.0-9.0時能保持90%以上的活性,本研究中,表面展示甲基對硫磷水解酶在pH4.0-10.5和45℃以下穩定性較好,在25-35℃和pH7.0-9.0能保持約90%的活性。說明本研究中的全細胞酶具有良好的穩定性,在不同溫度、pH的環境條件下不易變性失活,而且較非表面展示表達的甲基對硫磷水解酶更經濟、方便。
金屬離子對本研究中表面展示的甲基對硫磷水解酶活性具有一定影響,其中加入5.0 mmol/L的Mn2+可使展示酶比酶活達到71.9 U/mg細胞干重。Co2+、Zn2+、Ca2+、Hg2+、K+、Ni2+對展示酶均有激活作用,Na+、Fe3+、Ag+對酶活力有抑制作用,Mg2+、Cu2+、Fe2+、Ba2+、Li+對酶活力沒有明顯影響。楚曉娜等[19]研究發現不同金屬離子對假單胞菌WBC-3所產天然甲基對硫磷水解酶的活性也有影響,因此推測該酶為金屬酶。通過對該酶三維結構的研究發現,該酶的活性中心由Zn2+和Cd2+組成[21]。據報道,有機磷水解酶是一種金屬酶,具有由雙Zn2+或Co2+組成的活性中心,活性中心的金屬離子可以被Ni2+、Ca2+、Mn2+、Cd2+取代而保持活性[22]。因此推測表面展示的甲基對硫磷水解酶活性中心的Zn2+和Cd2+可能也可以被相應的金屬離子取代而使活性發生改變。
本研究的全細胞酶對水體中甲基對硫磷具有良好的降解效果,受水體pH的影響較小,而且操作穩定性較好,可多次重復利用,具有一定的實際應用潛力。但是本研究構建的酵母工程菌其甲基對硫磷水解酶的表達和展示必須要經過2%的半乳糖的誘導,不利于全細胞酶投入生產;質粒pYD1上攜帶有抗生素抗性基因,酵母工程菌在實際應用過程中存在抗生素抗性基因擴散的潛在危險。因此,本研究構建的酵母工程菌成為具有實用性的全細胞催化劑還需要進一步的探索。通過質粒改造使目的基因的表達不再需要誘導劑,并且移除抗生素抗性基因,同時嘗試選用不同的表面展示錨定蛋白,探索不同錨定蛋白對酶表達和活性的影響,進一步提高表面展示酶的活性,將是以后構建安全、高效、適用的表面展示甲基對硫磷水解酶工程菌研究的方向。
4 結論
本研究將假單胞菌WBC-3的甲基對硫磷水解酶在酒精酵母細胞中進行了表達展示,構建了具有全細胞甲基對硫磷水解酶催化活性的酵母工程菌。表面展示甲基對硫磷水解酶的比酶活為18.2 U/mg細胞干重,最適作用pH和最適作用溫度為9.5、30℃,在pH4.0-10.5之間和45℃以下穩定性較好。Mn2+、Co2+、Zn2+、Ca2+、Hg2+、K+、Ni2+對展示酶有激活作用,Na+、Fe3+、Ag+對展示酶活力有抑制作用。工程菌在1 h內對淡水中20 mg/L的甲基對硫磷的降解率在80%以上。
[1]Liu FY, Hong MZ, Liu DM, et al. Biodegradation of methyl parathion by Acinetobacter radioresistens USTB-04[J]. J Environ Sci, 2007,19(10):1257-1260.
[2]朱麗芳, 周文軍, 王經委. 杭嘉湖地區飲用水源有機農藥污染現狀調查與分析[J]. 浙江水利水電專科學校學報, 2012, 24(2):51-59.
[3]于志勇, 金芬, 孫景芳, 等. 北京市場常見淡水食用魚體內農藥殘留水平調查及健康風險評價[J]. 環境科學, 2013, 34(1):251-256.
[4]Theriot CM, Grunden AM. Hydrolysis of organophosphorus compounds by microbial enzymes[J]. Appl Microbiol Biotechnol,2011, 89(1):35-43.
[5]Cui ZL, Li SP, Fu GP. Isolation of methyl parathion degrading strain M6 and cloning of the methyl parathion hydrolase gene[J]. Appl Environ Microbiol, 2001, 67:4922-4925
[6]Pakala SB, Gorla P, Pinjari AB, et al. Biodegradation of methyl parathion and p-nitrophenol:evidence for the presence of a p-nitrophenol 2-hydroxylase in a gram-negative Serratia sp. strain DS001[J]. Appl Microbiol Biotechnol, 2007, 73:1452-1462.
[7]Fu GP, Cui Z, Huang T, et al. Expression, purification, and characterization of a novel methyl parathion hydrolase[J]. Prot Expres Purif, 2004, 36:170-176.
[8]Liu H, Zhang JJ, Wang SJ, et al. Plasmid-borne catabolism of methyl parathion and p-nitrophenol in Pseudomonas sp. strain WBC-3[J]. Biochem Biophys Res Commun, 2005, 334:1107-1114.
[9]Shen YJ, Lu P, Mei H, et al. Isolation of a methyl parathiondegrading strain Stenotrophomonas sp. SMSP-1 and cloning of the ophc2 gene[J]. Biodegradation, 2010, 21(50):785-792.
[10] Yu H, Yan X, Shen W, et al. Expression of methyl parathion hydrolase in Pichia pastoris[J]. Curr Microbiol, 2009, 59:573-578.
[11] Yang JJ, Yang C, Jiang H, et al. Overexpression of methyl parathion hydrolase and its application in detoxification of organophosphates[J]. Biodegradation, 2008, 19:831-839.
[12] Yang C, Zhao Q, Liu Z, et al. Cell surface display of functional macromolecule fusions on Escherichia coli for development of an autofluorescent whole-cell[J]. Biocatalyst Environ Sci Technol,2008, 42(16):6105-6110.
[13]Ueda M, Tanaka A. Genetic immobilization of proteins on the yeast cell surface[J]. Biotechnol Adv, 2000, 18:121-140.
[14] Li CK, Zhu YR, Benz I, et al Presentation of functional organophosphorus hydrolase fusions on the surface of Escherichia coli by the AIDA-I autotransporter pathway[J]. Biotechnol Bioeng, 2008, 99:485-490.
[15]張紅星, 李茜茜, 葉婷, 等. 有機磷水解酶的大腸桿菌細胞表面展示與酶活特性[J]. 華中農業大學學報, 2008, 54(2):227-233.
[16]張紅星, 李茜茜, 葉婷, 等. 細胞表面展示有機磷水解酶的惡臭假單胞菌工程菌的構建及全細胞酶活性分析[J]. 華中農業大學學報, 2008, 27(1):65-70.
[17]Yang C, Cai N, Dong M, et al. Surface display of MPH on Pseudomonas putida JS444 using ice nucleation protein and its application in detoxification of organophosphates[J]. Biotechnol Bioeng, 2008, 99(1):30-37.
[18]Yue LX, Chi ZM, Wang L, et al. Construction of a new plasmid for surface display on cells of Yarrowia lipolytica[J]. J Microbiol Method, 2008, 72:116-123.
[19]楚曉娜, 張先恩, 陳亞麗, 等. 假單胞菌WBC-3甲基對硫磷水解酶性質的初步研究[J]. 微生物學報, 2003, 43(4):453-459.
[20]Ryckaert S, Martens V, De Vusser K, et al. Development of a Saccharomyces cerevisiae whole cell biocatalyst for in vitro sialylation of oligosaccharides[J]. J Biotechnol, 2005, 119(4):379-388.
[21]Dong YJ, Bartlam M, Sun L, et al. Crystal structure of methyl parathion hydrolase from Pseudomonas sp. WBC-3[J]. J Mol Biol, 2005, 353(3):655-663.
[22]Efremenko EN, Sergeeva VS. Organophosphate hydrolase-an enzyme catalyzing degradation of phosphorus containing toxin and pesticides[J]. Russ Chem Bull Intern Ed, 2001, 50(10):1826-1832.
(責任編輯 李楠)
Surface Display of Methyl Parathion Hydrolase on Saccharomyces cerevisiae and Its Application in Degradation of Methyl Parathion
Wang Xingxing1Chi Zhe2
(1. Institute of Science and Technology Information of Gansu,Lanzhou 730000;2.Ocean University of China,Qingdao 266000)
The methyl parathion hydrolase(MPH)gene of Pseudomonas sp.WBC-3 was amplified by PCR and cloned into the multiple cloning site of the surface display vector pYD1 to construct a recombinant plasmid pYD1-MPH. Then plasmid pYD1-MPH was transformed into Saccharomyces cerevisiae EBY100. The 2% galactose was used to induce the expression of MPH on the cell surface of EBYl00, and the display of MPH on the cell surface of S.cerevisiae was confirmed by immunofluorescence. The characteristic of the displayed MPH and degradation effect of methyl parathion in water by the engineered yeast were also investigated. The result showed that the engineered yeast strain, which have a whole cell catalytic activity of MPH, was successfully constructed. The activity of MPH displayed on the yeast cells was 18.2 U/mg of cell dry cells by the induction of 2% galactose for 48 h. The displayed MPH had the optimal pH of 9.5 and the optimal temperature of 30℃, respectively and was stable in the pH range of 4.0-10.5 and up to 45℃. The displayed MPH was stimulated by Mn2+,Co2+,Zn2+,Ca2+,Hg2+,K+,Ni2+, and was inhibited by Na+,Fe3+,Ag+. The engineered yeast strain could hydrolyze over 80% of 20.0 mg/L methyl parathion in tap water in 1 h.
methyl parathion hydrolase;surface display;Saccharomyces cerevisiae;methyl parathion degradation
10.13560/j.cnki.biotech.bull.1985.2015.04.026
2014-08-06
甘肅省科技計劃資助項目(145RJZA042)
王星星,女,助理研究員,研究方向:污染生態學;E-mail:mmwxx1105@163.com

