幽門螺桿菌尿素酶B亞單位的克隆表達(dá)及純化
閆錦錦 閆東明 鄒雪 劉丹 彭超 蘇亞南
(蕪湖康衛(wèi)生物科技有限公司,蕪湖 241000)
幽門螺桿菌尿素酶B亞單位的克隆表達(dá)及純化
閆錦錦 閆東明 鄒雪 劉丹 彭超 蘇亞南
(蕪湖康衛(wèi)生物科技有限公司,蕪湖 241000)
為獲得高純度具有生物活性的尿素酶B亞單位(UreB)蛋白,利用PCR方法擴增出ureB目的基因,將其插入到pET28a載體中,構(gòu)建表達(dá)質(zhì)粒pET28a-ureB。將鑒定正確的質(zhì)粒轉(zhuǎn)入大腸桿菌中培養(yǎng),通過IPTG誘導(dǎo)表達(dá)獲得UreB蛋白。采用Q Sepharose High Performance陰離子交換層析純化,G-25凝膠過濾層析脫鹽,并通過SDS-PAGE和免疫雙擴散法對UreB蛋白進(jìn)行鑒定。結(jié)果表明,該蛋白相對分子質(zhì)量約為64 kD,與預(yù)期結(jié)果相符,脫鹽后獲得的UreB蛋白純度為98.5%;免疫雙擴散法證明該蛋白具有良好的生物活性和反應(yīng)特異性。最終確定的純化工藝,達(dá)到了一步純化即得到高純度、具有生物活性蛋白的目的,該純化工藝簡單、有效。
幽門螺桿菌;尿素酶B亞單位;UreB蛋白;蛋白純化
幽門螺桿菌(Helicobacter pylori,H. pylori)被公認(rèn)是消化性潰瘍、慢性活動性胃炎、胃黏膜相關(guān)淋巴組織(MALT)淋巴瘤的主要致病因素,與胃癌的發(fā)生存在密切關(guān)聯(lián)性[1-3],已被世界衛(wèi)生組織定為Ⅰ類致癌因子[4]。H. pylori感染呈現(xiàn)全球分布特點,據(jù)有關(guān)報道顯示,世界人口平均感染率已超過50%,發(fā)展中國家的H. pylori感染率更高,我國的感染率達(dá)到61%[5]。目前對于抗H. pylori感染方法主要采用的是藥物治療法,但都存在一定的局限性[6],因此開發(fā)抗H. pylori感染疫苗產(chǎn)品成為研究熱點。
尿素酶B亞單位(UreB)作為疫苗的有效抗原蛋白,具有無毒、免疫效果好等特點,已被相關(guān)實驗所證實[7-9]。目前關(guān)于ureB克隆表達(dá)及純化的方法已有報道,主要采用細(xì)菌培養(yǎng)的方法獲取大量H.pylori,利用基因工程技術(shù)克隆ureB基因,構(gòu)建表達(dá)質(zhì)粒,并使用親和層析及多級純化相結(jié)合的方法獲得較高純度的UreB蛋白[10-12],但利用離子交換層析技術(shù)進(jìn)行一步純化,來獲得高純度UreB蛋白的相關(guān)信息未見報道。
本研究以pET11c-LTB-ureB質(zhì)粒為模板,設(shè)計引物,克隆ureB基因,構(gòu)建重組質(zhì)粒pET28a-ureB,并使用離子交換層析一步純化法,獲得高純度且具有生物活性的目的蛋白,可作為疫苗參考品,為疫苗后續(xù)研究奠定基礎(chǔ)。
1 材料與方法
1.1 材料
1.1.1 菌株及質(zhì)粒 E . coli DH5α及E. coli BL21(DE3)由本實驗室保種,pET11c-LTB-ureB表達(dá)質(zhì)粒由本實驗室構(gòu)建保存,載體pMD18-T、pET-28a購自TaKaRa公司(大連)。
1.1.2 主要試劑 質(zhì)粒提取試劑盒、DNA凝膠回收試劑盒購自AXYGEN公司;Taq DNA聚合酶、T4 DNA連接酶、DL5000 DNA Marker、限制性內(nèi)切酶BamHⅠ、NdeⅠ、XbaⅠ、XhoⅠ均購自TaKaRa公司(大連);離子交換層析柱介質(zhì)Q Sepharose High Performance、凝膠過濾層析柱介質(zhì)Sephadex G-25 Medium購自美國GE公司。
1.2 方法
1.2.1 pET11c-LTB-ureB重組質(zhì)粒的克隆及序列測定 取5 μL pET11c-LTB-ureB質(zhì)粒轉(zhuǎn)化DH5α感受態(tài),涂Amp抗性的LB平板,挑取單克隆于LB液體培養(yǎng)基中大量擴增,用質(zhì)粒提取試劑盒提取質(zhì)粒。經(jīng)BamHⅠ、NdeⅠ雙酶切,電泳鑒定正確后,送上海生工測序。
1.2.2 ureB基因表達(dá)載體的構(gòu)建 根據(jù)測序結(jié)果,應(yīng)用Primer 5.0設(shè)計擴增ureB基因引物。上游引物:GTCTAGAAATAATTTTGTTTAACTTTAAGAAGGAGATATAATGAAAAAGATTAGCAGAAAAGAATATG(下劃線為XbaⅠ酶切位點),下游引物:CTCGAGTTACTAGAAAAT GCTAAAGAGTTGTGCCAAGCTCA(下劃線為XhoⅠ酶切位點)。以pET11c-LTB-ureB質(zhì)粒為模板,采用上述引物,進(jìn)行PCR擴增。擴增條件為:95℃ 2 min;95℃ 30 s,50℃ 30 s,72℃ 2 min;35個循環(huán)。1%瓊脂糖凝膠電泳鑒定后,用DNA凝膠回收試劑盒回收1 700 bp目的片段,并將ureB基因連接到pMD18-T載體上,轉(zhuǎn)化DH5α感受態(tài),提取陽性克隆質(zhì)粒,用XbaⅠ和XhoⅠ雙酶切鑒定質(zhì)粒,并將鑒定正確的質(zhì)粒送至上海生工測序。
利用XbaⅠ和XhoⅠ雙酶切測序正確的pMD18T-ureB和pET-28a載體質(zhì)粒,并回收1 700 bp和5 000 bp的目的條帶。將回收的目的片段和載體片段,用T4 DNA連接酶連接,連接產(chǎn)物轉(zhuǎn)化BL21(DE3)感受態(tài)細(xì)胞;均勻涂布于含有Kan抗性的LB平板,37℃恒溫培養(yǎng)箱過夜培養(yǎng),挑取單克隆于LB液體培養(yǎng)基中大量擴增,提取重組質(zhì)粒;經(jīng)XbaⅠ和XhoⅠ雙酶切鑒定正確后送上海生工測序。
1.2.3 UreB蛋白的誘導(dǎo)表達(dá) 將測序結(jié)果正確的重組工程菌接種于5 mL含Kan的LB液體培養(yǎng)基中,37℃搖床培養(yǎng)過夜。將過夜培養(yǎng)的重組工程菌按1%的比例轉(zhuǎn)接入50 mL含Kan的LB培養(yǎng)液中,37℃搖床培養(yǎng)(200 r/min)。待OD600≈1.0時,加入終濃度為1 mmol/L的IPTG開始誘導(dǎo),分別于誘導(dǎo)0、1、2、3、4、5 h取樣,并采用SDS-PAGE檢測目的蛋白誘導(dǎo)表達(dá)情況。
1.2.4 發(fā)酵菌體的處理 將高效表達(dá)的菌體以1∶10(M/V)比例與緩沖液(10 mmol/L Tris-HCl pH8.5)混合、溶解,攪拌均勻后,向菌體懸液液中加入冰袋將菌液冷卻至10℃左右,利用高壓均質(zhì)機高壓(800 bar)破碎2次,破碎后的菌液通過管式離心機離心收集粗包涵體沉淀(離心轉(zhuǎn)速:20 000 r/min;離心流速:1 L/min),-20℃保存。
1.2.5 UreB包涵體的洗滌及裂解 稱取UreB包涵體20 g,按照1∶10(m/v)的比例,用洗滌液Ⅰ(50 mmol/L Tris-HCl 1%Triton-X 100 pH8.5)溶解包涵體,高速分散器混勻后,攪拌1 h,8 000 g離心30 min,棄上清,預(yù)留上清(收集液)檢測,重復(fù)洗滌一次;沉淀再用洗滌液Ⅱ(50 mmol/L Tris-HCl 1 mol/L尿素pH8.5)溶解,高速分散器混勻后,攪拌1 h,8 000 g離心30 min,棄上清,預(yù)留上清檢測,重復(fù)洗滌一次;最后沉淀用pH8.5的50 mmol/L Tris-HCl 8 mol/L尿素溶解,高速分散器混勻后,裂解過夜。
1.2.6 UreB蛋白的Q Sepharose High Performance純化 柱床體積為150 mL,用5倍柱體積pH8.5 50mmol/L Tris-HCl、8 mol/L尿素平衡層析柱;用3倍柱體積含不同鹽濃度的50 mmol/L Tris-HCl 8 mol/L尿素 pH8.5的洗脫緩沖液進(jìn)行梯度洗脫,鹽濃度梯度分別為40 mmol/L、60 mmol/L、80 mmol/L、90 mmol/L、0.2 mol/L、2 mol/L NaCl, 流速為15 mL/ min,采取分段收集樣品的方法,對樣品進(jìn)行SDSPAGE檢測,利用凝膠成像系統(tǒng)進(jìn)行純度分析,系統(tǒng)的分析軟件為Imaglab(Version 4.1)。
1.2.7 超濾濃縮、脫鹽 Q柱樣品用截留量為50 kD的膜包進(jìn)行超濾濃縮后,用G-25凝膠過濾層析柱脫鹽處理(pH10.0 25 mmol/L碳酸氫鈉緩沖液),收集樣品進(jìn)行SDS-PAGE檢測,利用凝膠成像系統(tǒng)進(jìn)行純度分析,系統(tǒng)的分析軟件為Imaglab(Version 4.1)。
1.2.8 免疫雙擴散檢測蛋白特性 選用重約2 kg、健康狀況良好的新西蘭大耳兔2只,每只兔子采用背部多點皮內(nèi)注射1 mg抗原。免疫時間分別為0、10、17 d,3次免疫后取兔耳緣靜脈血,免疫雙擴散檢測UreB抗原的特異性。
用0.9%的生理鹽水配制1.5%的瓊脂糖凝膠,水浴加熱至充分溶化后,倒于載玻片上,制成厚度約為2-3 mm厚的瓊脂糖凝膠板;置于室溫冷卻凝固后,用打孔器準(zhǔn)確打孔,加熱封底。冷卻后,中央孔內(nèi)滴加一定的兔抗血清,加入量以不溢出為度,周邊孔分別滴加UreB純化蛋白(1、5、10、20 μg)、空白對照(pH10.025 mmol/L碳酸氫鈉緩沖液)、陰性對照(pET-28a空載質(zhì)粒轉(zhuǎn)化后誘導(dǎo)表達(dá)蛋白,采用Lowery法測蛋白質(zhì)含量,取10 μg加樣)。加完樣品后,將瓊脂平皿加蓋后放置于加蓋的濕盒內(nèi),37℃溫箱中孵育30 h,觀察并記錄結(jié)果。
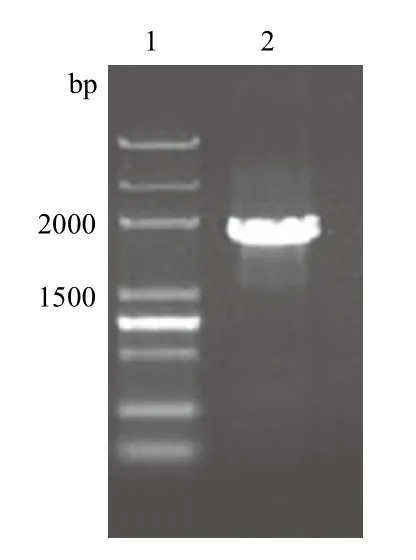
圖1 ureB基因的PCR擴增
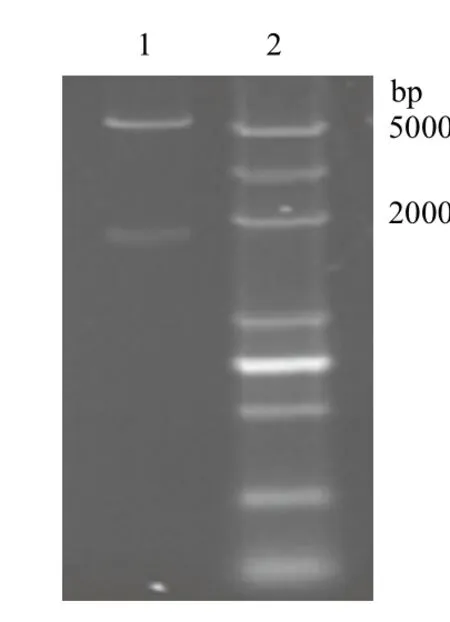
圖2 pET28a-ureB重組質(zhì)粒雙酶切鑒定
2 結(jié)果
2.1 ureB基因的核酸電泳鑒定
ureB基因的PCR擴增產(chǎn)物和重組質(zhì)粒pET28aureB雙酶切產(chǎn)物,用1.0%的瓊脂糖凝膠電泳檢測,結(jié)果分別見圖1、圖2。圖1中為擴增的目的基因電泳結(jié)果,經(jīng)序列測定:ureB基因大小為1 710 bp,與ureB基因的預(yù)期大小一致;從圖2中可以觀察到pET28a-ureB質(zhì)粒采用XbaⅠ和XhoⅠ雙酶切后,可見約5 000 bp和1 700 bp左右的條帶,與預(yù)期結(jié)果一致。
2.2 UreB蛋白的誘導(dǎo)表達(dá)
將重組質(zhì)粒轉(zhuǎn)入大腸桿菌中擴增培養(yǎng)后進(jìn)行誘導(dǎo)表達(dá)5 h,采用SDS-PAGE檢測(0、1、2、3、4、5 h)UreB目的蛋白的表達(dá)情況。結(jié)果(圖3)顯示,UreB的相對分子質(zhì)量約為64 kD,表達(dá)量隨誘導(dǎo)時間的延長而增加,誘導(dǎo)5 h時表達(dá)量最高,目的蛋白約占總蛋白的27.4%。
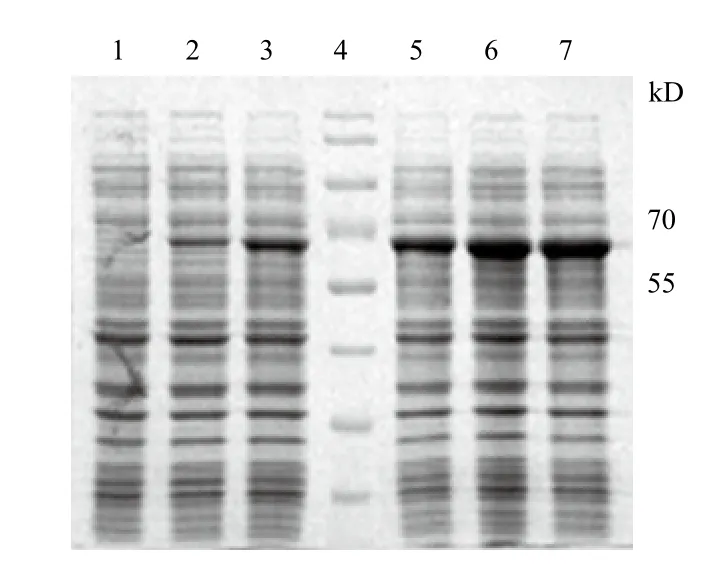
圖3 不同誘導(dǎo)時間下UreB的表達(dá)量分析
2.3 UreB包涵體洗滌
利用洗滌液Ⅰ和洗滌液Ⅱ?qū)Πw各洗滌兩次,SDS-PAGE檢測結(jié)果(圖4)顯示,包涵體洗滌效果良好,4次洗滌收集液中UreB目的蛋白的純度依次為9.7%、25%、37.5%、49.5%,而在裂解液中UreB純度達(dá)到了67.3%。
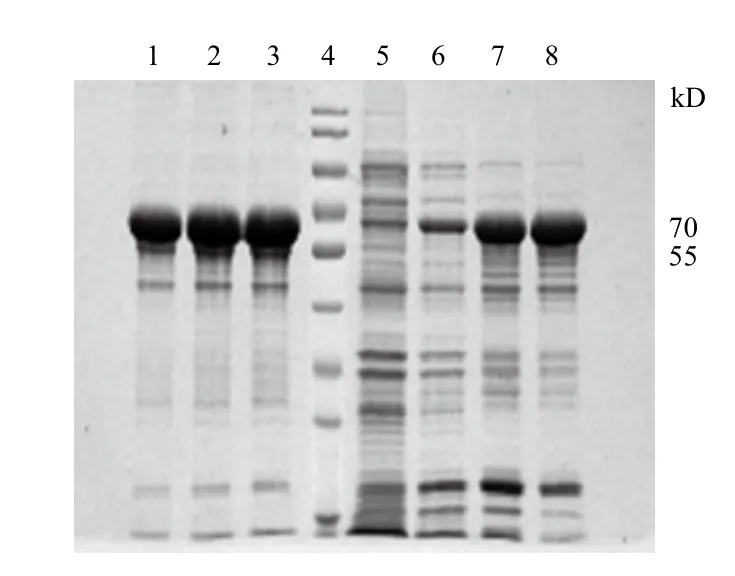
圖4 UreB包涵體的洗滌與裂解效果的電泳分析
2.4 UreB蛋白的純化
2.4.1 陰離子交換層析 采用Q Sepharose High Performance陰離子交換層析對UreB蛋白進(jìn)行純化,經(jīng)SDS-PAGE檢測(圖5),用80 mmol/L和90 mmol/L NaCl進(jìn)行洗脫可獲得較高純度的目的蛋白,純度可達(dá)到96.7%、96.9%。

圖5 80 mmol/L和90 mmol/L NaCl洗脫目的蛋白的電泳分析
2.4.2 G-25凝膠過濾脫鹽 Q柱樣品用截留量為50 kD的膜包進(jìn)行超濾濃縮,濃縮后的樣品用G-25脫鹽柱進(jìn)行脫鹽處理。脫鹽后目的蛋白以可溶性的形式存在,經(jīng)SDS-PAGE檢測(圖6),樣品中的目的蛋白純度高達(dá)98.5%。
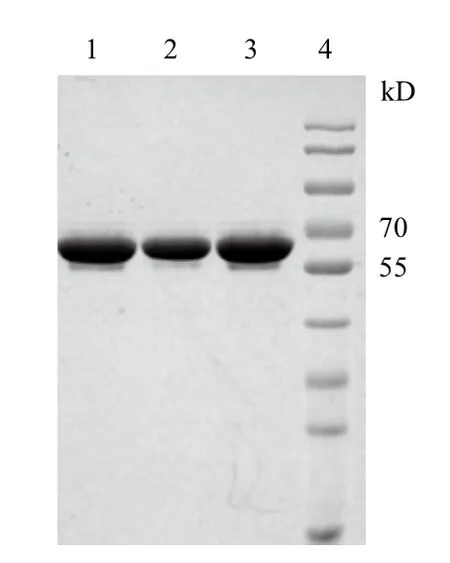
圖6 UreB蛋白脫鹽后電泳分析
2.4.3 目的蛋白免疫雙擴散鑒定結(jié)果 兔抗UreB血清免疫雙擴散結(jié)果(圖7)顯示,UreB抗原具有良好的反應(yīng)特異性,在兔抗血清與UreB純化蛋白之間出現(xiàn)明顯的免疫沉淀線,而兔抗血清與陰性對照之間未出現(xiàn)沉淀線。
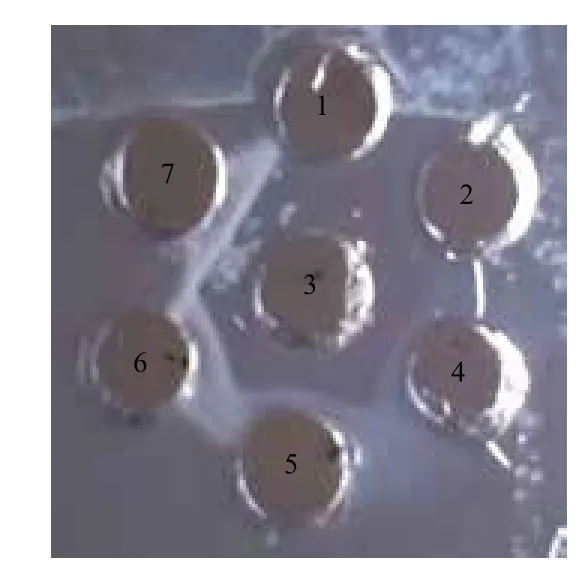
圖7 免疫雙擴散鑒定
3 討論
研究表明,UreB作為疫苗的抗原,具有較好的免疫保護(hù)作用,如何獲得高質(zhì)量UreB蛋白,是能否作為疫苗參考品的關(guān)鍵。這就要求不僅要獲得高純度的UreB蛋白,還需要保證其具有良好的生物活性、反應(yīng)特異性,為此我們構(gòu)建重組表達(dá)質(zhì)粒,進(jìn)行誘導(dǎo)表達(dá)及純化工藝的摸索。
本研究選用pET28a作為表達(dá)載體,并以實驗室保存的pET11c-LTB-ureB表達(dá)質(zhì)粒為模板,設(shè)計帶有XbaⅠ和XhoⅠ酶切位點上下游引物,克隆出疫苗的抗原基因,成功構(gòu)建了重組表達(dá)質(zhì)粒pET28aureB。將重組質(zhì)粒轉(zhuǎn)入大腸桿菌中進(jìn)行表達(dá),可獲得以包涵體形式表達(dá)的UreB蛋白,該形式被認(rèn)為可防止蛋白質(zhì)降解,且利于純化[13,14]。
我們優(yōu)化了包涵體洗滌工藝,進(jìn)行4次洗滌即可達(dá)到較好的洗滌效果,其中采用洗滌液Ⅰ進(jìn)行的前兩次洗滌,電泳檢測UreB蛋白純度只有9.7%和25%,這表明前兩次洗滌雜蛋白去除效果較好,而洗滌液Ⅱ中因含有尿素,導(dǎo)致目的蛋白有一定量的損失,但經(jīng)過工藝驗證,當(dāng)洗滌液Ⅱ中尿素濃度1 mol/L時,可使目的蛋白損失最小,而雜蛋白去除效率最大化,洗滌液在電泳檢測結(jié)果表明雜質(zhì)去除效果非常明顯,雜質(zhì)去除率可達(dá)30%以上。經(jīng)過多次試驗驗證,包涵體的最佳裂解液為pH8.5的50 mmol/L Tris-HCl 8mol/L尿素溶液。在蛋白純化過程中,樣品能否保證其生物學(xué)活性,被看作工藝是否成功的前提條件[15],而經(jīng)過多次純化必然會對蛋白的活性有所影響。因此,在UreB純化過程中,利用Q Sepharose High Performance陰離子交換層析進(jìn)行了多次實驗摸索,確定了最佳的平衡緩沖液為pH8.5的50 mmol/L Tris-HCl 8 mol/L尿素溶液。同時在目的蛋白洗脫的過程中,摸索出鹽離子最佳洗脫梯度,并采取分段收集樣品的方法檢測樣品,最終確定了一步純化即可獲得高純度且具有生物活性的目的蛋白的方法。而根據(jù)已有的相關(guān)報道,在利用陰離子交換層析法進(jìn)行UreB純化時,在裂解及平衡緩沖液組成上有所不同,所用緩沖液pH值多為8.0,大多采用了梯度洗脫,但都未采取分段收集樣品方法,這就導(dǎo)致收獲液的純度達(dá)不到要求,增加了純化難度。
實驗表明離子交換層析是一種高效分離蛋白的方法,可以根據(jù)蛋白表面靜電荷不同,建立適合的鹽離子洗脫梯度,從而獲得我們所需要具有生物活性的目的蛋白。目前有相關(guān)報道的UreB純化方法,一是采用親和層析進(jìn)行純化;二是采用多級純化法,如親和層析與離子交換層析相結(jié)合或離子交換層析與疏水層析相結(jié)合,這兩種方式都可以獲得較滿意蛋白純度,可見的報道中最高的蛋白純度為98.3%。相比以上兩種傳統(tǒng)的UreB純化方式,我們通過摸索純化工藝,優(yōu)化純化條件,最終確定了一步純化的工藝,將UreB蛋白經(jīng)Q Sepharose High Performance陰離子交換層析純化及G-25凝膠過濾脫鹽后,能夠快速獲得純度高且具有生物活性、反應(yīng)特異性的目的蛋白,蛋白純度可高達(dá)98.5%,在節(jié)省了時間的同時,保證了蛋白的活性,同時節(jié)省了生產(chǎn)成本。
4 結(jié)論
本研究確定的純化工藝,達(dá)到了一步純化即得到高純度、具有生物活性蛋白的目的,該純化工藝簡單、有效。制備的UreB蛋白,可作為口服重組幽門螺桿菌疫苗的參考品,用于疫苗的相關(guān)檢測試驗。
[1]Yamaoka Y. Mechanisms of disease:Helicobacter pylori virulence factors[J]. Nature Reviews Gastroenterology and Hepatology,2010, 7(11):629-641.
[2]Machado AM, Figueiredo C, Seruca R, et al. Helicobacter pylori infection generates genetic instability in gastric cells[J]. Biochimica et Biophysica Acta(BBA)-Reviews on Cancer, 2010,1806(1):58-65.
[3]Suerbaum S, Michetti P. Helicobacter pylori infection[J]. New England Journal of Medicine, 2002, 347(15):1175-1186.
[4]Peter S, Beglinger C. Helicobacter pylori and gastric cancer:the causal relationship[J]. Digestion, 2007, 75(1):25-35.
[5]Graham DY, Malaty HM, Evans DG, et al. Epidemiology of Helicobacter pylori in an asymptomatic population in the United States[J]. Gastroenterology, 1991, 100(6):1495-1501.
[6] 張衛(wèi)軍, 郭剛, 劉開云, 等. 幽門螺桿菌雙價亞單位分子內(nèi)佐劑疫苗的構(gòu)建表達(dá)與純化[J]. 第三軍醫(yī)大學(xué)學(xué)報, 2008, 30(17):1587-1590.
[7]Khoder G, Yamaoka Y, Fauchre JL, et al. Proteomic Helicobacter pylori biomarkers discriminating between duodenal ulcer and gastric cancer[J]. Journal of Chromatography B, 2009, 877(11):1193-1199.
[8]Hung CT, Leung WK, Chan FK, et al. Comparison of two new rapid serology tests for diagnois of Helicobacter pylori infection in Chinese patients[J]. Digestive and Liver Disease, 2002, 34(2):111-115.
[9]Voland P, Weeks DL, Marcus EA, et al. Interactions among the seven Helicobacter pylori proteins encoded by the urease gene cluster[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2003, 284(1):G96-G106.
[10]史彤, 劉文忠. 金屬螯合親和層析法對重組幽門螺桿菌尿素酶B 亞單位的純化[J]. 胃腸病學(xué), 2002, 7(4):199-201.
[11]袁小澎, 鄒全明, 柏楊, 等. 幽門螺桿菌尿素酶 B 亞單位功能片段的純化及活性研究[J]. 南方醫(yī)科大學(xué)學(xué)報, 2007, 27(7):959-962.
[12]王縛鯤, 鄒全明. 從包涵體中純化重組人幽門螺桿菌尿素酶 B亞單位[J]. 中國生物制品學(xué)雜志, 2002, 15(1):38-41.
[13]楊曉梅. 包涵體蛋白的復(fù)性技術(shù)[J]. 國外醫(yī)學(xué):臨床生物化學(xué)與檢驗學(xué)分冊, 2000, 21(2):98-99.
[14]Patra AK, Mukhopadhyay R, Mukhija R, et al. Optimization of inclusion body solubilization and renaturation of recombinant human growth hormone from Escherichia coli[J]. Protein Expression and Purification, 2000, 18(2):182-192.
[15]Cho WK, Sohn U, Kwak JW. Production and in vitro refolding of a single-chain antibody specific for human plasma apolipoprotein A-I[J]. Journal of Biotechnology, 2000, 77(2):169-178.
(責(zé)任編輯 李楠)
Cloning,Expression and Purification of Urease B Subunit of Helicobacter pylori
Yan Jinjin Yan Dongming Zou Xue Liu Dan Peng Chao Su Yanan
(Wuhu Kangwei Biotechnology Co.,Ltd.,Wuhu 241000)
In order to obtain high-purity and bioactive urease B subunit protein(UreB), the fragments of ureB amplified by PCR was inserted into expression vector pET28a, and the recombinant plasmid pET28a-ureB was constructed successfully. The identified plasmid was transformed into Escherichia coli, which was induced to express by IPTG. The expressed protein UreB was purified by Q Sepharose High Performance anion exchange chromatography and desalted by G-25 gel filtration chromatography, then analyzed by SDS-PAGE and double immunodiffusion. The results indicated that the molecular weight of the protein was about 64 kD and its purity was 98. 5% after desalting, which was in accord with the prediction. Double immunodiffusion showed that protein UreB possessed a favorable bioactivity and specificity. The finalized purification process achieved the goal of 1-step purification may obtain high-purity and bioactive protein, and it was simpler than the existing purification process as well as effective.
Helicobacter pylori;urease B subunit;UreB protein;protein purification
10.13560/j.cnki.biotech.bull.1985.2015.07.034
2014-10-15
國家科技重大專項子課題項目(2014ZX09102042-002),安徽省科技攻關(guān)計劃項目(1301041020)
閆錦錦,男,碩士,研究方向:生物化學(xué)與分子生物;E-mail:yanjinjin222702@163.com
劉丹,女,博士,研究方向:醫(yī)學(xué)免疫學(xué);E-mail:luckyliu2001@sina.com

