綠豆酯酶的固定化條件優化
徐艷陽,呂燕婷,曾珊,于芮,付佳,李文強
(吉林大學生物與農業工程學院,吉林長春130022)
綠豆酯酶的固定化條件優化
徐艷陽,呂燕婷,曾珊,于芮,付佳,李文強
(吉林大學生物與農業工程學院,吉林長春130022)
為了探索綠豆酯酶的固定化方法,對陰離子交換樹脂D261、D280、D301、D380酸堿處理后,通過離子交換吸附法來固定綠豆酯酶,篩選出固定效果較好的陰離子交換樹脂D380,并進行固定化條件的優化研究。考查了固定化溫度、固定化時間和粗酶液稀釋倍數對固定化綠豆酯酶活力的影響,通過響應面法優化綠豆酯酶的固定條件。結果表明較佳的固定化條件為:粗酶液稀釋25倍,固定化溫度為30℃,固定化時間為3.0 h。實際測得固定化綠豆酯酶活力為0.825 1 U/g,與理論預測值相對誤差為-1.7%,二者基本吻合。
綠豆;酯酶;陰離子交換吸附;固定化;響應面法
固定化酶是指在一定的空間范圍內起催化作用,并能反復和連續使用的酶[1-2]。將酶固定化之后,既保持了酶的催化特性,又克服了游離酶的不足之處,使其具有回收反復使用的優點,并且在生產工藝上易于實現連續化和自動化[3]。因此,酶的固定化技術化學、生物技術、醫學及生命科學等領域的研究異常活躍,在工業生產和分析檢測方面也得到了迅速發展和廣泛應用。
基于酶抑制技術的農藥殘留檢測在有機磷農藥檢測方面得到了應用[4-8],使用的酶主要有乙酰膽堿酯酶、有機磷水解酶、植物酯酶等。其中乙酰膽堿酯酶主要來源于動物及昆蟲,如馬血、雞血、豬血及蒼蠅、棉鈴蟲等,但是動物體中膽堿酯酶含量少,因此較難獲得、成本高。植物酯酶和乙酰膽堿酯酶具有相似的檢測限,測量精密度較好,具有取材方便、酶源豐富、制備簡單和成本低等優點,成為研究的熱點。我國學者林素英、李建科和許學琴等[9-12]分別對植物酶源和固定化技術進行了研究。但對綠豆酯酶的固定化技術研究較少。所以本文對綠豆酯酶的固定化條件進行了優化研究。
1材料與方法
1.1試驗材料
綠豆購于長春市遠方超市,陰離子交換樹脂D380、大孔弱堿性苯乙烯系陰離子交換樹脂D301、大孔強堿性苯乙烯系陰離子交換樹脂D280、大孔徑強堿性陰離子交換樹脂D261購于南開大學化工廠。
1.2儀器與設備
JB-2型恒溫磁力攪拌器:上海雷磁新徑儀器有限公司;JA3003A電子精密天平:上海精天電子儀器有限公司;HH數顯恒溫水浴鍋:江蘇金壇市金城固勝實驗儀器廠;PB一10數字酸度計:SAI賽多利斯科學儀器(北京)有限公司;Fw177型中草藥粉碎機:天津市泰斯特儀器有限公司;TDL一4A型臺式低速離心機:上海菲恰爾分析儀器有限公司;T22N紫外可見分光光度計:上海精密科學儀器有限公司。
1.3方法
1.3.1綠豆酯酶的提取
準確稱取綠豆粉碎樣品5.00 g置于燒杯中,加入0.2 mol/L磷酸緩沖溶液25.0 mL,用磁力攪拌器攪拌30 min,靜置12 h。然后用離心機以4 000 r/min離心20 min,取上清液于4℃條件下保存備用。
1.3.2綠豆酯酶的固定化條件
1.3.2.1樹脂的處理
用去離子水浸泡樹脂,使其充分溶脹,離心脫水。經過一定濃度的酸堿溶液處理后,用去離子水洗至中性,即得Cl-型交換樹脂,加適量去離子水于4℃條件下貯存。
1.3.2.2固定化酯酶的單因素和響應面優化試驗
分別選擇不同粗酶液稀釋倍數、固定化溫度、固定化時間為因素,進行單因素試驗研究。并根據單因素試驗結果,以固定化酶活力為考指標,進行響應面法優化試驗。
在試管中依次加入的不同稀釋倍數10、20、30、40、50、60、80、100倍的粗酶液,按6∶1 mL/g液料比混合樹脂,在30、40℃下,分別靜置1、3、6、9、12、15、18 h后,用濾紙進行過濾,將固定化酶與酶液分開。用磷酸鹽緩沖液對以上固定化酶洗滌8次,最后將其浸在緩沖液中即得固定化酶。
1.3.3試驗指標及測定方法
1.3.3.1α-萘酚標準曲線的制作
將不同濃度的α-萘酚乙醇溶液與0.5 mL 0.08%固藍B鹽溶液混合,在波長595 nm處測定其吸光度。以α-萘酚溶液濃度為縱坐標、吸光度為橫坐標作圖,得到標準曲線的斜率為:
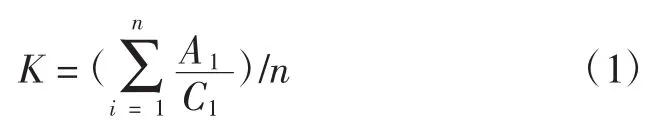
式(1)中:K為標準曲線的斜率;C1為α-萘酚溶液濃度,(μg/mL);A1為反應液在595 nm處的吸光度;n為標準曲線的濃度點數。
1.3.3.2總酯酶活力的測定
將50 μL 16 mmol/L α-乙酸萘酯乙醇溶液加入一定體積的稀釋粗酶液中,混勻,在30℃恒溫水浴中反應5 min。然后加入0.5 mL 0.08%固藍B鹽,同時做空白試驗,在595 nm處測吸光度。總酯酶活力的計算式如下:
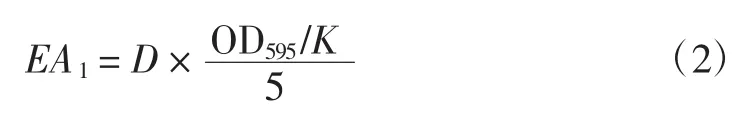
式(2)中:EA1為每毫升酶液所含的總酯酶活力,(U/mL);D為酶液的稀釋倍數;OD595為在595 nm處測得的吸光度;kat為酶活力單位,1 U定義為在30℃下,1分鐘內催化1 μmol α-萘酚所需的酶量。
1.3.3.3固定化酶活力的測定
稱取適量的固定化酶,按1∶20(g/mL)加人磷酸鹽緩沖溶液,再加人80 mmol/L α-乙酸萘酯乙醇溶液使其濃度達到0.4 mmol/L,混勻,在30℃的恒溫水浴中反應5 min。在上述反應液中加入0.5 mL 0.08%固藍B鹽,同時做空白試驗,在595 nm處測定吸光度。固定化酶活力的計算式為:
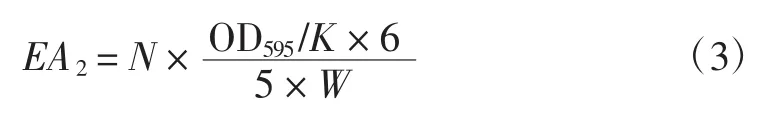
式(3)中:EA2為每克固定化酶所含的總酯酶活力(U/g);N為固定化樹脂與緩沖溶液的比例;W為固定化酶質量,g。
1.3.3.4固定化酶回收率
固定化酶回收率的計算式如下:
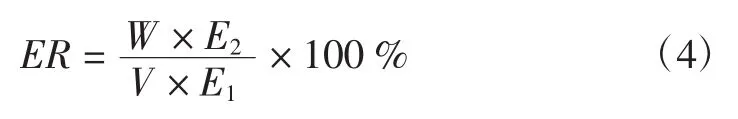
式(4)中:ER為固定化酶回收率,%;W為固定化酶質量,g;E2為固定化酶活力,(U/g);V為粗酶液體積,mL;E1為粗酶液活力,(U/mL)。
2結果與分析
2.1樹脂的選擇
選擇合適的樹脂對于固定綠豆酯酶有較大的影響,本實驗對陰離子交換樹脂D380、D301、D280、D261 4種樹脂分別進行綠豆酯酶的固定化實驗并測定其酶活力,以選擇出有較好固定化效果的樹脂。
由表1可得知,當溫度和稀釋倍數固定時,4種樹脂中D380固定的綠豆酯酶活力最高,因此,選擇陰離子交換樹脂D380的固定化效果較好。
2.2影響固定化酶活力的單因素試驗
2.2.1酶液稀釋倍數對固定化酶活力的影響
酶液稀釋倍數是影響綠豆酯酶固定化的重要因素。當稀釋倍數較小時,固定化酶活力較低,影響對有機磷農藥殘留量檢測的靈敏度;當稀釋倍數較大時,樹脂上的結合位點趨向飽和,浪費大量的酶蛋白,不僅增加成本,還使酶活力下降。酶液稀釋倍數對固定化酶活力的影響見圖1。
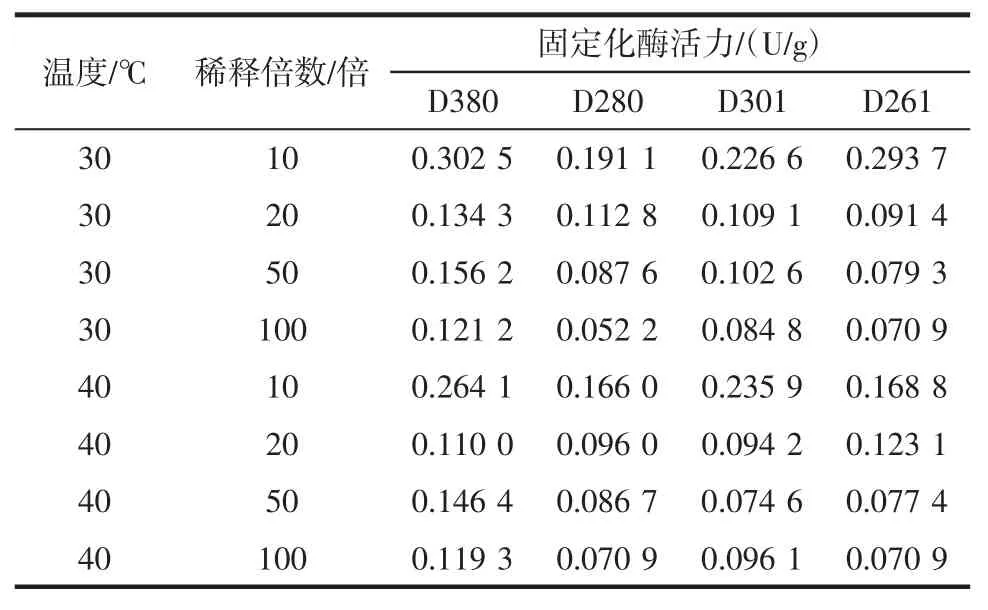
表1 不同樹脂固定化綠豆酯酶的活力Table 1Aactivy of immobilized mung bean esterase by different kinds of resins
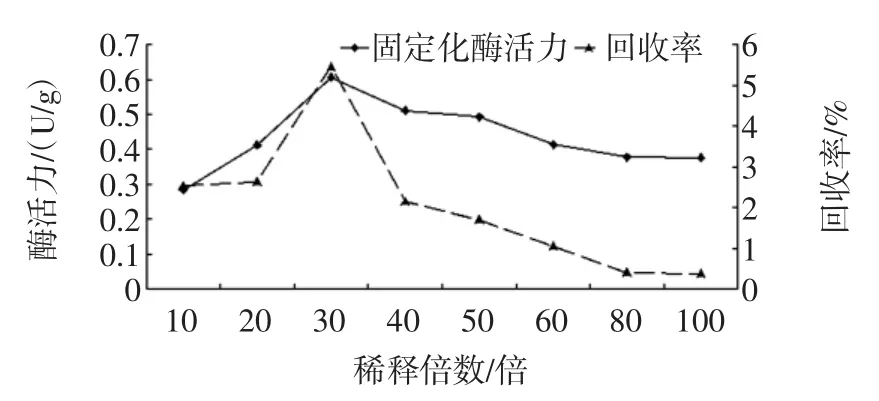
圖1 稀釋倍數對固定化酶活力和回收率的影響Fig.1Effects of dilution times on the activity and recovery rate of immobilized enzyme
由圖1可知,當酶液稀釋倍數小于30時,固定化酶活力及其回收率隨稀釋倍數的增大而增大,當酶液稀釋倍數大于30倍時,固定化酶活力及其回收率隨稀釋倍數的增大而減小,因此,當酶液稀釋倍數為30倍時,固定化效果較佳。
2.2.2固定化溫度對固定化酶活力的影響
酶反應對溫度的變化非常敏感。當溫度升高到一定程度后,會對蛋白質的空間結構產生破壞作用,從而使酶變性失活。固定化溫度對固定化酶活力及其回收率的影響見圖2。

圖2 固定化溫度對固定化酶活力和回收率的影響Fig.2Effects of immobilized temperature on the activity and recovery rate of immobilized enzyme
由圖2可知,固定化溫度在30℃~40℃范圍內,30℃時固定化酶活力比40℃時固定化酶活力高。
2.2.3固定化時間對固定化酶活力的影響
隨著固定化時間的增加,固定化酶活力升高,且酶回收率增大。當達到一定時間后,酶活力增加緩慢,這可能是由于一方面樹脂的結合位點接近飽和,另一方面可能是因為游離酶在磷酸鹽緩沖溶液中放置過久使酶活力下降。固定化時間對固定化酶活力及其回收率的影響見圖3。
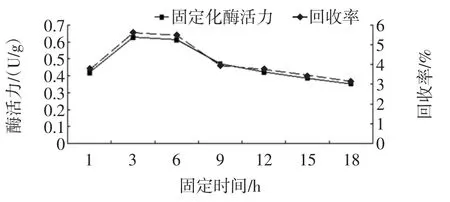
圖3 固定化時間對固定化酶活力和回收率的影響Fig.3Effects of immobilized time on the activity and recovery rate of immobilized enzyme
由圖3可知,從1 h~3 h固定化酶活力及其回收率隨吸附時間延長而增大,從3 h開始酶活力緩慢下降。由此可見,延長固定化時間不一定能夠增加酶活力及其回收率。
2.3響應面法優化與分析
2.3.1響應面設計
在單因素試驗的基礎上,用Design-Expert8.05軟件對各因素及水平進行設計,主要影響因素固定化溫度、固定化時間和稀釋倍數間分別用A、B、C表示,試驗結果見表2和3。
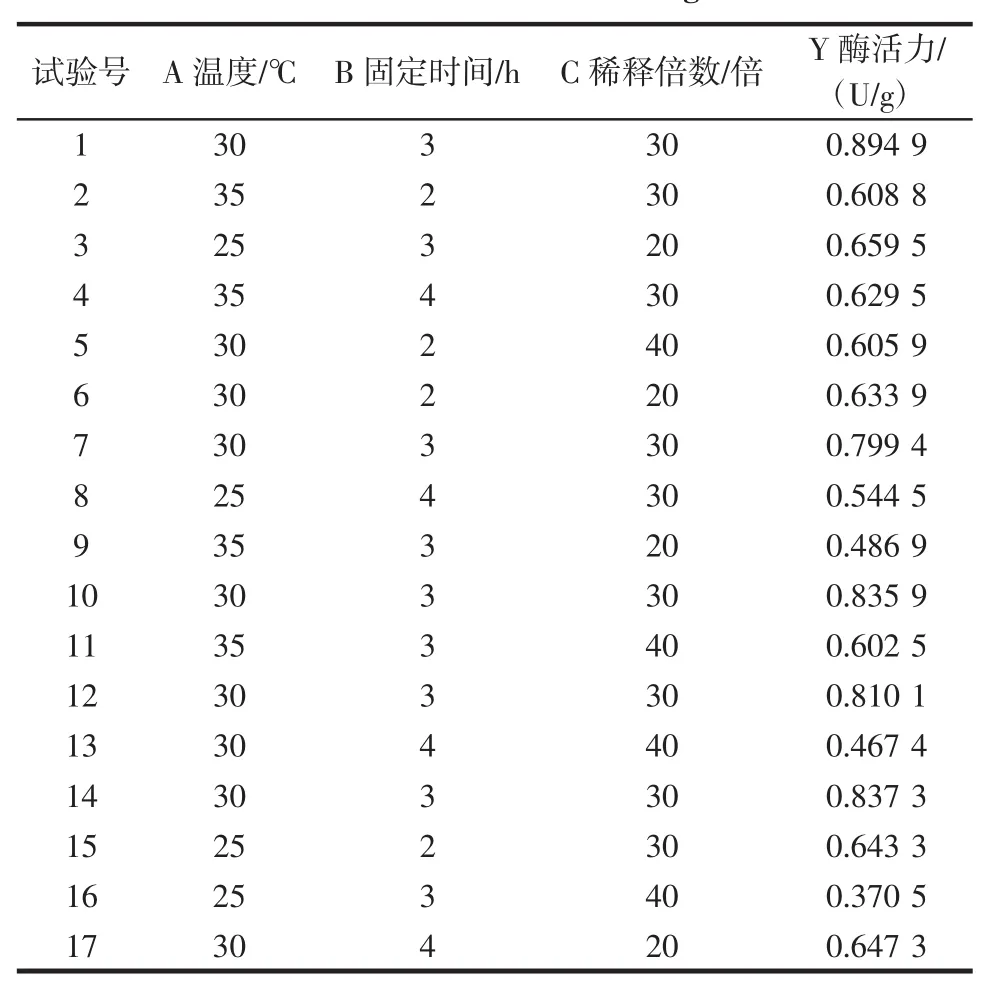
表2 BBD優化試驗結果Table 2Results of BBD design
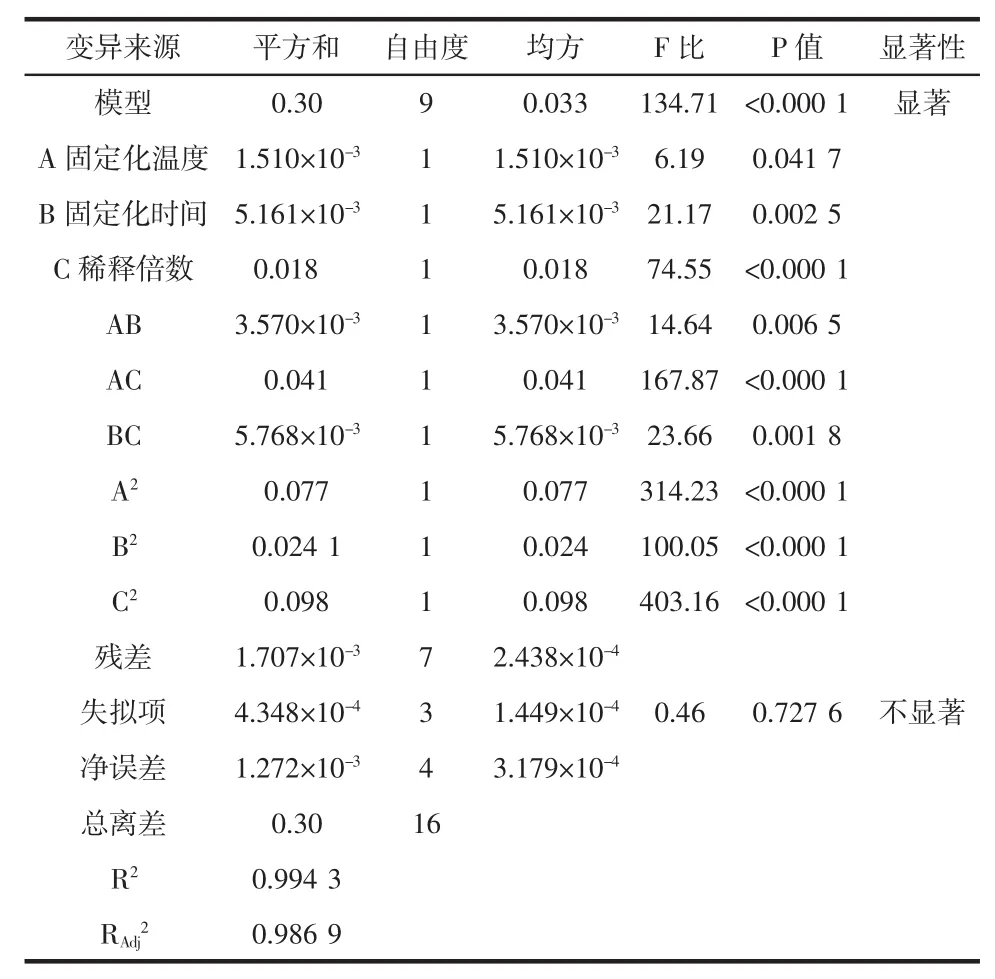
表3 二次回歸模型的方差分析Table 3ANOVA for quadratic regression model
應用Design-Expert8.05軟件對試驗數據進行多元回歸擬合,由各因素之間交互作用的顯著性都在α= 0.05水平以下,得到固定化酶活力(y)與固定化溫度(A)、固定時間(B)和稀釋倍數(C)三因素的二次模擬模型:y=0.82+0.014×A-0.025×B-0.048×C+0.030×A×B+ 0.10×A×C-0.038×B×C-0.13×A2-0.076×B2-0.15×C2
從模型可以看出,影響綠豆酯酶固定的因素大小順序為:稀釋倍數>固定化時間>固定化溫度。
由表2方差分析可以看出,上述二次模擬模型模型的R2=0.994 3,該模型有非常高的顯著性(P<0.001)。失擬性在0.05水平以上不顯著(P=0.727 6>0.05),表明該模型能夠對固定化綠豆酯酶酶活力進行準確的預測和分析。調整確定系數為RAdj2=0.986 9,模型擬合程度良好,可以用來確定和預測綠豆酯酶固定化條件。
2.3.2響應曲面分析
根據回歸方程來繪制交互作用較為明顯的響應面立體分析圖和等高線圖,如圖4、圖5和圖6。
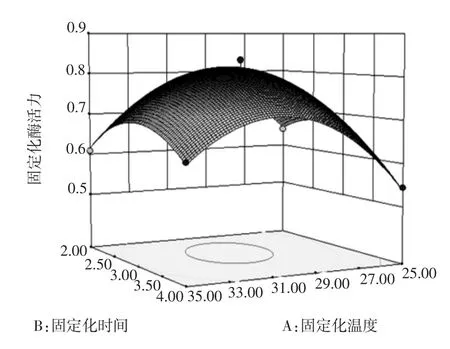
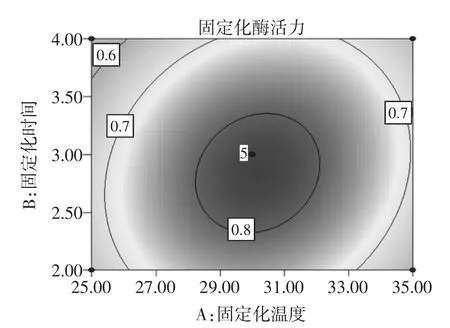
圖4 固定化溫度和固定化時間對固定化綠豆酯酶酶活力影響的響應面圖和等高線圖Fig.4Response surface and contour plots of activity of immobilized enzyme under the interaction between immobilized temperature and time
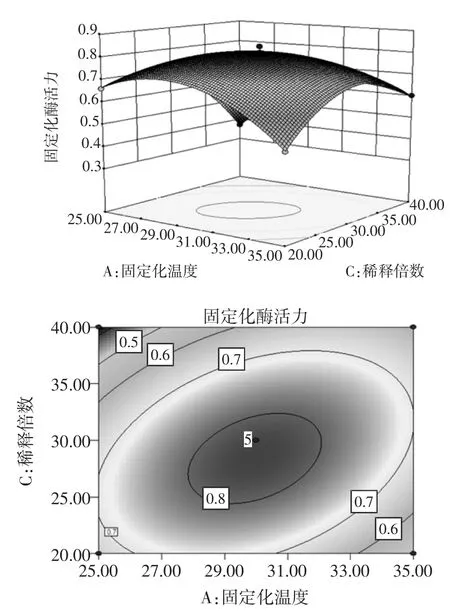
圖5 固定化溫度和稀釋倍數度固定化綠豆酯酶酶活力影響的響應面圖和等高線圖Fig.5Response surface and contour plots of activity of immobilized enzyme under the interaction between immobilized temperature and dilution times
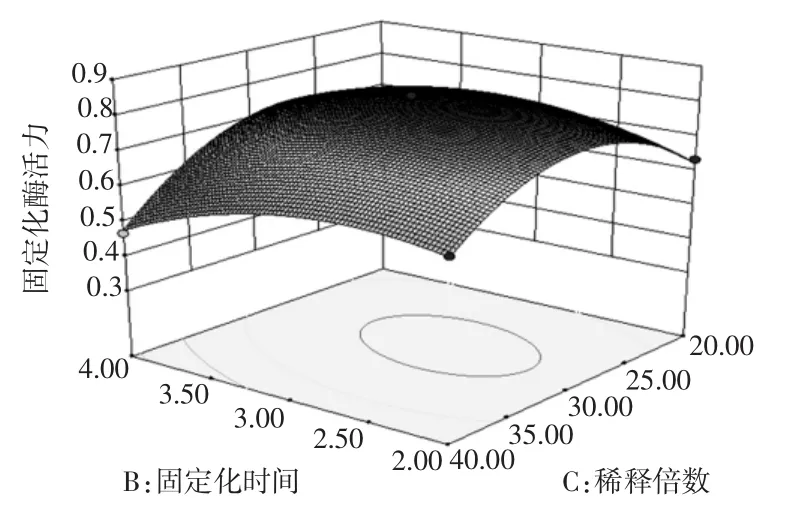
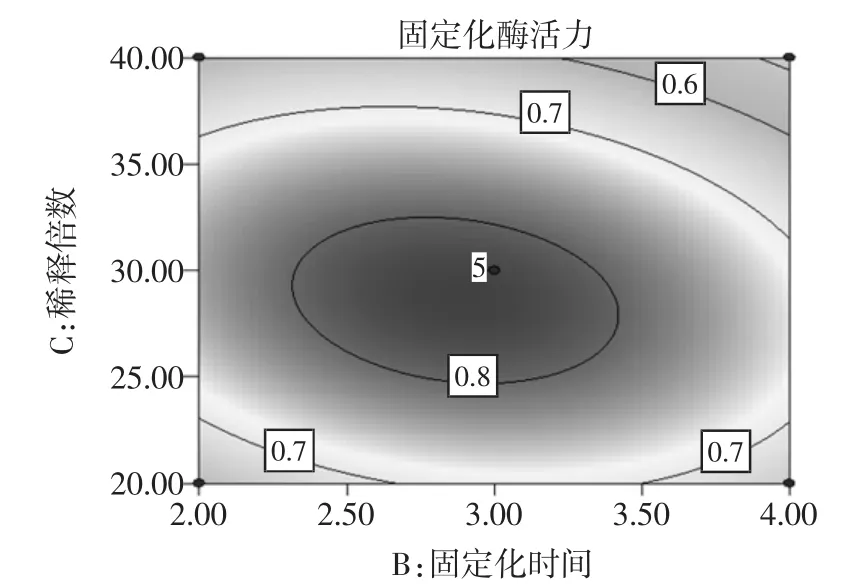
圖6 固定化時間和稀釋倍數度固定化綠豆酯酶酶活力影響的響應面圖和等高線圖Fig.6Response surface and contour plots of activity of immobilized enzyme under the interaction between immobilized time and dilution times
固定化溫度、固定化時間和稀釋倍數均對固定化綠豆酯酶的酶活力有顯著的影響(P<0.05)。圖4~圖6直觀地反映了各因素對響應值的影響,由等高線圖可以看出存在極值的條件應該在近圓心處。由圖4可知,固定化時間對固定化綠豆酯酶酶活力的影響比固定化溫度大,表現為固定化時間所對應的曲線較固定化溫度的曲線陡。由圖4中等高線的形狀可以確定這兩個影響因素的較優水平范圍為:固定化溫度為28℃~32℃,固定化時間為2.3 h~3.2 h。
由圖5可知,稀釋倍數對固定化綠豆酯酶酶活力的影響比固定化溫度大,表現為稀釋倍數所對應的曲線較固定化溫度對應的曲線陡。由圖5中等高線的形狀可以確定這兩個影響因素的較優水平范圍為:固定化溫度為28℃~32℃,稀釋倍數為22倍~34倍。
由圖6可知,稀釋倍數對固定化綠豆酯酶酶活力的影響比固定化時間大,表現為稀釋倍數所對應的曲線較固定化時間對應的曲線陡。由圖6中等高線的形狀可以確定這兩個影響因素的較優水平范圍為:固定化時間為2.2 h~3.5 h,稀釋倍數為25倍~32倍。
通過對y的回歸系數的檢驗可知,各因素對固定化酶活力影響的大小順序為稀釋倍數>固定化時間>固定化溫度。對函數進行分析得到其最大值點為A= 29.90℃、B=2.87 h、C=28.55,此時固定化酶活力最大,最大值為0.835 5 U/g,即最優綠豆酯酶固定化條件為固定化溫度為29.90℃,固定化時間為2.87 h,稀釋倍數28.55倍。
2.4驗證試驗
為檢驗響應面實驗法的可靠性,按照最佳反應條件進行實驗驗證,重復3次,同時考慮到實際操作的便利,將綠豆酯酶固定化最佳條件調整為固定化溫度30℃、固定化時間3.0 h,酶液稀釋倍數為25倍。實際測得固定化綠豆酯酶活力為0.825 1 U/g,與模型理論預測值相比相對誤差為-1.7%。因此,綠豆酯酶固定化采用響應面實驗法優化得到的參數準確可靠,具有實用價值。
3結論
1)采用響應面法建立了固定化綠豆酯酶酶活力(y)與固定化溫度(A)、固定時間(B)和稀釋倍數(C)三因素的二次回歸模型為:y=0.82+0.014×A-0.025×B-0.048×C+0.030×A×B+0.10×A×C-0.038×B×C-0.13×A2-0.076×B2-0.15×C2
綠豆酯酶固定化的影響因素大小順序為:稀釋倍數>固定化時間>固定化溫度。
2)獲得綠豆酯酶固定化的最佳工藝參數為:稀釋倍數25倍,固定化溫度為30℃,固定時間為3.0 h。
[1]許學勤,徐斐,吳燕雯,等.固定化對動植物酯酶性質的影響[J].食品與發酵工業,2004,30(7):38-42
[2]何國慶,丁立孝.食品酶學[M].北京:化學工業出版社,2006:3-5
[3]Aziz Amine,Hasna Mohammad,Ilhame Bourais,et al.Enzyme inhibition-based biosensors for food safety and environmental monitoring[J].Biosensors and Bioelectronics,2006,21:1405-1423
[4]黃志勇,袁園,呂禹澤.蔬菜中有機磷農藥殘留的兩種酶抑制快速檢測方法的比較研究[J].食品科學,2003(8):135-137
[5]溫艷霞,蘭文禮,李建科.大豆酯酶的分離、純化及性質研究[J].食品科學,2008,29(5):292-294
[6]溫艷霞,李建科,張曉敏,等.植物酯酶檢測有機磷農藥的敏感性和檢測限的研究[J].食品科學,2006,27(9):186-188
[7]于基成,邊辭,趙娜,等.酶抑制法快速檢測蔬菜中有機磷農藥殘留[J].江蘇農業科學,2006(5):170-172
[8]游金坤,余旭亞,趙鵬.吸附法固定化酶的研究進展[J].化學工程,2012,4,40(4):1-5
[9]林素英,林少琴.豆類酯酶的提取及其在有機磷農藥檢測中的應用[J].現代農業科學,2008,15(9):14-15
[10]許學勤,徐斐,華澤釗.用于有機磷農藥殘留快速檢測的固定化小麥酯酶研究[J].食品科學,2003,24(5):122-126
[11]張開旺,雷勃鈞,盧翠華,等.野生半野生栽培大豆及其小豆、綠豆的酯酶同工酶酶譜的比較研究[J].黑龍江農業科學,1985(3):52-54
[12]李建科,溫艷霞,牛樂,等.一種大豆酯酶的制備方法:中國2005 10096207-4[P].2007-04-25
Optimination of Immobilization Conditions for Mung Bean Esterase
XU Yan-yang,Lü Yan-ting,ZENG Shan,YU Rui,FU Jia,LI Wen-qiang
(College of Biological and Agricultural Engineering,Jilin University,Changchun 130022,Jilin,China)
To explore imobilization method of mung bean esterase,four types of anion exchange resins D261,D280,D301and D380 were treated using a given content acid and alkali solutions,and applied to imobilze mung bean esterase.Anion exchange resin D380 was better immobilization effect and its immobilization conditions were optimized.Based on single factor and response surface method experiments,immobilization conditions of mung bean esterase were investigated.Results showed that optimun immobilization conditions were a diluted 25 times of original enzyme solution,an immobilization temperature of 30℃,and an immobilization time of 3 hours.Under these conditions,imobilized mung bean esterase activity was 0.825 1 U/g,relative error between determined and predicted value was-1.7%,and tested and predicted value was similar basically.
mung bean;esterase;anion exchange adsorption;immobilization;response surface method
10.3969/j.issn.1005-6521.2015.14.032
2014-03-12
吉林大學大學生創新項目(2008AA100802)
徐艷陽(1972—),女(漢),副教授,博士,主要從事食品安全研究。

