快眼動睡眠剝奪及腺苷受體拮抗劑對抑郁模型大鼠自發活動的影響
菊軒 許崇濤*
快眼動睡眠剝奪及腺苷受體拮抗劑對抑郁模型大鼠自發活動的影響
菊軒許崇濤*
目的 研究快眼動睡眠剝奪(REMSD)抗抑郁機制中腺苷及其受體對抑郁模型大鼠自發活動的影響。方法 成年雄性SD大鼠56只,隨機分為正常對照組(8只)和應激模型組(48只),應激模型組經21d慢性不可預見性應激(CUS)和單籠孤養建立抑郁模型,再隨機分為抑郁模型組、睡眠剝奪組、水環境對照組、生理鹽水對照組、腺苷A1受體拮抗劑組、腺苷A2A受體拮抗劑組,每組各8只;行72h REMSD觀察大鼠自發活動路程的變化。結果 72h REMSD后,睡眠剝奪組總路程、中央路程、周邊路程大于水環境對照組,差異有統計學意義(P<0.05);72h REMSD后,腺苷A1受體拮抗劑組總路程和周邊路程較前明顯增加,差異有統計學意義(P<0.01),中央路程無明顯變化,差異無統計學意義(P>0.05);72 h REMSD后,腺苷A2A受體拮抗劑組總路程和周邊路程較前顯著增加,差異有統計學意義(P<0.01),中央路程增加,差異有統計學意義(P<0.05)。結論 72h REMSD可使抑郁模型大鼠的自發活動增加,在72h REMSD過程中腺苷A1受體或A2A受體失活時也可使抑郁模型大鼠的自發活動增加。
睡眠剝奪 腺苷 抑郁 自發活動
文獻提示,睡眠剝奪可以快速發揮抗抑郁作用,而且無明確的禁忌證和副反應[1]。部分睡眠剝奪可使約60%的患者抑郁癥狀得以緩解[2],整夜的睡眠剝奪可使抑郁癥患者漢密爾頓抑郁量表的總分下降50%[3]。睡眠剝奪可使腺苷水平明顯升高,腺苷受體也會發生一系列的改變[4]。腺苷受體有4種亞型,其中A1和A2A受體在腦中含量最多,且在睡眠調節、情緒改變中起重要作用。本實驗通過對慢性不可預見性應激(CUS)模型大鼠進行72h快眼動睡眠剝奪(REMSD)并結合腺苷受體拮抗劑,觀察對大鼠自發活動的影響,以探討睡眠剝奪抗抑郁機制中腺苷及其受體可能發揮的作用。
1 材料與方法
1.1實驗動物 成年雄性SD大鼠(汕頭大學醫學院實驗動物中心提供)56只,體質量220~260g。實驗前1周開始晝夜交替各喂養12 h,環境溫度22℃,大鼠自由進食、進水。
1.2實驗儀器與試劑 DigBehv自發活動視頻分析系統,大鼠睡眠剝奪箱:32cm×30cm×36cm,腺苷A1、A2A受體拮抗劑(Tocris公司,美國)。
1.3動物分組 大鼠隨機分為正常對照組(8只)和應激模型組(48 只),并對其進行第1次行為學測試。應激模型組進行21d CUS,并進行第2次行為學測試。隨后再將應激模型組分為抑郁模型組、睡眠剝奪組、水環境對照組、生理鹽水對照組、腺苷A1受體拮抗劑(DPCPX)組、腺苷A2A受體拮抗劑(ZM241385)組,每組各8只。第2次行為學測試完成后對睡眠剝奪組、水環境對照組、生理鹽水對照組、腺苷A1受體拮抗劑組、腺苷A2A受體拮抗劑組分別進行72h REMSD,并在72h REMSD過程中分別對生理鹽水對照組,腺苷A1、A2A受體拮抗劑組注射生理鹽水(1ml/kg)、腺苷A1受體拮抗劑(DPCPX 2mg/kg)、腺苷A2A受體拮抗劑(ZM241385 1mg/kg)[1]。72h REMSD后對上述5組進行第3次行為學測試。
1.4實驗方法 (1)抑郁模型的建立:本實驗選用21d CUS和單籠孤養兩種模式建立抑郁模型[1],將行為束縛2h,4℃冰水游泳5min,禁食24h,禁水24h,明暗顛倒24h,夾尾1min,點擊足底10min(10次/ min,1s/次),鼠籠傾斜45°24h,潮濕墊料10h,空瓶放置5h和45℃高溫5min,11種刺激隨機安排在21d 內,1種/d。在整個過程中刺激平均出現2~3次/種,同種刺激不能連續出現,使動物不能預料刺激的發生。(2)REMSD模型的建立[5]:本實驗采用改良小平臺睡眠剝奪法建立72h REMSD大鼠模型。在睡眠剝奪箱中央放置1個直徑6.3 cm的平臺,平臺高8.0 cm,底部固定于水箱中央,在平臺周邊注滿水,水溫保持在22℃左右,水面距平臺面約1.0 cm,大鼠站在平臺上可自行飲食、飲水。當大鼠進入REM睡眠時,由于全身肌張力降低,節律性地垂頭觸水或落入水中而覺醒,從而使動物始終不能進入REM睡眠期。睡眠剝奪期間燈光持續照射,水箱中的水每天更換。水環境對照組采用與睡眠剝奪組尺寸相同的水箱,但在其底部則放置直徑為18 cm的大平臺,使大鼠可以在臺上睡眠,其他條件均與睡眠剝奪組相同。各組處理時間均持續72h。(3)行為學測試:應用DigBehv動物自發活動視頻跟蹤分析系統檢測大鼠的總路程、中央區路程、周邊路程。在應激前、應激后及72 h REMSD后分別測定大鼠的自發活動。
1.5統計學方法 采用SPSS16.0統計軟件。計量資料以(x±s)表示。多組比較采用單因素方差分析,自身前后比較采用配對樣本t檢驗,兩樣本均數比較采用獨立樣本t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1REMSD對抑郁模型大鼠自發活動的影響 見表1。

表1 REMSD對抑郁模型大鼠自發活動的影響[cm,(x±s)]
2.2腺苷A1、A2A受體拮抗劑對睡眠剝奪改善大鼠抑郁樣行為的影響 見表2。
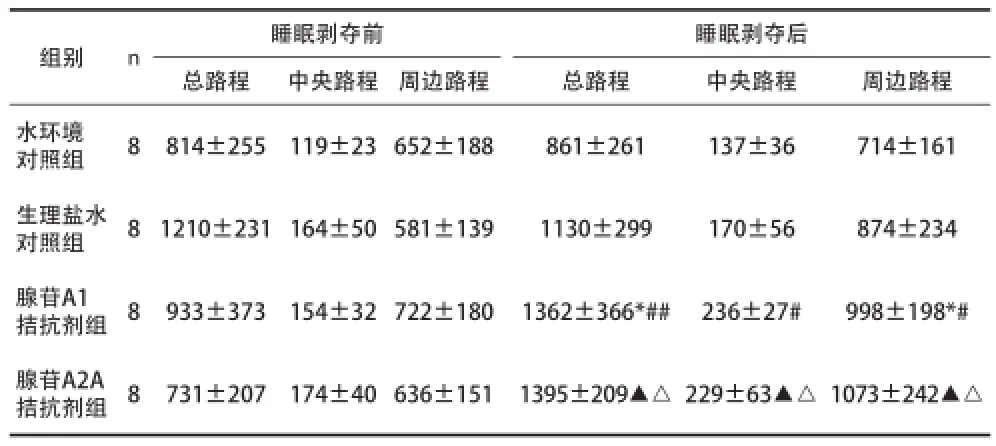
表2 各種處理方式對抑郁模型大鼠自發活動的影響[cm,(x±s)]
3 討論
抑郁癥的藥物治療需要長時間才能起效,而睡眠剝奪則可快速發揮抗抑郁作用,此特點明顯優于抗抑郁藥物[1]。本實驗對抑郁模型大鼠進行72h REMSD,發現睡眠剝奪后抑郁組大鼠的活動路程明顯增加。為排除水環境在方法上的干擾,本實驗設置水環境對照組;結果發現睡眠剝奪組大鼠的活動路程相比水環境組有明顯增加。所以72h REMSD可以逆轉抑郁模型大鼠的抑郁樣行為。睡眠剝奪后大鼠腦內能量代謝增加,ATP消耗增多,胞內腺苷含量隨之增加,通過非濃度依賴型腺苷轉運體將腺苷從胞內轉移到胞外,進而作用于腺苷受體。通過特異性受體拮抗劑,可證明腺苷的抗抑郁作用是通過A1R和A2AR的激活來實現的[6]。電休克、睡眠剝奪和抗抑郁藥物等多種抗抑郁治療均可引起A1R上調[3],24h睡眠剝奪可以模擬SSRIs類藥物的作用降低強迫游泳實驗中大鼠的不動時間[7]。故作者推測睡眠剝奪的抗抑郁機制與腺苷及其受體有著密切的關系。
在持續覺醒狀態下,細胞外腺苷水平會明顯升高,腺苷本身對于記憶、認知、睡眠周期、焦慮和攻擊行為都發揮重要的作用[8]。本項目在72h REMSD過程中對抑郁模型大鼠分別腹腔注射腺苷A1及 A2A受體拮抗劑。結果發現腺苷A1受體拮抗劑組前后比較總路程、周邊路程明顯增加,提示A1受體被選擇性拮抗、A2A受體發揮主導作用時睡眠剝奪可以使抑郁模型大鼠的自發活動增加,發揮抗抑郁作用;腺苷A2A受體拮抗劑組前后比較,總路程、中央路程和周邊路程顯著增加,提示A2A受體被選擇性拮抗、A1受體發揮主導作用時睡眠剝奪也可使抑郁模型大鼠的自發活動增加,發揮抗抑郁作用。本實驗設立生理鹽水對照組以排除腹腔注射的干擾,結果提示試驗中單純腺苷受體拮抗劑發揮作用。本實驗發現72h REMSD過程中,腺苷A1和A2A受體分別失活時均可以發揮抗抑郁的效果。
腺苷作為神經調質在突觸水平上影響其它神經遞質的功能,當腺苷A1受體發揮主要作用時,抑郁模型大鼠經72h REMSD表現出抗抑郁作用。A1受體對于睡眠剝奪的抗抑郁作用是必須的,而且該受體的激活可持續維持抗抑郁作用[9]。腺苷A1受體可通過抑制興奮性神經元的釋放、降低細胞的興奮性來保護細胞。腺苷與A1受體結合抑制5-HT的釋放,而5-HT系統與抑郁癥密切相關;有實驗發現正常大鼠72h睡眠剝奪后,由于負反饋調節機制,海馬及中腦腺苷A1受體mRNA表達明顯降低[10],故可以推測72h睡眠剝奪抑制A1受體的表達,進而使腺苷抑制5-HT釋放的作用減弱,使細胞間5-HT的含量增加發揮抗抑郁作用。也有實驗證明睡眠剝奪改變星形膠質細胞介導的信號通路產生抗抑郁作用[9],而星形膠質細胞的作用通過A1受體的介導[11];A1受體可刺激星形膠質細胞釋放神經保護因子,而且可通過PI3/ERK1/2/MAPK通路減少膠質細胞凋亡[12],所以可推測A1受體通過影響星形膠質細胞從而產生的抗抑郁效應。
當腺苷A2A受體發揮主要的作用時,抑郁模型大鼠經72h REMSD仍表現出抗抑郁作用。腦室內注射A2A受體激動劑可以促進視前核及腹外側視前區GABA神經元的激活[13],同時A2A受體可影響紋狀體GABA的釋放[14];而GABA濃度的上升可產生明確的抗抑郁作用。腺苷A2A受體激動劑還可增強海馬、紋狀體單胺類神經遞質的釋放從而發揮抗抑郁作用[14]。內源性腺苷所介導的A2A受體激活,促進神經元的可塑性從而發揮抗抑郁作用[15]。故可推測睡眠剝奪可通過激活A2A受體產生抗抑郁作用。不過有實驗提示睡眠剝奪可使嗅球、蒼白核、尾狀核3個實驗腦區的腺苷A2A受體密度降低,與本實驗的推測并不一致[16],其原因可能是由A2A受體與多巴胺受體形成的二聚體相互作用造成的[17]。
1Baghai TC,Moller HJ,Rupprecht R,et al.Recent Progress in pharmacological and non-pharmacological treatment options of major depression .Current Pharmaceutical Design,2006,12(4):503~515.
2Ellen T,Kahn-Greene,Desiree B,et al.The effects of sleep deprivation on symptoms of psychopathology in healthy adults.Sleep Medicine, 2007,8(8):215~221.
3Francesco Benedetti,Cristina Colombo.Sleep Deprivation in Mood Disorders. Neuropsychobiology,2011,64(3):141~151.
4Chapman D P,Perry G S,Strine T W.The vital link between chronic disease and depressive disorders .Prev Chronic Dis,2005,2(1): A14.
5Allard J S,Tiazbi Y,Shaffery J P,et al.Effects of rapid eye movement deep deprivation on hypocretin neurons in the hypothalamus of a rat model of depression.Neuropeptides,2007,41(5):329~337.
6Kaster MP,Rosa A,Rosso MM,et al.Adenosine administration produces an antidepressant like effect in mice: evidence for the involvement of A1 and A2A receptors.Neurosci Lett,2004,355(1~2):21~24.
7Hua-Cheng YAN, Xiong CAO, Manas Das, et al. Behavioral animal models of depression . Neurosci Bull,2010,26(4): 327~337.
8J.A. Ribeiro,A.M. Sebastia,A. de Mendonc,et al. Adenosine receptors in the nervous system: pathophysiological implications .Prog Neurobiol,2003,26(8):377~392.
9DJ Hines,LI Schmitt,RM Hines,et al.Antidepressant effects of sleep deprivation require astrocyte-dependent adenosine mediated signaling. Transl Psychiatry,2013,3:e212.
10張金玲,張印南,唐建軍,等.睡眠剝奪對大鼠自發活動及各腦區腺苷A1受體表達的影響.汕頭大學醫學院學報,2012,25(4):202~205.
11L.Ian Schmitt,Robert E. Sims,Nicholas Dale,et al.Wakefulness Affects Synaptic and Network Activity by Increasing Extracellular Astrocyte-Derived Adenosine. The Journal of Neuroscience,2012, 32(13):4417~4425.
12Dalimontel,Ballerinip,Nargie,et al.Staurosporine-induced apoptosis in astrocytes is prevented by A1 adenosine receptor activation .Neuroscilett, 2007,418(1):66~71.
13Sunil Kumar,Seema Rai,Kung-Chiao Hsieh,et al.Adenosine A2A receptors regulate the activity of sleep regulatory GABAergic neurons in the preoptic hypothalamus. Am J Physiol Regul Integr Comp Physiol,2013,305:31~41.
14Sebasti?o AM, Assaife-Lopes N,Diógenes MJ,et al. Modulation of brain-derived neurotrophic factor (BDNF) actions in the nervous system by adenosine A(2A) receptors and the role of lipid rafts.Biochim Biophys Acta,2011, 1808(5):1340~1349.
15Emily Urry,Hans Peter Landolt. Adenosine,Caffeine,and Performance From Cognitive Neuroscience of Sleep to Sleep Pharmacogenetic.Curr Top Behav Neurosci,2015,25:331~366.
16Youngsoo KimDavid,Elmenhorst Angela,Weisshaupt,et al. Chronic sleep restriction induces long-lasting changes in adenosine and noradrenaline receptor density in the rat brain. Journal of Sleep Research,2015,4. Epub ahead of print.
17Lazarus M,Chen J F,Urade Y et al.Role of the basal ganglia in the control of sleep and wakefulness.Curr Opin eurobiol,2013,23(5):780~785.
Objective To investigate the effects of adenosine and its receptors for spontaneous activities of depression-model rats in antidepressive mechanism of Rapid-Eye-Movement sleep deprivation (REMSD). Methods 56 adult males Sprague-Dawley rats were randomly divided into two groups: normal control group (n=8) and stress-model group (n=48). The stress-model group used chronic unpredicted stress(CUS) and Single cage solitary raise way to establish depression model. The stress-model group were divided into six groups in randomized method:the depression-model group (n=8),sleep deprivation group(n=8),water control group(n=8),adenosine A1 receptor antagonist group(n=8),adenosine A2A receptor antagonist group(n=8),saline group(n=8). The function of the 72h REMSD was to observe the changes of rats spontaneous activities of the distance. Results After 72 hours sleep deprivation,the total distance the central distance and the around distance in sleep deprivation group was longer than that in water control group(P<0.05); After 72h REMSD,the total distance and the around distance in A1 receptor antagonist group increased significantly compared with that before perform(P<0.01),the central distance had no significant difference(P>0.05). After 72 h REMSD,the total distance and the around distance in A2A receptor antagonist group increased significantly compared with that before perform(P<0.01),the central distance increased compared with that before perform(P<0.05).Conclusion The spontaneous activities of depression-model rats can be increased by 72h REMSD. In the process of 72h REMSD,the spontaneous activities of depression-model rats can be also increased when the A1 receptor antagonist or A2A receptor antagonist were inactivated.
Sleep deprivation Adenosine Depression Spontaneous activity
國家自然科學基金資助項目(30670756)
310013杭州市第七人民醫院(菊軒)515065汕頭大學精神衛生中心(許崇濤)

