發酵和焙烤對可可豆多酚、黃酮和風味品質的影響
易橋賓,谷風林*,那治國,房一明徐 飛
(1.黑龍江東方學院食品與環境工程學部,黑龍江 哈爾濱 150086;2.中國熱帶農業科學院香料飲料研究所,海南 萬寧 571533;3.農業部香辛飲料作物遺傳資源利用重點實驗室,國家重要熱帶作物工程技術研究中心,海南 萬寧 571533)
發酵和焙烤對可可豆多酚、黃酮和風味品質的影響
易橋賓1,2,谷風林2,3,*,那治國1,房一明2,3,徐 飛2,3
(1.黑龍江東方學院食品與環境工程學部,黑龍江 哈爾濱 150086;2.中國熱帶農業科學院香料飲料研究所,海南 萬寧 571533;3.農業部香辛飲料作物遺傳資源利用重點實驗室,國家重要熱帶作物工程技術研究中心,海南 萬寧 571533)
本實驗采用高效液相色譜儀(high performance liquid chromatography,HPLC)、色差儀、電子鼻分別檢測未發酵、發酵和焙烤海南可可豆的總酚含量、總黃酮含量、色度和可可豆風味差異。結果表明:未經焙烤的未發酵豆總酚(464.03 mg/10 g)和總黃酮(126.86 mg/10 g)含量明顯高于發酵豆總酚(211.86 mg/10 g)和總黃酮(61.98 mg/10 g)含量。105~145 ℃焙烤30 min,未發酵豆總酚和總黃酮含量分別為419.5~129.8 mg/10 g和77.8~16.8 mg/10 g;發酵豆總酚和總黃酮含量分別為182.53~86.25 mg/10 g和34.7~7.0 mg/10 g。其中,125 ℃焙烤20~40 min,未發酵豆總酚和黃酮含量分別為353.74~289.45 mg/10 g和42.86~32.20 mg/10 g;發酵豆總酚和黃酮含量分別為152.08~123.55 mg/10 g和25.12~21.14 mg/10 g。在105~145 ℃的溫度焙烤下沒食子酸含量變化顯著。可可豆色度值的范圍:L*值集中在40.0~47.0之間,a*值集中在5.0~6.8之間,b*值集中在4.0~8.5之間。未發酵和發酵可可豆之間,以及不同溫度焙烤可可豆之間的電子感官風味分析結果差異較大。
海南可可豆;焙烤;多酚;黃酮;風味
可可具有較高的營養價值,廣泛用于巧克力、飲料、糕點和冰激凌制造等行業,與咖啡、茶同被稱為世界三大軟飲料[1]。近幾年來,對可可的研究主要集中在可可豆所富含的多酚特別是黃酮類物質,研究發現,天然可食可可黃烷醇活性物質可扭轉和年齡相關的記憶衰退[2]。可可豆是一種富含類黃酮的食品來源,Langer等[3]研究了可可終端產品--堿化黑巧克力中類黃酮-原花青素的含量,為(48.4±4.3)~(334.0±5.9)mg/100 g,其具有極強的抗氧化活性,能有效地清除羥自由基(·OH)和超氧陰離子自由基(O2-·),保護DNA免受·OH引起的氧化損傷,還可以有效地抑制脂質過氧化[4]。可可豆中含有的多酚和黃酮類物質,總量達到336.04~427.22 mg/10 g[5],新鮮脫脂可可豆中表兒茶素含量達到218.9~432.7 mg/10 g[6],多酚類具有抗氧化、抗衰老、抗癌、抗輻射等多種生物活性[7-9]。在以往的研究中,人們往往關注的是不同植物多酚和類黃酮的含量,及其測定方式和功能,而忽視了在樣品加工處理過程中保護多酚的條件研究。
可可豆的加工主要由3 個步驟構成,即發酵、干燥和焙烤。Nicholas等[10]在使用木箱發酵新鮮的可可豆后發現多酚類物質含量明顯降低了10%~50%,同時在發酵過程中微生物連續不斷的活性作用,形成了可可豆的風味前體物質[11],從而降低了可可豆的抗氧化能力[12]。有文獻表明20~60 min、120~150 ℃為發酵可可豆常用的焙烤條件[11]。可可豆在焙烤過程中會發生美拉德反應,氨基化合物與羰基化合物縮合,即可可豆中酚酮等含有羰基類的物質與含氨基的氨基酸反應,產生特殊的香氣物質,導致可可豆中多酚類物質含量進一步減少[13-14]。
為研究發酵和焙烤對可可豆酚類物質、類黃酮物質和風味的影響,本實驗以海南可可豆作為研究對象,以發酵與否、焙烤溫度和焙烤時間作為影響因素,測定可可豆中多酚和類黃酮物質總含量的變化、色度和電子鼻感官風味的差異,為可可的開發利用提供理論依據。
1 材料與方法
1.1材料與試劑
海南可可鮮果由中國熱帶農業科學院香料飲料研究所提供。
無水甲醇、無水乙醇、正己烷、冰醋酸(均為分析純) 廣東省汕頭市西隴化工廠;Folin-酚試劑美國Sigma公司;沒食子酸(gallic acid,GA)、兒茶素(catechin,CE)、表兒茶素(epicatechin,EC)上海源葉生物科技有限公司。
1.2儀器與設備
DG-0.2真空凍干機 蘭州科近真空凍干技術有限公司;單爐咖啡烘焙機 德國Probat公司;全自動磨樣機(RS200混合型碾磨儀) 德國Retsch公司;AL104電子天平 美國Mettler Toledo公司;恒溫水浴搖床丹麥Foss公司;Z36HK型全能臺式高速冷凍離心機 德國Hermle公司;GM-0.33H真空抽濾器 天津市津騰實驗設備有限公司;水浴鍋 上海精宏實驗設備有限公司;KL-RO-20超純水機 中國沃特爾公司;SPECORD 250PLUS型紫外-可見分光光度儀 德國耶拿公司;1260型安捷倫高效液相色譜儀 美國安捷倫公司;色差儀 美國Xrite公司;電子鼻 法國Alpha MOS公司。
1.3方法
1.3.1可可豆前期處理
可可鮮果去殼后得到可可豆,一部分使用木箱進行自然發酵6 d[15],洗凈可可豆,進行晾曬干燥后于-20 ℃條件下冷藏,得到發酵豆(F);另一部分不進行發酵直接洗凈,晾曬干燥-20 ℃冷藏,得到未發酵豆(UF)。通過PROBAT咖啡烘焙機焙烤,以20~60 min、120~150 ℃為焙烤條件[11],不同焙烤溫度條件:分別設定為105、115、125、135、145 ℃的溫度焙烤30 min,表示為UF/F-105、UF/F-115、UF/F-125、UF/F-135、UF/F-145;不同焙烤時間條件:溫度設定為125 ℃分別焙烤20、25、30、35、40 min,分別表示為UF/F-20、UF/F-25、UF/F-30、UF/F-35、UF/F-40。焙烤豆和未焙烤豆去皮磨粉過60 目篩備用。
1.3.2多酚和總黃酮提取液的制備
稱取5.000 g不同處理的可可粉,加入100 mL 80%的甲醇溶液放于250 mL圓底燒瓶內,置于水浴搖床中35 ℃提取24 h,4 ℃、8 000 r/min低溫冷凍離心15 min,真空過濾,用80%的甲醇溶液定容250 mL溶液待測,待測液4 ℃條件下保存。
1.3.3提取物中多酚和總黃酮含量的測定
采用Folin-酚方法[16]測定不同提取液中多酚類物質的總含量。以沒食子酸為標準品,相同質量原料提取液的多酚含量表示為每10 g原料(以干質量計,下同)中含有的沒食子酸當量(mg GA/10 g);參考蜂膠中總黃酮含量的測定方法,以表兒茶素為標準品,相同質量原料的提取液的總黃酮含量表示為每10 g原料中含有的表兒茶素當量(mg EC/10 g)。
1.3.4可可豆提取物的高效液相色譜(high performance liquid chromatography,HPLC)分析
稱取一定量不同處理的可可粉用正己烷脫脂3 次(37 ℃,3×4 h)[17],脫脂可可粉低溫干燥后,用80%甲醇溶液35 ℃提取24 h,過濾配制成50 mL溶液[18]。色譜柱:Eclipse plus C18(4.6 mm×100 mm,3.5 ?m)。用100%甲醇溶液A和pH 2.5~3.0的乙酸溶液B做流動相。分析方法:0~10 min,40%A;10~20 min,60%A;20~30 min,80%A;30~40 min,90%A。檢測波長為280 nm,進樣體積10 ?L,流速0.5 mL/min。
1.3.5色度測定
按1.3.1節的方法準備樣品,稱取精細磨粉和過篩后的可可粉,測定其色度值。
1.3.6電子鼻測定感官風味
準確稱量1.3.1節制備的可可粉1.3 g放入進樣瓶,上機測定。分析條件:孵化溫度50 ℃,振蕩速率500 r/min,孵化時間120 s,以合成干燥空氣為載氣,流速為150 mL/min,注射體積1 500 ?L,注射針溫度60 ℃,注射速率1 000 ?L/s,獲取時間90 s,延滯時間300 s,每個樣品重復6 次。
1.4數據分析
數據通過SPSS 19和Origin 9.0軟件處理,不同樣品之間進行顯著性差異分析,以P<0.05為差異顯著,同一樣品平均數之間采用標準偏差檢驗,電子鼻結果使用主成分分析(principal component analysis,PCA)。
2 結果與分析
2.1發酵對可可豆多酚和總黃酮含量的影響
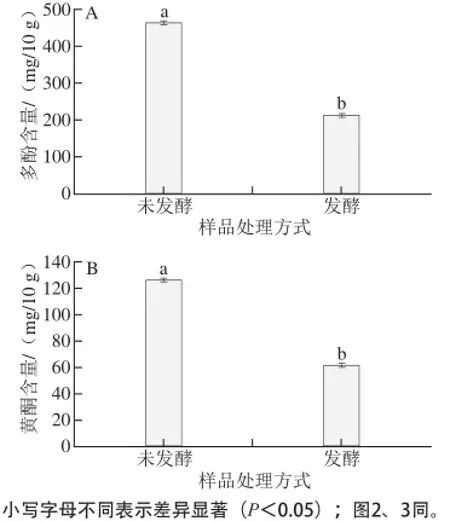
圖1 未焙烤可可豆多酚和總黃酮含量Fig.1 Total polyphenol and flavonoid contents in unroasted cocoa beans
由圖1A可知,未發酵和發酵可可豆在焙烤前多酚總含量分別為(464.03±23.20) mg/10 g和(211.86±16.05) mg/10 g,說明發酵使得多酚大量減少,發酵后多酚含量僅為未發酵的45.66%。可可豆的發酵溫度為50~60 ℃,此溫度范圍酶促褐變反應劇烈,酚類被氧化成醌類。本實驗未發酵可可豆多酚含量高于Gu Fenglin等[5]測定的海南發酵豆的301.01 mg/10 g,高于谷風林等[15]所測定的不同發酵方式可可豆的363.70~296.10 mg/10 g的范圍,同一個品種有較大差異的原因可能是年份、發酵方式和發酵程度的不同造成。由圖1B可知,未發酵和發酵豆在焙烤前總黃酮含量分別為(126.86±0.78)mg/10 g和(61.98±1.17) mg/10 g,說明發酵使得總黃酮大量減少,發酵可可豆僅為未發酵可可豆總黃酮含量的48.86%。未發酵可可豆總黃酮含量接近Gu Fenglin等[5]測定不同年份發酵海南可可豆的黃酮含量(35.03~126.21 mg/10 g)的最大值,發酵豆包含在此范圍內。發酵過程對單一的黃酮類物質的影響與對多酚的影響相同,黃酮類物質自身含有酚羥基和羰基在發酵過程中發生氧化、聚合,大量減少。
2.2焙烤對可可豆多酚含量的影響
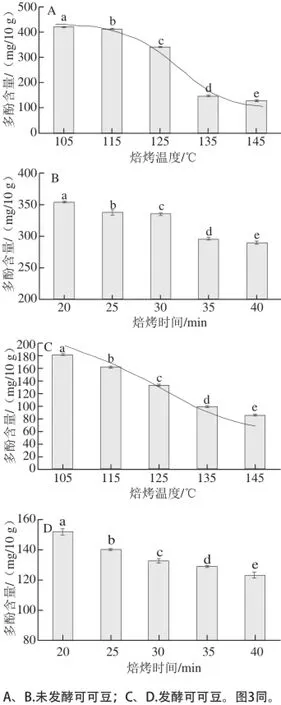
圖2 焙烤可可豆的多酚含量Fig.2 Total polyphenol contents in roasted cocoa beans
由圖2A可知,經不同焙烤溫度焙烤30 min,未發酵可可豆多酚總含量明顯減少,焙烤溫度升高,可可豆多酚含量呈一定的函數下降趨勢,以多酚含量為縱坐標,溫度為橫坐標,擬合的回歸曲線方程見表1,回歸方程顯著(P<0.05)。在115~135 ℃溫度區間內多酚含量變化最顯著,變化范圍為(412.09±8.22)~(146.73±7.65)mg/10 g。由圖2B可知,125 ℃條件下,經不同時間焙烤,未發酵可可豆在20~30 min含量變化差值為(18.10±0.58) mg/10 g,從整體變化趨勢分析發現焙烤時間對多酚含量的影響較小。
由圖2C可知,經焙烤30 min,不同焙烤溫度發酵可可豆多酚含量減少比圖2A中未發酵的可可豆多酚含量下降趨勢要平緩。在105~145 ℃范圍內呈現一定的線性關系,以溫度為橫坐標,多酚含量為縱坐標,擬合回歸曲線方程見表1,回歸方程顯著(P<0.05),沒有顯著變化的溫度區間,整個105~145 ℃溫度區間變化范圍為(182.53±0.47)~(86.25±0.80) mg/10 g。由圖2D可知,在125 ℃條件下,經20~30 min焙烤,發酵可可豆多酚含量的整體變化差值為(11.20±0.34) mg/10 g,變化量為溫度引起變化量的11.6%。
由于發酵可可豆在焙烤之前的發酵過程中損失了大量多酚,造成初始含量低于未發酵可可豆,僅為未發酵可可豆含量的45.66%,使得圖2C中多酚含量比圖2A中的下降趨勢要略平緩。焙烤溫度高于100 ℃使得酶類鈍化,主要以氨基化合物與羰基化合物之間縮合的美拉德反應為主,且溫度為影響反應的關鍵因素,隨溫度的升高,可可豆中酚類明顯減少。在20~40 min常用的焙烤時間內,時間因素對多酚含量的影響有限,引起的含量變化較小,故在測定3 種單體多酚含量變化時,未將時間作為單因素進行研究。
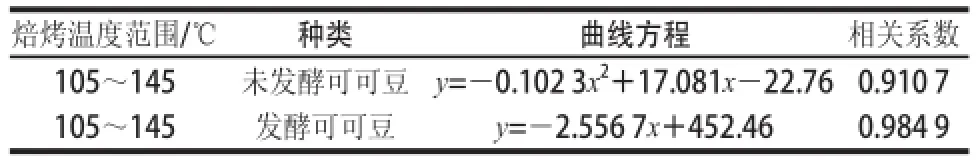
表1 不同溫度焙烤可可豆多酚含量變化方程、相關系數Table 1 Variation equations of total polyphenol contents with correlation coefficients and temperature ranges for roasted cocoa beans
2.3焙烤對總黃酮含量的影響

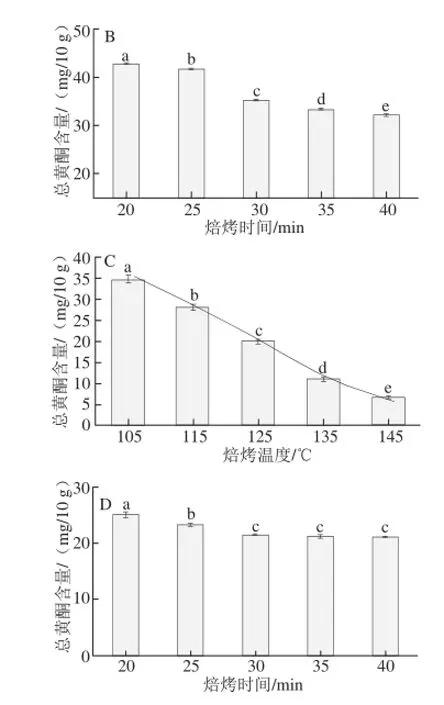
圖3 焙烤可可豆的總黃酮含量Fig.3 Total flavonoid contents of roasted cocoa beans
由圖3A可知,經不同溫度焙烤30 min,未發酵可可豆總黃酮含量在105~115 ℃基本上持平,僅相差2.42 mg/10 g,在115~135 ℃由(75.3±0.11) mg/10 g減少至(21.8±0.07)mg/10 g,變化顯著,占總干質量含量由(0.75±0.012)%降至(0.22±0.023)%,說明115~135 ℃是總黃酮在未發酵可可豆焙烤過程中含量變化的轉折點,整體變化趨勢呈一定的函數關系,以總黃酮含量為縱坐標,溫度為橫坐標,擬合回歸曲線方程見表2,回歸方程顯著(P<0.05)。由圖3B可知,未發酵可可豆在125 ℃條件下,經不同時間焙烤,25~30 min區間內總黃酮含量變化較明顯,變化差值也僅為6.33 mg/10 g,20~40 min內總黃酮含量變化范圍為(42.86±0.03)~(32.20±0.15) mg/10 g。
由圖3C可知,經不同溫度焙烤30 min,發酵可可豆總黃酮含量呈臺階式梯度下降,不同溫度區間內總黃酮含量變化較小,在105~145 ℃呈一定的線性關系,以總黃酮含量為縱坐標,溫度為橫坐標,擬合回歸曲線方程見表2,回歸方程顯著(P<0.05);135 ℃時總黃酮含量為(11.28±0.01) mg/10 g,為焙烤之前含量的18.20%,僅為可可豆總干質量的0.11%,說明發酵豆經較高溫度焙烤后進一步損失了80%的黃酮類物質。由圖3D可知,5 個時間點的總黃酮含量值基本上持平,變化范圍為(25.12±0.18)~(21.14±0.03) mg/10 g。
焙烤過程對總黃酮含量整體的影響趨勢為:不同焙烤溫度下,未發酵可可豆有一個顯著變化的溫度區間(115~135 ℃),發酵可可豆在整個實驗選定的溫度范圍內含量變化呈一定的線性關系,高于135 ℃焙烤,總黃酮含量減少至很低;經不同時間焙烤,未發酵可可豆總黃酮含量在20~30 min范圍內有較明顯變化,發酵可可總豆黃酮含量在整個設定的實驗時間范圍內含量變化不明顯。
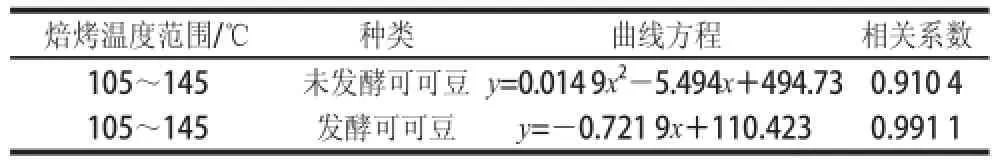
表2 不同溫度焙烤可可豆總黃酮含量變化方程、相關系數Table 2 Variation equations of total flavonoid contents withcorrelation coefficients and temperature ranges for roasted cocoa beans
2.4可可豆提取物的HPLC圖譜分析
為選擇一個使可可豆中3 種主要多酚(沒食子酸、兒茶素和表兒茶素)吸收都較強的合適吸收波長,以獲得較高的靈敏度,根據相關文獻選擇比較了280、320、510 nm波長處3 種標準品混合溶液的吸光度差異[19]。如圖4所示,結果表明3 種標準品混合溶液在280 nm波長處的吸光度遠比其他2 種波長強。故最終選擇檢測波長為280 nm。
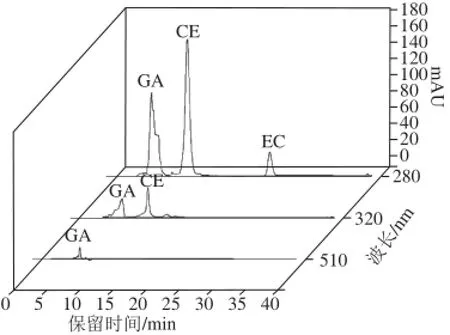
圖4 標準品在280、320、510 nm波長處的HPLC結果Fig.4 HPLC of three standard substances at 280, 320 and 510 nm
由2.1、2.2節可知發酵與否和焙烤溫度2 個因素對總酚含量影響較大,為觀察3 種多酚單體含量的變化趨勢,以未發酵豆、發酵豆和3 個溫度焙烤豆(105、
125、145 ℃條件下焙烤30 min)作為研究對象進行液相色譜分析,選擇沒食子酸、兒茶素和表兒茶素標準品配制成混標。由圖4可知,3 種標準品出峰順序為沒食子酸(GA)、兒茶素(CE)和表兒茶素(EC),與文獻中酚類物質標準品的出峰順序相一致[20]。由圖5可知,未發酵可可豆(UF)GA和EC峰面積明顯高于發酵可可豆(F),可能是造成2.1節中未發酵豆與發酵豆多酚、總黃酮含量差異的主要原因之一;CE峰處物質含量相差不大,對總黃酮含量變化貢獻較小。由圖6A可知,未發酵焙烤可可豆(UF)在105、125、145℃ 3 個焙烤溫度下,GA峰面積變化較為明顯,可能是影響2.2節中可可豆不同焙烤溫度下多酚含量變化的主要原因之一;CE和EC峰處物質含量變化不明顯,對總黃酮含量變化貢獻較小。圖6B中,GA、CE和EC峰面積變化趨勢和圖6A接近。
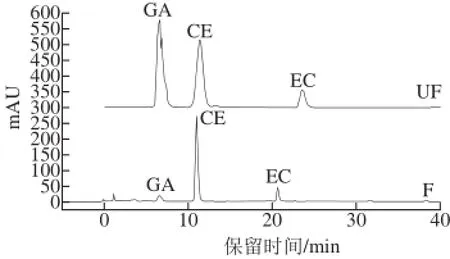
圖5 未焙烤可可豆的提取物在280 nm波長處的HPLC結果Fig.5 HPLC of unroasted cocoa bean extracts a t 280 nm

圖6 焙烤可可豆的提取物在280 nm波長處的HPLC結果Fig.6 HPLC of roasted cocoa bean extracts at 280 nm
從HPLC圖譜變化分析可知,發酵與否和焙烤溫度對3 種單體多酚的影響排序分別為:沒食子酸(明顯)>表兒茶素(較明顯)>兒茶素(不明顯)。
2.5可可豆色度的變化
L*值是色彩的明度值,表示色彩的明暗程度;a*值和b*值是色彩的色度值,a*值表示從紅(+a*)到綠(-a*)漸變、b*值表示從黃(+b*)到藍(-b*)漸變[21-22]。由表3可知,發酵與未發酵豆、不同溫度焙烤豆L*、a*、b*值之間均存在顯著性差異:未焙烤豆L*值大小為UF>F,說明未發酵豆湯色明度要好于發酵豆;不同溫度焙烤豆L*值大小分別為UF-105>UF-115>UF-125>UF-135>UF-145和F-105>F-115>F-125>F-135>F-145,即溫度越高,L*值越小,湯色明度越差。未焙烤豆的a*值大小為UF<F,說明發酵可可豆湯色相較未發酵可可豆的湯色更紅;焙烤可可豆中未發酵豆在125~135 ℃范圍內a*值較高,發酵豆在115~125 ℃范圍較高,說明此范圍是焙烤豆偏紅的區域。未發酵可可豆的b*值大于發酵豆,即未發酵可可豆湯色比發酵可可豆較黃;焙烤可可豆的b*值高于未焙烤可可豆,焙烤可可豆湯色比未焙烤可可豆較黃。由表3可知,不同焙烤時間可可豆的色度值差異不明顯。綜上所述,發酵與否、焙烤溫度對可可豆的色度值有明顯的影響,而焙烤時間對可可豆的色度值影響較小。由圖7可知,可可豆的色度值正態分布情況為,L*值集中在40.0~47.0之間,a*值集中在5.0~6.8之間,b*值集中在4.0~8.5之間,說明可可豆的色度值向一定的范圍趨近。
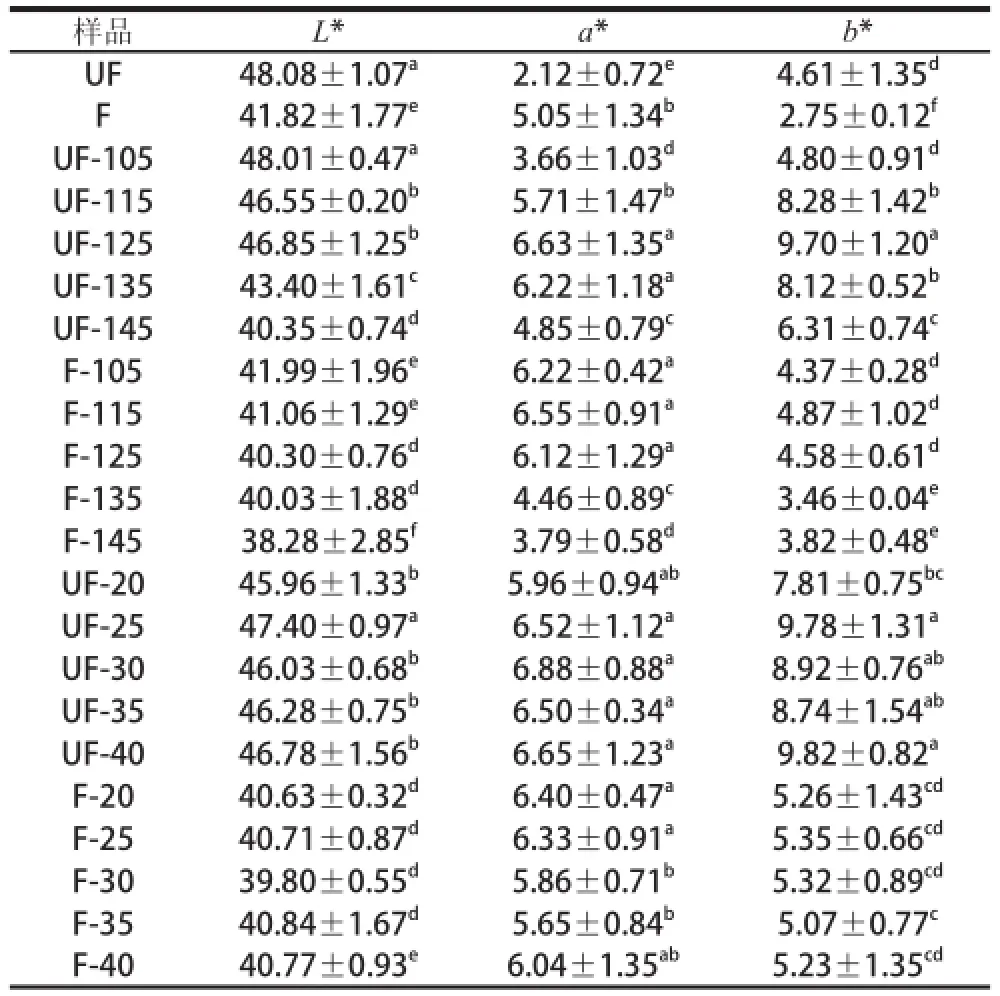
表3 可可豆色度值Table 3 Color parameters of cocoa beans
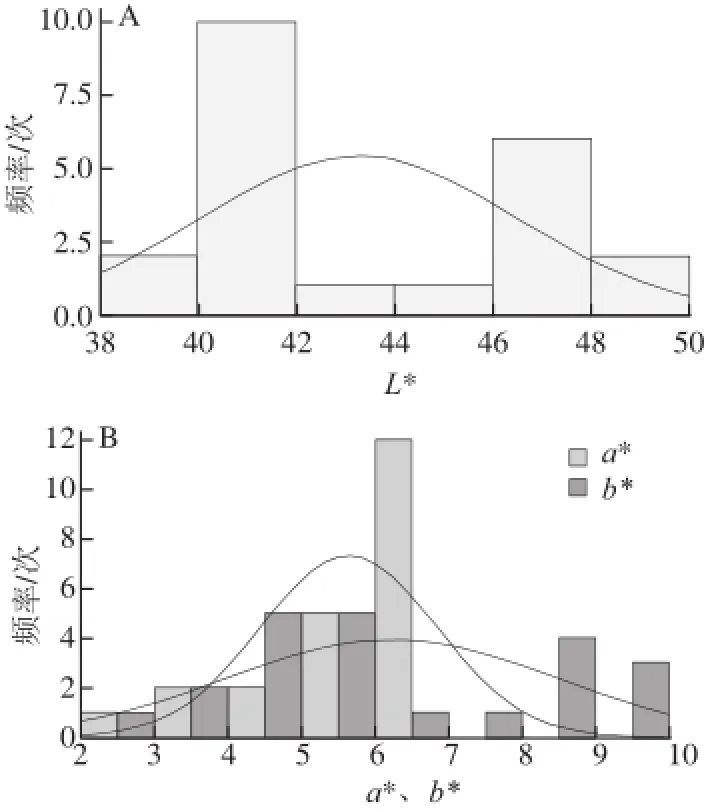
圖7 可可豆色度值的正態分布曲線Fig.7 Normal distribution curve of cocoa bean chroma
2.6未發酵、發酵和焙烤可可豆的風味比較
有文獻表明可可豆在發酵過程中形成了其特征香氣的前體物質[11]。由圖8可知,未發酵可可豆和發酵可可豆分別聚集在不同區域且無重疊部分,第一主成分(PC1)貢獻率為99.188%,說明了第一主成分包含大量信息,能反映被測樣品的整體信息,2 個樣品在橫坐標上的距離越大,表明它們的差異越大,未發酵與發酵可可豆能被電子鼻明顯區分開[23-24],說明發酵改變了可可豆的風味。
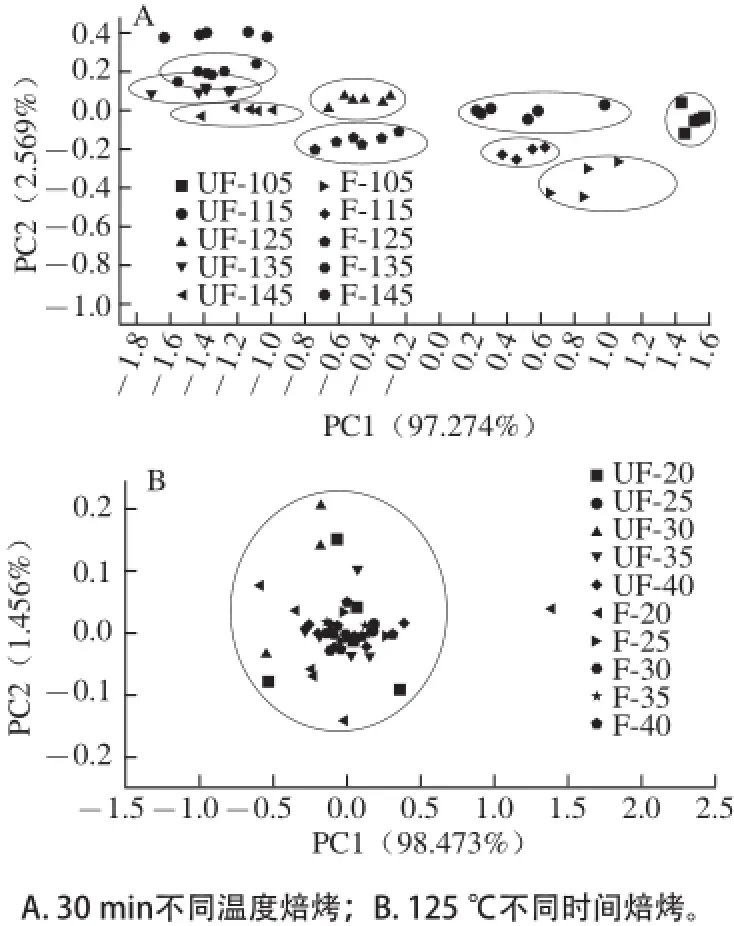
圖9 焙烤可可豆電子鼻主成分分析圖Fig.9 Principal component analysis of roasted cocoa beans
電子鼻對經30 min不同溫度焙烤下可可豆的PCA分析見圖9A。未發酵焙烤可可豆和發酵焙烤可可豆可以較好地用電子鼻系統進行區分,其第一主成分(PC1)貢獻率達到了97.274%。PC1和PC2的總貢獻率為99.843%,所以2 個主成分能較好地反映原始高維矩陣數據的信息。另外,未發酵焙烤可可豆和發酵焙烤可可豆在不同的焙烤溫度下,風味有較明顯的改變,從整體區域聚集情況看,135、145 ℃高溫焙烤區域數據較為集中,其區分效果沒有低溫區域好,UF-125和F-125接近,UF-135和F-135有重疊區域,這說明未發酵可可豆和發酵可可豆在125~135 ℃的焙烤條件下風味差異小于其他區域,區分結果差。
電子鼻對經125 ℃不同時間焙烤下可可豆的PCA分析見圖9B。經不同時間焙烤后未發酵豆和發酵豆,基本上集中在一個區域內,風味差別小,無明顯改變,區分結果差。
為更好地觀察125、135 ℃溫度焙烤下差異較小的4 種焙烤可可豆(UF-125、F-125、UF-135、F-135)的區別,對樣品電子鼻的6 個傳感器信號最大響應值數據進行分析,并形成直觀的雷達圖[25],如圖10所示。T30/1、T70/2和LY2/AA傳感器的響應值集中差異較小,P30/2、PA/2和LY2/gCT相差較大,從整個響應值的集中趨勢分析125~135 ℃的焙烤溫度范圍內,未發酵和發酵可可豆相似部分在T30/1、T70/2和LY2/AA型傳感器上,差異主要在于P30/2、LY2/gCT和PA/2型傳感器上。
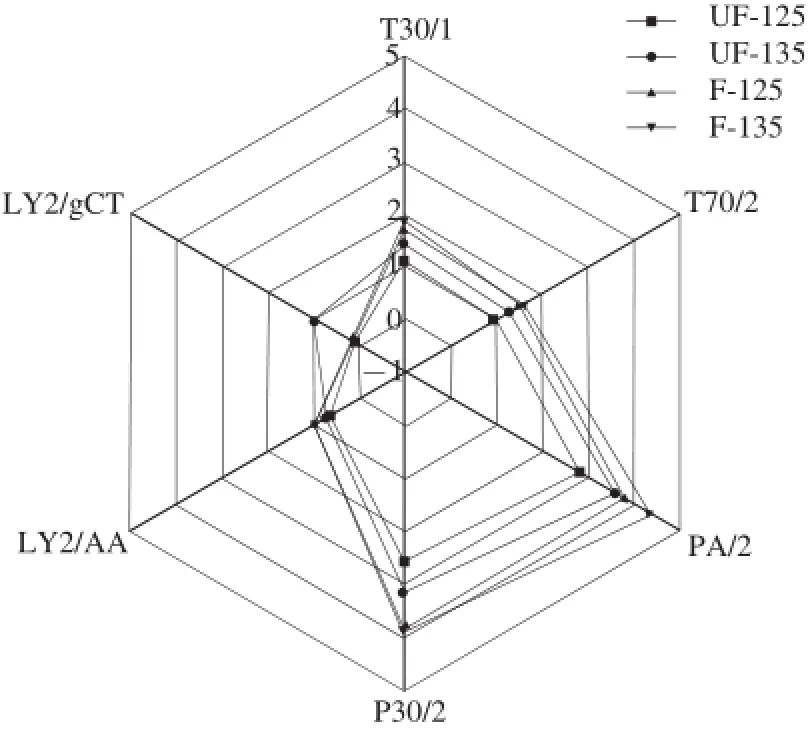
圖10 4 種焙烤可可豆的雷達圖Fig.10 Radar chart of four samples of roasted cocoa beans
3 結 論
發酵后可可豆中多酚和總黃酮含量大量減少,均減少至未發酵前的50%以下,3 種單體多酚中沒食子酸和表兒茶素含量顯著減少,兒茶素含量變化不明顯;發酵后可可豆色度發生明顯變化,未發酵豆比發酵豆湯色好,發酵豆比未發酵豆更紅,未發酵豆比發酵豆更黃;未發酵豆和發酵豆之間電子感官風味主成分分析聚集區域差別大,風味差異明顯。
可可豆經不同溫度焙烤后多酚和總黃酮含量呈一定的線性變化規律,在105~145 ℃溫度范圍內未發酵豆多酚和總黃酮含量表現為二次方程函數變化規律,其中未發酵豆在115~135 ℃溫度區間變化顯著,發酵豆表現為一次方程函數變化趨勢;經不同溫度焙烤后的未發酵豆和發酵豆所含3 種多酚單體中沒食子酸含量隨溫度的升高而減少,兒茶素和表兒茶素含量隨溫度的升高變化較小;經105~145 ℃焙烤后未發酵豆和發酵豆色度值存在一定差異,并出現L*、a*和b*值分別向40.0~47.0、5.0~6.8和4.0~8.5集中的趨勢;經不同溫度焙烤后的未發酵豆和發酵豆之間電子感官風味差異有一定的變化規律,105~115 ℃低溫焙烤區域比較分散差異大,125 ℃中溫焙烤區域差異較大,135~145 ℃高溫焙烤比較集中差異較小,由低溫至高溫焙烤未發酵豆和發酵豆之間風味差異有減小的趨勢。
經20~40 min焙烤后,未發酵豆多酚和總黃酮含量在25~35 min之間變化較大,發酵豆在20~30 min之間變化較大,二者都呈減少趨勢;未發酵豆的L*、a*和b*值分別接近于46.00、6.50和9.00,發酵豆的L*、a*和b*值分別接近于40.20、6.00和5.15;125 ℃焙烤20~40 min后,未發酵豆和發酵豆的電子感官風味差異小,區分結果較差。
[1] 黃希韻, 魏麗珍, 吳微, 等. 速溶奶茶的研究進展及前景[J]. 飲料工業, 2009, 12(11): 1-4.
[2] BRICKMAN A M, KHAN U A, PROVENZANO F A, et al. Enhancing dentate gyrus function with dietary flavanols improves cognition in older adults[J]. Nature Neuroscience, 2014, 17(2):1798-1803.
[3] LANGER S, MARSHALL L J, DAY A J, et al. Flavanols and methylxanthines in commercially available dark chocolate: a study of the correlation with nonfat cocoa solids[J]. Journal of Agricultural and Food Chemistry, 2011, 59(15): 8435-8441 .
[4] de REZENDEA A A A, ULRICH G, DA ROSA GUTERRESA Z,et al. Protective effects of proanthocyanidins of grape(Vitis vinifera L.) seeds on DNA damage induced by doxorubicin in somatic cells of Drosophila melanogaster[J]. Food and Chemical Toxicology, 2009, 47(7): 1466-1472.
[5] GU Fenglin, TAN Lehe, WU Huasong, et al. Comparison of cocoa beans from china, indonesia and papua new guinea[J]. Foods, 2013,2(2): 183-197.
[6] KIM H, KEENEY P G. (-)-Epicatechin content in fermented and unfermented cocoa beans[J]. Journal of Food Science, 1984, 49(4):1090-1092.
[7] ABBE MALEYKI M J, AMIN I. Polyphenols in cocoa and cocoa products: is there a link between antioxidant properties and health?[J]. Molecules, 2008, 13(9): 2190-2219.
[8] OTHMAN A, ISMAIL A, GHANI N A, et al. Antioxidant capacity and phenolic content of cocoa beans[J]. Food Chemistry, 2007, 100(4):1523-1530.
[9] RIMBACH G, MELCHIN M, MOEHRING J, et al. Polyphenols from cocoa and vascular health: a critical review[J]. International Journal of Molecular Sciences, 2009, 10(10): 4290-4309.
[10] NICHOLAS C, TOM D W, SOLOMON K A, et al. Fermentation of cocoa beans: influence of microbial activities and flavone concentrations on the flavour of chocolate[J]. Journal of the Science of Food amd Agriculture, 2008, 88(13): 2288-2297.
[11] BIEHL B, ZIEGLEDER G. Encyclopedia of food sciences and nutrition[M]. 2nd ed. Pittsburgh: Academic Press, 2003: 1441-1458.
[12] MISNAWI, JINAP S, JAMILAH B, et al. Effects of incubation and polyphenol oxidase enrichment on colour, fermentation index,procyanidins and astringency of unfermented and partly fermented cocoa beans[J]. International Journal of Food Science and Technology,2003, 38(3): 285-295.
[13] NOOR-SOFFALINA S S, JINAP S, NAZAMID S, et al. Effect of polyphenol and pH on cocoa Maillard-related flavour precursors in a lipidic model system[J]. International Journal of Food Science and Technology, 2009, 44(1): 168-180.
[14] CHARLTON A J, BAXTER N J, KHAN M L, et al. Polyphenol/ peptide binding and precipitation[J]. Journal of Agricultural and Food Chemistry, 2002, 50(6): 1593-1601.
[15] 谷風林, 房一明, 徐飛, 等. 發酵方式與萃取條件對海南可可豆多酚含量的影響[J]. 中國食品學報, 2013, 13(8): 269-271.
[16] 張國友, 唐玲, 陳瑋, 等. 分光光度法測定蒙古櫟葉中多酚的含量[J].中國科學院研究生院學報, 2009, 3(5): 319-322.
[17] REDOVNIKOVIC I R, DELONGA K, MAZOR S. Polyphenolic content and composition and antioxidative activity of different cocoa liquors[J]. Czech Journal of Food Sciences, 2009, 27(5): 330-337.
[18] CAI Yizhong, LUO Qiong, SUN Mei, et al. Antioxidant activity and phenolic compounds of 112 traditional Chinese medicinal plants associated with anticancer[J]. Life Sciences, 2004, 74(17): 2157-2184.
[19] 張水平, 谷風林, 吳桂蘋, 等. 胡椒果與胡椒葉抗氧化能力的比較[J].食品工業科技, 2013, 34(20): 132-133.
[20] 陳智毅, 徐玉娟, 尹艷, 等. 甜玉米多酚類成分的測定[J]. 食品科學,2010, 31(10): 236-237.
[21] 吳瑞梅, 趙杰文, 陳全勝, 等. 綠茶湯色品質感官評價的色差儀表征方法研究[J]. 河南農業科學, 2014, 43(1): 149-153.
[22] 賴凌凌, 郭雅玲. L*、a*、b*表色系統與綠茶湯色的相關性分析[J].熱帶作物學報, 2011, 32(6): 1172-1175.
[23] 趙穎, 王飛生, 許燦, 等. 不同處理工藝板栗酥餅風味成分的電子鼻檢測[J]. 食品工業科技, 2014, 35(3): 285-286.
[24] 陳曉明, 馬明輝, 李景明, 等. 電子鼻在天然蘋果香精檢測中的應用[J].食品科學, 2007, 28(3): 261-265.
[25] 胡明明, 張國文, 何力. 響應面法優化超聲波提取花生殼多酚[J]. 南昌大學學報: 理科版, 2011, 35(3): 241-245.
Effect of Fermentation and Roast on Polyphenols, Flavonoids and Flavors in Cocoa Beans
YI Qiaobin1,2, GU Fenglin2,3,*, NA Zhiguo1, FANG Yiming2,3, XU Fei2,3
(1. Department of Food and Environmental Engineering, East University of Heilongjiang, Harbin 150086, China;2. Spice and Beverage Research Institute, Chinese Academy of Tropical Agricultural Sciences, Wanning 571533, China;3. Key Laboratory of Genetic Resources Utilization of Spice and Beverage Crops, Ministry of Agriculture,National Center of Important Tropical Crops Engineering and Technology Research, Wanning 571533, China)
The differently processed cocoa beans such as unfermented, fermented and roasted cocoa beans were anzlyzed for total polyphenol contents, total flavonoid contents, chroma, and flavors by HPLC, color difference meter and electronic nose. The results showed that total polyphenol and flavonoid contents in unroasted unfermented cocoa beans were significantly higher than those of the unroasted fermented ones. By roasting at 105-145 ℃ for 30 min, total polyphenol content ranged from 419.5 to 129.8 mg/10 g in unfermented cocoa beans and ranged from 182.53 to 86.25 mg/10 g in fermented cocoa beans. Total flavonoid content was in the range of 77.8-16.8 mg/10 g for unfermented cocoa beans, and 34.7-7.0 mg/10 g for fermented cocoa beans. By roasting at 125 ℃ for 20-40 min, total polyphenol content ranged 353.74-289.45 mg/10 g in unfermented cocoa beans and ranged from 152.08 to 123.55 mg/10 g in fermented cocoa beans. Total flavonoids were found to be between 42.86 mg/10 g and 32.20 mg/10 g for unfermented cocoa beans, and 25.12-21.14 mg/10 g for fermented cocoa beans. The content of gallic acid was significant changed by roasting temperature in the range of 105-145 ℃ for 30 min. The range of chromaticity values in cocoa beans were in the range of 40.0-47.0 for L*, and 5.0-6.8 for a*, and 4.0-8.5 for b*. Unfermented cocoa beans were different from fermented cocoa beans by sensory quality and flavor. By roasting at 105-145 ℃ for 30 min, cocoa beans presented a large difference in electronic sensory evaluation.
cocoa beans from Hainan; roast; polyphenols; flavonoids; flavor
TS201.1
A
1002-6630(2015)15-0062-08
10.7506/spkx1002-6630-201515013
2014-11-13
中央級公益性科研院所基本科研業務費專項(1630052012017)
易橋賓(1990—),男,碩士研究生,研究方向為熱帶作物產品加工。E-mail:yiqiaobin@yeah.net
谷風林(1976—),男,副研究員,博士,研究方向為食品化學。E-mail:xiaogu4117@163.com

