短C肽門冬胰島素制備工藝的研究
付志成,馬妍,張增濤,劉日勇,何勇,范開
(1.重慶理工大學,重慶400054;2.富進生物醫藥有限公司,重慶400041)
短C肽門冬胰島素制備工藝的研究
付志成1,馬妍1,張增濤2,劉日勇2,何勇2,范開1
(1.重慶理工大學,重慶400054;2.富進生物醫藥有限公司,重慶400041)
為研究門冬胰島素制備工藝,參照畢赤酵母偏好密碼子,設計合成N-端連接引導肽EEAEAEAEPK,以KEWK作為短C肽,A、B鏈結構完整的門冬胰島素cDNA序列。利用Xho I-Not I酶切位點將其插入表達質粒pPICZαA,采用電轉移方法將重組質粒轉入畢赤酵母x-33,篩選高拷貝重組子作為工程菌株進行高密度發酵,表達量可達到0.57 g/L。發酵液經金屬螯合層析和SP陽離子層析純化后鑒定正確。建立CPB/Trypsin雙酶切工藝,對不同溫度及pH條件下產生的酶切產物進行分析,初步建立了酶切最佳pH值和溫度條件。酶切產物經純化后制得純度為91.7%的門冬胰島素,副產物為B鏈30位缺失的門冬胰島素。該設計方法為含短C肽EWK門冬胰島素制備中選用Lys-c酶切成本過高的問題提供了備選解決方案。
門冬胰島素;畢赤酵母;短C肽;純化
門冬胰島素(Insulin Aspart,商品名Novo Rapid)由丹麥諾和諾德(Novo Nordisk)公司開發,是一種速效胰島素類似物,于2000年在美國上市[1]。其設計原理為通過基因重組將胰島素B鏈第28位脯氨酸(Pro)置換為天冬氨酸(Asp)。該陰離子的引入未改變其受體親和力、分離的速度及體內的藥物效能,而是通過增大胰島素分子間的相互排斥阻止二聚體的形成,使其吸收速度為人胰島素的2倍[2]。Thim等[3]比較含不同長度C肽與去除C肽胰島素原在畢赤酵母中的表達情況,發現C肽長度由4個氨基酸殘基縮短至2 h,胰島素原的表達量上升。自此,C肽的設計成為胰島素重組表達中受到關注的問題,以期達到更高的表達量,降低胰島素的制備成本。Kjeldsen等[4]將去除B30蘇氨酸(Thr)后用小C肽代替人胰島素C肽或B29賴氨酸(Lys)與A1甘氨酸(Gly)直接連接的A、B鏈結構連于前導肽α因子,提高了其在釀酒酵母中的分泌表達水平;而后發現在短C肽中引入一個芳香族氨基酸以及在分子疏水核心加入酚結合位點能夠使門冬胰島素在釀酒酵母中的表達量提高5倍[5]。Annibali[6]設計以賴氨酸(Lys)或精氨酸(Arg)構成的2個氨基酸短肽的人胰島素原在畢赤酵母中得以表達。
國內對于門冬胰島素的研究主要集中在以其為組成成分的預混胰島素類似物的藥理學特點[7]、在I型及II型糖尿病臨床應用的研究[8]、在妊娠期糖尿病中應用的安全性和有效性[9-10],以及與二甲雙胍、阿卡波糖等降血糖藥物聯合用藥臨床效果[11]等方面,而對于門冬胰島素的重組表達和制備工藝所進行的研究鮮有報道。筆者所在實驗室曾設計構建在α-MF信號肽序列后插入氨基酸序列EEAEAEAEPK作為引導肽,以EWK作為短C肽,B30Thr缺失的胰島素原,用pPICZαA為載體質粒,畢赤酵母x-33作為表達菌株,構建的表達Insulin Aspart的重組菌株發酵誘導64 hr表達量達到2.55 g/L。但在酶切處理過程中,常用的能切開賴氨酸(Lys,K)或精氨酸(Arg,R)的胰蛋白酶不能切除C肽,因此選用賴氨酸內肽酶(Lys-c)進行酶切去除引導肽和C肽。但有關該酶的文獻報道較少,制備需培養天然篩選菌株,產量較低,使用需向日本Wako公司購買,成本較高。因此,設計N-端連接引導肽EEAEAEAEPK,以KEWK作為短C肽的A、B鏈結構完整的門冬胰島素序列,IAsp:EEAEAEAEPK-B1-B28Asp-B29Lys-B30-K-E-W-K-A1-A21。以pPICZαA為載體質粒,畢赤酵母x-33作為表達菌株,構建篩選高表達菌株,建立成本較低的酶切工藝。
1 材料與方法
1.1材料
E.coli/Top10F',P.Pastoris/x-33,表達質粒pPICZαA均由重慶富進生物醫藥有限公司保存;限制性內切酶Xho I,NotⅠ,T-4 DNA連接酶購自TAKARA公司;羧肽酶B(CPB),胰蛋白酶(Trypsin)由富進生物醫藥有限公司制備;中分子蛋白標準購自TIANGEN公司;Zeocin購自邁晨科技(北京)有限公司;金屬螯合層析柱和離子交換層析柱填料均購自GE公司。
LB培養基,MD、MY、YPG固體培養,BMMY、BMGY液體培養基等均參照Invitrogen公司畢赤酵母操作手冊進行配制。
1.2方法
1.2.1重組質粒pPICZαA-IAsp的構建
根據設計門冬胰島素原的氨基酸序列組成,選擇酵母偏愛密碼子設計cDNA序列,其中TGA和TAA為兩個終止密碼子序列,并在序列5'端和3'端分別設計Xho I(CTCGAG)和Not I(GCGGCCGC)限制性酶切位點。設計的cDNA委托寶生物工程(大連)有限公司全基因合成,連于pMD19-T質粒。門冬胰島素基因序列如圖1所示。

圖1 門冬胰島素基因序列
將攜帶目的基因的甘油菌保接種于8 mL LB培養基中,于37℃、180 r/min搖床培養過夜后,取適量菌液,按Omega公司質粒小提試劑盒操作,抽提重組質粒pMD19-T-IAsp。利用Xho I-Not I分別雙酶切pMD19-T-IAsp質粒和pPICZαA,經瓊脂糖凝膠電泳后分別回收大小約200 bp和3300 bp片段并鏈接兩片段,構建質粒pPICZαAIAsp。重組質粒pPICZαA-IAsp,用CaCl2法轉入E.coli Top10F',涂布LB-Zeocin平板篩選重組子。挑取平板上菌落,搖瓶培養后抽提質粒,經Xho I-Not I雙酶切后,送大連寶生物公司測序。
1.2.2重組質粒轉化畢赤酵母x-33
Sac I單酶切重組質粒pPICZαA-IAsp,線性化質粒電擊法轉入畢赤酵母x-33感受態細胞。轉化液涂布在含有0.5,1,1.5,2 mg/mL Zeocin的YPD平板上,30℃培養4 d,每24 h觀察平板上菌落的生長情況。
1.2.3重組子搖瓶誘導表達
根據重組拷貝數與Zoecin濃度計量依賴關系,于YPD-Zeocin平板(1.5 mg/mL)挑取pPICZαA -IAsp/x-33菌落,接種于50 mL BMGY培養基;在30℃、220 r/min搖床培養約16 h至OD600值約為10,換用BMMY培養液50 mL,30℃繼續培養96 h,按終濃度0.5%每隔24 h補加無水甲醇,將誘導96 h后的各單菌落搖瓶培養液離心收集上清,通過SDS-PAGE鑒定其表達產物。
1.2.4重組酵母的高密度發酵
將鑒定正確的高表達的菌株所保菌種接種于1L YPD培養基中,搖瓶培養約24 h。配制BSM培養基9 L,于瑞士比歐生物工程公司30 L發酵罐中滅菌降溫至28℃后,氨水自控pH值到4.8,補加PTM1,用種子液接種進行發酵。培養約24 h后培養基內甘油耗盡,補加50%甘油補料,至菌體濕重約200 g/L,停止流加甘油并饑餓約1 h,開始流加含甲醇的甘油補料進行誘導。誘導起始甲醇終濃度為0.2%,隨發酵過程逐漸提高甲醇誘導濃度至0.6%,過程中取樣HPLC檢測分泌表達產物含量。發酵進行至64 h后下罐收集離心上清。
HPLC檢測選用Welch UltimateR XB-C18(5μm 4.6×100 mm);A液:DDW+0.1%三氟乙酸;B液:100%乙腈+0.1%三氟乙酸,為流動相;流速為1 mL/min,0%~95%B;檢測波長為214 nm,上樣20 μL。目的蛋白保留時間為12.5 min,18 000 000 mAU峰面積為1 mg/L。
1.2.5表達產物的純化
金屬螯合柱純化:1 mol/L NaCl沖洗柱填料2個柱體積后,以20 mmol/L Na2HPO4,0.3 mol/L NaCl,pH值為6.5~7.0的緩沖液洗柱,直至穿出液pH值約為7.0;用0.1 mol/L CuSO4和0.3 mol/L NaCl混合液進行再生,DDW沖洗未結合Cu2+;柱層析平衡液平衡(20 mmol/L Na2HPO4、0.3 mol/L NaCl、pH值為6.5~7.0)后上樣(發酵液離心取上清,將pH值調到7.0);平衡液(20 mmol/L Na2HPO4、0.3mol/L NaCl、pH值7.0)復平衡至吸收基線,開始用洗脫液(20 mM Na2HPO4、50 mM咪唑、pH值6.5~7.0)洗脫,收集目的蛋白峰。
SP柱純化:平衡液(20 mmol/L CH3COONa、pH值為3.0~3.5)平衡柱填料,直至穿出液pH值約為3.5;上述洗脫液用去離子水稀釋至電導小于10 Ms/cm2,調pH值為3.0~3.5后上樣;平衡液復平衡至基線,洗脫液洗脫(20 mmol/L CH3COONa、1 mol/L NaCl、pH值為3.0~3.5),收集目的蛋白。與層析柱填料結合的色素可用1 mol/L NaOH除去。
1.2.6酶切體系建立
根據蛋白序列,需切除引導肽-EEAEAEAEPK-及C肽-KEWK-,形成正確的B1-B28Asp -B29-B30-A1-A21門冬胰島素序列。將SP陽離子柱層析收集樣品,采用HPLC法標定濃度后,稀釋至濃度1 mg/mL,分裝后分別調節pH值至7.5和8.5,按以下比例設置實驗組。表1中比例均為酶與底物質量比,酶切過夜。HPLC檢測酶切結果,并通過質譜比照判斷各個酶切條件的酶切效果。
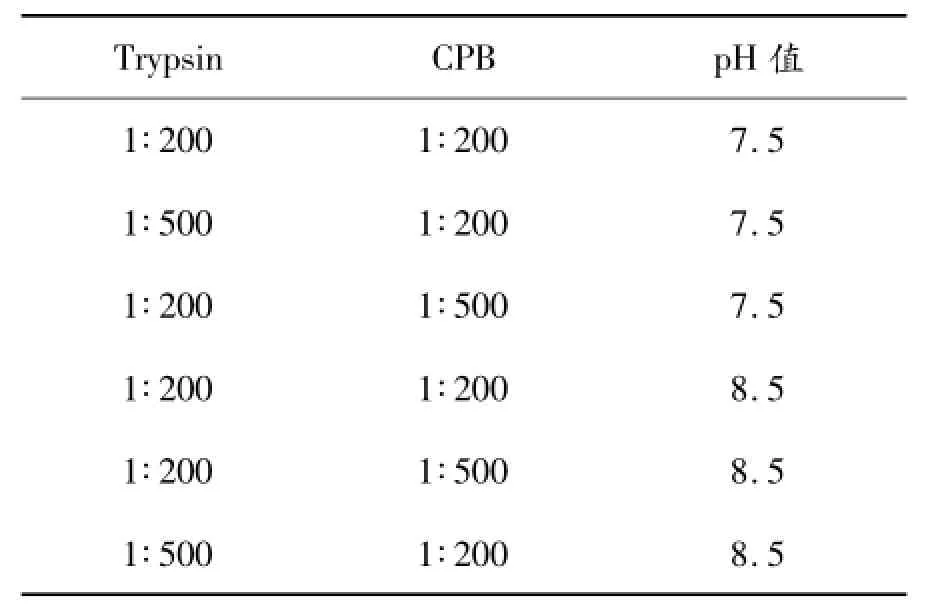
表1Trypsin/CPB雙酶切比例
1.2.7酶切產物回收與分析
將樣品pH值調低到3.0,通過反相Source 15RPC純化回收目的蛋白。以Source 15RPC(75 mL)為制備柱。A液:0.1 M(NH4)2SO4,10%乙腈,0.1%H2SO4;B液:70%乙腈,10%甲醇為流動相。洗脫梯度:5%B至25%B 5 min;25%B至40%B 30 min,收集各洗脫峰。
利用RP-HPLC對收集到的各個洗脫峰進行鑒定,因C18普通反相不能有效分離Insulin Aspart與IAsp-DesB30組分,因而選用Kromasil 100 -10-C8分析柱。A液:90%緩沖,10%乙腈;B液:40%緩沖,60%乙腈作為流動相。30%B至80%B 50 min,檢測波長214 nm。
2 結果與分析
2.1重組質粒的酶切鑒定
構建重組質粒pPICZαA-IAsp后,經Xho INot I雙酶切,結果如圖2所示,可見在3 300 bp和200 bp左右有明亮條帶,與理論值相符,證明重組質粒含有設計的基因序列。測序結果與設計序列一致,說明編碼含短C肽門冬胰島素序列已連接入pPICZαA質粒。

圖2 重組質粒酶切鑒定
2.2重組菌株的篩選與搖瓶誘導表達
重組畢赤酵母表達外源蛋白的表達量一定程度上受到基因組內所整合編碼外源蛋白的基因拷貝數影響。由于選用的質粒pPICZαA帶有Zeocin抗性基因,且重組子對Zeocin的抗性與外源基因的拷貝數在一定范圍內成正比關系,故挑取1.5 mg/mL Zeocin濃度YPD平板上菌落作為工程菌株,搖瓶誘導表達并進行高密度發酵,考察表達量。
目的蛋白理論相對分子質量為7 853.86,利用中分子蛋白Marker作為對照,能夠看到在低于14.4 kDa處有明顯條帶,初步判斷目的蛋白在重組菌株中能夠得以分泌表達。

圖3 重組子誘導表達SDS-PAGE
2.3工程菌發酵表達量
對所篩菌株進行小規模高密度發酵,不僅能夠對構建的工程菌株發酵條件進行初步摸索,還能為后續純化及酶切提供足夠的樣品。依據筆者所在實驗室對以EWK作為短C肽pPICZαAIAsp(EWK)/x-33發酵工藝為參照,對本菌株進行高密度發酵培養,誘導64 h對目標蛋白表達量進行檢測,表達量約為0.57 mg/L,見圖4。

圖4 發酵誘導表達64 h上清RP-HPLC檢測
2.4目的蛋白純化
發酵上清經金屬螯合層析,SP柱純化后,以除去絕大部分雜蛋白和可能干擾酶切的色素,純化結果如圖5所示。雖經Zn2+沉淀復溶后,能夠更加徹底地清除溶液中的色素,但Zn2+沉淀引入Zn2+可能干擾蛋白酶的酶切效率,而復溶需加入EDTA螯合Zn2+,EDTA為蛋白酶活性抑制劑。因此,經兩步純化的樣品,多數色素被除去。純化終樣品RP-HPLC檢測如圖5,目的峰為單一峰,保留時間為12.5 min左右。
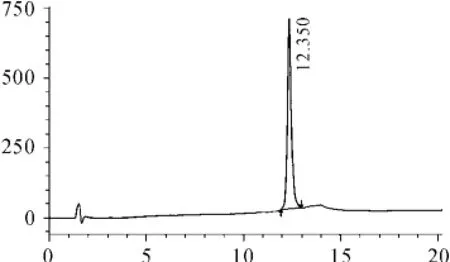
圖5 純化產物RP-HPLC檢測
2.5酶切處理結果
經酶切處理樣品,利用C-18 RP-HPLC檢測,除可見引導肽C肽外,有3種主要酶切產物,結合質譜結果分析,分別為錯切B22Arg剩余多肽和帶有C肽未能切除的門冬胰島素原形式。在正確酶切產物峰中,混合了切除TKEWK的結構,即B30Thr缺失的IAsp-DesB30。各個組分在不同酶切條件下所占比例如表2、3所示。
表2、3中:組分I為未被酶切門冬胰島素原;組分II為在B22Arg位點錯誤切開的肽段;組分III為酶切正確的門冬胰島素蛋白;組分IV為帶有C肽KEW(K)而被切去引導肽的多肽鏈。由表2、3可知,pH值對酶切效率有一定的影響,高pH值可能造成錯切率升高,低pH值則會造成未被酶切的門冬胰島素原過多。Trypsin1∶500,CPB1∶200,pH值8.5實驗組雖然錯切B22Arg的產物最多,但是其產物中酶切正確的Insulin Aspart所占比例也最高。由此,參照該實驗方案,將制備樣品稀釋至4 mg/mL,Typsin與目的蛋白質量比為1∶800,CPB與目的蛋白比為1∶200,pH值為8.5,20℃酶切5 h后,RP-HPLC檢測結果如圖6所示。13.191 min保留峰經高分辨質譜測定分子量為5 826 Da,與理論分子量一致。

表2 酶切產物組分表(pH值為7.5)

表3 酶切產物組分表(pH值為8.5)

圖6 酶切產物RP-HPLC檢測
2.6酶切產物的回收與分析結果
利用15RPC對酶切產物進行純化,洗脫時分別收集4個洗脫峰,見圖7。對4個洗脫峰RP-HPLC進行分析,并與標準品比照,可知峰3收集即為Insulin Aspart,見圖8。

圖7 酶切產物15RPC純化

圖8 15RPC收集峰RP-HPLC檢測
因副產物IAsp-DesB30與目的蛋白Insulin Aspart結構類似,只有B30Thr缺失,C18-HPLC難以分離,因此選用Kromasil 100-10-C8柱對純化后酶切產物進行分析,結果見圖9。純化后的酶切產物已為純度較高的Insulin Aspart,其純度達到91.71%。

圖9 酶切回收峰3 Kromasil 100-10-C8檢測
3 結論
胰島素及胰島素類似物在畢赤酵母中的表達量不僅受到編碼外源蛋白基因特性的影響,蛋白本身結構也是決定性因素之一。對于在畢赤酵母中表達胰島素及其前體,在質粒信號肽α-MF序列和胰島素基因之間加入EEAEAEAEPK信號肽序列能有效地提高表達量。國內多選擇以AAK作為短C肽提高胰島素或胰島素類似物Detmir前體(B30Thr缺失的人胰島素)[11],而對門冬胰島素的報道并不多見。設計短C肽KEWK,在C肽中引入芳香族類氨基酸,以期能夠提高表達量。在工程菌株高密度表達的發酵過程中,外源蛋白表達量決定于菌種本身和外源蛋白的性質,同時也受到的發酵環境的影響。參照畢赤酵母表達人胰島素前體發酵條件[11],對構建工程菌進行高密度培養,誘導表達門冬胰島素前體,64 h表達量為0.57 g/L。就本實驗結果而言,為了酶切而在EWK序列前引入的氨基酸增加了C肽的長度,很有可能是限制表達量的因素之一。發酵的表達量通過改變補料流加的時機和誘導模式,有進一步提升的潛力。
發酵上清液中所含無機鹽、色素及背景蛋白均會對門冬胰島素制備中的酶切造成干擾。畢赤酵母分泌表達胰島素原早期運用硫酸銨沉淀后陰離子柱層析分離[12],之后多用超濾或大孔樹脂吸附層析后經SP離子交換層析,再經Zn2+沉淀制得[11,13]。本文發現在目的蛋白不帶有組氨酸標簽的情況下,胰島素前體能與銅金屬螯合層析柱填料結合,有效除去發酵液中背景蛋白,但對色素清除能力不強,故仍需使用SP離子交換層析去除部分色素。因酶切工藝易受到Zn2+和EDTA的干擾,故未進行Zn2+沉淀與復溶的步驟,所得樣品經HPLC檢測為單一峰,殘留少許色素,能夠滿足酶切需要,色素可在酶切后純化中被除去。
因含C肽的胰島素原不具有生物學活性,需切除短C肽的胰島素原[14]。故設計短C肽時,不僅需要考慮C肽對表達量的影響,還要考慮其在后續處理中純化酶切。羧肽酶B和胰蛋白酶常在重組蛋白表達后酶切加工時使用[15],目前已經完成了基因工程重組表達的研究,可利用工程菌大量制備,使得其生產或購買的成本降低。使用CPB/Trypsin雙酶切體系,能夠被酶切的位點為B22Arg,B29Lys,以及C肽第1位和第4位的Lys,因此,若CPB作用與C肽第1位Lys切斷C端肽鍵,會在B鏈C端引入一個多余的Lys,而B29Lys仍可被內肽酶作用,多余Lys連同B30Thr一同被切除,形成B鏈第30位缺失的門冬胰島素(IAsp-DesB30)。門冬胰島素B30缺失對藥效和藥代動力學的影響研究目前還未見相關報道,所以需進一步純化分離IAsp-DesB30,并應用分離度較好的檢測方法作為質量控制的手段。經Kromasil 100-10-C8反相色譜檢測15 RPC制備柱純化后的樣品,酶切純化制得樣品門冬胰島素純度達到91.7%,雜質即為IAsp-DesB30。該類物質經純化分離后可繼續加工,在B鏈末尾連接一個Thr,以制備門冬胰島素。
本實驗將在以后的研究中對發酵的工藝進行進一步優化,提高產量,改進酶切體系,提高酶切效率,減少錯誤酶切的副產物,提高純化收率,為速效胰島素工業化生產提供幫助。
[1]滕香宇.新型胰島素類似物的研究進展[J].世界臨床藥物,2004,25(12):714-717.
[2]Home P D,Lindholm A,Hylleberg B,et al.Improved glycemic control with insulin aspart:a multicenter randomized double-blind crossover trial in type 1 diabetic patients[J].Diabetes Care,1998,21(11):1904-1909.
[3]Thim L,Hansen M T,Norris K.et al.Secretion and processing of insulin precursors in yeast[J].Proc Natl Acad Sci U S A,1986,83(18):6766-6770.
[4]Kjeldsen T.Yeast secretory expression of insulin precursors[J].Appl Microbiol Biotechnol,2000,54(3):277 -286.
[5]Kjeldsen T,Ludvigsen S,Diers I,et al.Engineering enhanced protein secretory expression in yeast with application to insulin[J].J Biol Chem,2002,277(21):18245 -18248.
[6]Annibali.Expression of a human insulin precursor in P[P].pastoris US Patent,7,091,032.2006-08-15.
[7]董超.門冬胰島素30臨床應用進展[J].山西醫藥雜志,2009,38(11):991-992.
[8]李淑穎.胰島素類似物的研究進展[J].河北醫藥,2005,27(9):693-694.
[9]于四永,王慧麗,陳永立,等.胰島素類似物治療妊娠期糖尿病的患者的臨床觀察[J].臨床薈萃,2013,28(5):573-575.
[10]呂詩詩,徐勇,劉霜,等.胰島素類似物治療妊娠期糖尿病的研究進展[J].臨床薈萃,2015,30(2):228 -230.
[11]李紅亮.不同啟動子對重組畢赤酵母高密度表達人胰島素前體的影響[D].重慶:重慶理工大學,2012.
[12]高劍坤.一種新型長效人胰島素類似物的研制[D].重慶:重慶大學,2007.
[13]Xie T,Liu Q,Xie F,et al.Secretory expression of insulin precursor in Pichia pastoris and simple procedure for producing recombinant human insulin[J].Prep Biochem Biotechnol,2008,38:308-317.
[14]吳穎.小C肽人胰島素原在甲醇酵母中的分泌表達[D].浙江:浙江大學,2005:6-7.
[15]Chunsheng Leng,Hang Cui.Application of recombinant enzymes in the production of human insulin[J].Journal of Chinese Pharmaceutical Science,2011,23(5):335 -337.
(責任編輯何杰玲)
Research on Preparation of Insulin Aspart with Short C-Peptide
FU Zhi-cheng1,MA Yan1,ZHANG Zeng-tao2,LIU Ri-yong2,HE Yong2,FAN Kai1
(1.Chongqing University of Technology,Chongqing 400054,China;2.FAGEN Biological Medicine Co.Ltd.,Chongqing 400041,China)
In order to study the preparation techniques of insulin aspart,we designed and linked EEAEAEPK to its N-terminal,referring to the preference codons of pichia pastoris,and took KEWK as C-peptide,which was a synthetise insulin aspart cDNA sequence with integrated A,B chain structure.We inserted the target sequence into expression plasmid pPICZαA by the restriction enzyme sites Xho I and Not I.The combination of P.Pastoris/x-33 was constructed by electrotransformation and the high-yield strain was selected.The combinant strain expressed 0.57 g/L at the 64th hours of fermentation.We obtained the purer insulin aspart precursor from broth through metal ion-affinity chromatography,SP ion-exchange chromatography and the result of authentication was correct.The system of enzyme digestion by CPB/Trypsin was established and probed the effect in different pH and temper-ature.The product after enzyme digestion was made into insulin aspart and the by-product was insulin aspart DesB30.The purity of insulin aspart reached 91.7%.This design would be another choice to the preparation of insulin aspart,compared with which with short C-peptide EWK,as its high cost in use of Lys-c.
insulin aspart;pichia pastoris;short C-peptide;purification
R977.15
A
1674-8425(2015)04-0060-07
10.3969/j.issn.1674-8425(z).2015.04.012
2015-01-26
付志成(1990—),男,碩士研究生,主要從事基因工程藥物方面研究。
付志成,馬妍,張增濤,等.短C肽門冬胰島素制備工藝的研究[J].重慶理工大學學報:自然科學版,2015(4):60-66.
format:FU Zhi-cheng,MA Yan,ZHANG Zeng-tao,et al.Research on Preparation of Insulin Aspart with Short CPeptide[J].Journal of Chongqing University of Technology:Natural Science,2015(4):60-66.

