嗜水氣單胞菌LAMP的快速檢測方法研究
喻蔚 周穎 周有祥 等

摘要:利用環介導等溫擴增技術(LAMP)建立了一種對嗜水氣單胞菌(Aeromonas hydrophila)進行快速檢測的方法。基于嗜水氣單胞菌tbpA基因,設計了一套引物,并優化了反應體系的溫度、時間和Mg2+濃度,分析了該方法的特異性與靈敏度。結果表明,在59 ℃條件下,LAMP的最適擴增時間為40 min,能有效檢測到1 pg/?滋L核酸濃度,且檢測出嗜水氣單胞菌為陽性,其他菌株為陰性,該方法耗時短,靈敏度高,特異性好,適合嗜水氣單胞菌的快速檢測。
關鍵詞:嗜水氣單胞菌(Aeromonas hydrophila);環介導等溫擴增技術(LAMP);tbpA基因;快速檢測
中圖分類號:S917.1 文獻標識碼:A 文章編號:0439-8114(2015)20-5125-04
DOI:10.14088/j.cnki.issn0439-8114.2015.20.051
Study on the Rapid Detection of Aeromonas hydrophila by
Loop-mediated Isothermal Amplification
YU Wei1a,ZHOU Ying1b,ZHOU You-xiang2,LIN Li1a,ZHOU Yang1a
(1a.College of Fisheries;1b.College of Food Science and Technology,Huazhong Agricultural University,Wuhan 430070, China;2.Institute of Agricultural Quality Standards and Testing Technology Research, Hubei Academy of Agricultural Sciences,Wuhan 430064, China)
Abstract: LAMP (Loop-mediated isothermal amplification) as a kind of rapid detection method for Aeromonas hydrophila was established. A set of primers were designed based on the sequences of the tbpA gene of A. hydrophila. Temperature, time, Mg2+ concentration of reaction system were optimized, and detected the specificity and sensitivity of this method. The results showed that under 59 ℃, the LAMP amplification optimum time for 40 min, this method could effectively detect the nucleic acid concentration with 1 pg/μL, and the LAMP of A. hydrophila reactions was positive, others were negative. In a conclusion, the LAMP detective method was short time-consuming, sensitivity and specificity; and it was suitable for rapid detection of A. hydrophila.
Key words: Aeromonas hydrophila; LAMP; tbpA gene; rapid detection
嗜水氣單胞菌廣泛存在于自然界中,能在水體及土壤中生長繁殖[1],是一種典型的人-畜-魚共患病病原菌[2]。嗜水氣單胞菌已被證實為腹瀉病原菌[3],可引起人類急性胃腸道感染和食物中毒,出現腹痛、腹瀉、發熱、急性胃腸炎等[4,5],給人類的健康帶來了威脅。而國外早已將嗜水氣單胞菌納入腹瀉病原菌的檢測范圍,是食品衛生檢驗的對象[6]。嗜水氣單胞菌可感染草魚、鯽魚、鰱魚、團頭魴、黃顙魚等多種淡水魚,并引起水產養殖中的鰻紅鰭病、鱉赤斑病、羅非魚腐皮病[7,8]。從20世紀90年代起,全國各地爆發性魚病案例中分離出的致病菌中,嗜水氣單胞菌所占比例越來越大。2006年,全國水產養殖業因病害造成的損失約為115億元[9],而嗜水氣單胞菌是各種病原菌中危害最大的,其使得養殖魚類在短短幾天中大量死亡,造成了巨大的經濟損失。故嗜水氣單胞菌對水產養殖行業有著極大的威脅。
因此,建立嗜水氣單胞菌的快速檢測方法對食品安全和水產養殖具有重要意義。目前,嗜水氣單胞菌的傳統檢測方法包括細菌分離、培養、生理生化試驗和血清鑒定等步驟,至少需要3~5 d時間[10],不僅耗時長、步驟多,還容易出現漏檢等問題。此外,酶聯免疫吸附檢測法、免疫熒光抗體和聚合酶鏈式反應(PCR)法等檢測方法[11,12],也都存在操作復雜、敏感性和特異性差等缺點。環介導等溫擴增技術(Loop-mediated isothermal amplification,LAMP)是日本學者Notomi[13]于2000年發明的一種核酸恒溫擴增技術,具有操作簡單、特異性強、靈敏度高、操作簡便等特點。該技術通過針對靶基因的6個區域而設計4種特異引物,在具有鏈置換活性的Bst DNA聚合酶作用下進行的一種自動鏈置換DNA 合成反應,Nagamine[14]發現通過添加環引物,可大大加快反應速度。該技術在恒溫下就可進行核酸擴增[15],通常反應在1 h內完成。本試驗通過生物信息學方法,發現tbpA基因在嗜水氣單胞菌中高度保守,不存在于其他菌種中。故建立基于嗜水氣單胞菌tbpA基因的LAMP技術,實現快速檢測嗜水氣單胞菌,同時也可為相關研究提供參考。
1 材料與方法
1.1 材料
嗜水氣單胞菌J1為南京農業大學劉永杰教授饋贈,乳鏈球菌、枯草芽孢桿菌、噬熱脂肪芽孢桿菌、噬熱液化芽孢桿菌購于北京北納創聯生物技術研究院。
細菌基因組提取試劑盒為北京康為世紀生物科技有限公司產品,Bst DNA聚合酶大片段及ThermoPolTm Reaction Buffer為New England Biolabs公司產品,SYBR Green I為北京索萊寶科技有限公司產品,dNTPs為大連寶生物工程有限公司產品,MgCl2為Thermo Scientific公司產品。
1.2 儀器
DYY-6C型電泳儀(北京市六一儀器廠),PCR儀(ProFlexTM公司),Gel Doc XR+型凝膠成像系統(Bio-Rad 公司)。
1.3 方法
1.3.1 LAMP引物設計與合成 根據嗜水氣單胞菌ML09-119的tbpA基因選取保守性較高的一段序列,利用專門設計LAMP 引物的在線設計軟件[Primer Explorer Version 3(http://primerexplorer.jp/lamp3.0.0/index.html)]設計LAMP反應引物。所得引物序列,由北京擎科新業生物技術有限公司合成,引物序列見表1。
1.3.2 基因組的提取 應用細菌基因組提取試劑盒(康為世紀公司)提取細菌基因組,提取的基因組保存于-20 ℃,待用。
1.3.3 LAMP方法的優化 Mg2+濃度、反應溫度和反應時間對于反應的靈敏性和特異性均有影響,因此采用控制變量法優化Mg2+濃度、反應溫度和反應時間。LAMP 反應體系包括:1 ?滋L 0.8 μmol/L FIP,1 ?滋L 0.8 μmol/L BIP,0.25 ?滋L 0.1 ?滋mol/L F3,0.25 ?滋L 0.1 ?滋mol/L B3,1 ?滋L 0.4 μmol/L LB,1 ?滋L 0.4 μmol/L LF,1.5 ?滋L 0.6 mmol/L dNTPs,2 ?滋L 4 mmol/L MgCl2(除優化Mg2+濃度時),10 mmol/L KCl,20 mmol/L Tris-HCl(pH7.5),10 mmol/L(NH4)2SO4,0.5 ?滋L DNA模板,0.2 ?滋L Bst DNA鏈置換聚合酶,最后用滅菌去離子水補足至25 ?滋L。
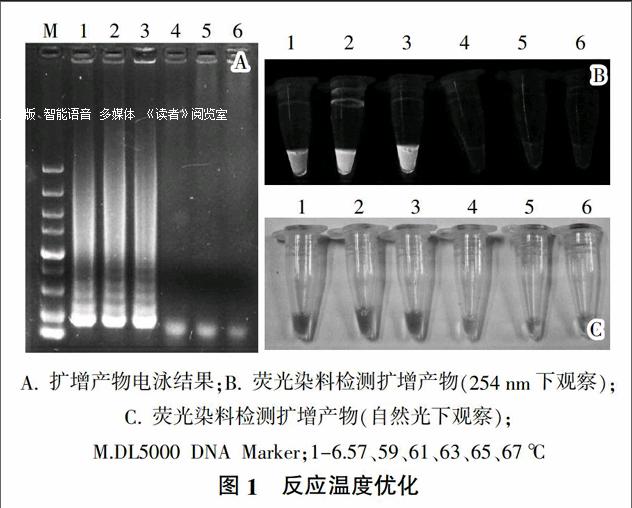
1)反應溫度的優化。保持反應體系內各組分濃度不變,反應時間為40 min。選擇57、59、61、63、65和67 ℃ 6個不同的反應溫度,在同樣的反應條件下,將擴增產物在1%瓊脂糖凝膠上110 V電泳分離30 min,觀測結果。并向擴增產物中加入1 ?滋L稀釋10倍的SYBR Green I熒光染料,在254 nm處紫外光照射下觀察其熒光強度。
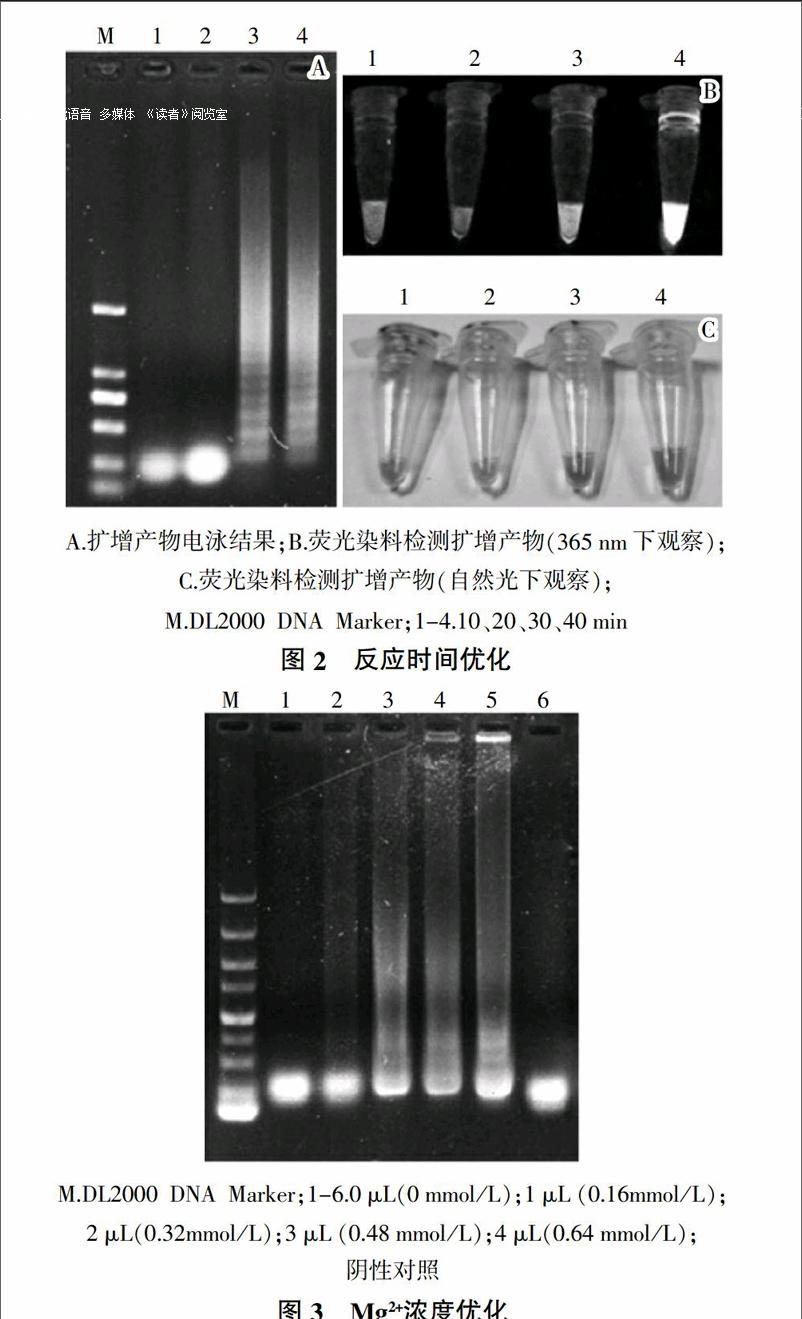
2)反應時間的優化 保持反應體系內各組分濃度不變,反應溫度為59 ℃。選擇10、20、30和40 min不同的反應時間,在同樣的反應體系下,將擴增產物在1%瓊脂糖凝膠上110 V電泳分離30 min,觀測結果。并向產物中加入1 ?滋L稀釋10倍的SYBR Green I熒光染料,在365 nm處紫外光照射下觀察其熒光強度。
3)Mg2+濃度的優化。保持反應體系內除Mg2+濃度外各組分濃度不變,反應溫度為59 ℃,反應時間為40 min。選擇反應體系內Mg2+終濃度分別為0、0.16、0.32、0.48和0.64 mmol/L。在同樣反應條件下,將擴增產物在1%瓊脂糖凝膠上110 V電泳分離30 min,并觀測結果。
1.3.4 LAMP特異性試驗 應用已優化的LAMP反應體系,在同樣的反應條件下,同時對乳鏈球菌、枯草芽孢桿菌、噬熱脂肪芽孢桿菌、噬熱液化芽孢桿菌和嗜水氣單胞菌進行擴增,將擴增產物在1%瓊脂糖凝膠上110 V電泳分離30 min,并觀測結果。
1.3.5 LAMP靈敏度試驗 將嗜水氣單胞菌基因組模板依次稀釋為1 ng/μL、100 pg/μL、10 pg/μL、1 pg/μL。應用于已優化的LAMP反應體系,同反應條件下對不同濃度的嗜水氣單胞菌基因組進行擴增,將擴增產物在1%瓊脂糖凝膠上110 V電泳分離30 min。向產物中加入1 μL稀釋10倍的SYBR Green I熒光染料,在365 nm處紫外光照射下觀察其熒光強度。
2 結果與分析
2.1 反應溫度的優化
試驗發現當反應溫度為57、59、61 ℃時,均能擴增tbpA基因,得到條帶。向擴增產物中加入SYBR Green I熒光染料后,59 ℃條件下擴增產物的熒光強度明顯高于57、61 ℃反應下的擴增產物。故說明最適反應溫度為59 ℃(結果見圖1)。
2.2 反應時間的優化
結果如圖2所示,在10、20 min條件下無擴增條帶,而在30、40 min條件下均可得到梯型條帶。向擴增產物中加入SYBR Green I熒光染料后,40 min條件下擴增產物的熒光強度明顯高于 30 min的擴增產物。故說明最適反應時間為40 min。
2.3 Mg2+濃度的優化
電泳結果如圖3所示。加入2、3、4 μL Mg2+時均可得到梯型條帶,且條帶亮度差異不大,考慮到試驗成本,加入2 μL即LAMP體系內Mg2+終濃度為0.32 mmol/L為最優條件。
2.4 LAMP特異性試驗
對乳鏈球菌、枯草芽孢桿菌、噬熱脂肪芽孢桿菌、噬熱液化芽孢桿菌和嗜水氣單胞菌的擴增結果如圖4所示。只有嗜水氣單胞菌出現梯型條帶,呈陽性反應,其他非嗜水氣單胞菌菌株檢測結果均為陰性。
2.5 LAMP靈敏度試驗
將嗜水氣單胞菌基因組模板稀釋后進行擴增,產物經熒光染料染色后,可觀察到各個濃度下的擴增產物均有明顯的熒光,結果如圖5所示。經電泳檢測,在1 pg/μL時依然可以得到梯型條帶,說明LAMP檢測方法靈敏度高。
3 討論
嗜水氣單胞菌是一類廣泛存在于自然界的人-畜-魚共患病病原菌,不僅在食品安全上對人類健康造成威脅,對水產養殖行業也帶來了嚴重的經濟損失。因此,對嗜水氣單胞菌的檢測在動物疾病和食品衛生研究上都具有重要意義。
通過生物信息學的方法,發現tbpA基因在嗜水氣單胞菌中高度保守,在其他菌種中卻沒有發現。故本試驗基于tbpA基因建立一種LAMP方法以達到快速檢測嗜水氣單胞菌的目的。
本試驗通過優化LAMP反應體系中的Mg2+濃度、反應時間和反應溫度,發現當LAMP體系內Mg2+終濃度為0.32 mmol/L,59 ℃反應40 min為該方法的最優化條件。通過特異性試驗和靈敏性試驗,發現該方法特異性強,靈敏度高。只有嗜水氣單胞菌在該方法下擴增出現梯型條帶,呈陽性反應,而其他非嗜水氣單胞菌菌株檢測結果均為陰性,可檢測到核酸濃度為 1 pg/μL,說明該方法具有較高的靈敏度。
本試驗利用LAMP技術建立的快速檢測方法,在保證靈敏性和特異性的前提下,簡化了操作步驟,大大節省了時間和成本,通過瓊脂糖凝膠電泳法和熒光染色法均可判斷結果,該方法為開發適用于基層的快速水產品中的嗜水氣單胞菌檢測方法提供參考。
參考文獻:
[1] YUCEL N,ERDOGAN S. Virulence properties and characterization of aeromonads isolated from foods of animal origin and environmental sources[J]. J Food Prot,2010,73(5):855-860.
[2] 付喬芳,邱軍強,胡 鯤,等.嗜水氣單胞菌毒力基因在傳代過程中的穩定性研究[J].生物技術通報,2011(9):130-135.
[3] 黃 艷,韋小瑜,王定明,等.一起嗜水氣單胞菌引起的食物中毒調查[J].中國食品衛生雜志,2012,24(4):391-393.
[4] 王琳娜.嗜水氣單胞菌感染導致群體性腹瀉的病原學分析[J]. 中國衛生檢驗雜志,2007,5(17):922-923.
[5] 趙曉艷,蘇領彥,王明良.北京市某敬老院一起食源性嗜水氣單胞菌急性胃腸炎暴發調查[J].職業與健康,2014,30(4):521-523.
[6] 楊守明.嗜水氣單胞菌及其對人的致病性[J].疾病控制雜志,2006,10(5):511-514.
[7] 陳懷青,陸承平.嗜水氣單胞菌:黃鱔出血性敗血癥的病原[J].中國人獸共患病雜志,1991,7(4):21-23.
[8] 陳愛平,朱澤聞,王立新,等.2006年中國水產病害檢測報告[J].科學養魚,2007(7):48-49.
[9] 肖克宇,江為民,彭順平,等.中華鱉暴發性死亡癥的病原及防治研究[J].湖南農業大學學報,1998,24(1):67-71.
[10] 夏 凡,楊麗君,王 靜,等.病原性海洋弧菌致病機理及其快速檢測方法研究進展[J].食品工業科技,2011,32(1):366-376.
[11] SUBASHKUMAR R, THAVUMANAVAN T, VIVEKANANDHAN G, et al . Occurrence of Aeromonas hydrophila in acute gasteroenteritis among children [J]. Indian J Med Res, 2006, 123(1): 61-66.
[12] 肖婧凡,王 玥,張元興,等.海水養殖細菌性病害檢測方法研究進展[J].中國工程科學,2014,16(9):10-15.
[13] NOTOMI T. Loop-mediated isothermal amplification[J]. Nip-pon Rinsho,2007,65(5):957-961.
[14] NAGAMINE K,HASE T, NOTOMI T. Accelerated reaction by loop-mediated isothermal amplification using loop primers[J]. Mol Cell Probe,2002,16(3):223-229.
[15] 黃火清,郁 昂.環介導等溫擴增技術的研究進展[J].生物技術,2012,22(3):90-94.

