貧營養條件下IAMBR污泥微生物群落結構的演變
薛圓圓,孫寶盛*,杜 江,薛士瓊,王明圓,李 愷(.天津大學環境科學與工程學院,天津 30007;.中國建筑設計研究院,北京 00044)
貧營養條件下IAMBR污泥微生物群落結構的演變
薛圓圓1,孫寶盛1*,杜 江2,薛士瓊1,王明圓1,李 愷1(1.天津大學環境科學與工程學院,天津 300072;2.中國建筑設計研究院,北京 100044)
采用PCR-DGGE技術并結合系統處理效果研究了貧營養條件下IAMBR污泥微生物群落結構,結果表明:IAMBR污泥中總細菌多樣性特征、相似性特征和種群歸屬特征具有高度的協同性.運行前18天,氨氮去除率由95%降至73%后增加至82%,同時SVI值由123.7mL/g升至135.2mL/g再降至128.4mL/g.微生物群落在試驗末期演替劇烈,總細菌相似性指數下降到63.6%,SVI值最終升至132.5mL/g.通過克隆測序分析,IAMBR系統中微生物菌種大部分為未培養菌種,其中亞硝化螺菌屬占據優勢地位,說明貧營養環境對IAMBR微生物群落產生不良影響,污泥微生物功能性指向明顯,即硝化功能菌占據優勢地位.
貧營養;IAMBR;PCR-DGGE;活性污泥;微生物群落結構
膜生物反應器(MBR)研究距今已有40多年,具有高污泥濃度,泥齡長,對氨氮的去除效果好,占地面積少等[1]特點被廣泛應用于生活污水、工業廢水、醫療廢水、垃圾滲濾液處理等領域[2-3].而間歇曝氣式膜生物反應器(IAMBR)對總氮的去除效果和活性污泥抗沖擊能力都優于MBR而被研究[4].IAMBR在長污泥齡下運行,隨著微生物濃度升高有機負荷下降,微生物易于處在營養相對貧乏的狀態,進而加劇膜污染.微生物群落結構的變化能靈敏的反映出環境現狀及變化趨勢,在污水治理中具有重要的指導作用[5],但針對貧營養下IAMBR中微生物群落結構變化及對膜污染影響的研究了解還較少.
PCR-DGGE技術可從樣品微生物中提取DNA或RNA,將宏觀現象與微觀分子相結合,它能鑒別出不可培養的細菌,并對細菌生態學的發展起到了巨大的推動作用[6],成為對微生物種群演替進行分析的主要分子生物學方法之一[7].
本研究以無碳源進水為限制條件對污泥進行周期培養,采用PCR-DGGE技術考察完整運行周期內反應器污泥中微生物群落結構演替和優勢菌群的變化,以期對延緩膜污染,優化IAMBR運行提供理論指導.
1 材料與方法
1.1 試驗裝置和運行條件
試驗采用IAMBR工藝,接種污泥取自某高校MBR反應池,工藝流程見圖1所示,池體采用有機玻璃結構,有效容積4L,反應器高50cm,內截面積10cm×10cm.中間設一隔板,隔板長20cm,下端距底5cm,起到平衡曝氣和模擬水力循環的作用.體積大的區域放置浸沒式無紡布平板膜一片,底設砂頭曝氣裝置2個,體積較小的區域放置攪拌器.曝氣:停曝=2h:1h,按此方式循環運行.曝氣時攪拌停止,停曝時攪拌開啟.格內水位降到3.5L時電磁閥開啟,由高位水箱進水至4L同時電磁閥關閉停止進水.水力停留時間8.5h,進水pH值7.5~8,DO初期2~3mg/L,后期為增強對膜表面的沖刷、減少膜污染,DO維持在3~4mg/L.采用間歇進水連續出水方式.

圖1 試驗工藝流程示意Fig.1 Schematic diagram of the IAMBR process
1.2 試驗原水與取樣方法
以碳源作為限制營養,人工配置進水,組成見表1.取一定體積的MBR活性污泥混合液,靜沉2h后去上清液,蒸餾水清洗,重復此步驟3次以去除原水基質.

表1 進水組分及濃度(mg/L)Table 1 Components and concentration of influent (mg/L)
試驗開始前投加上述預處理污泥和原MBR反應池廢水至IAMBR反應器內,以實際廢水進水馴化一周,最終形成污泥濃度5500mg/L左右的混合液.
正式開始試驗后,試驗不間斷運行24d,期間不排泥[8].并在第1,2,4,8,12,16,20,24d取樣,提取活性污泥樣品DNA,編碼I1~I8.每次取樣均從污泥混合液中獲取,取樣20mL,活性污泥樣品預先在-20℃保存,提取前離心破壁預處理.
1.3 樣品預處理
取50mL滅菌離心管,加入15mL污泥混合液,6~10℃、9165×g下離心10min;去上清液,并加入滅菌去離子水30mL;相同條件下離心10min;去上清液,加入滅菌1×TE緩沖液30mL,漩渦振蕩混勻;去上清液,加入滅菌去離子水15mL混勻.
1.4 樣品DNA的提取
采用化學裂解-酚/氯仿/異戊醇抽提-試劑盒純化法提取樣品DNA,具體方法參見文獻[9].
1.5 總細菌的PCR擴增
采用適合大多數細菌和古細菌16SrDNA基因V3區的通用引物對F357-GC和R518,擴增產物片段長約240bp[10].PCR擴增采用50μL反應體系,組成為:1μLDNA模板,25μL2×Taq PCR Master Mix,1μL的25μmol/L 上游引物,1μL的25μmol/L 下游引物,其余用無菌超純水補足至50μL.
采用降落式PCR 反應策略:94℃下預變性5min,前20個循環是94℃變性1min,65~55℃退火1min,72℃延伸1min(每個循環后退火溫度下降0.5℃),后10 個循環是94℃變性1min,55℃退火1min,72℃延伸1min,最后在72℃下延伸8min[11].
1.6 總細菌PCR產物的DGGE分析
采用C.B.S.SCIENTIFIC公司DGGE-2001系統對總細菌PCR產物進行變性梯度凝膠電泳分離[12],完成后將凝膠進行硝酸銀染色,碳酸鈉顯影,最后將膠板于觀測儀中拍照存檔.
1.7 凝膠片段的回收和克隆測序
切取凝膠上清晰明亮的獨立條帶,浸泡在50μL滅菌去離子水中,80℃水浴加熱20min,然后進行總細菌的PCR擴增,擴增產物在1.5%瓊脂糖凝膠中檢測,當DGGE鑒定為單一條帶后,將擴增產物送至上海生工生物科技有限公司完成克隆測序.
1.8 樣品的生物多樣性分析與相似性分析
應用Quantity One軟件對得到的DGGE圖譜進行定性分析.利用Shannon-Wiener (H)多樣性指數評價微生物種群多樣性.應用戴斯系數(Cs)判定微生物種群相似性.
Shannon-Wiener指數公式:

式中:Pi=ni/N ;ni是菌種i的峰面積;N是所有峰的總面積.
戴斯系數公式:

式中: j是泳道A和B的共有條代數;a和b是泳道A和B的各自條代數.
2 結果與討論
2.1 貧營養條件對氨氮、總氮去除的影響
圖2、圖3給出了試驗運行期間IAMBR內氨氮、總氮的去除情況.圖2顯示,整個工況期間,進水水質波動不大,而出水氨氮呈現出先增后減再增加態勢.說明IAMBR中期出水氨氮降低不是由進水水質不穩定所致,而是反應器去除能力增強所造成的.
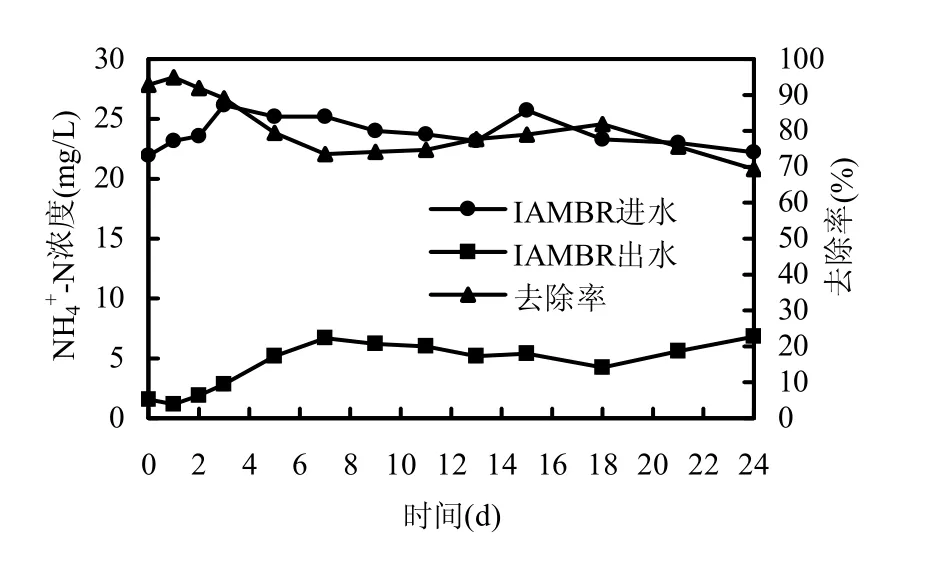
圖2 IAMBR的氨氮去除效果Fig.2 Removal effect of ammonia nitrogen in the IAMBR
從曲線可看出,前7d內氨氮去除率由95%降至73%,之后的7~18d內又升至82%,末期才再次回落,降到周期內最低點69%.這與污泥容積指數監測結果吻合,SVI值在7~18d內發生下降即污泥沉降性能增強.推測這是由于硝化細菌的數量短暫增加所致.貧營養條件刺激微生物代謝EPS、SMP并被膜截留而積累,盡管EPS、SMP可被生物降解,但被微生物利用呈現滯后性,當條件繼續惡劣時,微生物對二者的吸附能力降低,EPS、SMP濃度增加,反而抑制硝化反應,致使試驗最后氨氮去除率降到最低.
圖3顯示,整個工況期間,除前3d總氮仍有一定的去除效果外,基本維持進水含量水平,最后6d出水總氮高于進水總氮.間歇曝氣有利于實現反硝化作用,達到同步硝化反硝化的目的.試驗前4d EPS溶解產生的SMP可被微生物利用[13],污泥活性得到維持,所以貧營養運行后總氮仍有一定的去除率.

圖3 IAMBR的總氮去除效果Fig.3 Removal effect of total nitrogen in the IAMBR

圖4 出水硝態氮含量的變化Fig.4 Changes of nitrate and nitrite in the effluent
圖4示IAMBR出水中硝態氮含量的變化,從曲線可看出,反應器內沒有的積累.趨于穩定后出水的平均值為21.40mg/L.貧營養條件限制進水碳源的補充,因此反硝化受阻.所以圖4中前3d濃度迅速增加,由3.14mg/L變為21.40mg/L.說明系統硝化反應進行良好,反硝化不徹底,氮的轉化一直停留在硝酸鹽階段.
2.2 污泥培養期內MLSS、SVI及SV的變化情況
IAMBR運行期內,每2~4d在好氧段末取100mL均勻污泥混合液靜置30min,觀察污泥所占比例.圖5顯示IAMBR內污泥濃度和污泥體積指數的變化情況.貧營養條件會加劇內源呼吸和EPS釋放,不利于污泥沉降,所以前7d SVI的上升與EPS的釋放有關. EPS能被絲狀菌優先利用,進而引起污泥膨脹[8].貧營養條件下,SMP對污泥的活性有抑制作用.因此試驗初期,MLSS從5660mg/L降到5030mg/L,7~11d出現小幅增幅到5210mg/L,之后呈下降趨勢.

圖5 IAMBR污泥濃度和體積指數的變化Fig.5 Changes of MLSS, SVI in the IAMBR
污泥沉降比隨時間變化如圖6.接種污泥SV是75%,試驗期內SV呈波動下降,規律性不明顯.總體保持在60%~70%之間,試驗后期相比于前期,SV值更低一些.

圖6 IAMBR污泥沉降比的變化Fig.6 Changes of SV in the IAMBR
2.3 總細菌的DGGE圖譜分析
在貧營養IAMBR系統內選取的8個不同時期污泥樣品,經提取總細菌基因組PCR擴增后,進行DGGE圖譜分析,結果如圖7所示.從圖7可以看出,貧營養條件下,IAMBR微生物種群結構經歷了一個明顯的變化過程.根據條帶的變化,細菌種類大致可分作五類,見表2.

圖7 污泥樣品總細菌DGGE分離圖譜Fig.7 DGGE profile of bacteria in sludge samples
從圖7看出,共4條條帶在整個貧營養周期內始終存在,如條帶2、3、7、10.貧營養對這些菌種的影響較小,從而保證了碳源匱乏下污水處理的效果.其中條帶2、7是不同階段的優勢菌種.結合表3可知,貧營養條件下IAMBR系統中優勢菌種大部分為未培養菌種(Uncultured bacterium),表明自然環境尤其極端環境下存在大量不可培養的微生物,被鑒定出的微生物僅僅是極小的一部分[14].變形菌門下的Nitrosospira占據了測序條帶不少的比例,條帶2、9、11均屬于此類型功能菌群.其中條帶2與亞硝化螺菌屬(Nitrosospira)同源性只有91%,亞硝化螺菌屬大多為專性化能自養型好氧菌,不能利用有機培養基[15],因此推測能較好的適應貧營養環境,這也解釋了系統中良好硝化作用的現象.條帶9末期消失,說明該菌未能適應末期極端條件而被淘汰.運行16d后,條帶11出現,亮度偏弱,豐度較低,表明該菌能適應劣勢碳源匱乏條件但并不占據優勢地位.條帶3代表假單胞菌屬(Pseudomonas),具備世代周期長、好氧、分解復雜有機物和脫氮除磷的特點,屬脫氮功能的菌群[16].條帶3始終存在反應體系,能有力的抵抗貧營養環境,屬優勢菌種,這同樣解釋了系統中良好硝化作用的現象.樣品I1還包括條帶5、8,運行2d后消失,推測這些菌群對極端條件敏感,無法適應而處于休眠狀態或被淘汰.

表2 污泥樣品總細菌圖譜的條帶分類Table 2 Classification of bacterial bands in the DGGE profile
圖7中條帶8代表γ-變形菌(Gamma proteobacterium).該類菌種屬厭氧或兼性厭氧菌,已被發現于多種不同的污水生物處理中,通過細菌胞外酶作用,大分子有機物被降解成水溶性的小分子[17],對有機物的去除起主要作用.運行12d后條帶8又出現,亮度雖弱但開始穩定存在于系統中,推測γ-變形菌休眠后經過數量上的選擇逐漸適應新環境而存在于末期IAMBR系統中.條帶6代表酸桿菌屬(Acidobacteria),異養型嗜酸菌,所以在碳源匱乏的條件下僅僅存在于個別泳道,但目前對它們的研究較少,在土壤生態系統中占據重要地位[18].變形菌門下紅環菌屬(Dechloromonas),為革蘭氏陰性菌,光合類,可利用不同的有機底物進行厭氧光照生長或黑暗好氧生長,常見于序批式反應器活性污泥中[19].條帶10屬該類菌屬,降解能力可變,適應貧營養環境,因此屬于IAMBR中的優勢菌.

表3 部分條帶16S rDNA對比結果Table3 Comparisons of some partial 16S rDNA sequences
2.4 總細菌的Shannon-Wiener多樣性指數分析
從圖8可知,IAMBR初始污泥菌群多樣性最高,因為正常環境下微生物群落結構最為完整.隨著貧營養的進行,多樣性指數下降,說明部分微生物對極端環境敏感,生長受到抑制.運行第8d多樣性指數顯著回升,推測出現適應碳源匱乏條件的自養微生物,從而多樣性指數短暫回升.此后直至貧營養末期,多樣性指數基本穩定,說明貧營養條件基本完成對微生物的選擇.由于膜高效截留特點,即便碳源持續匱乏導致多樣性指數下降,H指數扔維持在0.8上下.

圖8 樣品DGGE條帶的Shannon指數Fig.8 Shannon index of DGGE in samples
2.5 總細菌DGGE圖譜的相似性分析和聚類分析
總細菌種群相似性分析見圖9.圖9是以正常運行條件下的I1作為對照時各泳道與其相似性的比較圖.與DGGE凝膠電泳圖譜類似,I2、I3與I1的泳道相似性更為接近,平均值86%,說明菌群大部分處于緩沖適應期,群落結構變化較小.I4~I7這段時期內與I1的相似性差別較大,且呈不規則變化趨勢,一方面由于菌群適應極端環境作出正面調節,另一方面因為碳源匱乏內源呼吸加劇又對菌群產生負面調節.總體上與該段H指數變化趨勢較為一致.末期I8泳道相似性指數最低,為63.6%,說明微生物調整已接近極限,與初期I1相似性差距最大.

圖9 樣品總細菌各泳道相似性圖譜Fig.9 Similarity index of the bacteria in samples

圖10 總細菌DGGE 圖譜的聚類分析Fig.10 Cluster analysis of bacterial DGGE
采用UPGMA算法對污泥樣品泳道進行族群劃分,結果如圖10所示.IAMBR樣品可大致分為三大族群:I1~I4為一族群,I5~I7為一族群,I8單獨為一個族群.前兩個族群相似性75%,與I8族群相似性僅為66%.取樣的時間順序與劃分結果相對應,說明間歇曝氣一定程度上可延緩微生物群落變化,即在貧營養末期菌群結構才會發生明顯變化.
3 結論
3.1 貧營養條件下,IAMBR污泥微生物群落結構演替明顯,其中既有始終存在的優勢菌種,又有不適應該環境而漸漸消失的菌種,還有部分適應此極端環境而出現的菌種.IAMBR污泥中微生物會隨生存條件的改變來調整自身結構,以適應極端環境提高污水處理效果.
3.2 隨著貧營養條件的進行,污泥中總細菌多樣性指數逐漸降低并趨于穩定,相似性指數在經歷緩沖時期和不規則變化后,在I8時期相差最大,形成三大族群.相鄰泳道相似性指數變化不大,說明總細菌為適應環境而逐步有序的進行調整.
3.3 切膠測序發現,貧營養條件下IAMBR總細菌中大部分屬于未經培養菌種,已經檢測出的Nitrosospira始終存在系統內并占據優勢地位,另外還存在Pseudomonas和Gamma proteobacterium等類別,為優化IAMBR處理洗浴水的長期運行和減緩膜污染提供定的理論依據.
[1]Fenu A, Roels J, Wambecq T, et al. Energy audit of a full scale MBR system [J]. Desalination, 2010,262(1/3):121-128.
[2]梁文鐘,湯 兵,陳 烜,等.浸沒式膜生物反應器中生物質的增殖及其對運行效能的影響 [J]. 中國環境科學, 2013,33(8):1399-1406.
[3]Roberts J A, Sutton P M, Mishra P N. Application of the membrane biological reactor system for combined sanitary and industrial wastewater treatment [J]. International Biodeterioration and Biodegradation, 2000,46(1):37-42.
[4]Benaliouche H, Abdessmed D, Nezzal G. The effects of operation conditions of carbon/nitrogen ratio and PH on nitrogen removal in intermittently aerated membrane bioreactor [J]. Desalination and Water Treatment, 2013,51(4-6):1057-1062.
[5]孫慶華,柏耀輝,趙 翠,等.DGGE、T-RFLP、LH-PCR對兩種活性污泥的微生物種群多樣性分析的比較 [J]. 環境工程學報,2009,3(8):1365-1355.
[6]Namba A, Shigenobu Y, Kobayashi M, et al. A new primer for 16S rDNA analysis of microbial communities associated with Porphyra yezoensis [J]. Fisheries Science, 2010,6(5):873-878.
[7]Sanz J L, Kochling T. Molecular biology techniques used in wastewater treatment: An overview [J]. Process Biochemistry,2007,42(2):119-133.
[8]黃 興,孫寶盛,孫井梅,等.貧營養條件下EPS、SMP和微生物多樣性的研究 [J]. 環境科學, 2009,30(5):1468-1472.
[9]Rosenbrger S, Laabs C, Lesjean B, et al. Impact of colloidal and soluble organic material on membrane performance in membrane bioreactors for wastewater treatment [J]. Water Research, 2006,40(4):710-720.
[10]Muyzer G, Waal E C, Uitterlinden A G. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction amplified genes encoding for 16S rRNA [J]. Applied and Environmental Microbiology,1993,59(3):695-700.
[11]Miura Y, Hiraiwa M N, hoe T, et a1. Bacterial community structures in MBRs treating municipal wastewater: Relationship between community stability and reactor performance [J]. Water Research, 2007,41(3):627-637.
[12]陳 誼,孫寶盛,張 斌,等.不同MBR反應器中硝化菌群落結構的研究 [J]. 中國環境科學, 2011,30(1):69-75.
[13]齊庚申,陳 誼,孫寶盛,等.膜生物反應器中貧營養條件下SMP的產出研究 [J]. 環境科學與技術, 2010,33(2):52-55.
[14]Amann R I, Ludwing, Schleifer K H. Phylogenetic identification and in situ detection of individual microbial cells without cultivation [J]. Microbiological Reviews, 1995,59(1):143-169.
[15]Liz J. Shaw, Graeme W. Nicol, Zena Smith, et al. Nitrosospira spp. Can produce nitrous oxide via a nitrifier denitrification pathway[J]. Environmental Microbiology, 2006,8(2):214-222.
[16]郭飛宏,鄭 正,張繼彪.PCR-DGGE技術分析塔式蚯蚓生態濾池微生物群落結構 [J]. 中國環境科學, 2011,31(4):597-602.
[17]Kapley A, Purohit H. Changes in microbial diversity in fed-batch reactor operation with wastewater containing nitroaromatic residues [J]. Bioresource Technology, 2007,98(13):2479-2484.
[18]張政科,虢清偉,顏智勇,等.PCR-DGGE研究沸石植生混凝土微生物群落結構 [J]. 中國環境科學, 2013,33(9):1615-1621.
[19]Ramesh K. Goel, Patricia Sanhueza, Daniel R. Noguera. Evidence of Dechloromonas sp. Participating in enhanced biological phosphorus removal (EBPR) in a bench-scale aerated-anoxic reactor [J]. Proceedings of the Water Environment Federation,2005,41(8):3864-3871.
Analysis of IAMBR on succession of sludge microbial community composition in the oligotrophic condition.
XUE Yuan-yuan1, SUN Bao-sheng1*, DU Jiang2, XUE Shi-qiong1, WANG Ming-yuan1, LI Kai1(1.School of Environmental Science and Engineering, Tianjin University, Tianjin 300072, China;2.China Architecture Design and Research Group,Beijing 100044, China). China Environmental Science, 2015,35(3):839~845
The microbial community in the IAMBR activated sludge grown in a oligotrophic condition was investigated with PCR-DGGE technology and the treatment effect of the IAMBR system was evaluated. The results showed that there was a high degree of cooperativity among the diversity, similarity and population belonging of the total bacteria. In the first 18days, the ammonia nitrogen removal dropped from 95% to 73%, and then increased to 82%. At the same time, the SVI increased from 123.7mL/g to 135.2mL/g, and then decreased to 128.4mL/g. Microbial community experienced a drastic succession at the end of experimental period. The similarity index of bacteria dropped to 63.6%, and the SVI increased to 132.5mL/g eventually. The cloning sequencing analysis revealed that the majority of bacteria in the IAMBR belonged to uncultured bacterium and the Nitrosospira held a dominant position. The research showed that oligotrophic condition had adverse effects on microbial community in the IAMBR. The sense of functional orientation of the microbial community was obvious and the nitrifying bacteria occupied a dominant position.
oligotrophic;IAMBR;PCR-DGGE;activated sludge;microbial community composition
X172
A
1000-6923(2015)03-0839-07
薛圓圓(1991-),女,山東日照人,天津大學碩士研究生,主要從事水污染控制與環境微生物學研究.
2014-07-18
天津市應用基礎研究計劃項目(07JCZDJC02100)
* 責任作者, 副教授, Baosheng_sun@sina.com

