福建省3例輸入性卵形瘧的實驗診斷分析
林耀瑩,張山鷹,楊發柱,謝漢國,歐陽榕,陳朱云
卵形瘧最早是1900年Charles F.Craig發現,1922年Stephens從一個非洲回英國的士兵血液里被感染的紅細胞中發現,并正式命名[1]。卵形瘧主要流行于西非、菲律賓、印尼東部和巴布亞新幾內亞[2],孟加拉、柬埔寨、印度、泰國和越南也有報道。全球每年大約有1 500萬卵形瘧感染,在西非瘧疾病例中卵形瘧超過10%。卵形瘧通過基因方法分為兩個亞種—卵形瘧curtisi和卵形瘧wallikeri[3-4],兩個亞種的譜系分離各自發生在100萬和350萬年前[5]。Calderaro A 等報道[1],流行病學和生物學的調查發現,卵形瘧與間日瘧形態相似,蟲種密度低,只引起密度相對低的蟲血癥,即使實在首發感染,蟲密度峰值也低于10 000/μL。隨著前往卵形瘧流行地區回國人員的增加以及瘧疾檢測技術的不斷完善,偶爾會發現卵形瘧病例和形態難以區分的混合感染,甚至是其少見的變異亞種,因此需加強鏡檢技術培訓,并結合PCR等聯合診斷,提高檢出率。
1 材料與方法
1.1 樣本收集 收集3例輸入性可疑卵形瘧病人(編號分別為FJ1、FJ2、FJ3)的血片以及濾紙血樣本。鏡檢以吉氏染色為準,Whatman903濾紙采集末梢全血,留取直徑為1cm濾紙血3滴,干燥后保存在-20。C冰箱。
1.2 病例 FJ1吉林省人,在石獅做生意,2010年12前往加納,2011年10月25日回國,10月22日在外期間已出現發冷發熱癥狀,10月28日就診福州市傳染病院。FJ2建甌人,2010年6月前往加納,2010年8月初回國,8月22日出現發熱等癥狀,8月25日就診福州市傳染病院。FJ3福清人,2009年5月前往尼日利亞,2010年1月回國,此后未離開過福建省,2010年7月21日出現發冷發熱等癥狀,病人自述每日發熱,在當地中醫院按中暑治療后稍好轉,8月12日再次出現發冷發熱癥狀,8.17就診福州市傳染病院。3例我中心瘧疾實驗室鏡檢初步診斷都為間日瘧感染,當年未做PCR確診,但留有血片和濾紙血。
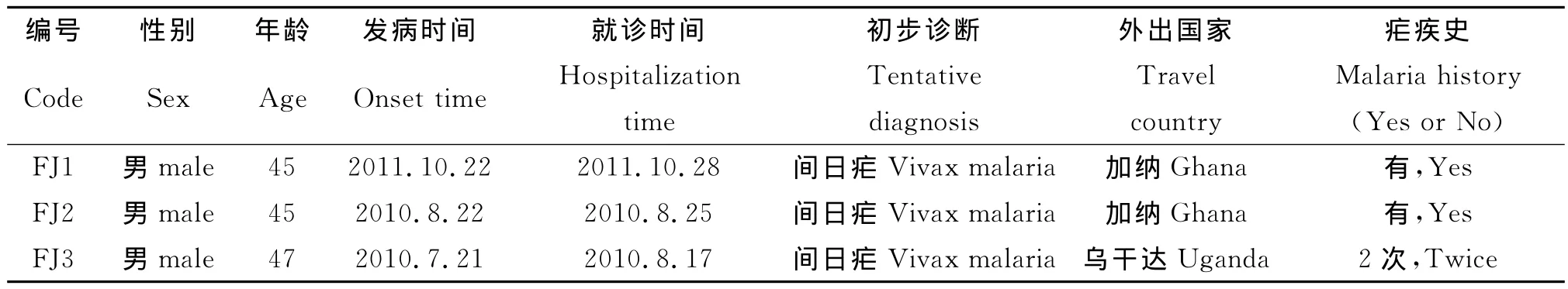
表1 3例病例流行病學史基本資料Tab.1 Epidemiological information of three cases in this study
1.3 DNA提取 根據德國Qiagen的QIAamp DNA Mini kit(250)試劑盒,提取3份濾紙血樣本的DNA,-20。C保存。
1.4 套式PCR擴增 參考18SSUrRNA片段[6]進行套式PCR擴增,第1次擴增是通過瘧原蟲屬特異性引物(rPLU6、rPLU5,表2)擴增產物,長度為1 200bp,第2次擴增4種瘧原蟲P.vivax,P.falciparum,P.malariae,P.ovalecurtisi的種特異產物 (rFAL1、rFAL2,rVIV1、rVIV2,rMAL1、rMAL2,rOVA1、rOVA2,表3),四種瘧原蟲的預期擴增片段長度分別是120bp,205bp,144bp,800 bp。
第1輪擴增:20μL反應體系中包括模板DNA3.0μL,0.5μL Taq聚合酶(5U/μL),各1.0 μL屬 特 異 性 引 物 (10μmol/L),0.4μL dNTPs(10mmol/L),2.0μL 10×Buffer,2.0μL Mg2+(25 mmol/L)。擴增條件:94。C變性3min;94。C變性30s,55。C退火30s,72。C延伸1min,共擴增34個循環;72。C延伸5min。
第2輪擴增:20μL體系中包括第1輪擴增產物2.0μL,0.5μL Taq聚合酶(5U/μL),各1.0μL 4對種特異性引物上、下游引物(10μmol/L),0.4μL dNTPs(10mmol/L),2.0μL 10×Buffer,2.0μL Mg2+(25mmol/L)。擴增條件與第1輪相同。
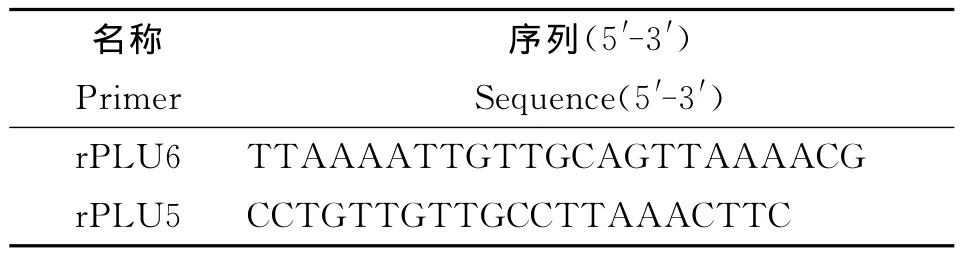
表2 屬特異性引物Tab.2 Generic specific primers
1.4 產物電泳 取5μL擴增產物,與2μL的上樣緩沖液混勻后,加樣于2%瓊脂糖凝膠(含溴化乙錠5μg/mL)電泳,80V電泳約30min,凝膠分析儀進行觀察和分析。

表3 4對種特異性引物Tab.3 Four couples of specific primers
2 結 果
2.1 鏡檢
2.1.1 樣本FJ1 在圖1A中可見較為典型的卵形瘧原蟲滋養體,胞漿不規則,未見寄生紅細胞脹大,但仍可見稍不明顯的鋸齒形;圖1B可見卵形瘧原蟲裂殖體,且有12個左右的裂殖子不規則分布,顆粒呈深棕色;圖1C可見一個紅細胞中含有兩個環狀體,可能為惡性瘧原蟲環狀體,由于未見惡性瘧配子體,故很難確定,需要進一步基因分析診斷(圖A、C為薄血膜,B圖為厚血膜)
2.1.2 樣本FJ2 圖2可見典型的卵形瘧原蟲滋養體,寄生紅細胞脹大,空泡、薛氏點清晰明顯,瘧色素呈棕黃色,散在胞漿分布;圖E小配子體,呈圓形,瘧色素均勻明顯,寄生紅細胞未脹大,可見均勻散在薛氏點。鏡下整體紅細胞鋸齒狀不明顯,有散在環狀體出現,但數量不多,制片質量差,雜質多,攝影設備較落后等原因,故未列出圖片(圖為薄血膜)
2.1.3 樣本FJ3 圖3可見典型的卵形瘧原蟲滋養體,寄生紅細胞變大,鋸齒狀十分明顯,瘧色素顆粒清晰可見。圖G為卵形瘧原蟲雄配子體,呈卵圓形,核疏松偏一側,胞漿深藍色,瘧色素棕黃色偏暗,在胞漿上散在分布。樣本未見其它時期形態(薄血膜)

圖1 鏡下卵形瘧原蟲形態Fig.1 Morphology of P.ovalein microscope

圖2 鏡下卵形瘧原蟲形態Fig.2 Morphology of P.ovalein microscope
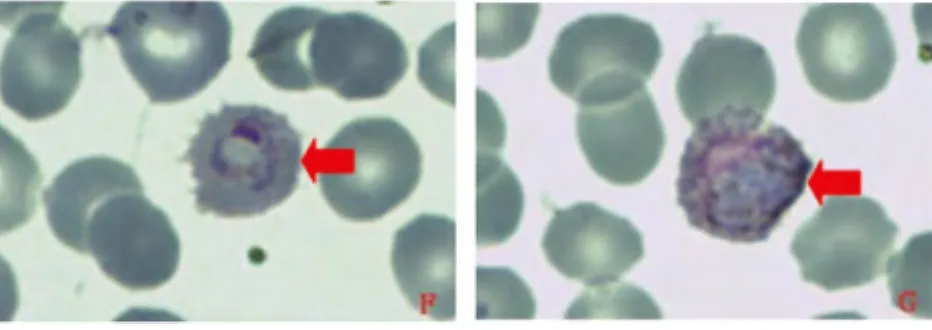
圖3 鏡下卵形瘧原蟲形態Fig.3 Morphology of P.ovalein micnoscope
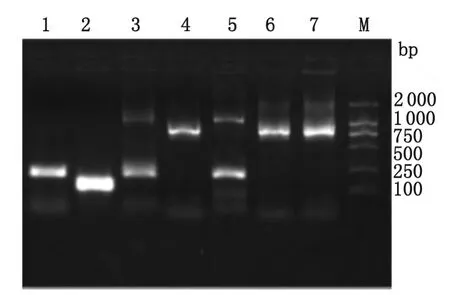
圖4 PCR電泳結果Fig.4 Electrophoresis result of PCR
2.2 PCR檢測 將4對引物分別進行擴增,然后電泳,并設惡性瘧、間日瘧陽性對照,發現FJ1、FJ2有產生惡性瘧及卵形瘧位置的2條帶,FJ3只有卵形瘧位置的1條帶。證實FJ1和FJ2是卵形瘧亞種curtisi和惡性瘧混合感染,FJ3是單一卵形瘧亞種curtisi感染,見圖4。
2.3 測序結果 通過上海生工測序,FJ1擴增產物與登錄號為KC633226.1卵形瘧分離株ZJ04ssr-RNA基因以及登錄號為AB182489.1卵形瘧ssr-RNA完整序列的經典亞種有99%的一致性。FJ2擴增產物與登錄號為KC633226.1卵形瘧分離株ZJ04ssrRNA基因一致性為99%。FJ3擴增產物與登錄號為AB182489.1卵形瘧ssrRNA完整序列的經典亞種有98%的一致性。

表4 測序結果信息Tab.4 Result of sequencing
3 討 論
由于歷史上福建省卵形瘧報道較少,卵形瘧血片與相關培訓少,形態易與間日瘧混淆,3例鏡檢都誤診為間日瘧。在回顧性復核時發現FJ1、FJ2除了具有卵形瘧原蟲的形態特點外,鏡檢未見惡性瘧配子體,且環狀體密度低難以與其它蟲種區分等,導致惡性瘧均未檢出,出現混合感染漏診,需要PCR確診。FJ2制片染色較差。FJ3有卵形瘧原蟲的典型特點,經過培訓的熟練鏡檢員不致于誤診。國內卵形瘧誤診漏診等情況也有多家報道。師永霞等[7]2011年報道1例來自赤道幾內亞輸入性卵形瘧血樣初次鏡檢陰性,通過鏡檢復核和PCR擴增后,發現該病例為卵形瘧感染,顯示PCR檢測的必要。姚立農等[8]在2014年報道的浙江省5例來自非洲的輸入性瘧疾誤診病例中,發現在基層醫療機構鏡檢初步都診斷為間日瘧,后經復核和PCR擴增發現為卵形瘧感染。3例卵形瘧除了來自烏干達的FJ3為單一感染卵形瘧外,其它2例都伴有惡性瘧感染,因此要加強對西非等歸國人員瘧疾知識的宣傳和關注,避免少見類型、形態難以區分混合類型、癥狀嚴重的惡性瘧的誤診、漏診等。由于肝細胞期休眠子的潛伏期不同,導致一系列復發的可能,有些肝細胞期存在延遲發育,有報道可能導致復發發生在感染后4年出現,應提醒病人不要忽視復發的存在。
隨著經濟全球化,出國交流、務工、經商的人越來越多,出現越來越多的來自非洲、東南亞、南美洲的輸入性瘧疾,也給中國帶來更多少見和罕見瘧疾類型,如三日瘧,卵形瘧(經典亞種P.ovalecurtisi和變異亞種P.ovalewallikeri)[9]以及諾氏瘧原蟲等。雖然兩個亞種的分型鑒別目前仍在研究討論中[4,10-11],但是必須要加強和借鑒全球瘧疾專家和學者的研究,完善診斷檢測方法,真正了解全球瘧疾的分布流行。
[1]Calderaro A,Piccolo G,Gorrini C,et al.A new real-time PCR for the detection ofPlasmodiumovalewallikeri[J].PLoS ONE,2012,7(10):e48033.DOI:10.1371/journal.pone.0048033
[2]Zhou RM,Zhang HW,Deng Y,et al.Laboratory detection on two cases with importedPlasmodiumovaleinfection[J].Chin J Parasit Dis Ctrl,2013,31(2):127-129.(in Chinese)周瑞敏,張紅衛,鄧艷,等.2例輸入性卵形瘧的實驗室檢測[J].中國寄生蟲學與寄生蟲病雜志,2013,31(2):127-129.
[3]Calderaro A,Piccolo G,Perandin F,et al.Genetic polymorphisms influencePlasmodiumovalePCR detection accuracy[J].J Clin Microbiol,2007,45(5):1624-1627.DOI:10.1128/JCM.02316-06
[4]Li M,Xia ZG,Tang LH.Overviews onPlasmodiumovalewallikeriand its genetic detection system[J].Chin J Parasit Dis Ctrl,2014,32(1):64-67.(in Chinese)李美,夏志貴,湯林華.卵形瘧原蟲wallikeri亞種及其基因檢測體系的研究進展[J].中國寄生蟲學與寄生蟲病雜志,2014,32(1):64-67.
[5]Putaporntip C,Hughes AL,Jongwutiwes S,et al.Low level of sequence diversity at merozoite surface protein-1locus ofPlasmodiumovalecurtisiandP.ovalewallikerifrom Thai isolates[J].PLoS One,2013,8(3):e58962.DOI:10.1371/journal.pone.005 8962
[6]Snounou G,Viriyakosol S,Zhu XP,et al.High sensitivity of detection of human malaria parasites by the use of nested polymerase chain reaction[J].Mol Biochem Parasitol,1993,61(2):315-320.
[7]Shi YX,Huang JC,Su JK,et al.Laboratory diagnosis of a suspected case of importedPlasmodiumovaleinfection[J].Chin J Zoonoses,2011,27(10):914-920.(in Chinese)師永霞,黃吉城,蘇錦坤,等.1例國內罕見的輸入性卵形瘧的實驗室檢測[J].中國人獸共患病學報,2011,27(10):914 920.
[8]Yao LN,Zhang LL,Ruan W,et al.Species identification in 5 imported cases previously diagnosed asVivaxmalaria by parasitological and nested PCR techniques[J].Chin J Parasitol Parasit Dis,2013,31(3):221-234.(in Chinese)姚立農,張玲玲,阮衛,等.浙江省5例輸入性瘧疾誤診病例的病原學診斷分析[J].中國寄生蟲學與寄生蟲病雜志,2013,31(3):221-234.
[9]Li YC,Wang GZ,Sun DW,et al.A case ofPlasmodiumovale wallikeriinfection in a Chinese worker returning from West Africa[J].Korean J Parasitol,2013,51(5):557-562.DOI:10.3347/kjp.2013.51.5.557
[10]Tanomsing N,Imwong M,Sutherland CJ,et al.Genetic marker suitable for identification and genotyping ofPlasmodium ovalecurtisiandPlasmodiumovalewallikeri[J].J Clin Microbiol,2013,51(12):4213-4216.DOI:10.1128/JCM.01527-13
[11]Fuehrer HP,Stadler MT,Buczolich K,et al.Two techniques for simultaneous identification ofPlasmodiumovalecurtisiandPlasmodiumovalewallikeriby use of the small-subunit rRNA gene[J].J Clin Microbiol,2012,50(12):4100-4102.DOI:10.1128/JCM.02180-12

