重組人源膠原蛋白的分離純化及其結構表征*
周愛梅,張靜,鄧愛鵬,高力虎,仲昭財,楊樹林
(南京理工大學生物工程研究所,江蘇南京,210094)
膠原蛋白是脊椎動物的主要結構蛋白,廣泛分布于動物結締組織、韌帶、跟腱等,約占生物體自身總蛋白含量的30%[1-3]。同時,參與細胞的增殖、分化與遷移,使骨、腱、軟骨和皮膚具有一定機械強度[4-6]。因具有其他合成材料無法比擬的生物相容性、可生物降解性以及可大規模生產的可行性等優點[7-8],膠原蛋白廣泛應用于健康食品、化妝品、生物材料和醫藥工業[9-11]。目前,膠原蛋白主要來自于動物組織,如牛骨、牛皮或豬皮[12],但其品質,純度和功能都具有不可預測性[13]。而且,動物源膠原蛋白可能帶有傳染性病原體(如瘋牛病病毒、禽流感病毒)和引發機體免疫反應[14]。重組人源膠原蛋白技術的發展,使得高可靠性、高純度、化學結構確定和低免疫源性膠原蛋白的獲得成為可能。
研究發現,通過不同的編碼基因進行編碼,至少存在27 種不同的膠原蛋白分子[15-16],其中Ⅰ、Ⅱ、Ⅲ和Ⅴ型是纖維狀的膠原蛋白[17]。通常,膠原蛋白帶有3條多肽鏈(α鏈),每條α多肽鏈由甘氨酸充當氨基殘基形成甘氨酸-X-Y(Gly-X-Y)重復結構[18-19],X和Y可以代表除了甘氨酸以外的其他氨基酸殘基。Ⅲ型膠原蛋白的螺旋結構是一種同型三聚體[α1(Ⅲ)]3,能強化微血管強度與彈性,可提供細胞充足的養分,并且可以直接與血管母細胞結合,從而促進新血管形成[20]。因此,Ⅲ型膠原蛋白是一種極好的生物醫學組織工程材料。
基于人源Ⅲ型膠原蛋白α1鏈膠原域Gly-X-Y的三肽重復序列特征,本實驗室成功構建了巴氏畢赤酵母基因工程菌GS115/pPIC9KG6,進行高密度發酵,獲得Ⅲ型重組人源膠原蛋白。本研究探索利用透析法、鹽析-柱層析結合法對發酵上清液內RHSC進行純化,同時對純化獲得的膠原蛋白進行結構表征。
1 材料與方法
1.1 材料
巴氏畢赤酵母基因工程菌GS115/pPIC9KG6,本實驗室構建;透析袋14 kDa,南京寶靈科生物;Ⅲ型膠原蛋白,Sigma;Sephadex G100,Amersham Biosciences;其他均為國產分析純試劑。
1.2 儀器與設備
冷凍干燥機(FDU-1200,日本Tokyo RIKAKIKAI公司);電泳儀(PROTEANⅡ,美國BIO-RAD);差示掃描量熱儀(TA2100,美國TA公司);紫外可見分光光度計(Ultrospec 4300 pro,美國GE Healthcare);紅外光譜儀(Nicolet iS10,Nicolet);核磁共振波譜儀(Bruker AVANCE 500,Bruker)。
1.3 實驗方法
1.3.1 膠原蛋白獲得
通過BMG培養基對巴氏畢赤酵母基因工程菌GS115/pPIC9KG6進行高密度發酵,甲醇低速流加誘導膠原蛋白表達。4℃,12 000 r/min離心5 min,實現菌體與菌液的分離,上清液-20℃保存。對菌體進行細胞裂解,之后細胞裂解液與發酵上清液進行SDS-PAGE電泳分析。
1.3.2 透析法純化膠原蛋白
取10 mL的發酵上清液裝入14 kDa的透析袋內,以去離子水作為交換液,置于4℃冰箱,每8 h更換去離子水,分別透析12,24,36和48 h,透析液冷凍干燥。
1.3.3 鹽析-柱層析結合法純化膠原蛋白
精確稱取0℃時達到 20%、30%、40%、50%、60%、70%、80%、90%和100%飽和度的(NH4)2SO4沉淀所需(NH4)2SO4固體的量。冰水浴條件下,邊緩慢攪拌邊將硫酸銨固體慢慢加入到發酵上清液中,15 min內加完,繼續攪拌15 min。4℃,10 000 r/min離心5 min,傾出上清液,將沉淀按原體積溶解備用。取40%飽和度硫酸銨沉淀的鹽析溶解液經過凝膠柱Sephadex G100,去離子水洗脫,收集洗脫液,冷凍干燥。
1.3.4 分析方法
1.3.4.1 蛋白回收率測定
蛋白回收率測定采用二喹啉甲酸(BCA)檢測法,以牛血清白蛋白(BSA)作為標準蛋白,562 nm處測得吸光度值做標準曲線。
按公式計算蛋白回收率(η):
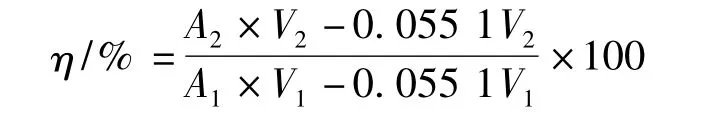
式中:A1,待純化溶液的吸光度值;A2,純化后溶液的吸光度值;V1,待純化溶液的體積,L;V2,純化后溶液的體積,L。
1.3.4.2 RHSC純度分析
運用SDS-PAGE垂直電泳分析RHSC純度,10%的分離膠和5%的濃縮膠,Tris-甘氨酸緩沖系統,80 V電壓濃縮蛋白,120 V電壓分離。考馬斯亮藍R-250染色,Quantity One 4.5.2 軟件分析[21]。
1.4 結構表征
1.4.1 差示掃描量熱法(DSC)分析
稱取2~3 mg RHSC凍干樣品與標準Ⅲ型膠原蛋白,分別密封于DSC坩鍋中,以空坩堝作為參比,從30℃加熱到80℃,升溫速率為10℃/min[22],氮氣在樣品室中流量為20 mL/min。
1.4.2 紫外掃描分析
取RHSC凍干樣與Ⅲ型膠原蛋白分別配制成1 g/L的膠原蛋白溶液,在200~400 nm的近紫外區進行光譜掃描。
1.4.3 傅里葉變換紅外光譜(FT-IR)分析
膠原蛋白基團的特征吸收峰可以被紅外光譜分析檢測,試驗取微量RHSC和Ⅲ型膠原蛋白分別與KBr研磨成粉后壓片。室溫下,在4 000-400 cm-1范圍內掃描[23]。
1.4.41 H-NMR和13C-NMR
將RHSC凍干樣溶于D2O中,形成濃度為0.1 mg/mL的NMR樣品。NMR檢測條件:恒溫在298 K,氫譜和碳譜的觀測頻率分別為 500 MHz,125 MHz;采樣次數分別為64次和8 000次。
2 實驗結果
2.1 發酵液與菌體內的RHSC分析
如圖1所示,在工程菌細胞裂解液中檢測到了目的蛋白,但含量極少,并且其他雜蛋白含量很高,而發酵上清液中有大量目的蛋白存在。說明重組人源膠原蛋白是一種細胞外分泌型的膠原蛋白。經分析,在發酵液中RHSC主要以分子質量約為112 kDa的二聚體形式存在,同時還有部分分子質量為56 kDa的單體。

圖1 重組酵母GS115表達重組人源膠原蛋白的SDS-PAGE分析Fig.1 SDS-PAGE profile of RHSC expressed by recombinant yeast GS115
2.2 RHSC的純化
2.2.1 透析純化結果
透析法是利用小分子物質在溶液中可通過半透膜,而大分子物質不能通過達到分離效果的方法[24]。發酵上清液中色素與小分子雜蛋白都屬于小分子物質,可以透過半透膜以除去。試驗發現,透析超過12 h后,透析袋內的液體顏色澄清,表明發酵上清液內的色素已除去。由表1蛋白的回收率與純度關系可知,RHSC的純度隨著透析時間的增加而有所增高,說明小分子質量的雜蛋含量逐漸減少,而目大的蛋白均被截留。但透析時間超過24 h后,RHSC的純度增加并不明顯,而且透析時間過長會對蛋白的活性造成影響。圖2為發酵上清液透析24 h后的SDS-PAGE譜圖。從圖2中可以看出,RHSC的單體與二聚體條帶清晰,而分子質量低于56 kDa的小分子雜蛋白幾乎沒有條帶,說明雜蛋白含量極低。由此可以判斷,發酵上清液最佳的透析時間為24 h。
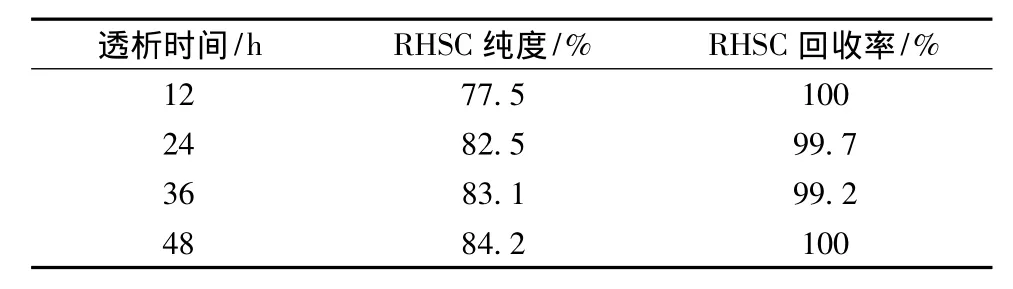
表1 RHSC的回收率與純度Table 1 The recovery and purity of RHSC

圖2 發酵液透析24h后的SDS-PAGE譜圖Fig.2 SDS - PAGE profile of fermentation broth after dialysised 24 h
2.2.2 鹽析-柱層析結合純化結果
表2為發酵上清液經過不同飽和度硫酸銨沉淀后二聚體的純度表。
由表2可知,硫酸銨飽和度為20%時不能將RHSC沉淀下來,而飽和度達到30%以后,二聚體能被沉淀出來,并且實現了二聚體與單體的分離。同時,上清液經40%飽和度的(NH4)2SO4沉淀,二聚體的純度最高,之后,隨著(NH4)2SO4濃度增高,二聚體純度降低。因此,根據以上結果可以確定(NH4)2SO4沉淀的最佳飽和度為40%。圖3為發酵上清液直接過Sephadex G100與40%飽和度(NH4)2SO4沉淀后經過Sephadex G100的SDS-PAGE電泳圖譜,比較可以看出經過(NH4)2SO4沉淀后再過Sephadex G100層析柱,不僅實現了二聚體與單體的分離,而且得到的二聚體達到了電泳純。
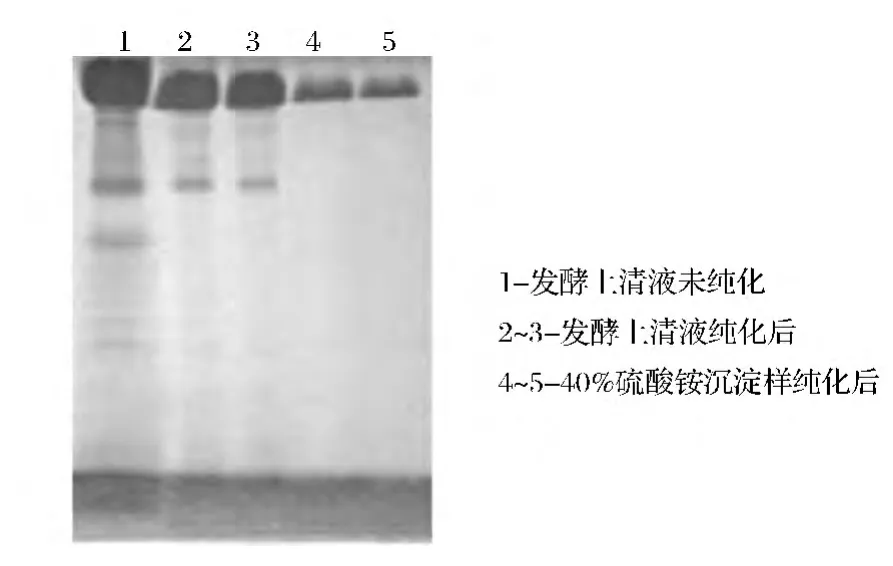
圖3 RHSC經Sephadex G100純化后的SDS-PAGE電泳圖譜Fig.3 The SDS-PAGE spectrum of RHSC purified by Sephadex G100 columm chromatography
2.3 RHSC結構表征
2.3.1 DSC分析
DSC是測定蛋白質熱穩定性常用的方法,其原理是通過測定物質在升溫過程中的吸熱,放熱來反映此種物質的相變和化學反應的過程[25]。圖4-(a)、圖4-(b)分別為Ⅲ型膠原蛋白和RHSC的DSC圖譜,可以看出RHSC的Tm40.68℃,與Ⅲ型膠原蛋白的Tm39.36℃基本相同,且測定的Tm值都在文獻報導的膠原蛋白的變性溫度范圍內[26],表明RHSC與Ⅲ型膠原蛋白具有類似結構。

表2 不同飽和度硫酸銨沉淀后RHSC的純度表Table 2 Purities of RHSC precipitated by ammonium sulfate
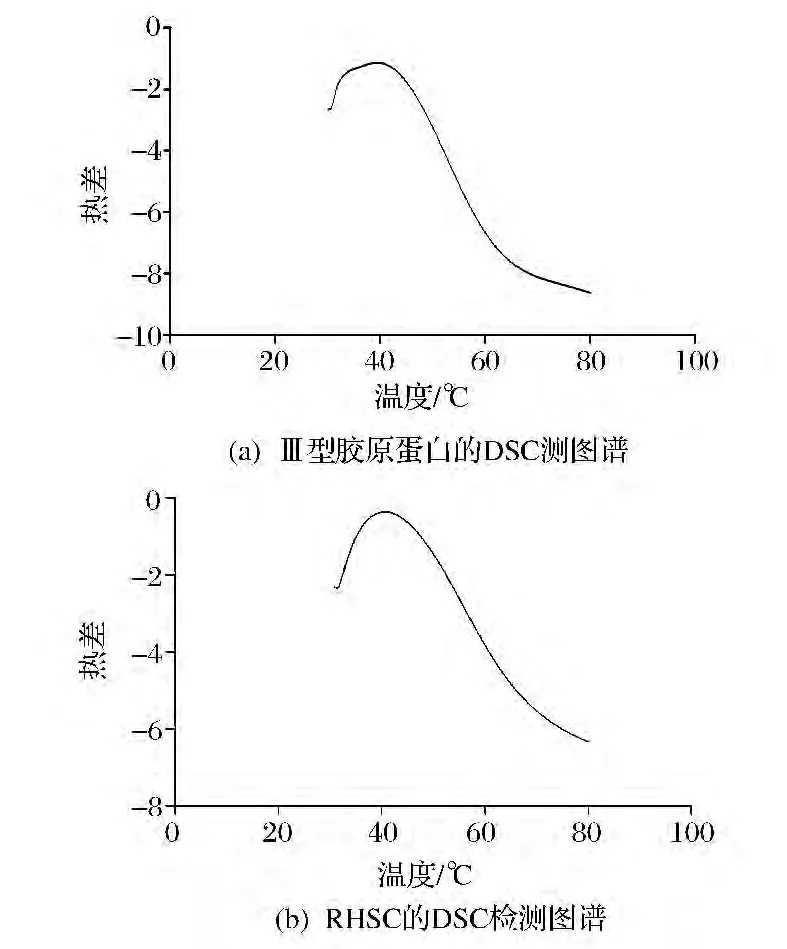
圖4 膠原蛋白DSC圖譜Fig.4 The DSC spectrums of collagen
2.3.2 紫外光譜分析

圖5 膠原蛋白紫外掃描圖Fig.5 UV scan of collagen
2.3.3 紅外掃描分析
由圖6可知,標準的Ⅲ型膠原蛋白的紅外譜圖中的主要峰在RHSC的紅外譜圖中都有所體現,說明兩者微觀結構存在著很大的相似性。在圖6-(b)圖中,3 307 cm-1附近吸收峰是酰胺A帶N—H伸縮振動,并且N—H參與形成氫鍵[27]。3 080 cm-1附近是酰胺B帶的C—H伸縮振動;1 661 cm-1處是酰胺Ⅰ帶的CO伸縮強峰,并且伴隨著氫鍵的作用;1 541 cm-1處吸收峰是酰胺Ⅱ帶的N—H彎曲振動和酰胺基C—N伸縮振動;1 242 cm-1為酰胺Ⅲ帶的N—H伸縮振動變形峰。
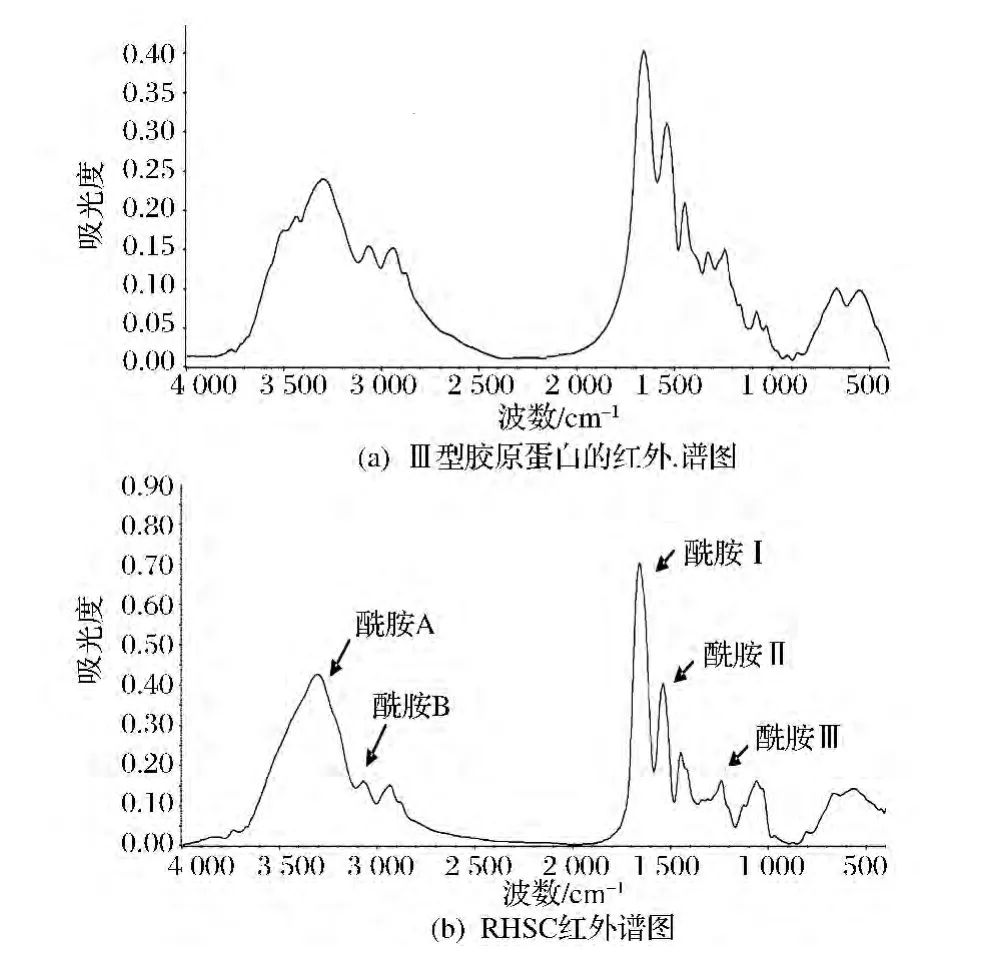
圖6 膠原蛋白的紅外譜圖Fig.6 IR spectra of collagen
2.3.4 RHSC的1H-NMR和13C-NMR譜分析
對于蛋白質的結構研究,核磁共振譜將會顯得越來越重要,它將提供更多的信息。目前,核磁共振譜在膠原蛋白上的應用還很少[28]。RHSC基因序列的設計是基于人Ⅲ型膠原蛋白α1鏈膠原域三肽重復序列特征,其編碼的氨基酸主要包括天冬氨酸(Asp)、谷氨酸(Glu)、甘氨酸(Gly)、賴氨酸(Lys)、脯氨酸(Pro)和絲氨酸(Ser)等。本研究根據何有節等[29-30]提供的明膠標準氫譜和碳譜的譜線歸屬表,對RHSC的譜線進行歸屬。從表3、表4的結果可知,RHSC的氫譜與碳譜的主要峰和其含有的主要氨基酸產生的峰可以一一對應。因此,核磁共振波譜的結果從分子結構上佐證了發酵產生的RHSC即為目的蛋白。
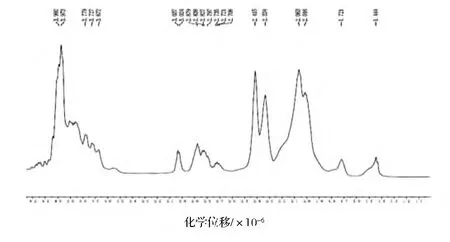
圖7 RHSC的1H-NMRFig.7 1H-NMR of RHSC

表3 RHSC的1H-NMR譜峰歸屬Table 3 Attribute the1H-NMR to RHSC
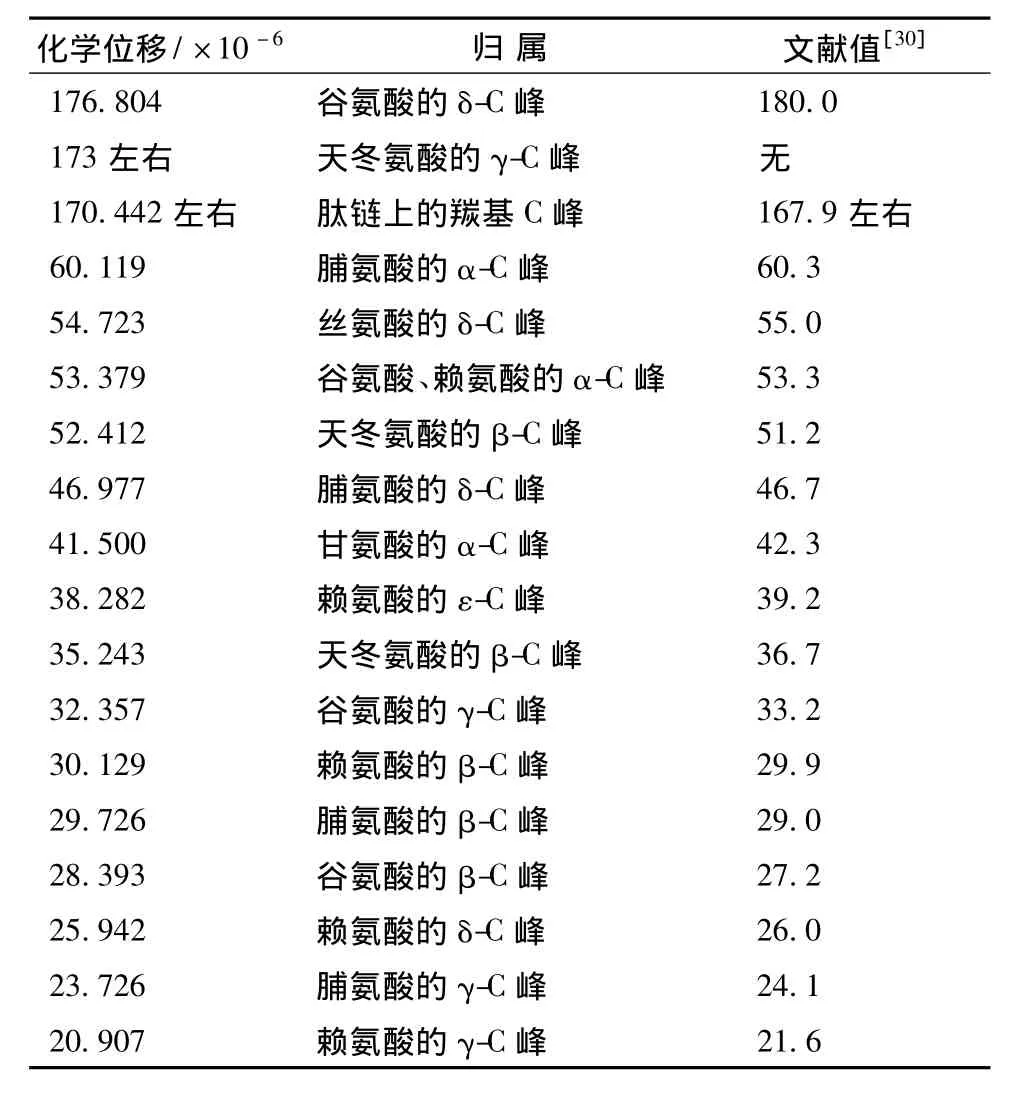
表4 RHSC的13C-NMR譜峰歸屬Table 4 Attribute13C-NMR to RHSC
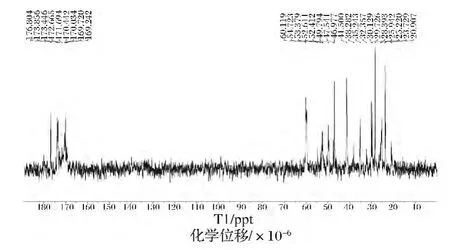
圖8 RHSC的13C-NMR譜圖Fig.8 13C-NMR of RHSC
3 結論與討論
采用高密度發酵獲得的RHSC量近于總蛋白量的60%,約為15 g/L,表達量豐富,利于擴大再生產。在整個發酵行業,分離純化是限制發酵工業生產的因素,純化費用約占整個產值的20%~30%,甚至更高,因而從發酵液中分離純化出目蛋白顯得尤為重要。本試驗采用低溫高速離心的方法分離菌體與菌液,并且運用2種純化方法對發酵上清液進行純化,獲得不同的產物。通過透析法獲得的RHSC混合物可用于食品和醫藥,其降解成小肽后也可應用于化妝品行業。而結合運用鹽析-柱層析法純化獲得的高純度二聚體可以作為生物醫學組織工程材料的原料。同時對純化的膠原蛋白進行了DSC、紫外和紅外光譜分析,并與標準的Ⅲ型膠原蛋白進行比對,結果表明RHSC具有Ⅲ型膠原蛋白的特征結構。同時,NMR的結果從結構上也佐證了高密度發酵獲得的膠原蛋白即為目的蛋白。
[1]Jus S,Stachel I,Schloegl W,et al.Cross-linking of collagen with laccases and tyrosinases[J].Materials Science and Engineering C,2011,31(5):1 068 -1 077.
[2]YAN Ming-yan,LI Ba-fang,ZHAO Xue.Isolation and characterization of collagen from squid(Ommastrephes bartrami)Skin[J].Oceanic and coastal Sea Research,2009,8(2):191-196.
[3]Sher Bahadar Khan,QIAN Zhong-ji,BoMi Ryu,et al.Isolation and biochemical characterization of collagens from seaweed pipefish,syngnathus schlegeli[J].Biotechnology and Bioprocess Engineering,2009,14(4):436 -442.
[4]付步芳,陳丹丹.膠原蛋白的鑒別及其雜蛋白檢測技術[J].藥物分析雜質,2010,30(7):1 351 -1 353.
[5]Sascha Heinemann,Hermann Ehrlich,Timothy Douglas,et al.Ultrastructural studies on the collagen of the marine sponge chondrosia reniformis nardo[J].Biomacromolecules,2007,8(11):3 452 -3 457.
[6]劉曉寧,劉安軍,曹東旭,等.魚鱗膠原蛋白的提取研究初探[J].食品研究與開發,2007,28(1):56 -59.
[7]JIA Yuan-jun,WANG Hai-bo,WANG Hai-yin,et al.Biochemical properties of skin collagens isolated from black carp(Mylopharyngodon piceus)[J].Food Sci Biotechnol,2012,21(6):1 585 -1 592.
[8]李國英,張忠楷,雷蘇,等.膠原、明膠和水解膠原蛋白的性能差異[J].四川大學學報,2005,37(4):54-58.
[9]LI Chun-mei,ZHONG Zhao-hui,WAN Qiong-hong.Preparation and thermal stability of collagen from scales of grass carp(Ctenopharyngodon idellus)[J].Eur Food Res Technol,2008,227(5):1 467 -1 473.
[10]Phanat Kittiphattanabawon,Soottawat Benjakul,Wonnop Visessanguan,et al.Isolation and properties of acid-and pepsin-soluble collagen from the skin of blacktip shark(Carcharkinus limbatus)[J].Eur Food Res Technol,2010,230(3):475 -483.
[11]Ka-jeong Lee,Hee Yeon Park,Yeon Kye Kim,et al.Biochemical characterization of collagen from the starfish asterias amurensis[J].J Korean Soc Appl Biol Chem,2009,52(3):221-226.
[12]Shoshi Mizuta,Mayu Nishizawa,Fuuta Sekiguchi,et al.Enzymatic solubilization of collagen in the skin of diamond squid Thysanoteuthis rhombus:application of a fungal acid protease[J].Fish Sci,2013,79(5):841 - 848.
[13]YANG Chun-lin,Patrick J Hillas,Julio A Baez,et al.The application of recombinant human collagen in tissue engineering[J].Biodrugs,2004,18(2):103 -119.
[14]DU Chun-ling,WANG Ming-qi,LIU Jin-ying,et al.Improvement of thermostability of recombinant collagen-linke protein by incorporating a foldon sequence[J].Appl Microbiol Biotechnol,2008,79(2):195 -202.
[15]WU Ji-min,LI Zhi-hong,YUAN Xiao-yan,et al.Extraction and isolation of typeⅠ,Ⅲ andⅤ collagens and their SDS-PAGE analyses[J].Trans Tianjin Univ,2011,17(2):111-117.
[16]Nazeer R A,Kavitha R,Jai Ganesh R,et al.Detection of collagen through FTIR and HPLC from the body and foot of Donax cuneatus Linnaeus,1758[J].J Food Sci Technol,2014,51(4):750 -755.
[17]劉高梅,任海偉,王永剛.豬軟骨Ⅱ型膠原蛋白的制備及結構表征[J].食品研究與開發,2012,33(8):47-50.
[18]Nasim A,Saeed A,Shahla J,et al.Purification and characterization of pepsin-solubilized collagen from skin of sea cucumber Holothuria parva[J].Appl Biochem Biotechnol,2014,173(1):143 -154.
[19]Olena S R,Peggy C,David L K.Collagen structural hierarchy and susceptibility to degradation by ultraviolet radiation[J].Materials Science and Engineering C,2008,28(8):1 420-1 429.
[20]Sailakshni G,Tapas Mitra,Gnanamani A,et al.Bonding interactions and stability assessment of biopolymer material prepared using typeⅢcollagen of avian intestine and anionic polysaccharides[J].J Mater Sci:Mater Med,2011,22(6):1 419 -1 429.
[21]雷靜,李和生,張麗媛,孫楠楠.烏賊皮膠原蛋白的提取及結構表征[J].天然產物研究與開發,2012,24(5):575-580.
[22]Tapas M,Sailakshmi G,Gnanamani A,et al.Exploring the dual role of di-carboxyl1ic acids in the preparation of collagen based biomaterial[J].J Porous Mater,2013,20(4):647-661.
[23]Hee-Seok Jeong,Jayachandran Venkatesan,Se-Kwon Kim.Isolation and characterization of collagen from marine fish(Thunnus obesus)[J].Biotechnology and Bioprocess Engineering,2013,18(6):1 185 -1 191.
[24]Tsumoto K,Ejima D,Kumagai I,et al.Practical consideration in refolding proteins from inclusion bodies[J].Protein Expr Purif,2003,28(1):1 -8.
[25]Lee J M,Perira C A,Abdulla D,et al.A multisample denaturation temperature tester for collagenous biomaterials[J].Med Eng Phys,1995,17(2):115 -121.
[26]Akkasit J,Soottawat B.Isolation and characterization of acid and pepsin-solubilised collagens from the skin of Brownstripe red snapper[J].Food Chemistry,2005,93:475 -484.
[27]Doyle BB,Bendit EG,Blout ER.Infrared spectroscopy of collagen and collagen-like polypeptides[J].Biopoly,1975,14(5):937 -957.
[28]蔣挺大.膠原與膠原蛋白[M].北京:化學工業出版社,2006:171-173.
[29]何有節,張邁華,劉其則,等.明膠的標準1H和13CNMR譜[J].皮革科學與工程,1990(2):5-9.
[30]James C W,Wise W B.Natural abundance carbon-13 nuclear magnetic resonance study of gelatin[J].Biochemistry,1973(12):3 418.

