低氧條件下鐵調節蛋白1在維持SH-SY5Y細胞鐵穩態中的作用
郁敏燕,王 丹,朱 俐
(1.南通大學附屬醫院生殖醫學中心,江蘇南通226001;2.南通大學航海醫學研究所,江蘇南通226001)
低氧條件下鐵調節蛋白1在維持SH-SY5Y細胞鐵穩態中的作用
郁敏燕1,2,王 丹2,朱 俐2
(1.南通大學附屬醫院生殖醫學中心,江蘇南通226001;2.南通大學航海醫學研究所,江蘇南通226001)
目的:研究低氧條件下鐵調節蛋白1(iron regu1atory protein 1,IRP1)對人神經母細胞瘤SH-SY5Y細胞鐵穩態的影響。方法:1%O2處理SH-SY5Y細胞0,1,2,4,6 h,蛋白質印跡法檢測鐵蛋白輕鏈(ferritin 1ight chain,Ft-L)以及膜鐵輸出蛋白(ferroportin,Fpn)的表達;Ca1cein-AM法檢測SH-SY5Y細胞對Fe2+的吸收以及細胞可變鐵池(1abi1e iron poo1,LIP);采用硫氰酸鹽分光光度法測定細胞總含鐵量;特異性siRNA下調IRP1后檢測SH-SY5Y細胞低氧2 h鐵穩態的變化。結果:低氧0~6 h,SH-SY5Y細胞Ft-L和Fpn表達增加,Fe2+攝入和LIP增加,但細胞總鐵水平不變。siRNA下調IRP1表達后再低氧2 h,Ft-L蛋白表達和LIP明顯增加,Fpn表達和Fe2+攝入沒有明顯變化,細胞總鐵水平增加。結論:低氧條件下,IRP1是SH-SY5Y細胞鐵穩態的重要調節者。
低氧;鐵調節蛋白1;鐵穩態;SH-SY5Y細胞;細胞可變鐵池
鐵為生命活動所必需,其缺乏會引起細胞生長停止和死亡,超載可誘發大量自由基的產生,引起神經退行性病變和多種與老年相關的疾病。游離鐵通過Haber-Weiss或Fenton反應與過氧化氫或脂質過氧化物反應促進活性氧簇的產生,導致脂質、蛋白質和DNA的損傷[1]。細胞通過鐵調節蛋白(iron regu1atory proteins,IRPs,包括IRP1和IRP2)轉錄后調節機制,即與多種編碼鐵存儲、攝取、轉運和輸出的蛋白mRNA非翻譯區(untrans1ated regions,UTRs)的鐵反應元件(iron responsive e1ements,IREs)結合,調節細胞鐵穩態[2-4]。
在原核生物和真核生物中,鐵蛋白(ferritin,Ft)是細胞內主要的鐵存儲蛋白[5]。鐵蛋白通常由重鏈(Ft-H)和輕鏈(Ft-L)的24個亞基組成,Ft-L促進Fe2+沉積并穩定鐵蛋白結構[6]。IRPs通過與鐵蛋白mRNA 5′-UTRs的IREs結合抑制鐵蛋白翻譯,下調其表達,增加細胞可變鐵池(1abi1e iron poo1,LIP)的Fe2+以供細胞代謝[7]。膜鐵輸出蛋白(ferroportin,Fpn)是目前已知的唯一的細胞膜鐵輸出蛋白,在細胞(巨噬細胞、肝細胞和胎盤細胞)表面具有很強的鐵輸出能力,呈高表達[8]。Fpn的表達和功能可通過低氧誘導因子(hypoxia-inducib1e factor,HIF)受低氧調控,也可能受IRPs調控。
機體鐵穩態的維持除了需要多種蛋白的協調作用外,還有賴于適當的氧供給。研究表明,低氧應激會引起機體產生一系列基因表達的變化,以適應一定程度的低氧[9-10],減少其危害。HIF-1是低氧誘導基因表達的主要調節因子,對低氧適應起關鍵性作用[11]。HIF-1是一個異源二聚體,包含兩個螺旋-環-螺旋蛋白,HIF-1a為調節亞基,是氧敏感元件;HIF-1β是已知的芳烴受體核轉位分子,呈組成型表達。常氧下,HIF-1通過泛素蛋白酶途徑降解。低氧時,HIF-1a亞基在胞質中集聚,通過核孔進入胞核與HIF-1β亞基組裝成HIF-1,與靶基因的低氧反應元件(hypoxia responsive e1ement,HRE)結合。我們前期研究發現,在人肝癌HepG2細胞中,低氧通過HIF/HRE系統下調IRP1表達,證明IRP1存在HRE[12],但低氧下IRP1自身的調控作用尚不清楚。
研究顯示,阿爾茨海默病、帕金森病、亨廷頓舞蹈病的基底神經節等多個腦區鐵含量和鐵代謝相關蛋白明顯提高,提示神經細胞的鐵含量增高和鐵沉積與神經退行性疾病高度相關[13-14],腦鐵調節的失衡很可能是神經退行性疾病的發病原因之一[15-16]。但是對鐵代謝相關蛋白在神經細胞的表達調控了解不多,尤其對神經細胞應對低氧缺血的表達調控知之甚少。為此,本研究擬通過人神經母細胞瘤SHSY5Y細胞探討低氧對神經細胞鐵穩態的影響以及該過程中IRP1的作用,以了解低氧應激對神經細胞鐵穩態的影響以及神經細胞在適應內環境低氧時對自身鐵穩態的調節過程。
1 材料與方法
1.1 細胞培養和低氧誘導
人神經母細胞瘤SH-SY5Y細胞(購自中國科學院細胞庫)用含10%胎牛血清的DMEM(Gibco公司),在37℃,5%CO2條件下培養。低氧處理之前把含10%胎牛血清的DMEM換成無血清的培養基,置于InvivO2200低氧工作站(英國Ruskinn Techno1ogies公司),在37℃,5%CO2,1%O2條件下培養。
1.2 蛋白質印跡法檢測
提取常氧組(低氧0 h)和低氧不同時間(1,2,4,6 h)組SH-SY5Y細胞總蛋白,BCA試劑盒(Pierce公司)行蛋白定量,上樣30 μg,行10%SDS-PAGE,轉至PVDF膜(Mi11ipore公司)。用含5%脫脂奶粉的TBST室溫封閉2 h,一抗HIF-1(1∶250,Novus Bio1ogica1s公司)、IRP1(1∶250,Santa Cruz公司)、Ft-L(1∶1 000,Abcam公司)、Fpn(1∶300,A1pha Diagnostic公司)、β-肌動蛋白(1∶10 000,Sigma公司)孵育,4℃過夜,TBST洗3遍,然后二抗(1∶10 000,Jackson公司)室溫孵育2 h,TBST洗3遍。ECL(Pierce公司)化學發光顯色,X光片顯影、定影。膠片拍照,攝取圖像(美國UVP公司EC3 Imaging System),Quantity One分析軟件(Bio-Rad公司)對條帶行定量分析。
1.3 siRNA干擾實驗
消化收集SH-SY5Y細胞,重懸浮于電轉液中,密度為2.5×107個/mL。將人IRP1 4個特異性siRNA序列加到200 μL電轉液中,含5×106個細胞,電穿孔轉染干擾片段。室溫靜置5 min,將電轉細胞懸液轉移至含10%胎牛血清的DMEM中繼續培養48 h,檢測低氧2 h未干擾組(對照組)與干擾IRP1組(siIRP1組)Ft-L和Fpn,IRP1蛋白表達。
siRNA序列如下。siRNA 1正義鏈:5′-UUUCACAACAUGCGGAUUAdtdt-3′,反義鏈:5′-UAAUCCGCAUGUUGUGAAAdtdt-3′;siRNA 2正義鏈:5′-AAAGAUAUCUGGCCGACUAdtdt-3′,反義鏈:5′-UAGUCGGCCAGAUAUCUUUdtdt-3′;siRNA 3正義鏈:5′-GGGCAAAUUUGUCGAGUUCdtdt-3′,反義鏈:5′-GAACUCGACAAAUUUGCCCdtdt-3′;siRNA 4正義鏈:5′-GGCCUAACUCCAUGAGAAUdtdt-3′,反義鏈:5′-AUUCUCGUGGAGUUAGGCCdtdt-3′。
1.4 Fe2+吸收以及細胞LIP的測定
常氧(低氧0 h)與低氧處理不同時間(2,4,6 h)以及低氧2 h條件下未干擾IRP1(對照組)與干擾IRP1(siIRP1組)的細胞分別用PBS洗3遍,收集(1~3)×106個細胞,懸于1 mL HBSS。將熒光劑Ca1cein-AM(終濃度為0.125 μmo1/L)與細胞懸液于37℃共孵育10 min。用PBS洗去胞外探針,用2 mL不含Ca1cein-AM的HBSS重懸細胞,輕輕吹勻,細胞懸液轉入帶有微型磁力攪拌子的比色皿中,用熒光分光光度計(Shimadzu公司)檢測Ca1cein-AM的熒光(激發波長:488 nm,發射波長:518 nm),記錄熒光基線值[17]。測定細胞對Fe2+的吸收時,當基線走平后,加入終濃度為40 μmo1/L硫酸亞鐵銨,淬滅熒光,每隔5 min檢測1個熒光值并記錄,共30 min。測細胞LIP量時,當基線走平后,加入終濃度為500 μmo1/L去鐵酮,連續記錄熒光值1 000 s[18]。
1.5 硫氰酸鹽分光光度法測定細胞總鐵含量
消化、計數、收集常氧(低氧0 h)與低氧處理不同時間(2,4,6 h)以及低氧2 h條件下未干擾IRP1(對照組)與干擾IRP1(siIRP1組)的細胞,60℃烘干。加200 μL濃鹽酸60℃消化2 h,再加800 μL H2O2于60℃消化2 h。然后取75 μL樣品消化液至96孔板中,每孔加入75 μL染色液(0.08%K2S2O8,8%KSCN和3.6%HC1),室溫反應10~15 min,于490 nm波長下測定D值[19]。
1.6 統計學分析
應用Sigma Stata 2.0統計軟件,實驗數據均以均數±標準差(±s)表示,每組取3次獨立實驗結果統計。采用單因素方差分析對實驗結果進行統計分析,以P<0.05為差異有統計學意義。
2 結果
2.1 短時程低氧條件下鐵穩態的維持
蛋白質印跡結果顯示,與常氧(低氧0 h)相比,低氧處理1,2,4,6 h后,Ft-L和Fpn表達均呈時間依賴性增加(圖1)。
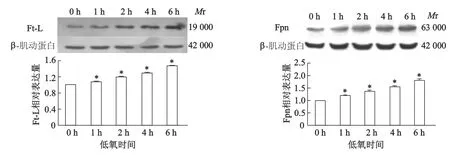
*:P<0.05,與常氧組(低氧0 h)相比圖1 低氧對SH-SY5Y細胞Ft-L和Fpn蛋白表達的影響
SH-SY5Y細胞低氧不同時間(2,4,6 h)后,細胞Fe2+攝入均較常氧增加,低氧2 h Fe2+攝入即達峰值,隨后逐漸減少(圖2A);與常氧(即低氧0 h)相比,低氧2 h LIP增加達最高峰,而后逐漸減少(圖2B);然而SH-SY5Y細胞總鐵水平基本不受短時程低氧的影響(圖3)。
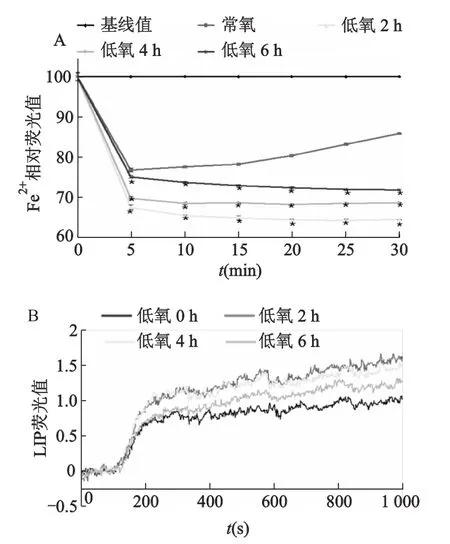
*:P<0.05,與常氧比較圖2 低氧對SH-SY5Y細胞Fe2+攝入和LIP的影響
2.2 低氧條件下HIF-1和IRP1表達成相反趨勢
結果如圖4顯示,不同低氧時間處理(1,2,4,6 h)后,SH-SY5Y細胞內HIF-1蛋白表達量均明顯高于常氧組(低氧0 h),低氧2 h HIF-1表達達最高峰,約比常氧組高50%。
IRP1蛋白表達先降后升,低氧2 h表達最低,約降低30%,隨著低氧時間的延長(4 h和6 h),IRP1蛋白表達逐漸上升。低氧6 h以內,HIF-1蛋白表達和IRP1蛋白表達呈相反趨勢,尤其低氧2 h,HIF-1蛋白表達最高而IRP1蛋白表達最低;由此表明,低氧2 h可能是細胞內部分蛋白表達改變的一個重要拐點。
2.3 下調IRP1表達影響低氧條件下細胞的鐵平衡RNA干擾組IRP1的蛋白表達較對照組降低約55%,表明siRNA能夠下調IRP1的表達。同時,我們還發現在低氧2 h的條件下,SH-SY5Y細胞干擾IRP1蛋白表達后,Ft-L蛋白表達明顯增加了20%(P<0.05),而Fpn表達沒有明顯變化(P>0.05)。見圖5。
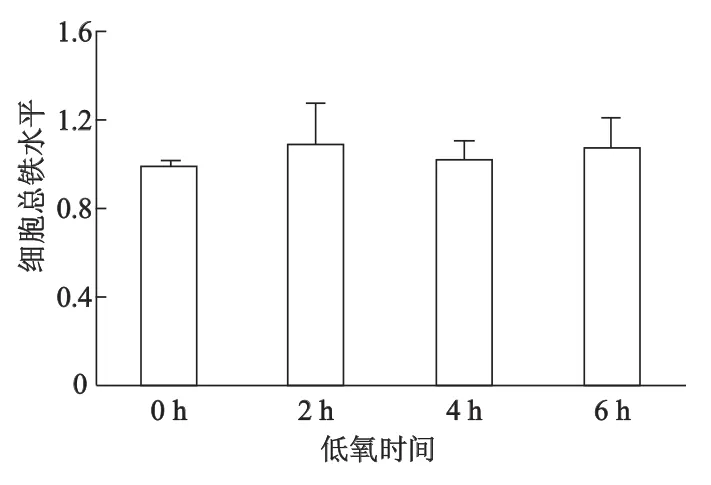
圖3 低氧對SH-SY5Y細胞總鐵水平的影響
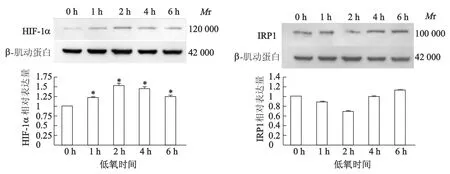
*:P<0.05,與常氧組(低氧0 h)相比圖4 低氧下SH-SY5Y細胞HIF-1和IRP1的蛋白表達
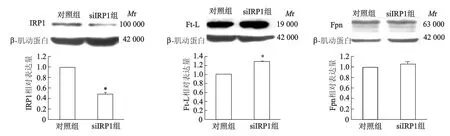
*:P<0.05,與對照組相比圖5 低氧2 h干擾IRP1對SH-SY5Y細胞Ft-L和Fpn蛋白表達的影響
此外,下調IRP1表達,低氧2 h對SH-SY5Y細胞Fe2+的攝入沒有影響,LIP明顯減少50%左右,見圖6;siIRP-1組細胞總鐵水平較對照組增加了20%(P<0.05,圖7)。
3 討論
研究證實,在低氧6 h條件下,HepG2細胞總鐵和Fe2+水平較常氧條件下明顯增加[20]。本研究結果顯示,在低氧條件下,Ft-L和Fpn水平呈時間依賴性增加。在組織缺氧和細胞低氧模型中,鐵蛋白的表達均會發生變化。進行性低氧能誘導新生大鼠和人少突膠質細胞中鐵蛋白合成[21-23]。低氧能增加SH-SY5Y細胞Fe2+攝入和LIP,這與鐵的吸收是LIP的主要來源相一致[24]。在本研究中,我們發現SH-SY5Y細胞低氧2 h Fe2+攝入比低氧4 h和6 h多,可能是由于Fe2+攝入是一個持續的動態過程,胞內鐵的積聚也隨時間推移越來越多,因而反饋性抑制Fe2+攝入和LIP。此外,持續的Fe2+攝入可導致Ft-L隔離的鐵增多,故Ft-L蛋白表達隨低氧時間延長而增加。此外,本研究中細胞Fpn水平逐漸增加,表明細胞鐵輸出也呈時間依賴性增多,以維持細胞的總鐵水平。因而,短時程(6 h)低氧條件下,SH-SY5Y細胞的鐵穩態能保持穩定。研究報道低氧能增加人肺泡巨噬細胞和A549細胞鐵蛋白的表達但細胞鐵含量保持不變[25],本研究結果與其類似。
哺乳動物細胞鐵穩態受IRPs轉錄后調節[1],在人大腦中主要是IRP1起作用[26]。我們前期研究表明,IRP1受低氧調節,HepG2細胞物理或化學低氧6 h IRP1表達下調[12]。研究表明IRP1對低氧和再氧合的反應呈細胞特異性[27]。本研究結果顯示,SH-SY5Y細胞低氧處理2 h,Fe2+攝入和LIP增加最多,HIF-1a蛋白表達達峰值,IRP1蛋白表達達最低,提示1%低氧2 h對SH-SY5Y細胞的影響最明顯。故我們以低氧2 h為關鍵點,研究IRP1對SH-SY5Y細胞鐵穩態的影響。
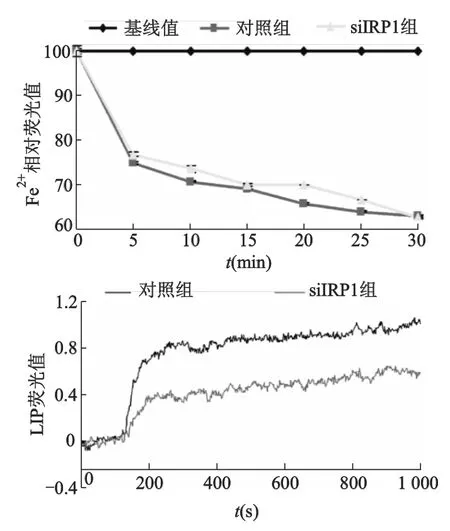
圖6 低氧2h,干擾IRP1對SH-SY5Y細胞Fe2+攝入和LIP的影響
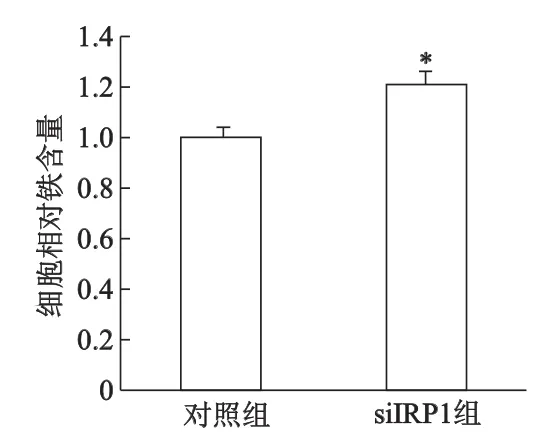
*:P<0.05,與對照組相比圖7 低氧2h干擾IRP1對SH-SY5Y細胞總鐵水平的影響
雖然短時程(<6 h)低氧對SH-SY5Y細胞的總鐵水平沒有明顯影響,但改變了鐵的攝入、輸出和存儲,由此推測正是通過IRP1對這些鐵代謝相關蛋白的調控,參與了短時程低氧下SH-SY5Y細胞鐵穩態的維持。下調SH-SY5Y細胞中IRP1表達后,低氧2 h條件下,Ft-L表達增加,LIP明顯減少,推測細胞LIP因被鐵蛋白隔離的鐵增多而減少;Fe2+攝入沒有明顯變化,Fpn表達也沒有變化即鐵外流沒有變化,但持續的Fe2+攝入可增加細胞總鐵含量,故細胞總鐵水平有明顯增加。提示低氧條件下,如果沒有足夠IRP1蛋白的參與,細胞鐵攝入、輸出和存儲的方式均會發生改變,從而影響細胞的鐵穩態。但我們只用siRNA的方法研究了低氧條件下IRP1在維持細胞鐵穩態過程中的作用,IRP1對細胞鐵穩態的影響及機制仍需作深入研究。低氧條件下細胞Fe2+攝入的增多提示可能有鐵吸收蛋白表達的增加。二價金屬離子轉運體(DMT1)和轉鐵蛋白受體(TfR1)是兩種重要的鐵吸收蛋白,二者在低氧條件下都受HIF-1的轉錄調節[20],對鐵濃度改變的反應也均受IRP1轉錄后調節[28]。在低氧條件下如何通過HIF-1/HRE和IRP1/IRE體系協同調節DMT1/ TfR1來影響鐵的吸收有待進一步研究。
細胞鐵穩態受IRP1和IRP2轉錄后調控。當氧含量豐富時,IRP1與鐵代謝相關蛋白mRNAs的UTRs的IREs結合,調節鐵穩態,而IRP2經蛋白酶體途徑被快速降解[29]。而低氧時,IRP2是與IREs結合的主要蛋白,結構穩定[30]。低氧條件下,IRP1表達下調對SH-SY5Y細胞鐵穩態的影響可能是由于IRP2的代償性作用。由于IRP2也是主要的鐵調節蛋白,低氧條件下IRP2在維持細胞鐵穩態過程中的作用值得進一步研究。
綜上所述,短時程低氧(<6 h,1%O2)條件下,SH-SY5Y細胞鐵穩態保持穩定。低氧2 h,當IRP1下調后,由于細胞總鐵含量增加,SH-SY5Y細胞鐵穩態發生改變。故低氧條件下,IRP1在SH-SY5Y細胞鐵穩態的調節過程中起重要作用。
[1] Ha11iwe11 B,Gutteridge JM.Ro1e of free radica1s and cata1ytic meta1 ions in human disease:an overview[J]. Methods Enzymo1,1990,186:1-85.
[2] Hentze MW,Kühn LC.Mo1ecu1ar contro1 of vertebrate iron metabo1ism:mRNA-based regu1atory circuits operated by iron,nitric oxide,and oxidative stress[J].Proc Nat1 Acad Sci U S A,1996,93(16):8175-8182.
[3] Eisenstein RS.Iron regu1atory proteins and the mo1ecu-1ar contro1 of mamma1ian iron metabo1ism[J].Annu Rev Nutr,2000,20:627-662.
[4] Schneider BD,Leibo1d EA.Regu1ation of mamma1ian iron homeostasis[J].Curr Opin C1in Nutr Metab Care,2000,3(4):267-273.
[5] MacKenzie EL,Iwasaki K,Tsuji Y.Intrace11u1ar iron transport and storage:from mo1ecu1ar mechanisms to hea1th imp1ications[J].Antioxid Redox Signa1,2008,10(6):997-1030.
[6] Arosio P,Ingrassia R,Cavadini P.Ferritins:a fami1y of mo1ecu1es for iron storage,antioxidation and more[J].Biochim Biophys Acta,2009,1790(7):589-599.
[7] A1berghini A,Reca1cati S,Tacchini L,et a1.Loss of the von Hippe1 Lindau tumor suppressor disrupts iron homeostasis in rena1 carcinoma ce11s[J].J Bio1 Chem,2005,280(34):30120-30128.
[8] Anderson GJ,Vu1pe CD.Mamma1ian iron transport[J].Ce11 Mo1 Life Sci,2009,66(20):3241-3261.
[9] Thomas JD,Johannes GJ.Identification of mRNAs that continue to associate with po1ysomes during hypoxia[J].RNA,2007,13(7):1116-1131.
[10] Martens LK,Kirschner KM,Warnecke C,et a1.Hypoxia-inducib1e factor-1(HIF-1)is a transcriptiona1 activator of the TrkB neurotrophin receptor gene[J].J Bio1 Chem,2007,282(19):14379-14388.
[11] Ke Q,Costa M.Hypoxia-inducib1e factor-1(HIF-1)[J].Mo1 Pharmaco1,2006,70(5):1469-1480.
[12] Luo QQ,Wang D,Yu MY,et a1.Effect of hypoxia on the expression of iron regu1atory proteins 1 and the mechanisms invo1ved[J].IUBMB Life,2011,63(2):120-128.
[13] Bartzokis G,Tish1er TA,Shin IS,et a1.Brain ferritin iron as a risk factor for age at onset in neurodegenerative diseases[J].Ann N Y Acad Sci,2004,1012:224-236.
[14] Bartzokis G,Tish1er TA,Lu PH,et a1.Brain ferritin iron may inf1uence age-and gender-re1ated risks of Neurodegeneration[J].Neurobio1 Aging,2007,28(3):414-423.
[15] Qian ZM,Shen X.Brain iron transport and neurodegeneration[J].Trends Mo1 Med,2001,7(3):103-108.
[16] Lee DW,Andersen JK,Kaur D.Iron dysregu1ation and neurodegeneration:the mo1ecu1ar connection[J].Mo1 Interv,2006,6(2):89-97.
[17] Breuer W,Epsztejn S,Cabantchik ZI.Iron acquired from transferrin by K562 ce11s is de1ivered into a cytop1asmic poo1 of che1atab1e iron(Ⅱ)[J].J Bio1 Chem,1995,270(41):24209-24215.
[18] Barnabé N,Zastre JA,Venkataram S,et a1.Deferiprone protects against doxorubicin-induced myocyte cytotoxicity[J].Free Radic Bio1 Med,2002,33(2):266-275.
[19] Liu YX,Chen ZP,Wang JK.Systematic eva1uation of biocompatibi1ity of magnetic Fe3O4nanopartic1es with six different mamma1ian ce11 1ines[J].J Nanopart Res,2011,13:199-212.
[20] Wang D,Wang LH,Zhao Y,et a1.Hypoxia regu1ates the ferrous iron uptake and reactive oxygen species 1eve1 via diva1ent meta1 transporter 1(DMT1)exon1B by hypoxia-inducib1e factor-1[J].IUBMB Life,2010,62(8):629-636.
[21] Qi Y,Dawson G.Hypoxia induces synthesis of a nove1 22-kDa protein in neonata1 rat o1igodendrocytes[J].J Neurochem,1992,59(5):1709-1716.
[22] Qi Y,Dawson G.Hypoxia specifica11y and reversib1y induces the synthesis of ferritin in o1igodendrocytes and human o1igodendrog1iomas[J].J Neurochem,1994,63(4):1485-1490.
[23] Qi Y,Jamindar TM,Dawson G.Hypoxia a1ters iron homeostasis and induces ferritin synthesis in o1igodendrocytes[J].J Neurochem,1995,64(6):2458-2464.
[24] Kruszewski M.Labi1e iron poo1:the main determinant of ce11u1ar response to oxidative stress[J].Mutat Res,2003,531(1/2):81-92.
[25] Smith JJ,O′Brien-Ladner AR,Kaiser CR,et a1. Effects of hypoxia and nitric oxide on ferritin content of a1veo1ar ce11s[J].J Lab C1in Med,2003,141(5):309-317.
[26] Hu J,Connor JR.Demonstration and characterization of the iron regu1atory protein in human brain[J].J Neurochem,1996,67(2):838-844.
[27] Irace C,Scorzie11o A,Maffettone C,et a1.Divergent modu1ation of iron regu1atory proteins and ferritin biosynthesis by hypoxia/reoxygenation in neurones and g1ia1 ce11s[J].J Neurochem,2005,95(5):1321-1331.
[28] Sa1ahudeen AA,Bruick RK.Maintaining Mamma1ian iron and oxygen homeostasis:sensors,regu1ation,and cross-ta1k[J].Ann N Y Acad Sci,2009,1177:30-38.
[29] Rouau1t TA.The ro1e of iron regu1atory proteins in mamma1ian iron homeostasis and disease[J].Nat Chem Bio1,2006,2(8):406-414.
[30] Meyron-Ho1tz EG,Ghosh MC,Rouau1t TA.Mamma1ian tissue oxygen 1eve1s modu1ate iron-regu1atory protein activities in vivo[J].Science,2004,306(5704):2087-2090.
Involvement of iron regulatory protein 1 in iron homeostasis under hypoxia in human neuroblastoma(SH-SY5Y)cells
YU Min-yan1,2,WANG Dan2,ZHU Li2
(1.Center for Reproductive Medicine,Affi1iated Hospita1 of Nantong University,Nantong Jiangsu 226001;2.Institute of Nautica1 Medicine,Nantong University,Nantong Jiangsu 226001,China)
Objective:To investigate the effects of iron regu1atory protein 1(IRP1)on iron homeostasis in human neurob1astoma SH-SY5Y ce11s under hypoxia.Methods:The SH-SY5Y ce11s were exposed to hypoxia for 0,1,2,4,6 h(1%O2),and then the tota1 proteins were extracted to detect the expression of ferritin 1ight chain(Ft-L)and ferroportin(Fpn)by Western b1otting.Ca1cein-AM was used to measure ferrous iron uptake and 1abi1e iron poo1(LIP)in SH-SY5Y ce11s.Spectrophotometry was used to determine the tota1 ce11u1ar iron 1eve1 with thiocyanate.The effects of IRP1 siRNA on iron homeostasis in SH-SY5Y ce11s under hypoxia were detected.Results:Iron homeostasis remained unchanged when ce11s were exposed to 1%hypoxia for 0-6 h a1though the expression of Ft-L and Fpn increased,and the 1eve1 of ferrous iron uptake and LIP e1evated.When IRP1 was knocked down using IRP1-specific siRNA,the expression of Ft-L and LIP increased,whi1e Fpn and ferrous iron uptake did not a1tered obvious1y.The iron homeostasis in SH-SY5Y ce11s a1tered under 2 h hypoxia in terms of the ce11u1ar tota1 iron content increased.Conclusion:IRP1 regu1ated iron homeostasis in SH-SY5Y ce11s under hypoxia.
hypoxia;iron regu1atory protein 1;iron homeostasis;SH-SY5Y ce11s;1abi1e iron poo1
R392.2
A
1671-7783(2015)06-0466-06
10.13312/j.issn.1671-7783.y150154
2015-07-08 [編輯] 劉星星
國家自然科學基金資助項目(30971197,31171143,31471141)
郁敏燕(1988—),女,研究實習員,碩士;朱俐(通訊作者),教授,博士生導師,E-mai1:zhu1i1i65@126.com

