雙重熒光實時定量PCR法檢測TNF-α mRNA表達水平
姚 霜,鄭 璐,于 洋,喻妙梅,潘麗莉,張 俊,馮悅華,羅光華
(蘇州大學附屬第三醫院綜合實驗室,江蘇常州213003)
雙重熒光實時定量PCR法檢測TNF-α mRNA表達水平
姚 霜,鄭 璐,于 洋,喻妙梅,潘麗莉,張 俊,馮悅華,羅光華
(蘇州大學附屬第三醫院綜合實驗室,江蘇常州213003)
目的:建立單管檢測腫瘤壞死因子-α(TNF-α)和內參GAPDH mRNA表達水平的雙重熒光實時定量PCR方法。方法:脂多糖刺激小鼠巨噬細胞Ana-1后提取細胞RNA,經反轉錄合成cDNA,應用自行設計的不同熒光標記的TNF-α和GAPDH引物探針,經PCR擴增后,在FAM通道和CY5通道分別讀取Ct值,同時應用基因測序技術對結果進行驗證,并構建質粒標準品分析該方法的靈敏度和重復性。結果:雙重熒光實時定量PCR法檢測TNF-α的靈敏度達4×101拷貝/μL,檢測線性范圍可達6個數量級,批內和批間重復性好。結論:新方法消除了目的基因與內參的加樣誤差,節約成本,快速準確,適用于TNF-α mRNA的定量檢測。
雙重熒光定量PCR;腫瘤壞死因子-α;GAPDH
巨噬細胞是機體重要的免疫細胞和炎性細胞,經致炎因素刺激后能夠產生炎癥因子,調控炎癥反應[1]。脂多糖是革蘭陰性菌細胞壁的重要成分,是誘導機體產生炎癥反應的關鍵物質,通過脂多糖刺激巨噬細胞產生促炎因子建立體外炎癥模型,常用于某些潛在抗炎因子(如載脂蛋白M等)或藥物作用機制的研究[2]。炎癥模型建立的成功與否主要通過細胞產生的腫瘤壞死因子-α(tumor necrosis factor a1pha,TNF-α),白細胞介素-1β(inter1eukin-1 beta,IL-1β)等炎癥因子的變化水平來衡量,因此,不斷探索和改進這些炎癥因子mRNA表達水平的PCR檢測方法十分必要。本實驗以TNF-α為例,以雙重熒光實時定量PCR方法代替傳統的單重熒光PCR,消除了多管反應體系造成的加樣誤差,操作簡便,準確快捷,現報告如下。
1 材料與方法
1.1 材料
小鼠巨噬細胞株Ana-1購于中國科學院上海細胞庫。脂多糖(Sigma公司)。RNA提取試劑盒購于上海博彩生物科技公司,反轉錄試劑盒(TheroFish公司),PCR熱啟動酶及其反應體系(Bio1ine公司),LightCyc1er熒光定量PCR儀(Roche公司)。
1.2 體外炎癥模型的建立
1×106個/mL的Ana-1細胞鋪6孔板,3 h后加入10 μg/mL的脂多糖,6 h后提取細胞RNA。
1.3 細胞RNA的提取及反轉錄
按照RNA提取試劑盒和反轉錄試劑盒說明書進行操作。
1.4 引物及探針的設計和合成
根據NCBI數據庫中小鼠TNF-α和GAPDH的基因序列,應用Primer Premier 5.0軟件設計正、反義引物和探針,引物和探針均由上海生工公司合成和修飾,見表1。
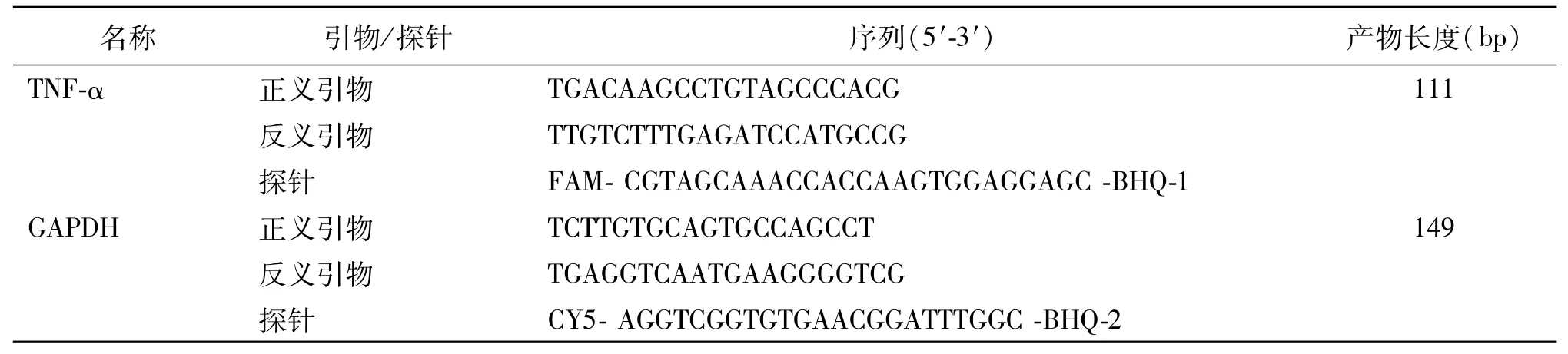
表1 檢測小鼠TNF-α和GAPDH的引物探針
1.5 實時熒光PCR
總反應體系為25 μL,包括cDNA模板2 μL,50 mmo1/L MgC12溶液1.5 μL,IMMOLASE DNA熱啟動酶0.2 μL,100 μmo1/L TNF-α及GAPDH正、反義引物和探針均為0.04 μL,40 mmo1/L 4×dNTP 1 μL,10×緩沖液2.5 μL,雙蒸水補足至25 μL。循環參數:95℃預變性10 min;95℃5 s,60℃27 s(溫度轉換率為4.4℃/s),共40個循環,60℃收集熒光數據。反應在LightCyc1er 480Ⅱ型熒光定量PCR擴增儀上進行。
1.6 質粒載體構建
分別構建TNF-α及GAPDH的載體,擴增產物片段送上海生工公司克隆并測序。
1.7 靈敏度和檢測范圍
分別選取TNF-α和GAPDH載體作為模板,經10倍梯度稀釋(4×101~4×106),按上述條件進行熒光定量RT-PCR。
1.8 統計學分析
應用GraphPad Prism 5.0對數據進行統計學分析,兩組間比較采用t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 結果判斷
TNF-α在FAM通道出現明顯“S”形擴增曲線,在CY5通道無擴增;GAPDH在CY5通道出現明顯“S”形擴增曲線,在FAM通道無擴增,分別讀取Ct值。
2.2 準確性分析
選取TNF-α和GAPDH的樣本各一份送至上海生工公司測序,經BLAST比對后,RT-PCR結果與測序結果一致。測序圖如圖1。
2.3 標準曲線的建立及靈敏度檢測
該法檢測TNF-α和GAPDH的靈敏度均為4×101拷貝/μL,TNF-α標準曲線的方程為Y= -3.566X+42.60,r2=0.988,擴增效率為91%。GAPDH標準曲線的方程為Y=-3.541X+38.57,r2=0.996,擴增效率為92%。其中Y代表Ct值,X代表模板量的對數值。其線性范圍可達6個數量級(圖2和圖3)。
2.4 批間重復性
將4×106拷貝/μL的TNF-α和GAPDH混合作為標準品原液進行10倍梯度稀釋,批內設置3個復孔,批間重復檢測3次,批內和批間變異系數小于3.53%。見表2和表3。
2.5 脂多糖刺激Ana-1細胞前后TNF-α mRNA表達的差異
雙熒光通道RT-PCR結果顯示,脂多糖處理后Ana-1細胞表達TNF-α mRNA顯著高于對照組(t= 21.20,P<0.01),差異有統計學意義。見圖4。
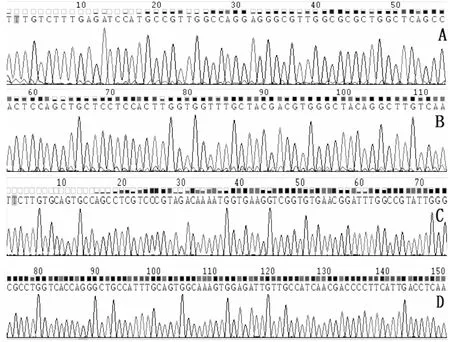
A、B為TNF-α,C、D為GAPDH圖1 TNF-α產物測序圖
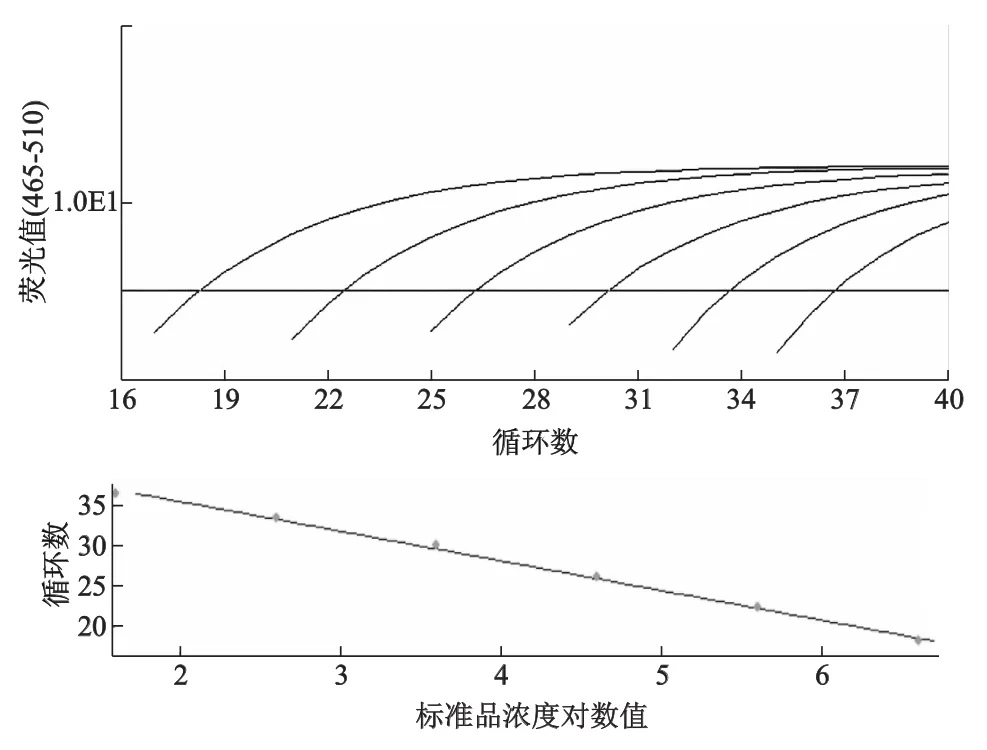
圖2 TNF-α不同稀釋度擴增曲線
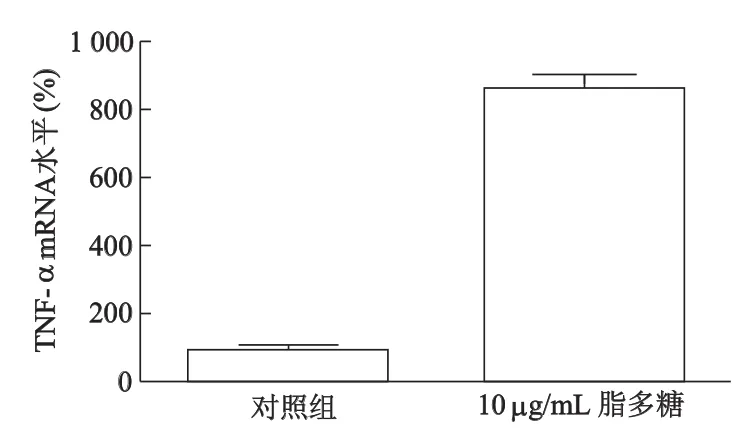
圖4 TNF-α mRNA在Ana-1細胞中的表達
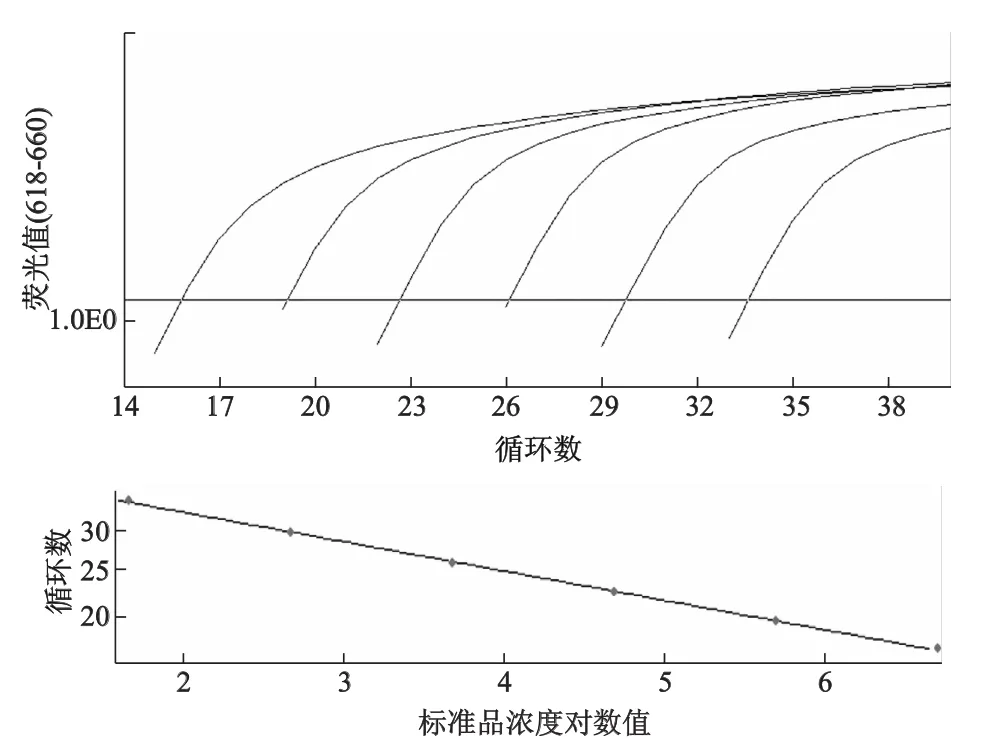
圖3 GAPDH不同稀釋度擴增曲線
3 討論
在炎癥的發生發展過程中,巨噬細胞表面的模式識別受體可以識別多種病原相關分子模式(pathogen-associated mo1ecu1ar pattern,PAMP)分子啟動胞內信號傳導[3]。根據活化方式的不同巨噬細胞可以分為經典活化型(M1)和替代活化型(M2)兩種表型,脂多糖刺激后主要分化為M1a型,激活NF-κB通路表達TNF-α,IL-1β,IL-6等促炎細胞因子,而M2型巨噬細胞表達IL-10等抑炎細胞因子,降低炎癥反應促進組織修復[4]。TNF-α是維持體內免疫平衡的重要介質,在抗腫瘤、免疫防御的炎癥反應中起重要的作用。巨噬細胞經脂多糖刺激后在早期即可釋放大量TNF-α,TNF-α反向作用于NF-κB通路,促進其他炎癥因子的釋放,放大了炎癥反應[5]。因此,通常選取急性炎癥早期細胞因子TNF-α作為衡量炎癥反應模型成功與否的標準。
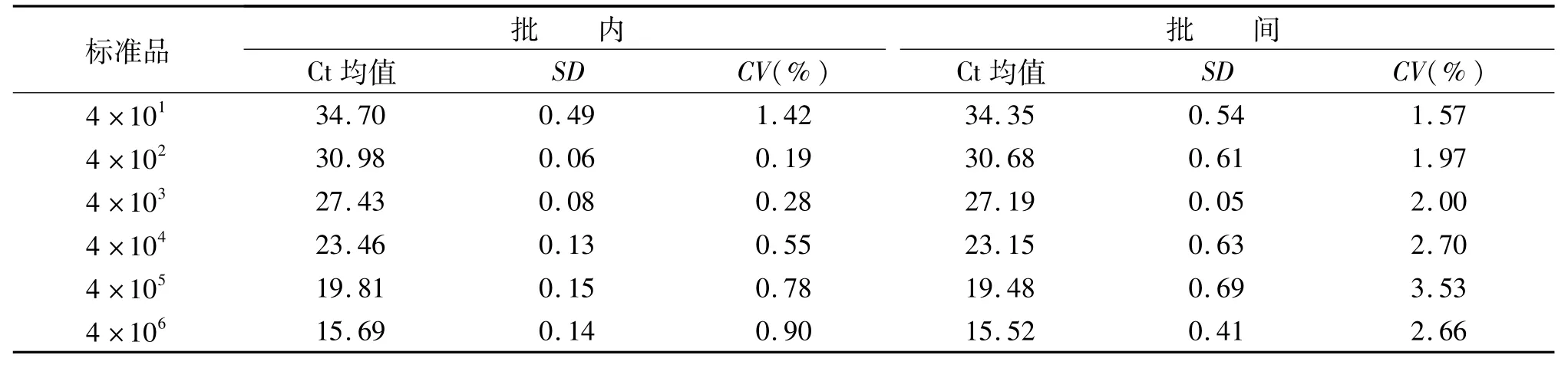
表2 TNF-α標準品的批內、批間重復性
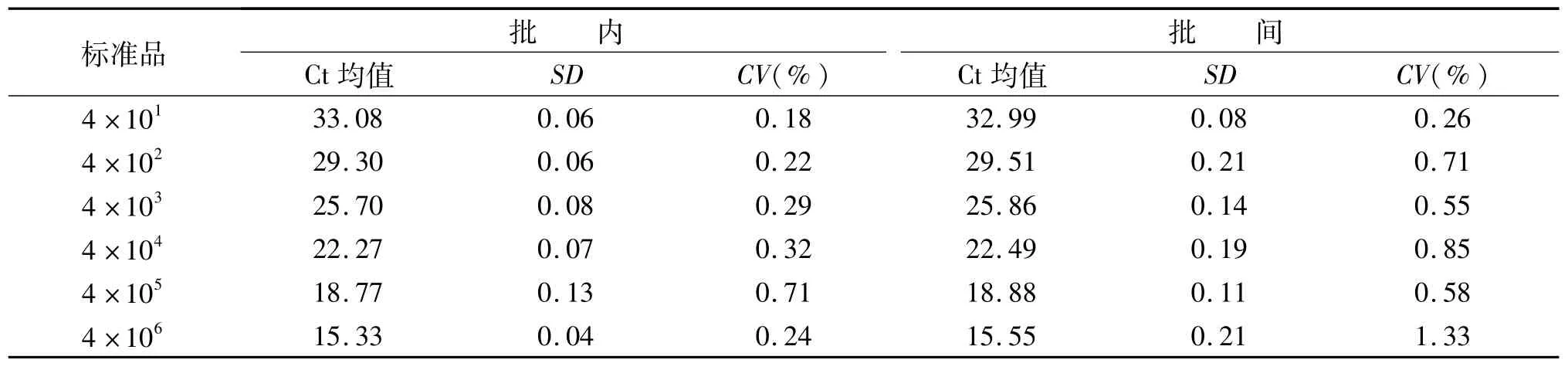
表3 GAPDH標準品的批內、批間重復性
多重PCR法通常用在同一反應管內檢測多個基因的表達或多種病原體。該方法縮短了檢測周期,并降低了檢測費用。傳統的單重熒光定量PCR在檢測多個基因時需要多管反應體系,不但耗費試劑、樣本,而且還浪費時間,較為煩瑣。
在定量研究目的基因表達水平時,通常會選取GAPDH作為內參基因。如果用單重熒光定量PCR檢測目的基因和內參基因,需要分兩管進行,會在模板(cDNA)加樣環節產生一個加樣誤差。為避免這個誤差并減少PCR次數,本研究旨在建立一種單管快速準確檢測TNF-α和GAPDH的方法,利用Primer Premier 5.0軟件設計出針對TNF-α和GAPDH高度特異的引物和探針,分別用FAM和CY5熒光基團標記。在以同一濃度陽性核酸作為模板的反應體系中,優選引物和探針的最佳濃度,根據最低Ct值選擇最佳引物和探針濃度,建立最優化的反應體系。LightCyc1er480Ⅱ型實時熒光定量PCR儀進行檢測后,分別在FAM和CY5通道讀取TNF-α和GAPDH的Ct值,擴增曲線為典型的“S”形。靈敏度實驗表明,檢出限可達4×101拷貝/μL,無交叉反應,批內和批間重復性好,在106~101拷貝/μL范圍內具有良好的線性,可以準確測定TNF-α的表達量,為炎癥模型建立成功與否提供了一個準確、經濟、快速的檢測方法。利用該方法定量檢測脂多糖誘導前后Ana-1細胞TNF-α的表達,結果顯示誘導組明顯高于對照組,說明炎癥模型建立成功。
[1] Morris MC,Gi11iam EA,Li L.Innate immune programing by endotoxin and its patho1ogica1 consequences[J].Front Immuno1,2014,5:680
[2] Li Y,Wu Q,Deng Y,et a1.D(-)-Sa1icin inhibits the LPS-induced inf1ammation in RAW264.7ce11sand mouse mode1s[J].Int Immunopharmaco1,2015,26(2):286-294.
[3] Mcnab F,Mayer-Barber K,Sher A,et a1.Type I interferons in infectious disease[J].Nat Rev Immuno1,2015,15(2):87-103.
[4] Liu K,Zhao E,I1yas G,et a1.Impaired macrophage autophagy increases the immune response in obese mice by promoting proinf1ammatory macrophage po1arization[J].Autophagy,2015,11(2):271-284.
[5] Napetschnig J,Wu H.Mo1ecu1ar basis of NF-κB signa-1ing[J].Annu Rev Biophys,2013,42:443-468.
Establishment of dual fluorescent quantitative real-time PCR for detection of TNF-α
YA0 Shuang,ZHENG Lu,YU Yang,YU Miao-mei,PAN Li-ii,ZHANG Jun,FENG Yue-hua,LU0 Guang-hua
(Comprehensive Laboratory,the Third Affi1iated Hospita1 of Soochow University,Changzhou Jiangsu 213003,China)
Objective:Estab1ish a dua1 f1uorescent quantitative rea1-time PCR for detection of TNF-α. Methods:The RNA was iso1ated from Ana-1 ce11 1ine after inducing by 1ipopo1ysaccharide.Primers and probes were designed according to mice TNF-α and GAPDH gene.The thresho1d cyc1es were reading through channe1 FAM and channe1 CY5,respective1y.After verifying the amp1ification resu1ts by gene sequencing,the standard p1asmid was constructed for ana1yzing the sensitivity and repeatabi1ity of the method. Results:The ana1ytica1 sensitivities of the dua1 rea1-time PCR assay for TNF-α and GAPDH reached to 4× 101copies/μL.No cross-reaction was observed during the reaction.The 1inear range and the intra-assay coefficient of variation were 4×101_4×106copies/μL and<3.53%.Conclusion:The new method can e-1iminate the errors caused by adding samp1es.It is a simp1e,economic and suitab1e method for assaying expression of target genes.
dua1 f1uorescent quantitative RT-PCR;TNF-α;GAPDH
R393
A
1671-7783(2015)06-0524-04
10.13312/j.issn.1671-7783.y150190
2015-08-28 [編輯] 何承志
國家自然科學基金資助項目(81201352,81370372);江蘇省自然科學基金資助項目(BK2012154,BK20130244);常州市應用基礎研究項目(CJ20122013)
姚霜(1989—),女,碩士研究生;羅光華(通訊作者),研究員,碩士生導師,E-mai1:shineroar@163.com

