枯草芽孢桿菌對銅綠微囊藻抑制效果的研究
張 睿,王廣軍,李志斐,郁二蒙,夏 耘(.中國水產科學研究院珠江水產研究所,農業部熱帶亞熱帶水產資源利用與養殖重點實驗室,廣東 廣州 50380;2.上海海洋大學水產與生命學院,上海 20306)
枯草芽孢桿菌對銅綠微囊藻抑制效果的研究
張 睿1,2,王廣軍1*,李志斐1,郁二蒙1,夏 耘1(1.中國水產科學研究院珠江水產研究所,農業部熱帶亞熱帶水產資源利用與養殖重點實驗室,廣東 廣州 510380;2.上海海洋大學水產與生命學院,上海 201306)
為探討枯草芽孢桿菌(Bacillus subtilis)對銅綠微囊藻(Microcystis aeruginosa)的抑制效果,在實驗室條件下,研究了枯草芽孢桿菌不同生長時期(延遲期、對數期、穩定期和衰亡期)無菌濾液對銅綠微囊藻生長的影響、枯草芽孢桿菌抑制銅綠微囊藻生長的作用方式以及無菌濾液影響下銅綠微囊藻丙二醛(MDA)含量、超氧化物歧化酶(SOD)活性和光合色素含量的變化.結果顯示:枯草芽孢桿菌對數期、穩定期和衰亡期濾液抑藻效果明顯好于延遲期,作用第8d,對銅綠微囊藻的去除率分別達到81.19%、91.41%、91.82%;4個處理組銅綠微囊藻的葉綠素a含量均顯著低于對照組.添加穩定期濾液后,銅綠微囊藻MDA含量顯著升高,SOD活性先升高后降低;在對光合色素的影響中,類胡蘿卜素受到的影響不如葉綠素a顯著.結果表明,枯草芽孢桿菌對銅綠微囊藻的抑制效果是通過分泌胞外物質實現的,且分泌物具有很強的熱穩定性.推測該胞外分泌物能夠破壞光合色素,影響光合作用,抑制藻細胞的生長;同時抑制SOD活性,使細胞膜脂過氧化程度不斷加深,進而破壞藻細胞的完整性,表現出對藻很強的抑制效果.
枯草芽孢桿菌;銅綠微囊藻;抑制;葉綠素a;丙二醛(MDA)
藻類是養殖水體的初級生產力,但由于水體內環境失衡,水體富營養化、水溫、pH值等因素的異常變化常導致藻類過渡生長引起藻類水華[1].細菌等微生物被認為在維持藻類生物量平衡方面起重要作用[2],因其具有經濟、便攜、環境友好等特點,在控藻領域的研究應用中受到越來越多的關注[3-4].細菌抑制藻類的作用方式主要是通過接觸或進入藻細胞內直接進攻宿主,或者同藻類競爭有限營養、分泌胞外物質間接進攻宿主兩大類[5].近年來,一些國內學者針對微囊藻進行了微生物控制的研究,篩選出了一系列具有抑制微囊藻效果的細菌[5],其中芽孢桿菌被多數學者篩選分離,逐漸成為研究熱點[6-8].
枯草芽孢桿菌是廣泛存在于自然界的一種非致命性細菌.目前,國內對其研究大部分集中于發酵條件的優化[9]、抗菌物質在生物防治領域的應用[10],以及作為動物飼料添加劑[11]、水質凈化制劑[12]等方面,而在控藻領域的研究尚未見報道.
本實驗選用枯草芽孢桿菌,研究其不同生長時期濾液對銅綠微囊藻的抑制效果和抑藻的作用方式,并結合在無菌濾液影響下藻類MDA含量、SOD活性和光合色素含量的變化,分析其抑藻的作用過程,為枯草芽孢桿菌在藻類防控方面提供理論基礎和應用指導.
1 材料與方法
1.1 試驗菌、藻種來源及培養條件
枯草芽孢桿菌(Bacillus subtilis,GIM1.372),購于廣東省微生物研究所微生物菌種保藏中心,培養基為牛肉膏蛋白胨,高溫滅菌后使用.菌種經平板活化后接種于液體培養基,在30℃、150r/min恒溫搖床中培養12h,備用.
銅綠微囊藻(Microcystis aeruginosa FACHB315),由中國科學院水生生物研究所藻種保藏中心提供.培養基為BG11,高溫滅菌后使用.藻種于25℃、光照強度2000lx、光暗比12h:12h恒溫培養箱中擴大培養,實驗時按所需藻量接種于BG11.
1.2 細菌生長曲線測定
取1mL培養12h的枯草芽孢桿菌菌液添加至裝有100mL牛肉膏蛋白胨的250mL錐形瓶中,在30℃、150r/min恒溫搖床中培養,定時取樣,參照沈等方法,用分光光度計測定OD600值,以培養時間和細菌吸光值繪制生長曲線[13].由于預實驗發現取樣量過大細菌液體量減少會加快細菌的生長速度,使同一時間OD600值變高,因此測定細菌生長曲線時,準備9個錐形瓶在搖床中同時培養,每次取樣3個平行,取樣10次換下一批,以此保證生長曲線的可靠性.
1.3 枯草芽孢桿菌不同生長時期濾液對銅綠微囊藻生長的影響
根據1.2節得到枯草芽孢桿菌生長曲線,設定t=2,12,34,52h代表枯草芽孢桿菌生長的延遲期、對數期、穩定期和衰亡期.分別在設定點取細菌菌液,用0.22μm濾膜過濾得到無菌濾液(經平板劃線證明無菌),取各期濾液5mL加入100mL初始生長、藻量為1.0×106cells/mL、葉綠素a含量為141.05μg/L的銅綠微囊藻液中,每天取樣,用血球計數板計算藻細胞濃度,繪制生長曲線,周期8d.第8d測各實驗組藻葉綠素含量.每個處理組設置3個平行.
1.4 枯草芽孢桿菌抑制銅綠微囊藻生長的作用方式
將細菌培養至穩定期,分別取5mL原菌液、離心菌體(10000r/min,4℃,10min離心,棄上清,無菌水沖洗2次)、5mL細菌濾液(0.22μm濾膜抽濾)、5mL高熱處理濾液(121℃高壓滅菌鍋加熱20min)加入100mL初始生長、葉綠素a含量為153.09μg/L的銅綠微囊藻液中,測第4d和第8d葉綠素a含量.每個處理組設置3個平行.
1.5 光合色素含量的測定
葉綠素a提取方法采用反復凍融-浸提法[14],取10mL藻液5000r/min、15min離心后棄上清液,將藻樣置-20℃冰箱和室溫下反復凍融3次,添加90%丙酮溶液10mL浸提20h,浸提后將藻樣4000r/min離心15min,分光光度計測上清液630,645,663,750nm處吸光值,根據以下公式[15]計算葉綠素a含量:
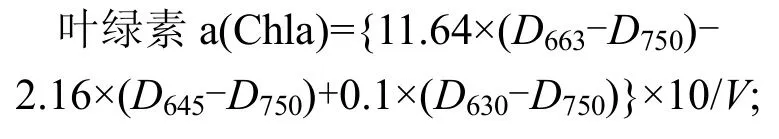
式中:V為樣品體積(L),μg/L;
類胡蘿卜素的測定參照文獻[16],由于藍藻不含葉綠素b,將公式優化計算其含量:
類胡蘿卜素(Car)=(1000D470-3.27Ca)× 10/229V;V為樣品體積(L),μg/L.
1.6 丙二醛(MDA)和超氧化物歧化酶(SOD)的測定
MDA測定采用硫代巴比妥酸法[16],待測樣品制備參照文獻[17],根據預實驗用反復凍融取代冰浴研磨破碎藻細胞,具體方法為:取一定量藻液5000r/min、4℃離心15min收集藻細胞,加少量磷酸緩沖液(pH7.8)置-20℃冰箱和室內下反復凍融3次,勻漿液8000r/min、4℃離心20min,收集上清液用作MDA含量測定.
SOD活性測定通過SOD WST-1法測定試劑盒(購買自南京建成生物工程研究所),具體參照培養細胞中SOD活性的測定方法.
1.7 分析方法
菌落計數采用平板涂布計數法.藻細胞計數使用血球計數板.
藻的去除率R定義為:R=(1-Ct/C0)×100%,其中,C0為對照組銅綠微囊藻初始濃度,×105cells/mL;Ct為處理組不同時間的藻細胞濃度,×105cells/mL.
實驗數據用平均值±標準差(x±s)表示,數據的統計分析用SPSS18.0軟件進行.對各實驗組的數據作單因素方差分析(one-way ANOVA)和Duncan’S多重比較分析.
2 結果與分析
2.1 枯草芽孢桿菌生長曲線
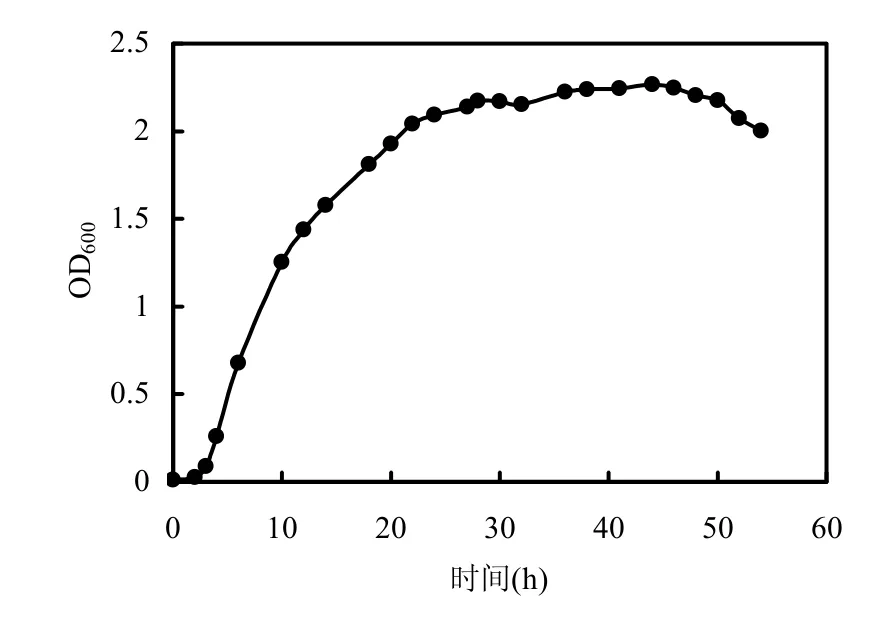
圖1 枯草芽孢桿菌生長曲線Fig.1 The growth curve of Bacillus subtilis
由圖1可知,枯草芽孢桿菌經過2h左右的延遲期后進入對數期,3~10h生長速率最快,12~22h速率變慢,大約在24h進入穩定期持續至48h,48h后開始衰亡.枯草芽孢桿菌延遲期短,生長速率快,對數期較長,用平板涂布計數法得知細菌在12,34,52h時生物量分別為7.6×108,1.0×109,7.0× 107CFU/cm3.可見,枯草芽孢桿菌能在較短時間達到較大生物量.
2.2 枯草芽孢桿菌不同生長時期濾液對銅綠微囊藻生長的影響
2.2.1 不同生長時期濾液影響下銅綠微囊藻的生長曲線 由圖2可知,枯草芽孢桿菌4個生長時期的濾液對銅綠微囊藻的生長均有較好的抑制作用,實驗第8d,4個處理組藻量分別為10.30× 105,2.30×105,1.07×105,1.00×105cells/mL,低于對照組的57.50×105cells/mL,差異極顯著(P<0.01),推測細菌從延遲期即開始分泌具有抑藻效果的胞外物質.細菌對數期、穩定期和衰亡期處理組的藻量極顯著低于延遲期處理組(P<0.01),延遲期處理組藻生長趨勢受到濾液影響,藻量變化不大;對數期和穩定期處理組中藻的生長曲線較為接近,實驗周期內藻呈現負生長狀態,藻量從1.0× 106cells/mL下降到2.30×105cells/mL和1.05× 105cells/mL,對藻有很好的抑制效果,且穩定期處理組藻量極顯著低于對數期處理組(P<0.01);衰亡期濾液在加入后的第1d,藻量有所增長,但仍顯著低于對照組(P<0.05),第2d藻量開始下降,藻呈現負生長狀態,第8d,藻量下降到1.00×105cells/mL,與穩定期處理組無顯著差異(P>0.05).衰亡期濾液對藻也有很好的抑制效果.經計算,濾液添加的第1d,延遲期和衰亡期處理組藻量分別增加14%和9.8%,對數期和穩定期處理組藻的去除率分別為2.3%和2%;第4d,4個處理組藻的去除率分別為1.7%、78.7%、69.3%、74.7%;第8d,延遲期處理組藻量增長3%,對數期、穩定期和衰亡期處理組藻的去除率分別為77%、89.5%、90%.延遲期濾液抑藻效果較差,對數期濾液在第4d抑藻效果最好,第8d則不如穩定期和衰亡期.從整體看,穩定期濾液的抑藻效果最穩定.
2.2.2 不同生長時期濾液對藻葉綠素a含量的影響 由圖3可知,受到枯草芽孢桿菌濾液的影響,銅綠微囊藻的葉綠素a含量明顯降低,且極顯著低于對照組中藻葉綠素a含量(P<0.01),說明在濾液的作用下,銅綠微囊藻的光合作用受到嚴重影響.實驗初始葉綠素a含量為141.05μg/L,第8d時,對照組葉綠素a含量為511.07μg/L,延遲期處理組為97.55μg/L,對數期處理組為87.38μg/L,穩定期處理組為69.39μg/L,衰亡期處理組為68.95μg/L.其中,延遲期處理組藻葉綠素a含量與對數期處理組差異不顯著(P>0.05),極顯著高于穩定期和衰亡期處理組(P<0.01),對數期處理組藻葉綠素a含量顯著高于穩定期和衰亡期處理組(P<0.05),穩定期和衰亡期處理組藻葉綠素a含量差異不顯著(P>0.05).

圖2 枯草芽孢桿菌不同生長時期濾液對銅綠微囊藻生長的影響Fig.2 Effects of B.subtilis filtrate in different growth periods on the growth of M.aeruginosa

圖3 枯草芽孢桿菌不同生長時期濾液對銅綠微囊藻葉綠素a含量的影響Fig.3 Effects of B.subtilis filtrate in different growth periods on the Chl a content of M.aeruginosa不同字母代表組間差異顯著P<0.05
2.3 枯草芽孢桿菌抑制銅綠微囊藻生長的作用方式
從圖4可以看出,枯草芽孢桿菌濾液、原菌液、高熱處理的濾液對藻葉綠素a含量影響極顯著,3個處理組藻的葉綠素a含量在第4d分別為91.47,135.73,90.82μg/L,第8d分別為59.78,81.73,56.60μg/L,比較實驗初始的153.09μg/L,葉綠素a含量明顯降低;而對照組在第4d和第8d分別上升至318.03μg/L和604.60μg/L.其中,高熱處理濾液和濾液處理組中藻的葉綠素a含量差異不顯著(4、8d:P>0.05),并且這兩個處理組在第4d時藻的葉綠素a含量均顯著低于原菌液處理組(P<0.05).但是實驗顯示添加枯草芽孢桿菌離心菌體時,銅綠微囊藻第4,8d的葉綠素a含量分別為361.83,959.75μg/L,均顯著高于對照組(4d:P<0.05、8d:P<0.01),結合原菌液處理組葉綠素a含量也高于濾液和高熱濾液處理組,可以說明枯草芽孢桿菌存在時,銅綠微囊藻的生長確實被促進,但具體原因不明.同時,第8d數據分析顯示,原菌液處理組與高熱處理濾液、濾液處理組的藻葉綠素a含量并無顯著差異(P>0.05),這可能是因為原菌液中含有的抑藻物質作用效果比藻受到的促進作用影響程度更大、持續時間更長.因此,本實驗說明,枯草芽孢桿菌的抑藻效果是通過分泌胞外物質實現,且該分泌物具有很強的熱穩定性.

圖4 枯草芽孢桿菌培養液不同處理方式對銅綠微囊藻葉綠素a含量的影響Fig.4 Effects of B.subtilis culture liquid with different treated methods on the Chl a content of M.aeruginosa不同字母表示同一天組間比較差異顯著P<0.05
2.4 MDA含量的測定
MDA是反映藻細胞膜脂過氧化程度的重要指標[16].圖5顯示加入枯草芽孢桿菌穩定期濾液后,銅綠微囊藻MDA含量的變化.實驗第1d,濾液組銅綠微囊藻的MDA含量比對照組提高59%(P<0.01),實驗第8d,比對照組提高918%(P<0.01),濾液組藻的MDA含量顯著升高.對照組銅綠微囊藻的MDA含量始終保持在較低水平,但第1d比第8d略高(P<0.05),這可能是因為接種于新的培養基,藻細胞在新環境中發生氧化應激反應造成MDA含量略微升高[18].該實驗結果說明枯草芽孢桿菌的胞外分泌物質對銅綠微囊藻的膜脂過氧化作用效果十分明顯且過氧化程度不斷加深.
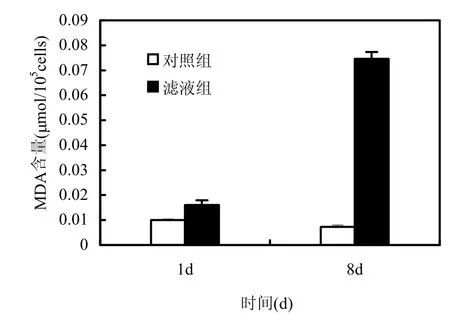
圖5 枯草芽孢桿菌濾液對銅綠微囊藻MDA含量的影響Fig.5 Effects of B.subtilis filtrate on the MDA content of M.aeruginosa
2.5 SOD活性的測定
圖6顯示加入枯草芽孢桿菌穩定期濾液后,銅綠微囊藻SOD活性的變化.SOD是藻細胞為防止過氧化損傷產生的保護性酶[18].實驗第1d,濾液組銅綠微囊藻的SOD活性顯著升高,比對照組提高159%(P<0.01),實驗第8d,其活性相比第1d明顯降低,但仍比對照組高63%(P<0.01),對照組藻的SOD活性始終保持在較低水平.該實驗結果說明,銅綠微囊藻在受到枯草芽孢桿菌的胞外分泌物質損傷時,會通過提高抗氧化酶活性來增強對活性氧的清除能力,防止藻細胞發生膜脂過氧化.但由于銅綠微囊藻受到的氧化損傷過大,SOD活性在第8d反而比第1d有所降低.
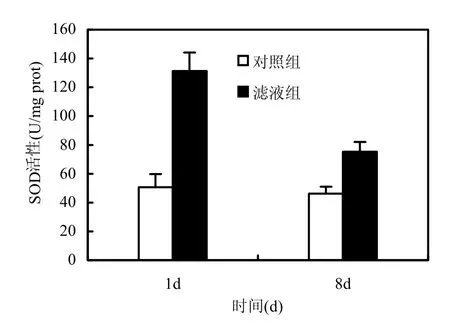
圖6 枯草芽孢桿菌濾液對銅綠微囊藻SOD活性的影響Fig.6 Effects of B.subtilis filtrate on the SOD activity of M.aeruginosa
2.6 光合色素含量的變化
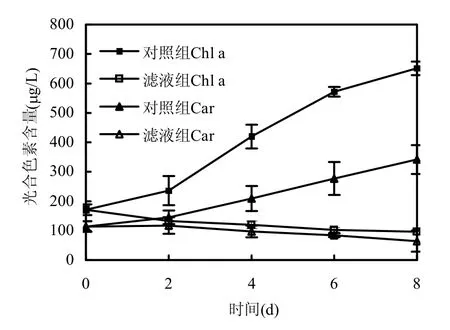
圖7 枯草芽孢桿菌濾液對銅綠微囊藻光合色素含量的影響Fig.7 Effects of B.subtilis filtrate on the photosynthetic pigments content of M.aeruginosa
圖7顯示加入枯草芽孢桿菌穩定期濾液后,藻的葉綠素a和類胡蘿卜素含量的變化情況.從圖中可以看出,濾液組中銅綠微囊藻兩種色素含量均受到嚴重影響,且影響效果隨著時間延長顯著增加,類胡蘿卜素受到的影響程度小于葉綠素a.數據顯示,濾液組中葉綠素a含量從170.69μg/L下降至96.69μg/L,對照組則上升至651.23μg/L,第4,6,8d時,其含量相比對照組分別減少71.48%、82.04%、85.15%,影響效果極顯著(P<0.01);類胡蘿卜素受到的影響較小,濾液組中其含量從114.01μg/L下降到64.12μg/L,對照組則上升至341.50μg/L,第4,6,8d時,其含量相比對照組分別減少53.56%、69.54%、81.22%,只有第8d的影響效果極顯著(P<0.01).
3 討論
3.1 枯草芽孢桿菌抑藻的作用方式
近年來,有關芽孢桿菌抑藻效果的報道越來越多,寧華等[6]在滇池中分離得到28株芽孢桿菌,發現其中6株有較好的抑藻效果,且抑藻效果都是通過分泌胞外物質實現.Nobuyuki等[19]、馬宏瑞等[8]通過實驗證明分離得到的芽孢桿菌是通過分泌胞外物質實現抑藻效果.也有報道,蠟樣芽胞桿菌是通過直接接觸的方式進攻宿主水華束絲藻[20],短小芽孢桿菌能同時通過分泌胞外物質和直接接觸藻細胞兩種方式抑制微囊藻、束絲藻和魚腥藻[7].可見不同芽孢桿菌對于不同的水華藻類有不同的作用方式,但就目前的資料來看,芽孢桿菌對于微囊藻屬的藻類主要還是通過間接方式抑藻[6].本實驗中,枯草芽孢桿菌對銅綠微囊藻的抑制效果也是通過分泌胞外物質間接實現.研究發現,枯草芽孢桿菌在生長代謝過程中,能分泌多種細菌素,而且一般是環肽[21].其中枯草菌素是研究較深的一種細菌素,具有抗酸抗熱的特性[22].據報道[23],含有10mg/L的枯草菌脂肽(產生于多種芽孢桿菌的環狀脂肽)培養基,可以在2d內去除85%的微囊藻,魚腥藻也可被去除70%.錢常娣等[24]從枯草芽孢桿菌發酵上清液提取出一種脂肽類化合物,表明其具有熱穩定性且耐受較廣的pH值范圍.此外,本實驗發現,延遲期濾液對藻生長雖然有抑制作用,但因為該時期細菌生物量較小且處于生長過渡階段,細菌代謝活動能力較弱,胞外分泌物濃度較低,所以對藻的生長影響較小;從對數期開始,細菌生物量顯著增加,代謝活動能力明顯增強,胞外分泌物濃度較高,因此對數期之后濾液對藻的生長影響較大;同時,由于細菌代謝產物的積累,所以穩定期濾液效果好于對數期;而衰亡期濾液與穩定期和對數期有所不同,這可能是因為細菌在衰亡階段,有毒物質積累,生長環境改變,細菌代謝產物的種類與之前有了較大差異.枯草芽孢桿菌在不同生長時期,代謝能力和代謝產物有所不同,造成了各時期濾液對藻生長的影響不同,因此表現出對藻去除率的差異.該結果與馬宏瑞等[8]研究結果一致.
3.2 枯草芽孢桿菌對銅綠微囊藻MDA含量、SOD活性的影響
MDA是細胞膜脂過氧化作用的產物之一,其產生數量的多少代表細胞膜脂過氧化的程度,也間接反映膜系統受氧化損傷程度[16].羅固源等[25]發現銅綠微囊藻在菌株S7無菌濾液的作用下,其MDA含量的升高和藻細胞結構的損傷具有一致性,他們發現隨著細胞膜脂過氧化程度加深,藻細胞結構發生變形并伴有膜壁分離現象.本試驗中,濾液組銅綠微囊藻MDA含量顯著升高,對照組始終保持在較低水平,說明濾液組銅綠微囊藻藻受氧化脅迫細胞膜脂過氧化作用十分明顯且過氧化程度不斷加深,這一現象與史順玉[17]研究結果相似,該研究發現加入抑藻細菌能夠引起銅綠微囊藻的活性氧積累,并激活藻細胞的抗氧化系統,如果植物細胞不能清除過量的活性氧,則會造成細胞膜脂過氧化程度加劇,進而損傷其膜功能和結構,最終導致一系列生理生化過程的改變.SOD是抗氧化系統中清除活性氧的重要酶類,普遍存在于動植物與微生物體內,能夠清除超氧陰離子自由基,防御活性氧或其他過氧化物自由基對細胞膜系統的傷害[16].本試驗中,濾液組銅綠微囊藻SOD活性先升高后降低,該結果與牛丹丹等[26]研究結果相似.已有報道[27],植物在輕度環境脅迫下,SOD活性會有所升高,以清除活性氧保護細胞膜系統;但在重度環境脅迫下,SOD活性反而會大幅度下降.這可能是因為SOD受到其歧化反應生成的H2O2和O2的濃度的影響導致活性降低[17].因此,可以推測枯草芽孢桿菌抑制銅綠微囊藻的作用過程為:一方面細菌的胞外分泌物使藻細胞產生大量活性氧,發生膜脂過氧化,藻細胞為清除活性氧表現出提升SOD活性的自我保護能力;另一方面隨著時間的延長,細菌的胞外分泌物對藻細胞傷害程度加深、作用時間長,超出了藻細胞的自我保護能力,SOD活性下降,活性氧累積,進一步加深膜脂過氧化程度,最終導致藻細胞的完整性被破壞.
3.3 枯草芽孢桿菌對銅綠微囊藻光合色素含量的影響
光合色素是藻類進行光合作用的物質基礎,其含量變化能較好的反映藻各階段生長發育情況正常與否,也間接反映出藻生物量的多少[28].葉綠素是植物進行光合作用主要色素,由于藍藻不含葉綠素b,本實驗統一用葉綠素a作為顯示藻量和藻光合作用能力的指標.而類胡蘿卜素除參與光傳遞過程外,還可以吸收剩余光能、猝滅活性氧,保護葉綠素和光合機能[29].從本實驗的結果可以看出,枯草芽孢桿菌濾液對銅綠微囊藻光合作用影響顯著,其原因可能是細菌的胞外分泌物使藻產生大量活性氧,在促使藻細胞發生膜脂過氧化的同時,也極易進攻光合色素及與之結合的類囊體膜[30].并且,大量存在的活性氧會改變光合電子傳遞鏈的氧化還原態,影響相關核基因的表達,使葉綠素定位受到干擾,導致自由狀態的葉綠素被降解,最終降低光合效率和葉綠素含量[31].這一過程中,由于類胡蘿卜素的保護機制,受到濾液的影響更不顯著.該結果與相關研究[32-33]結果類似.另一方面,由于藻細胞膜脂過氧化程度不斷加深,藻細胞的完整性被破壞,導致葉綠素被破壞.這一過程則直接表現為藻生物量的降低.本實驗發現,延遲期處理組銅綠微囊藻的葉綠素a含量從初始141.05μg/L降低至97.55μg/L,而藻量變化不大,說明在濾液的作用下,銅綠微囊藻的光合作用受到抑制,這一作用比藻細胞數量的變化更明顯.原因可能是細菌的胞外分泌物濃度還不足以完全破壞藻細胞,藻細胞葉綠素a有所降解,但保留一定的光合作用功能.相關研究[34]也有類似發現.所以,延遲期處理組藻量雖然大于對數期處理組,但葉綠素a含量的比較并無顯著差異;而對數期、穩定期和衰亡期3個處理組之間葉綠素a含量的比較和藻量的比較則具有一致性.
此外,本實驗在探討枯草芽孢桿菌抑藻的作用方式時,出現離心菌體處理組銅綠微囊藻生長受到促進的情況.實驗發現,將等量的枯草芽孢桿菌離心菌體加入BG11培養基時,其生物量從1.0×107CFU/cm3到第8d依次遞減為:5.5×106,3.0×106,1.8×106,6.2×105,4.6×105,3.2×105,1.3×105,1.1×103CFU/cm3,可以看出枯草芽孢桿菌在銅綠微囊藻適應的環境中因無法正常生長而大量死亡,但是否由于細菌死亡裂解釋放物質導致藻生長的促進,本實驗無法定論.所以,本實驗可證明枯草芽孢桿菌能通過分泌胞外物質抑制銅綠微囊藻生長,但有關細菌與藻存在的其它作用關系,還有待進一步研究.
4 結論
4.1 枯草芽孢桿菌不同生長時期濾液對銅綠微囊藻的生長均有抑制效果,其中穩定期濾液對藻的去除效果最佳;細菌濾液嚴重影響銅綠微囊藻光合作用,使其光合色素含量降低.
4.2 枯草芽孢桿菌對銅綠微囊藻的抑制效果是通過分泌胞外物質實現的,且該物質具有很強的熱穩定性.
4.3 枯草芽孢桿菌濾液添加后,銅綠微囊藻MDA含量明顯升高,說明藻受濾液影響發生膜脂過氧化;銅綠微囊藻SOD活性先升高后降低,是由于藻細胞的氧化損傷過大,SOD受到其歧化反應生成物濃度的影響,導活性降低.
[1]Steinberg C E W,Hartmann H M.Planktonic bloom-forming cyanobacteria and the eutrophication of lakes and rivers[J].Freshwater Biology,1988,20(2):279-287.
[2]趙以軍,劉永定.有害藻類及其微生物防治的基礎——藻菌關系的研究動態[J].水生生物學報,1996,20(2):173-181.
[3]汪 輝,劉兆普,魏 巍,等.一株溶藻菌的分離、鑒定及其溶藻物質的研究[J].中國環鏡科學,2008,28(5):461-465.
[4]Fu L,An X L,Li D,et al.Isolation and alga-inhibiting characterization of Vibrio sp.BS02 against Alexandrium tamarense[J].World J.Microbiol.Biotechnol.,2011,27:2949-2956.
[5]鄧建明,陶 勇,李大平,等.溶藻細菌及其分子生物學研究進展[J].應用與環境生物學報,2009,15(6):895-900.
[6]寧 華,張榮先,陳 浩,等.滇池中芽孢桿菌的ARDRA分類及溶藻特性[J].湖泊科學,2008,20(5):675-680.
[7]盧蘭蘭,李根保,沈銀武,等.溶藻細菌DC-L5的分離、鑒定及其溶藻特性[J].水生生物學報,2009,33(5):860-865.
[8]馬宏瑞,章 欣,王曉蓉,等.芽孢桿菌Z5溶銅綠微囊藻特性研究[J].中國環境科學,2011,31(5):825-833.
[9]代 陽,魏 利,王繼華,等.枯草芽孢桿菌發酵條件優化及其破乳效能[J].微生物學通報,2010,37(4):580-585.
[10]黃 曦,許蘭蘭,黃榮韶,等.枯草芽孢桿菌在抑制植物病原菌中的研究進展[J].生物技術通報,2010(1):24-29.
[11]沈斌乾,陳建明,郭建林,等.飼料中添加枯草芽孢桿菌對青魚生長、消化酶活性和魚體組成的影響[J].水生生物學報,2013,37(1):48-53.
[12]張峰峰,謝鳳行,趙玉潔,等.枯草芽孢桿菌水質凈化作用的研究[J].華北農學報,2009,24(4):218-221.
[13]沈 萍,范秀容,李廣武.微生物學實驗[M].北京:高等教育出版社,2002.
[14]林少君,賀立靜,黃沛生,等.浮游植物中葉綠素a提取方法的比較與改進[J].生態科學,2005,24(1):9-11.
[15]國家環境保護總局.水和廢水監測分析方法[M].北京:中國環境科學出版社,2006.
[16]張蜀秋.植物生理學實驗技術教程[M].北京:科學出版社,2011.
[17]史順玉.溶藻細菌對藻類的生理生態效應及作用機理研究[D].武漢:中國科學院水生生物研究所,2006.
[18]Shi Shunyu,Tang Dongshan,Liu Yongding.Effects of an algicidal bacterium Pseudomomas mendocina on the growth and antioxidant system of Aphanizomenon flos-aquae[J].Current Microbiology,2009,59(2):107-122.
[19]Nobuyuki Nakamura,Kazunori Nakano,Norio Sugiura,et al.A novel Cyanobacteriolytic Bacterium,Bacillus cereus,Isolated from a Europhic Lake[J].Bioscience and Bioengineering,2003,95(2):179-184.
[20]Shi Shunyu,Liu Yongding,Shen Yinwu,et al.Lysis of Aphanizomenon flos-aquae(Cyanobacterium)by a bacterium bacillus cereus[J].Biological Control,2006,(39):345-351.
[21]劉 雪,穆常青,蔣細良,等.枯草芽孢桿菌代謝物質的研究進展及其在植病生防中的應用[J].中國生物防治,2006,22(增刊):179-184.
[22]羅秀針.枯草芽抱桿菌FB123產生的枯草菌素的研究[D].福州,福建師范大學,2008.
[23]Ahn Chi-Yong,Joung Seung-Hyun,Jeon Jong-Woon,et al.Selective control of cyanobacteria by surfactin-containing culture broth of Bacillus subtilis C1[J].Biotechnology Letters,2003,25(14):1137-1142.
[24]錢常娣,李寶慶,趙 添,等.枯草芽孢桿菌BAB21脂肽類化合物的分離及穩定性分析[J].中國農業科技導報,2009,11(6):69-74.
[25]羅固源,劉 靜,王金霞,等.一株溶藻細菌對銅綠微囊藻的溶藻機理初探[J].生態環境學報,2010,19(11):2647-2651.
[26]牛丹丹,鄭青松,劉兆普,等.溶藻細菌YZ對銅綠微囊藻的溶藻特性研究[J].中國環境科學,2011,31(2):321-326.
[27]唐學璽,李永祺.久效磷對海洋微藻毒性機理的初步研究III.超氧化物歧化酶和過氧化物酶活性的變化[J].環境科學學報,1998,18(2):204-207.
[28]陳柳芳.三種喹諾酮類抗生素對斜生柵藻的毒性效應[D].長春:東北師范大學,2010.
[29]劉碧云,周培疆,吳振斌,等.焦酚對藍藻和綠藻生長、光合色素及微量元素的作用[J].武漢大學學報,2008,54(6):719-724.
[30]劉碧云,周培疆,李佳潔,等.丙體六六六對斜生柵藻生長及光合色素和膜脂過氧化影響的研究[J].農業環境科學學報.2006,25(1):204-207.
[31]Koussevitzky S,Nott A,Mockler T C,et al.Signals from chloroplasts converge to regulate nuclear gene expression[J].Science Signalling,2007,316(5825):715-719.
[32]楊彎彎,武氏秋賢,吳亦瀟,等.恩諾沙星和硫氰酸紅霉素對銅綠微囊藻的毒性研究[J].中國環境科學,2013,33(10):1829-1834.
[33]陳 群.溶藻細菌L7對銅綠微囊藻的溶藻效應及機理[D].廣州:華南理工大學,2010.
[34]趙 玲,陳淼銀,尹平河,等.細菌B1胞外活性物質對球形棕囊藻的溶藻機制初探[J].環境科學學報,2013,33(5):1286-1291.
Inhibition of Microcystis aeruginosa by Bacillus subtilis.
ZHANG Rui1,2,WANG Guang-jun1*,LI Zhi-fei1,YU Er-meng1,XIA Yun1(1.Key Laboratory of Tropical and Subtropical Fishery Resource Application and Cultivation,Ministry of Agriculture,Pearl River Fishery Research Institute,Chinese Academy of Fishery Sciences,Guangzhou 510380,China;2.College of Fisheries and Life Science,Shanghai Ocean University,Shanghai 201306,China).China Environmental Science,2015,35(6):1814~1821
To investigate the inhibition of Bacillus subtilis against Microcystis aeruginosa,the bacterium-free filtrate of B.subtilis culture from different growth periods(delayed,log,stable and decline phase)were used to study its inhibition and mode of action against M.aeruginosa.The MDA,SOD activity and the photosynthetic pigments content in M.aeruginosa were measured.The results showed that the inhibition of M.aeruginosa by the B.subtilis filtrate was greater in log phase,stable phase and decline phase than that in delayed phase with removing efficiency of 81.19%,91.41%and 91.82%,respectively on day 8.The chlorophyll a contents of M.aeruginosa in treated groups were significantly lower than that in the control group.The MDA contents increased obviously in treated group and the SOD activity increased first and then decreased when M.aeruginosa was cultured in the filtrate-containing medium.Carotenoids were not affected as much as chlorophyll a.Results showed that B.subtilis inhibited the growth of the algae by secreting extracellular substances.And these substances were highly thermal-stable.It was speculate that the substances can hinder the photosynthesis by destroying the photosynthetic pigments and increase the membrane lipid peroxidation by inhibiting the SOD activity at the same time,resulting in inhibition of M.aeruginosa.
Bacillus subtilis;Microcystis aeruginosa;inhibition;chlorophyll a;MDA
S946.3,X17
A
1000-6923(2015)06-1814-08
張 睿(1991-),男,福建清流人,上海海洋大學碩士研究生,主要從事水產動物健康養殖研究.
2014-10-20
“十二五”農村領域國家科技計劃課題(2012BAD25B01)
* 責任作者,副研究員,wgj5810@163.com

