反式(α)-細辛腦的制備技術與應用
張 寧鄧志堅王琳琳何 群陳小鵬謝清若
(1.廣西科技大學,廣西 柳州 545006;2.廣西億康藥業股份有限公司,廣西 柳州 545006;3.廣西大學,廣西 南寧 530004)
反式(α)-細辛腦的制備技術與應用
張 寧1鄧志堅2王琳琳3何 群2陳小鵬3謝清若1
(1.廣西科技大學,廣西 柳州 545006;2.廣西億康藥業股份有限公司,廣西 柳州 545006;3.廣西大學,廣西 南寧 530004)
反式(α)-細辛腦具有平喘、止咳、祛痰、鎮靜、解痙、抗驚厥及抗癌的藥理活性,醫學臨床應用廣泛。反式(α)-細辛腦在天然植物中含量低導致提取純品困難,化學合成法是有效的制備途徑。主要的合成路線有:以1,2,4-三甲氧基苯為原料經酰化、還原及脫水反應得到;以細辛醛為原料經還原和脫水反應制備;以氫醌為原料經氧化、三乙酰化、甲基化、甲酰化和脫水反應后即可得到反式(α)-細辛腦;以 erythro-2-甲基-3羥基-3苯丙酸為原料經立體選擇合成直接得到目的產物。反式(α)-細辛腦的分離純化主要有柱層層析的物理方法和催化異構的化學方法。
反式(α)-細辛腦;化學合成;分離;純化
反式(α)-細辛腦又名 α-細辛腦、α-細辛醚,英文名α-asarone、asarin、asarum camphor,化學名為反式-2,4,5-三甲氧基-1-丙烯苯,分子式 C12H16O3,分子量 208.25,是一種白色或類白色結晶或結晶性粉末,能溶于乙醇、乙醚、冰乙酸、四氯化碳等,幾乎不溶于水。其順式異構體為 β-細辛腦,兩者的結構式如圖1所示。
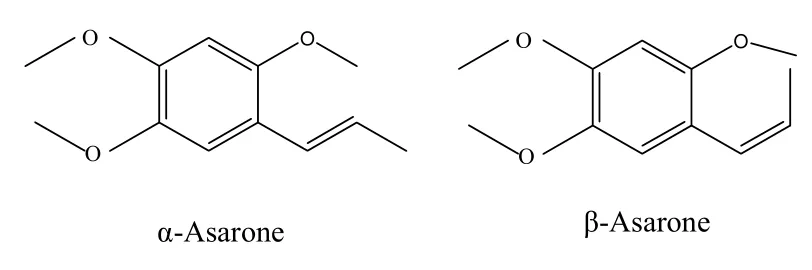
圖1 α-細辛腦與β-細辛腦的結構式
反式(α)-細辛腦有抗心肌缺血、止咳去痰、抗驚厥、抗潰瘍、抗癌、抗血小板、抗癲癇等多種藥理活性,并具有祛風散寒,通竅止痛,溫肺化飲的功效還可以抗菌、抗病毒;臨床上已經廣泛用于治療上呼吸道感染、支氣管炎、支氣管哮喘、急性及慢性膽囊炎、膽石癥、癲癇大發作等病癥,尤其是對于肺炎、支氣管哮喘和慢性阻塞性肺病的急性發作的治療具有顯著效果;同時其也是常用的醫藥中間體,而反式(α)-細辛腦的異構體β-細辛腦則已被證實具有致畸毒性。反式-細辛腦雖然可以從石菖蒲、水菖蒲、馬兜鈴科等植物的揮發油及胡椒種的葉中提取,但中藥資源有限且其在天然植物揮發油和葉中的含量很低、成份復雜導致提取純品困難,同時極易混入黃梓醚等致癌物[1],因此采用人工合成方法制備反式(α)-細辛腦才能滿足醫藥用途的大量需求。
1 反式(α)-細辛腦合成技術
1.11,2,4-三甲氧基苯氧化-還原合成法
以1,2,4-三甲氧基苯為原料,采用不同溶劑和催化劑制備反式(α)-細辛腦,主要四種合成路線如下。
(1)以1,2,4-三甲氧基苯為原料溶解于其6倍體積的二氯甲烷中,加入催化劑無水三氯化鋁、無水氯化鋅或碘為催化劑升溫至回流反應4 h,經甲醇重結晶得到1,2,4-三甲氧基苯甲醛,或者以二甲基甲酰胺為溶劑與三氯氧磷反應6 h得到1,2,4-三甲氧基苯甲醛,再與格氏試劑乙基溴化鎂或乙基溴化碘反應,最后反應產物溶解到苯或無水甲苯中脫水制備反式(α)-細辛腦[2-4],具體的合成路線如圖2-2a和2b所示。
(2)以1,2,4-三甲氧基苯為原料直接經Vilsmeier反應,反應產物與丙酸酐混合,攪拌溶解加熱升溫至回流3h左右減壓蒸餾,蒸餾產物重結晶后可制備產物反式(α)-細辛腦[5], 具體的合成路線如圖2-2c所示。
(3)以 1,2,4-三甲氧基苯為原料在無水氯化鋁的催化作用下與丙酰氯反應生成1,2,4-三甲氧基苯丙酮,將其溶解于甲醇中加入催化劑硼氫化鈉或氫化鋁鋰升溫至 40℃,反應 2 h后洗滌干燥得到1,2,4-三甲氧基-1-苯丙醇,再經丙酸酐脫水制得目的產物反式(α)-細辛腦,具體的合成路線如圖2-2d所示。
(4)以 1,2,4-三甲氧基苯為原料與二甲基甲酰胺甲酰化制備1,2,4-三甲氧基-1-苯甲醛,產物在丙酸酐作用下得到丁烯酸,再經脫羧制備反式(α)-細辛腦或1,2,4-三甲氧基-1-苯甲醛在格氏試劑作用下還原為1,2,4-三甲氧基-1-苯甲醇,經硫酸銅脫水制備反式(α)-細辛腦。具體的合成路線如圖2-2e所示。

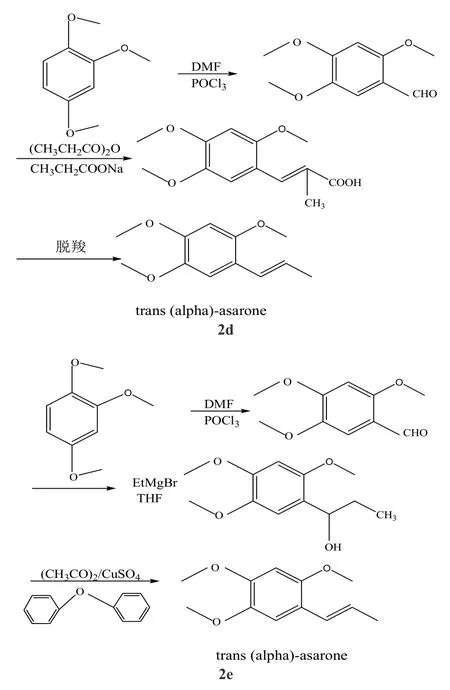
圖2 1,2,4-三甲氧基苯為原料制備反式(α)-細辛腦的反應
其中圖2-2a中產物的收率高且不需要分離直接可得目標產物,但是在第一步反應中使用了有毒害的溶劑丙酰氯;圖2-2b的合成線路第一步生成三甲氧基苯甲醛的過程中副反應較多而且還使用苯和甲苯等有毒有害溶劑,第二步還原過程中格氏試劑的使用導致整個生產過程中不能有水存在,加大了操作難度且脫水步驟控制不當會生成順反異構體兩種產物,為除去有毒的順式細辛腦必須增加分離順反異構體的工序,這不僅影響了順式細辛腦的產品質量還增加其生產成本;圖2-2c中反應簡單但不宜放大生產,操作過程中需要高溫蒸餾且產率不高;圖2d反應步驟簡單,產物純度高,成本昂貴,產物分離困難,收率有待進一步提高;圖2-2e反應時間短,副反應少,產品的純度及收率高,但成本較高,但反應溫度高,且脫水過程中所用的溶劑二苯醚價格昂貴,整個制備過程成本較高。
1.2細辛醛脫水-異構合成法
細辛醛,又名2,4,5-三甲氧基苯甲醛,以細辛醛為起點制備反式(α)-細辛腦,第一步原料與格氏試劑乙基溴化碘或乙基溴化鎂反應,反應產物經無水硫酸銅催化脫水后得到順式與反式細辛腦兩種同分異構體;或者原料直接經Witting反應制備順式與反式細辛腦的混合物[6-8],最后兩種同分異構體的混合物經分離純化可得到反式(α)-細辛腦,具體合成路線如圖3所示。
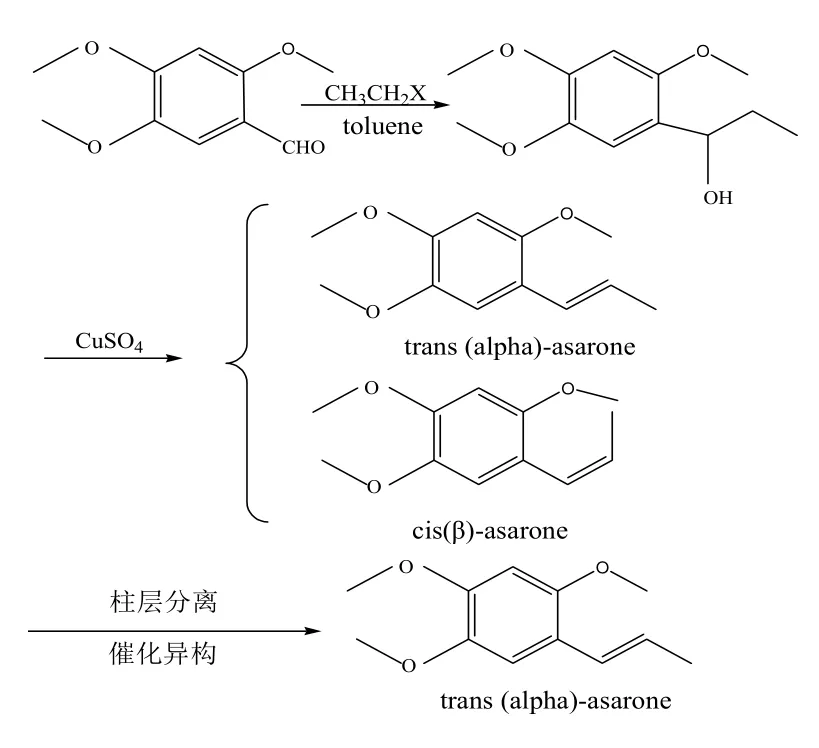
圖3 細辛醛為原料制備反式(α)-細辛腦的反應
圖3合成路線較簡單,可方便地制得順式與反式-細辛腦,反應經2.5 h后收率達到80.2%,但制備過程中使用了高毒性的有機溶劑甲苯,且最終產物為順式與反式兩種同分異構體,故仍需對其進行分離純化才能獲得反式(α)-細辛腦,同時格氏試劑的使用同樣要求無水存在,不便于工業化。
1.3氫醌氧化-酰化-脫水合成法
氫醌,又名對苯二酚,以氫醌為原料經氯酸鈉氧化、乙酸酐三乙酰化、硫酸二甲酯甲基化、Vilsmeier甲酰化和丙酸鈉脫水反應可制備得到反式(α)-細辛腦[9-11],具體合成路線如圖4所示。
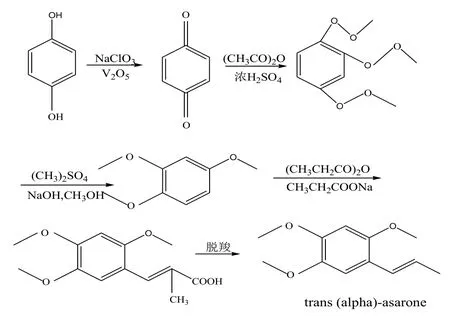
圖4 氫醌為原料制備反式(α)-細辛腦的反應
圖 4的合成路線中各反應條件相對溫和容易控制,收率高,副反應少,立體選擇高,反應過程沒有使用有毒有害溶劑,成本相對便宜,但其工藝流程太長,工序繁瑣。
1.4erythro-2-甲基-3羥基-3苯丙酸合成法
以erythro-2-甲基-3羥基-3苯丙酸為原料經立體選擇合成直接得到目的產物或經脫水和脫羧反應得到反式(α)-細辛腦[12-13],具體合成路線如圖5所示。
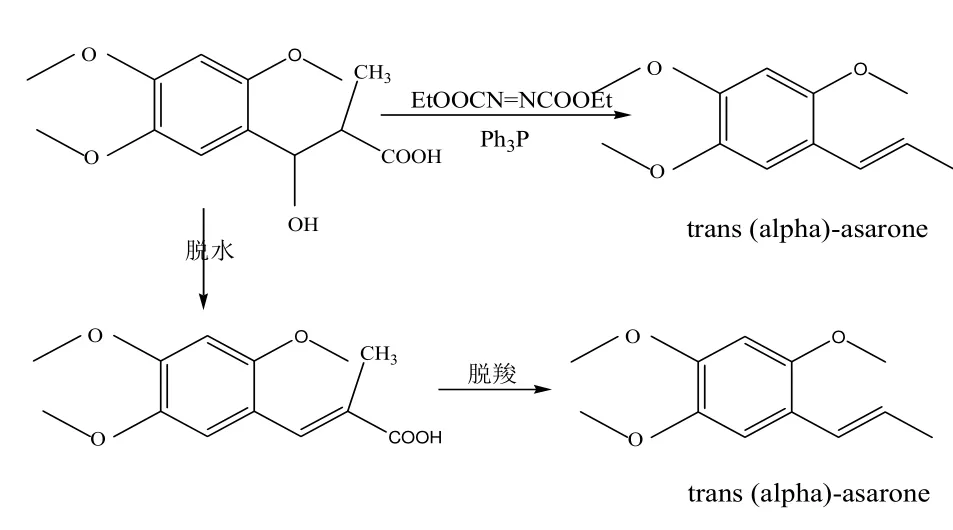
圖5 erythro-2-甲基-3羥基-3苯丙酸為原料制備反式(α)-細辛腦的反應
圖 5的合成路線較其他路線簡單,但所需的原料價格昂貴,中間體的制備不僅困難、不穩定還存在一定的爆炸性,操作過程不易控制且由脫水脫羧步驟制備的產物中混有順式異構體,然后須經過柱層層析分離得到反式(α)-細辛腦,柱層層析方法不適合工業化生產,影響反式(α)-細辛腦的收率,無形中增加了生產成本。
2 反式(α)-細辛腦的分離純化
上述的合成路線中得到的很多產物都是順式和反式細辛腦的同分異構體混合物,需要經過分離純化過程才能制備得到反式結構無毒的反式(α)-細辛腦,因此反式(α)-細辛腦分離純化對工業制備過程有重要的意義。目前,有關反式(α)-細辛腦的分離純化方法主要有物理法和化學法兩類。
2.1物理方法
由于順式-細辛腦與反式(α)-細辛腦的化學結構很相似,導致它們具有相近的分子間力及物性,從而采用常規的物理方法難以分離出純粹的大量的反式(α)-細辛腦。目前一般采用柱層層析方法可純化得到少量的反式(α)-細辛腦,其操作過程為:將兩種同分異構體的混合物20 g經硅膠色譜層析(100~200目),粗硅膠的量為待分離原料量的2倍,再用石油醚-乙酸乙酯混合液(50:50)梯度洗脫,洗脫下來的各流份再經硅膠柱(200~300目)反復層析及反復Sephadex LH-20色譜純化可得目標產物反式(α)-細辛腦。采用柱層色譜分離操作步驟繁瑣,處理量有限,不適合工業化生產,而且分離得到的順式細辛腦被丟棄[14],造成資源的浪費。
2.2化學方法
化學方法是將兩種同分異構體中的順式細辛腦通過催化異構化使其轉化為反式(α)-細辛腦,具體操作步驟為將α/β-細辛腦混合物溶于溶劑中,其次加入一定量的催化劑,加熱回流狀態下反應3~4h便可將順式細辛腦轉化為反式(α)-細辛腦。常用的溶劑有苯、二氯甲苯或乙酸乙酯,主要用到的催化劑有 Pd化合物催化劑如 PdCl2(CH3CO)2、PdCl2(CH3CN)2、PdCl2(PhCN)2和 PdCl2(PPh3)4、K(OH)催化劑及碘催化劑。
化學法分離所用的溶劑為苯和二氯甲苯是高毒性的有機溶劑,其中苯還是一種致癌物質,溶劑乙酸乙酯也具有一定的毒性。操作過程中溶劑不可避免地會殘留于產品中,影響了作為藥品使用的反式(α)-細辛腦的安全,同時對環境也帶來一定的危害。催化異構化中Pd催化劑的價格昂貴成本高,且產物中殘留的重金屬 Pd離子去除困難影響用藥的安全性。K(OH)催化劑的使用消耗量大,不僅浪費試劑,污染環境而且需要高溫下操作,產物中脫甲基副產物的生成造成二次分離困難[14]。碘催化劑用量小,操作簡單,分離徹底且沒有副產物的生成,但是碘催化劑易揮發、升華不易回收,因此研發合適的催化劑和無毒的綠色溶劑是化學分離的關鍵。
3 反式(α)-細辛腦的應用
反式(α)-細辛腦最初發現來源于菖蒲等中藥植物資源,具有很好的藥理和生物活性,已被開發應用于醫學臨床。在藥理活性方面,1993年Chamorro等[15]研究了反式(α)-細辛腦的藥理學和毒理學,結果表明其可以用來治療高膽固醇血癥;1997年Gardufio 等[16]用小鼠研究了細辛腦的降血脂活性,取得了不錯的效果;2005年Cassani-Galindo 等[17]對反式(α)-細辛腦的體外毒性進行了研究,發現其具有降血脂的功效。2010年Pages等[18]用動物模型研究了反式(α)-細辛腦的抗氧化及抗癲癇活性。
在醫學臨床應用方面,1986年楊玉[19]研究了反式(α)-細辛腦片治療慢性阻塞性肺部疾病,結果證明對咳嗽、喘息、哮鳴都有很好的效果,且對心、肝及腎臟也沒有危害。1993年楊正鴻等[20]首次報道了合成反式 α-細辛腦的人體各項藥物動力學參數,為人體用藥研究打下了堅實基礎。2003年梁愛武等[21]研究了反式(α)-細辛腦注射液配合西藥用于治療肺源性心臟病呼吸衰竭,發現有較好的療效。2005年李國慶等[22]觀察了細辛腦輔助治療新生兒肺炎的療效,得到的結果很令人滿意,且未見明顯毒副作用,值得推廣使用。2005年劉向東[23]探討了反式細辛腦吸入治療小兒哮喘的療效及安全性,結果表明很安全。2006年郝冬榮等[24]在治療嬰兒毛細管支氣管炎的過程中添加了部分細辛腦,結果表明加入后的治療效果更好。2009年韓琳等[25]的研究中將細辛腦用于癲癇病的治療,發現其具有較強的抗驚厥、 抗癲癇作用; 2013年Chen等[26]將其用于治療癲癇病,發現其在抗癲癇方面顯示出了很好的活性。2013年Ma等[27]探究了反式(α)-細辛腦注射劑-脂肪乳劑在臨床中的應用,結果表明其有很大的應用潛力。2014年Lu等[28]比較了反式(α)-細辛腦通過口服、靜脈注射和鼻腔三種不同的給藥方式注入小鼠體內后的分布情況。2014年甘海強[29]將其用于治療小兒呼吸道感染,結果表明治療過程中細辛腦的加入能迅速緩解癥狀,提高療效。
4 結語
由于天然植物中反式(α)-細辛腦的含量較低,因此通過化學合成方法是獲得高純度反式(α)-細辛腦的主要途徑。已有的合成路線中還存在一些弊端,比如原料價格昂貴、合成線路長、產物分離困難及有毒有害有機溶劑的使用等,這些都給反式(α)-細辛腦的工業化制備和實際應用帶來了一定的困難,因此對其制備的化學合成路線進行改進,用綠色溶劑替代有毒有害溶劑,縮短反應過程,尋找新的分離方法等解決反式(α)-細辛腦由于天然植物提取量少及過度開發使用的問題。同時深入研究其合成過程化學反應的熱力學及動力學可為其工業化生產提供理論依據;在臨床應用方面嘗試不同的劑型提高其生物利用度,為其進一步的開發應用開辟新的路徑。
[1] 周伊. 1. α-細辛腦的合成 2. 去氫駱駝蓬堿衍生物的合成及活性研究[D].長沙:湖南師范大學,2000.
[2] Díaz F,Muňoz H,Labarrios F,et al.Synthesis and hypolipidemic activity of some α-asarone analogs[J].Med Chem Res, 1993, 3(2):101-109.
[3] 王植材,蔣臘生,許杏祥. Z-和 E-細辛醚的合成[J].有機化學,1990, (10): 350-352.
[4] 張玲,劉素云.α-細辛腦的制備[J].中國醫藥工業雜志, 2007,38(7):477-478.
[5] 劉博純.α-細辛腦原料生產工藝:中國,CN1511817A[P]. 2004-07-14.
[6] 喻愛和,馮勛波,陳超越,等.合成α-細辛腦的脫水劑選擇[J].合成化學,2006,14(5):500-502.
[7] Cao R, Chen H, Peng W, et al. Design, synthesis and invitro and in Vivo antltumor activities of novel and carboline derivatives. Eur. J. Med.Chem,2005,40(10):991-1001.
[8] 陳毅平. 合成α-細辛腦的新方法:中國,CN101195562A[P].2007-12-11.
[9] 陳毅平,曾健. 1,2,4-三甲氧基苯的合成[J].廣西中醫學院學報, 1999, (2): 39-40.
[10] 陳雙英.合成 α-細辛腦的工藝研究[D].南寧:廣西中醫學院,2009.
[11] 蘭燁榮,劉素香,張鐵軍,等.細辛醚的研究進展[J].現代藥物與臨床, 2013, 28(2):252-257.
[12] Mulzer J, Lamrner O, olefins from β-hydroxycarboxylic acids-synthesis of isomerically pure α- and β-asarone. Angew. Chem. Int. Ed.1983,(22):628-629.
[13] 蔣勇軍,徐廣宇,周伊,等.一種 α-細辛腦的制備方法:中國,CN 101012159A[P].2006-03-15.
[14] 張為.一種合成 α-細辛腦的方法:中國,CN101215226A[P]. 2008-07-09.
[15] Chamorro G, Salazar M, Salazar S, et al. Pharmacology and toxicology of Guatteria gaumeri and alpha-asarone[J]. Revista de investigation clinica. 1993,45(6):597-604.
[16] Gardufio L, Salazar M, Salazar S, et al. Hypolipidaemic activity of α-asarone in mice [J].Journal of Ethnopharmacology, 1997,(55):161-163.
[17] Cassani-Galindo M, Madrigal-Bujaidar E, Chamorro G, et al. In vitro genotoxic evaluation of three a-asarone analogues [J].Toxicology in Vitro,2005,(19):547-552.
[18] Pages L,Maurois B, Delplanque B,et al.Activities of αasarone in various animal seizure models and in biochemical assays might be essentially accounted for by antioxidant properties[J].Neuroscience Research,2010,68(4): 337-344.
[19] 楊玉.α-細辛腦片治療18例慢性阻塞性肺部疾病[J].新藥與臨床,1986,5(4):210-212.
[20] 楊正鴻,吳闖,宋次嬌.α-細辛腦在人體中的藥物動力學[J].中國醫院藥學雜志,1993,13(1):7-8.
[21] 梁愛武,黃春萍,范悅.α-細辛腦合燈盞細辛注射液治療肺源性心臟病呼吸衰竭療效觀察[J].中國中西醫結合急救雜志. 2003,10(2):111-113.
[22] 李國慶,魏洪偉,薛慧敏.α-細辛腦注射液霧化吸入鋪助治療新生兒肺炎 45例臨床觀察[J].中國醫藥指南,2005,(3): 1-2.
[23] 劉向東.α-細辛腦吸入治療小兒哮喘效果觀察[J].齊魯醫學雜志,2005,20(2):148-149.
[24] 郝冬榮,武國霞.α-細辛腦治療嬰兒毛細支氣管炎 43例療效觀察[J].中國綜合臨床,2006, 22(8):758-759.
[25] 韓琳,湯道權.α-細辛腦的抗驚厥抗癲癇作用研究[J].井岡山醫專學報,2009,16(6):9-10,15.
[26] Chen H C, Li W G, Zhang X B, et al, Alpha-asarone from Acorus gramineus alleviates epilepsy by modulating AType GABA receptors[J].Neuropharmacology,2013,(65):1-11.
[27] Ma W C,Zhang Q,Li H,et al. Development of intravenous lipid emulsion of α-sarone with significantly improved safety and enhanced efficacy[J].International Journal of Pharmaceutics.,2013,(450):21-30.
[28] Lu J, Fu T M, Qian Y Y, et al. Distribution of α-asarone in brain following three different routes of administration in rats[J].European Journal of Pharmaceutical Sciences, 2014, (63):63-70.
[29] 甘海強.α-細辛腦佐治小兒下呼吸道感染的療效觀察[J].白求恩醫學雜志,2014,12(5):84-485.
The preparation and application of trans-asarone
Trans (alpha)-asarone has the pharmacological activity of cough, removing phlegm and preventing asthma, sedative, anticonvulsant and anti-cancer, and the clinical application of which is extensively. There are many difficulties in the extraction of α-asarone due to the low content in the natural plant, thus, the method of chemical synthesis is an effective way of preparing α-asarone. The main synthesis methods are: the α-asarone is obtained by acylation, reduction and dehydration reaction with 1,2,4- trimethoxy benzene as the raw material; the α-asarone is obtained by reduction and dehydration reaction, taking asarum aldehyde as raw material; the α-asarone is obtained by oxidation, three acetylation methyl, formylation and dehydration reaction, using hydroquinone as raw materials; the α-asarone is obtained with erythro-2- methyl -3 hydroxy -3 phenyl propionic acid as raw materials by stereoselective synthesis. The seperation of α-asarone includes physical separation method of layer chromatography column and the chemical separation method of catalytic isomerization.
α-asarone; chemical synthesis; separation; application
R625.1
A
1008-1151(2015)07-0033-04
2015-06-10
廣西科學研究與技術開發計劃項目(桂科能1298025-19)。
張寧(1989-),女,廣西科技大學生物與化學工程學院碩士研究生,從事化學反應工程研究。
謝清若,男,廣西平南人,廣西科技大學生物與化學工程學院碩士研究生導師。

