天然來源的寡聚脫氧核苷酸活性產物研究進展
郭妍,惠長野,熊偉,謝英,楊新躍
·綜述·
天然來源的寡聚脫氧核苷酸活性產物研究進展
郭妍,惠長野,熊偉,謝英,楊新躍
單鏈寡聚脫氧核苷酸(oligodeoxynucleotide,ODN)的生物學活性被證實與序列和空間構象特征有關,使得ODN類藥物的開發成為近年來的研究熱點[1]。短鏈ODN庫如果由n個脫氧核苷酸(deoxynucleotide,nt)組成,理論上庫容量為4n,30 nt的ODN庫容量就高達1018。豐富的序列及空間構象是ODN活性的基礎,高等真核生物和原核生物來源的ODN表現了不同的生物學活性。
在天然來源的高等真核生物ODN方面,歐洲的研究重點是傳統生化方法制備的ODN活性產物,其中最成功的就是意大利Gentium SpA公司開發的去纖苷(defibrotide,DF),豬源的主成分為45~90 nt的ODN混合物[2]。目前,DF臨床試驗主要圍繞肝小靜脈閉塞癥(hepatic venular occlusive disease,VOD)的預防和治療、多發性骨髓瘤的治療、腫瘤的輔助治療開展[2-4]。不同于脊椎動物,原核生物基因組富含CpG基序,基于此差異設計合成的CpG ODN在感染性、過敏性、免疫缺陷性疾病及腫瘤的免疫治療中表現了良好的應用前景[5]。下面對高等真核生物及原核生物基因組特點及兩種來源的ODN活性產物研究現狀分述如下。
1 高等真核生物及原核生物基因組特點
微生物在漫長的進化過程中,通過改變相關蛋白及脂類的表達來逃避宿主的免疫識別[6]。然而相對其他菌體成分來說,細菌基因組DNA是所有菌體中較保守的組成。細菌DNA有著與脊椎動物DNA明顯不同的結構特征,其中CpG二核苷酸出現頻率高,胞嘧啶呈未甲基化狀態;而脊椎動物DNA中CpG二核苷酸出現頻率低,并且60%~90%胞嘧啶第5碳原子甲基化[7]。這種差別使得細菌基因組在進化過程中成為病原體相關分子模式(pathogen associated molecular patterns,PAMPs),從而能夠被脊椎動物所識別,并產生相應的免疫應答。
對GenBank中收錄的已完成全基因組測序的高等真核及原核生物基因組CpG基序含量進行分析(表1),哺乳動物的CpG含量在2%~2.5%,鮭魚CpG含量也只有3.83%;相對于高等真核生物,原核生物CpG含量非常高,腸道益生菌嗜酸乳桿菌的CpG含量高達6.68%,致病菌結核分枝桿菌CpG含量甚至高達25.33%。圖1所示為各代表物種基因組序列中CpG基序(黑色突出顯示)局部分布情況。正是高等真核生物及原核生物基因組DNA這一明顯不同的結構特征,使得兩種天然來源的ODN具有顯著不同的生物學活性。
2 高等真核生物來源ODN——去纖苷
DF的化學本質是鏈長分布集中在45~90 nt(15~30 kD)的豬源ODN混合物,嘌呤嘧啶比大于0.85。DF可以通過靜脈注射及口服兩種方式給藥,鑒于消化道DNase水解、吸收效率及肝臟首過效應等因素,DF口服生物利用度不足70%[8]。注射給藥DF的半衰期為10~30 min,而口服給藥DF的清除需要數小時,DF及其代謝產物主要通過尿液及糞便排出體外[9]。

表1 高等真核生物與原核生物CpG基序含量分析

圖1 真核生物與原核生物基因組中CpG分布局部截圖
生物學活性多樣性是DF最突出的特點,大量研究證實DF具有促纖溶、抗炎、抗心肌缺血、抗動脈粥樣硬化及抗腫瘤的活性[2,9-10]。DF一系列生物學活性主要是針對微血管產生的[11]。促纖溶和抗凝活性被認為是通過提高血管內皮組織纖溶酶原激活劑(tissue plasminogen activator,tPA)的表達,同時降低抑制因子(plasminogen activator inhibitor-1,PAI-1)和組織因子(tissue factor,TF)分泌來產生的[12]。體外實驗證實DF是纖溶酶的激動劑,并可以增強肝素的抗凝活性[13]。大量的臨床研究是針對DF可以選擇性抗凝,并降低出血風險的特性展開的[10,14-15]。DF用于VOD治療的臨床實驗已經開展了I~III期,預防VOD進行了II~III期臨床試驗[3,9]。腫瘤組織周圍多發新生血管,DF具有抗血管新生的作用,且這一活性的發揮并不依賴于表皮生長因子受體[16-17]。體外實驗證實DF可以提高腫瘤細胞的化療敏感性,這些都表明DF在抗腫瘤治療方面有廣闊的開拓前景[18]。目前,DF用于多發性骨髓瘤的治療已經進入了II期臨床試驗階段。
2.1 去纖苷生物學活性基礎
已有的研究雖然揭示了DF多樣的生物學活性,但對DF活性序列特征、堿基組成、鏈長、作用受體等分子機制的了解并沒有深入。DF的ODN主成分鏈長集中在45~90 nt,圖2A為DF 5%~20%尿素變性PAGE膠銀染分析結果,DF電泳條帶呈拖尾狀,鑒于銀染的高靈敏度,可以看出DF鏈長實際分布范圍很廣;2%瓊脂糖電泳表明DF主要為小分子ODN(圖2B);DF凝膠過濾HPLC圖譜呈前沿峰(圖2C)。HPLC是DF分子量最常用的分析手段[19]。DF作為難于質控的多組分生化藥,除分子量分布外,其他可參考的理化參數如下:①DF所包含隨機序列分子式為P1-5(dAp)12-24(dGp)10-20(dTp)13-26(dCp)10-20,這就限定了DF類似物制備的原料來源,要求原料DNA至少具有和豬源DNA相近的GC含量;②酸水解制備DF過程中,會有脫嘌呤現象發生,脫嘌呤過高會嚴重影響DF生物學活性,因而限定DF的嘌呤嘧啶比要大于0.85,這對DF類似物的制備方法提出了挑戰。
凝膠過濾層析對DF進行分子量分級,體外促纖溶活性與DF分級組分的平均分子量呈正相關,20 nt以下組分則完全喪失促纖溶活性[13]。然而,DF分子量分級得到的12~30 nt(4~10 kD)的ODN卻表現了良好的局部抗缺血活性,并在免疫抑制治療過程中起到內皮細胞保護功能[20]。DF生物學活性一方面和其多聚陰離子的特性有關;另一方面,DF作為ODN混合物,其分子內存在堿基的互補配對,這些構成了DF序列多樣性和空間構象多樣性的基礎,推測與其多種生物學活性直接相關。DF類似于豬源的ODN文庫,很多學者嘗試用SELEX的技術篩選DF,用核酸適配體理論去證明或解釋DF的各種生物學活性,但結果不令人滿意。DF活性的多樣性取決于ODN混合物序列、長度及構象的多樣性,這一理論被大多數學者認同[4,14]。
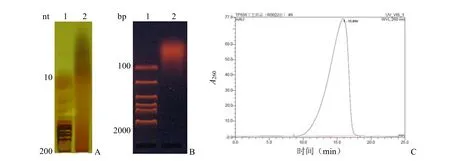
圖2 DF分子量分布分析(A:5%~20%梯度變性PAGE電泳;B:2%瓊脂糖凝膠電泳;C:凝膠過濾HPLC)
2.2 高等真核生物來源的ODN
Gentium SpA公司建立了哺乳動物來源DNA化學可控降解方法,并成功用于DF的制備[21]。近年來的研究表明DF生物學活性的發揮與ODN混合物序列、長度及構象特征等有關。高等真核生物基因組DNAGC含量、序列特征相近(表1),哺乳動物來源如豬源、牛源基因組DNA是DF及其類似物的理想制備原料來源[22-23]。鮭魚精DNA資源豐富,價格低廉,是功能性食品及核酸藥品生產的最主要原料來源,且GC含量與哺乳動物接近,是哺乳動物DNA的理想替代品。利用鮭魚精來源DNA,我們建立了高溫酸性條件下水解的方法,制備的鏈長集中在45~90 nt的ODN,在體內、體外均表現出了促纖溶的活性,有望成為新型的抗凝劑[19]。
3 原核生物來源ODN——CpG ODN
早在19世紀后期,學者發現腫瘤患者注射少量的天然細菌制品可以明顯減輕其癥狀,就是因為細菌DNA介導了這種抗腫瘤作用[24]。后續的研究證實,含有未甲基化CpG基序的寡核苷酸片段(CpG containing oligodeoxynucleotide,CpG ODN)是細菌DNA的最小作用單位,能夠完全模擬細菌DNA發揮免疫刺激作用[25]。胞嘧啶甲基化可導致活性減半,而核心基序C與G順序顛倒則活性完全喪失[26]。
3.1 CpG ODN來源
早期的研究均采用熱變性的單鏈大分子細菌基因組DNA,由淋巴細胞加工生成CpG ODN[7,25,27-29]。但細菌基因組DNA分子量大,一方面細胞攝取率低;另一方面難于純化去除菌體蛋白、內毒素等雜質,臨床試驗安全性低,因而僅局限于實驗室研究[25,28]。超螺旋質粒DNA可實現規模發酵、制備,內毒素、菌體蛋白等雜質易去除,可達到注射用藥標準[30],富含CpG基序的重組質粒在獸醫臨床中得到應用[31-32]。模擬淋巴細胞降解并遞呈CpG ODN的過程,研究者通過人工合成的方法制備出CpG ODN,其表現出了與細菌DNA相似的免疫刺激活性。
目前,人工合成的CpG ODN被認為是一種有效的免疫佐劑和治療劑而被應用于臨床研究。CpG單藥抗腫瘤的作用已在黑色素瘤、膀胱癌、結腸癌、淋巴瘤和肺癌等多種動物模型中得到了研究,證實其具有預防和消除實體瘤的療效[33]。CpG ODN與腫瘤疫苗、單克隆抗體、化療等聯合用于抗腫瘤的臨床研究也取得了滿意的療效[5]。
3.2 人工合成的CpG ODN
人工合成的CpG ODN根據結構和免疫刺激作用特點主要將其分為4種類型(表2)。利用磷硫酰骨架取代磷酸二酯鍵可抵抗核酸內切酶的水解,延長CpG ODN體內半衰期,但化學修飾對活性是否有影響還存在爭議[34-35]。為了提高CpG ODN的TLR9激活效應,通常在一條ODN鏈上串聯多個CpG基序,如B、C、P型ODN的設計[36]。也可引入回文序列,將CpG呈現于發夾結構頂端利于其與TLR9結合[36]。天然來源的菌體DNA具有序列多樣性,而人工合成的CpG ODN序列單一,鑒于CpG ODN具有種屬特異性的特點,圍繞著如何設計通用型CpG ODN,在串聯多個CpG基序的同時,引入人和鼠共識別的六核苷酸基序,如GTCGTT和GACGTT[34]。用于臨床研究的ODN序列均較長,主要集中在22~24 nt[5,24]。
3.3 CpG ODN新來源
盡管人工合成DNA技術不斷改進,但CpG ODN用藥劑量大,合成法制備成本仍非常高。在對序列進行優化,骨架進行修飾的同時,圍繞著如何提高CpG ODN生物利用度、改良劑型的報道也較多。納米粒攜帶可以促進細胞攝入CpG ODN,加強其免疫刺激效應[37-38]。如脂質體納米粒不但提高了CpG ODN生物利用度,還可促進TLR9由內質網遷移至內體,在內體艙內與CpG相互作用[39-40]。
CpG ODN化學合成的成本高,限制了其作為免疫佐劑在臨床尤其是獸醫臨床中的應用。國內外很多學者嘗試擴展CpG ODN的來源,并作為畜禽疫苗佐劑。相對于菌體基因組DNA,質粒DNA具有可獨立大量復制、易于純化的優點,作為DNA疫苗載體應用于人體,其安全性和有效性得到了充分證實[30]。將不同長度和不同CpG基序的DNA片段插入質粒,構建富含CpG的重組質粒,經大腸桿菌發酵、菌體裂解、純化等生物工程下游技術可大規模制備CpG重組質粒,研究證實CpG重組質粒具有和人工合成的CpG DNA相同的免疫刺激活性,可提高口蹄疫、禽流感滅活疫苗抗體水平2~4倍[31-32],增加畜禽抵抗感染性疾病的能力[41]。CpG重組質粒可在動物體內停留8~16 d,無基因組整合風險,符合農業轉基因生物安全評價的要求[42]。

表24 種類型CpG ODN結構特點及免疫功能對比
4 結語與展望
DF最初是由豬小腸黏膜基因組DNA通過控制解聚制得[21]。豬源臟器是應用最為廣泛的生化制藥原料,肝素、硫酸軟骨素、胰島素等傳統生化藥物品種都提取自豬臟器,其安全性、有效性經過了反復驗證,這可能是DF原料選擇的初衷,但正是這點大大限制了DF的來源,DF適應證目前正從VOD擴大到腫瘤用藥,首要解決的就是來源有限的問題。鮭魚DNA是哺乳動物來源DNA的理想替代品,利用改良的化學可控降解方法制備各類分子量分布的ODN,針對DF主要作用靶點內皮細胞和血小板,有望篩選得到新型的血管內皮細胞保護劑及抗凝劑。
人工合成CpG ODN技術成熟,但作為免疫佐劑及治療劑用藥劑量大[0.1~0.5 mg/(kg·d)],化學合成成本高,因而目前臨床試驗主要圍繞抗腫瘤及腫瘤的輔助治療開展,在感染性疾病的治療方面應用有限[26]。人工合成的CpG ODN長度在20~30 nt活性最強,小于8 nt則完全喪失生物學活性[24-25,34]。如果能將原核生物如細菌DNA體外降解為25 nt左右的ODN片段,每條鏈上的CpG基序平均將高達2~3個。是否能將DF及其類似物的制備方法用于細菌DNA的降解,在降解制備源于細菌的天然CpG ODN方面實現技術突破,值得進一步研究。該方法成本極其低廉、質量可控,有望成為CpG ODN的理想來源。
[1]Hu M,Zhang K.The application of aptamers in cancer research:an up-to-date review.Future Oncol,2012,9(3):369-376.
[2]Pescador R,Capuzzi L,Mantovani M,et al.Defibrotide:properties and clinical use of an old/new drug.Vascul Pharmacol,2013,59(1-2):1-10.
[3]Corbacioglu S,Cesaro S,Faraci M,et al.Defibrotide for prophylaxis of hepatic veno-occlusive disease in paediatric haemopoietic stem-cell transplantation:an open-label,phase 3,randomised controlled trial. Lancet,2012,379(9823):1301-1309.
[4]Hui CY,Zhang X,Huang SH.Defibrotide derived from mamalian polydeoxyribonucleotide.J Integr Technol,2012,1(3):28-34.(in Chinese)
惠長野,張希,黃勝和.去纖苷—單鏈脫氧寡核苷酸生化藥.集成技術,2012,1(3):28-34.
[5]Shirota H,Klinman DM.Recent progress concerning CpG DNA and its use as a vaccine adjuvant.Expert Rev Vaccines,2014,13(2):299-312.
[6]Akira S,Uematsu S,Takeuchi O.Pathogen recognition and innate immunity.Cell,2006,124(4):783-801.
[7]Krieg AM.CpG motifs in bacterial DNA and their immune effects. Annu Rev Immunol,2002,20:709-760.
[8]HuiCY,ZhangW,YangXQ,etal.Safetyevaluationof polydeoxyribonucleotide biochemical defibrotide.Chin J Pharmacol Toxicol,2013,27(S1):116.(in Chinese)
惠長野,張文,楊學琴,等.聚脫氧寡核苷酸生化藥去纖苷用藥安全性評價.中國藥理學與毒理學雜志,2013,27(S1):116.
[9]Richardson P,Linden E,Revta C,et al.Use of defibrotide in the treatment and prevention of veno-occlusive disease.Expert Rev Hematol,2009,2(4):365-376.
[10]Larocca A,Cavallo F,Magarotto V,et al.Defibrotide:a review on clinical use and future development.Expert Opin Biol Ther,2008,8(8):1201-1212.
[11]Echart CL,Somaini S,Distaso M,et al.Defibrotide blunts the prothrombotic effect of thalidomide on endothelial cells.Clin Appl Thromb Hemost,2011,18(1):79-86.
[12]Falanga A,Vignoli A,Marchetti M,et al.Defibrotide reduces procoagulantactivityandincreasesfibrinolyticpropertiesof endothelial cells.Leukemia,2003,17(8):1636-1642.
[13]Echart CL,Graziadio B,Somaini S,et al.The fibrinolytic mechanism of defibrotide:effect of defibrotide on plasmin activity.Blood Coagul Fibrinolysis,2009,20(8):627-634.
[14]Morabito F,Gentile M,Gay F,et al.Insights into defibrotide:an updated review.Expert Opin Biol Ther,2009,9(6):763-772.
[15]Guglielmelli T,Bringhen S,Palumbo A.Update on the use of defibrotide.Expert Opin Biol Ther,2012,12(3):353-361.
[16]Gottfried E,Kreutz M,Haffner S,et al.Differentiation of human tumour-associateddendriticcellsintoendothelial-likecells:an alternative pathway of tumour angiogenesis.Scand J Immunol,2007,65(4):329-335.
[17]KoehlGE,GeisslerEK,IacobelliM,etal.Defibrotide:an endothelium protecting and stabilizing drug,has an anti-angiogenic potential in vitro and in vivo.Cancer Biol Ther,2007,6(5):686-690.
[18]Mitsiades CS,Rouleau C,Echart C,et al.Preclinical studies in support of defibrotide for the treatment of multiple myeloma and other neoplasias.Clin Cancer Res,2009,15(4):1210-1221.
[19]Hui CY,Guo Y,Zhang X,et al.Oligodeoxyribonucleotides derived from salmon sperm DNA:an alternative to defibrotide.Biologicals,2013,41(3):190-196.
[20]Lanzarotti E,Mantovani M,Prino G,et al.Process producing lower molecular weight range oligodeoxyribonucleotides:US,5646268. 1997-07-08.
[21]Fedeli G,Diamantini G,Mantovani M,et al.Process for obtaining chemically defined and reproducible polydeoxyribonucleotides:US,5223609.1993-06-29.
[22]Guo Y,Hui CY,Zhang W,et al.Extraction and quality analysis of genomic DNA from bovine lung.Chin J Biologicals,2014,27(5):712-715.(in Chinese)
郭妍,惠長野,張文,等.牛肺基因組DNA的提取及其質量分析.中國生物制品學雜志,2014,27(5):712-715.
[23]Hui CY,Shao JH,Guo Y,et al.Extraction and quality control of DNA from porcine intestinal mucosa.J Shenyang Pharma Univ,2013,30(1):63-67.(in Chinese)
惠長野,邵建華,郭妍,等.豬小腸黏膜脫氧核糖核酸的提取及質量研究.沈陽藥科大學學報,2013,30(1):63-67.
[24]Shirota H,Klinman DM.Recent progress concerning CpG DNA andits use as a vaccine adjuvant.Expert Rev Vaccines,2013,13(2):299-312.
[25]Krieg AM,Yi AK,Matson S,et al.CpG motifs in bacterial DNA trigger direct B-cell activation.Nature,1995,374(6522):546-549.
[26]Klinman DM,Klaschik S,Sato T,et al.CpG oligonucleotides as adjuvants for vaccines targeting infectious diseases.Adv Drug Deliv Rev,2009,61(3):248-255.
[27]Sparwasser T,Miethke T,Lipford G,et al.Bacterial DNA causes septic shock.Nature,1997,386(6623):336-337.
[28]Schwartz DA,Quinn TJ,Thorne PS,et al.CpG motifs in bacterial DNA cause inflammation in the lower respiratory tract.J Clin Invest,1997,100(1):68-73.
[29]Hemmi H,Takeuchi O,Kawai T,et al.A Toll-like receptor recognizes bacterial DNA.Nature,2000,408(6813):740-745.
[30]Guo Y,Hui CY.Pilot-scale production and quality control of multiepitope hepatitis B virus DNA vaccine.J South Med Univ,2009,29(1):118-120.(in Chinese)
郭妍,惠長野.多表位HBV DNA疫苗的中試制備及質量研究.南方醫科大學學報,2009,29(1):118-120.
[31]Guo X,Jia H,Zhang Q,et al.CpG-enriched plasmid enhances the efficacy of the traditional foot-and-mouth disease killed vaccine. Microbiol Immunol,2012,56(5):332-337.
[32]Guo X,Zhang Q,Hou S,et al.Plasmid containing CpG motifs enhancestheefficacyofporcinereproductiveandrespiratory syndrome live attenuated vaccine.Vet Immunol Immunopathol,2011,144(3-4):405-409.
[33]Liu YG,Zhang Q,Chen LB.Progress of application of CpG ODN in tumor therapy.Oncol Prog,2010,8(1):34-37,28.(in Chinese)
劉允剛,張群,陳龍邦.CpG寡核苷酸在腫瘤治療中的應用研究進展.癌癥進展,2010,8(1):34-37,28.
[34]Bodera P,Stankiewicz W,Kocik J.Synthetic immunostimulatory oligonucleotides in experimental and clinical practice.Pharmacol Rep,2012,64(5):1003-1010.
[35]Paliakov E,Henary M,Say M,et al.Fujita-Ban QSAR analysis and CoMFAstudyofquinolineantagonistsofimmunostimulatory CpG-oligodeoxynucleotides.Bioorg Med Chem,2007,15(1):324-332.
[36]Wagner H.The sweetness of the DNA backbone drives Toll-like receptor 9.Curr Opin Immunol,2008,20(4):396-400.
[37]Malyala P,O'Hagan DT,Singh M.Enhancing the therapeutic efficacy of CpG oligonucleotides using biodegradable microparticles.Adv Drug Deliv Rev,2009,61(3):218-225.
[38]Hanagata N.Structure-dependent immunostimulatory effect of CpG oligodeoxynucleotides and their delivery system.Int J Nanomedicine,2012,7:2181-2195.
[39]de Jong SD,Basha G,Wilson KD,et al.The immunostimulatory activity of unmethylated and methylated CpG oligodeoxynucleotide is dependent on their ability to colocalize with TLR9 in late endosomes. J Immunol,2010,184(11):6092-6102.
[40]Wilson KD,de Jong SD,Tam YK.Lipid-based delivery of CpG oligonucleotides enhances immunotherapeutic efficacy.Adv Drug Deliv Rev,2009,61(3):233-242.
[41]QuanZ,QinZG,ZhenW,etal.PlasmidcontainingCpG oligodeoxynucleotides can augment the immune responses of pigs immunized with porcine reproductive and respiratory syndrome killed virus vaccine.Vet Immunol Immunopathol,2010,136(3-4):257-264.
[42]Zhu HF.The recombinant plasmid pcDNAKCpG biological safety research.Beijing:Chinese Academy of Agricultural Sciences,2005.(in Chinese)
朱鴻飛.重組質粒pcDNAKCpG生物安全性研究.北京:中國農業科學院,2005.
10.3969/cmba.j.issn.1673-713X.2015.01.012
深圳市科技研發資金項目(JCYJ20130401092802780)
518001深圳職業病防治院
惠長野,Email:hcy_sypu@163.com
2014-07-15

