淺談藥物或醫(yī)療器械臨床試驗過程中的妊娠
張育瑋,黃艷春,薛立明,武海波
·調(diào)查與研究·
淺談藥物或醫(yī)療器械臨床試驗過程中的妊娠
張育瑋,黃艷春,薛立明,武海波
按照GCP中的技術(shù)要求,臨床試驗選擇的受試者均以自愿為原則,女性受試者應(yīng)排除妊娠及哺乳期,因此在篩選時均應(yīng)對孕齡女性進行早孕檢測,以確保受試者的安全及試驗順利進行。但由于實際操作缺乏嚴密性,在試驗中出現(xiàn)個別女性受試者妊娠現(xiàn)象,且目前我國沒有明確的法律規(guī)定及倫理要求,使其處理方式多樣化。
目前大多數(shù)藥物臨床試驗機構(gòu)采用檢測尿液人絨毛膜促性腺激素(HCG)的方法,但該方法不能定量檢測HCG,女性在妊娠8~10 d才能被檢測出陽性結(jié)果,且個體差異大,部分女性甚至?xí)谀┐卧陆?jīng)后35~40 d才能檢出尿HCG。因此,篩選時單憑化驗結(jié)果來判斷是不足以確認妊娠的,相關(guān)的知情及倫理要求不足以成為事件的重要原因。
1 預(yù)防措施
1.1 完善妊娠檢測方案
相比尿液8~10 d甚至35~40 d才能檢出陽性結(jié)果,血液HCG的檢測更為準確,往往在停經(jīng)1~2 d就可檢出,可以把確診妊娠的時間提前,能更準確對妊娠做出判斷。由于血液HCG檢測要比尿液檢測費用高許多,可根據(jù)受試者的具體情況來判斷是否有必要對其進行血液檢測。如若受試者確定未發(fā)生過性行為或根據(jù)其月經(jīng)周期判斷妊娠發(fā)生幾率極低,可以只在篩選期對其進行尿妊娠檢查,若無法判斷,可以對其進行血液HCG檢查。
有些試驗篩選與入組存在時間間隔,為確保在此時間段內(nèi)不會發(fā)生妊娠,建議于入組前對女性進行妊娠檢測,或根據(jù)具體情況在入組前對其再次進行妊娠檢查,若無法確認在這段時間內(nèi)女性受試者是否發(fā)生性行為而具有發(fā)生妊娠的可能,則有必要在入組時確定其血液HCG含量。
1.2 全面知情同意
研究者要將試驗藥物基本信息、試驗流程、入排標準、可能會產(chǎn)生的風(fēng)險完全列入知情同意書并告知受試者,包括對其基本信息的保密、對其權(quán)利的保護、由于檢測方法的局限而無法100%檢出妊娠、妊娠后的危害、生育能力有無影響及采取的相應(yīng)措施等,并且告知其在接受試驗前、中、后的注意事項(如飲食、運動、避孕、服藥后多長時間才能發(fā)生妊娠或使其配偶妊娠等)及相關(guān)規(guī)定,研究者必須保證全面知情且使受試者了解、接受這些信息后才能簽署知情同意書和開展篩查工作。此外,對于男性受試者知情同意時也應(yīng)告知在試驗期間不得使其配偶妊娠或進行捐精活動。也可印發(fā)簡單的臨床試驗注意事項供受試者學(xué)習(xí)。
1.3 入選前基本情況的詢問及保密
在篩選過程中,除基本的病史、家族史的詢問外,對于女性受試者年齡、婚姻狀況、近期是否發(fā)生性行為、月經(jīng)周期及末次月經(jīng)時間、是否已有子女或預(yù)備妊娠、文化信仰(有些文化信仰認為胎兒比婦女的生命或健康更重要[1])等信息也要詳細收集并記錄,以確定對其進行血液還是尿液HCG檢測,及檢查的時間和頻次。如:①月經(jīng)周期是多長?上次月經(jīng)是什么時間?有無延遲史?延遲多久?②近兩個月是否有性生活?如有,是否頻繁?大概頻率?最后一次是什么時候?是否采取避孕措施?采用何種方式進行避孕?③近期是否有妊娠的計劃?是否有子女?根據(jù)以上問題,做出判斷,如:無性生活或兩個月內(nèi)無性生活,則可以根據(jù)尿HCG檢測結(jié)果判斷是否妊娠。若兩個月內(nèi)有性生活(Δt為入組與篩選的時間差),具體可參考圖1和圖2。
詢問以上問題均應(yīng)單獨進行,并由同性別研究人員進行,過程中應(yīng)注意措辭,解釋清楚原因,消除受試者的緊張感,相關(guān)記錄應(yīng)保密,其他人員不可隨意查看,可將記錄收歸倫理委員會相關(guān)部門,除必要情況不得對任何人公開。
1.4 倫理委員會成立專管部門
在倫理委員會成立專管部門,可負責試驗中妊娠的相關(guān)監(jiān)管工作,其職責包括試驗方案中女性受試者特殊權(quán)利的倫理審查及保護、試驗中涉及的相關(guān)隱私信息的保管及判斷孕婦的參加是否會對胎兒或哺育嬰兒造成風(fēng)險、發(fā)生妊娠或意外的處理規(guī)程的制定及補償措施的把控。也可以把妊娠與不良事件的監(jiān)管統(tǒng)一到一個部門,但需要由專人專項負責,因妊娠受試者人群的特殊性,盡管其處理上與不良事件有很多相似點,但本質(zhì)不同。
1.5 保險制度
在申辦方和研究者達成一致的前提下,可以針對孕齡女性受試者在試驗期間妊娠設(shè)立專項保險,在倫理機構(gòu)備案,并對受試者進行知情同意。
1.6 強化醫(yī)學(xué)常識的宣教
研究人員在知情和宣教的過程中充分告知受試者,如涉及藥物會對妊娠造成不同程度的傷害,可能會導(dǎo)致流產(chǎn)、胎兒致畸、先天疾病等后果,建議在試驗過程中注意采取有效的避孕措施及在試驗結(jié)束3個月內(nèi)不要妊娠或使配偶妊娠。但不要使受試者產(chǎn)生所有臨床試驗的藥物或器械都會影響胎兒發(fā)育的錯誤觀念,應(yīng)根據(jù)具體藥物具體分析。
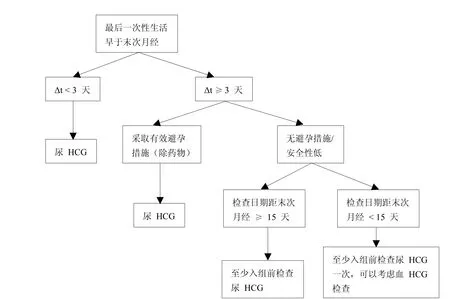
圖1 最后一次性生活早于末次月經(jīng)妊娠篩查參考流程圖
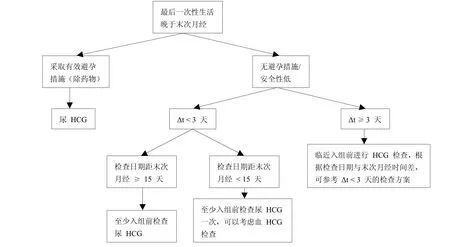
圖2 最后一次性生活晚于末次月經(jīng)妊娠篩查參考流程圖
1.7 建立相關(guān)規(guī)章制度
鑒于女性受試者特殊的生理現(xiàn)象,為保護女性受試者的權(quán)益、尊重新生命,相關(guān)部門制定相應(yīng)的臨床試驗規(guī)章制度顯得尤為重要。此外,倫理委員會也應(yīng)在臨床試驗的操作過程中實施監(jiān)督,規(guī)范研究者或其他試驗相關(guān)人員的行為,將傷害降至最低[2]。
2 處理
2.1 停藥檢查
如確認受試者妊娠,首先要立即停藥,對其進行全面檢查,確定妊娠發(fā)生的具體時間、受試者基本狀況、試驗期間有無合并用藥及對妊娠的影響,征求專科醫(yī)生或?qū)<业囊庖姡_定是否采取相應(yīng)的救護措施。
2.2 上報妊娠事件
臨床研究過程中發(fā)生的妊娠,研究者應(yīng)在獲知后的24 h內(nèi)上報該事件,并注明發(fā)生的時間、受試者目前的狀況、是否伴有其他不良反應(yīng)等。上報程序可按照《藥物臨床試驗質(zhì)量管理規(guī)范》中的相關(guān)規(guī)定進行。
需要說明的是妊娠本身不屬于嚴重不良事件。如在妊娠期間服用藥物或在發(fā)現(xiàn)妊娠前服用藥物,且血藥濃度仍保持在有效范圍,而對孕婦或胎兒產(chǎn)生的如異位妊娠、流產(chǎn)或致畸等則屬于不良事件或嚴重不良事件,需另行上報。
2.3 是否繼續(xù)妊娠
是否繼續(xù)妊娠的決定要在道德、正義、自愿的前提下進行,充分保護受試者利益[2]。
2.3.1 終止妊娠若已知試驗藥物具有明顯的妊娠毒性而必須要終止妊娠,或受試者自身要求終止妊娠,或為異位妊娠,請專科醫(yī)生判斷其身體狀況是否適合進行人工流產(chǎn),若允許,在手術(shù)進行前,申辦方、研究者應(yīng)與受試者達成書面協(xié)議,闡明三方均自愿簽署協(xié)議、手術(shù)存在的風(fēng)險、術(shù)后的隨訪及相應(yīng)的補償措施。詢問受試者是否為首次妊娠、是否曾經(jīng)發(fā)生流產(chǎn)(人工或意外)及其次數(shù)、是否有子女(可由篩選時信息獲得)、以后是否打算妊娠等信息,并根據(jù)受試者具體情況對其進行補償,但是補償額度不應(yīng)過大,避免誘使他們過度冒險、或不考慮自己的實際情況而自愿參加,使知情同意無效。所有提供給受試者的報酬、補償和醫(yī)療服務(wù)都必須得到倫理審查委員會的批準[3]。
2.3.2 繼續(xù)妊娠首先要與受試者達成書面協(xié)議,闡明申辦方對受試者給予相應(yīng)的補償,在妊娠期間每三個月跟蹤隨訪一次,做相應(yīng)的隨訪記錄,記錄妊娠時間、孕婦生命體征、各項檢測指標值、有無其他不適及胎兒狀況,受試者和隨訪人員簽字確認。胎兒出生后檢測是否存在藥物導(dǎo)致的先天疾病或畸形(家族遺傳除外),可在嬰兒2、6、12和24個月進行隨訪[4],分別檢測其體格發(fā)育情況,可采用“Gesell嬰幼兒智能發(fā)育階段初步檢查表”測量其DQ(發(fā)育商,即智齡)[5]。經(jīng)醫(yī)生判斷受試者和嬰兒健康狀況良好后可結(jié)束隨訪。若在妊娠期間發(fā)生意外流產(chǎn)且可能與藥物相關(guān),應(yīng)及時申報嚴重不良事件。
3 風(fēng)險等級
可根據(jù)具體情況分級處理妊娠事件,按照等級做出相應(yīng)的賠償,統(tǒng)一標準,使處理過程有據(jù)可循。評判可參考表1。

表1 風(fēng)險等級表
4 小結(jié)
加強臨床試驗妊娠管理,目的不是給受試者造成藥物試驗會危害妊娠、影響生育的印象,而是強調(diào)應(yīng)一直采取預(yù)防危害的措施,這是對受試者權(quán)益和安全及對未來生命的保護,也是對研究者和申辦方的保護。只有保障了受試者的權(quán)益,保障了研究人員操作的流暢性,臨床試驗才能得到最真實、最可靠的結(jié)果,才能為大眾提供更多的放心藥。
[1]Liu SL,Wang XQ,Xiong NN,et al.Ethic review in clinical research:women and pregnant women.Chin J Clin Pharmacol Ther,2006,11(4):477-480.(in Chinese)
劉沈林,汪秀琴,熊寧寧,等.臨床試驗的倫理審查:婦女和孕婦.中國臨床藥理學(xué)與治療學(xué),2006,11(4):477-480.
[2]Allesee L,Gallagher CM.Pregnancy and protection:the ethics of limiting a pregnant woman's participation in clinical trials.J Clin Res Bioeth,2011,2(108):1000108.
[3]Wang XQ,Xiong NN,Liu SL,et al.Ethic review in clinical research:subjects recruitment.Chin J Clin Pharmacol Ther,2004,9(11):1313-1316.(in Chinese)
汪秀琴,熊寧寧,劉沈林,等.臨床試驗的倫理審查:招募受試者.中國臨床藥理學(xué)與治療學(xué),2004,9(11):1313-1316.
[4]Mei XX.The effect of early intervention on growth and development of premature infants.J Practical Med Tech,2008,15(35):134-135.(in Chinese)
梅曉霞.早期干預(yù)對早產(chǎn)兒生長發(fā)育的效果觀察.實用醫(yī)技雜志,2008,15(35):134-135.
[5]Wang Q.To discuss issues related to the guiding principle of clinical research on traditional Chinese medicine in the treatment of male infertility.Sexology,1999,8(2):27-30.(in Chinese)
王琦.對《中藥治療男性不育的臨床研究指導(dǎo)原則》有關(guān)問題的商討.性學(xué),1999,8(2):27-30.
10.3969/cmba.j.issn.1673-713X.2015.01.018
100005北京精誠泰和醫(yī)藥信息咨詢有限公司(張育瑋、黃艷春、武海波);100050北京,中國醫(yī)學(xué)科學(xué)院藥物研究所科技開發(fā)處(薛立明)
武海波,Email:wuhaibo@giantcro.com
2014-11-16

