家兔作為胎齡期骨髓間充質干細胞動物模型的實驗研究
周權 祁美武 張智勇 周廣東 葉金艷 周曉
家兔作為胎齡期骨髓間充質干細胞動物模型的實驗研究
周權 祁美武 張智勇 周廣東 葉金艷 周曉
目的建立以家兔為對象的胎齡期BMSC研究動物模型。方法通過人工授精方法,獲得孕期3周的孕兔4只,行剖腹產術取出胎兔20只,沖取胎兔骨髓,以貼壁培養法進行體外擴增培養。測量第3代胎兔BMSC的生長曲線,克隆形成率,并進行成骨、成脂及成軟骨誘導分化。另外,將原代細胞凍存30 d后復蘇,測量其第3代生長曲線,對凍存前后增殖能力的變化進行觀察。掃描電鏡觀察胎兔BMSC與β-TCP形成細胞材料復合物的體外形態。將BMSCs-β-TCP復合物植入裸鼠皮下,于術后1、3、6個月分別取材,行HE、VG、Masson染色觀察。結果胎兔來源的BMSC于倒置相差顯微鏡下觀察,細胞飽滿均勻,呈梭形或倒三角形狀;傳代后各代細胞形態未發生明顯變化,生長曲線相差不大;成骨、成脂以及成軟骨誘導觀察到鈣結節、脂肪空泡、黏多糖。凍存30 d后復蘇,其第3代生長曲線與凍存前相比未見明顯變化。電鏡下觀察,與β-TCP復合7 d后,細胞能均勻緊密貼合于材料上,伸展良好分布均勻。植入裸鼠皮不同時間點取材行HE、VG、Masson染色,均顯示有新生骨組織生成。結論以家兔為研究動物模型,可以在胎齡期獲取并分離得到BMSC,并可在異位構建組織工程骨,是間充質干細胞動物研究的新選擇。
骨髓間充質干細胞種子細胞骨組織工程家兔
doi∶10.3969/j.issn.1673-0364.2015.02.013
骨髓間充質干細胞(BMSC)是良好的骨組織工程種子細胞來源[1],具有來源廣泛、體外擴增能力強、成骨分化能力高[2]、異體回植免疫原性低[3]、倫理接受度高等優點。BMSC根據供體年齡可分為:成年期(Adult BMSC),新生期(Perinatal BMSC)和胎齡期(Fetal BMSC)[4]。成年期BMSC已在各類動物模型上成功構建出骨組織[5-7],胎齡期BMSC與成年BMSC和臍帶間充質干細胞相比,具有更快的體外擴增速度,更強的成骨分化能力,同時還具有更低的免疫原性[8-14]。另外,胎齡期細胞比其他來源細胞更純凈,受到病毒以及細菌污染的可能更低,細胞特性更穩定,適于建庫儲存。因此,胎齡期BMSC已成為骨組織工程研究新的熱門研究種子細胞。
但是胎齡期BMSC的獲取來源主要是流產的胎兒,數量來源并不穩定,還可能受到倫理等因素限制。另外,人體也不適宜作為胎齡期BMSC的原位骨移植修復模型,既往的研究多為異位免疫缺陷動物模型。因此,迫切需要一種研究胎齡期BMSC的新的動物模型,既可以穩定充足地獲得胎齡期BMSC,也可作為直接的原位骨修復模型使用。本實驗以新西蘭大白兔為研究對象,成功從胎兔中分離出胎齡期BMSC,并進行了異位成骨的驗證,為后續的胎齡期BMSC研究提供了一種新的研究動物模型。
1 材料與方法
1.1 實驗動物、主要試劑及儀器
新西蘭孕大白兔4只,1~2歲,孕期3周,由上海甲干生物科技有限公司提供。
β-TCP(上海貝奧路生物材料有限公司);DMEM培養液(Thermo公司,美國);10%胎牛血清(Thermo公司,美國);0.25%胰酶(Thermo公司,美國);三抗(Thermo公司,美國);培養皿(BD公司,美國);離心管(BD公司,美國)。
倒置相差顯微鏡(Nikon公司,日本);石蠟包埋機(Leica公司,德國);多聚甲醛(上海生工);離心機(Thermo公司,美國);超低溫冰箱(Thermo公司,美國);CO2培養箱(Thermo公司,美國)。
1.2 實驗方法
1.2.1 胎兔BMSC的分離、培養和擴增
孕兔用10 g/L戊巴比妥鈉,按30mg/K g靜脈麻醉,腹臥位固定于手術臺上,常規消毒、鋪巾。最后一肋下方10 cm處沿腹中線作10 cm切口,取出子宮,結扎臍帶與血管后切開,暴露胎兔(圖1)。迅速取出胎兔四肢長骨,兩端剪開,無菌條件下2 mL注射器加入含10%血清的低糖DMEM反復沖洗骨髓。細胞懸液以8mL每皿接種于10 cm培養皿,置于37℃、5%CO2培養箱培養5~6 d,進行首次換液,3~4 d后細胞達到接近融合狀態時傳代培養。
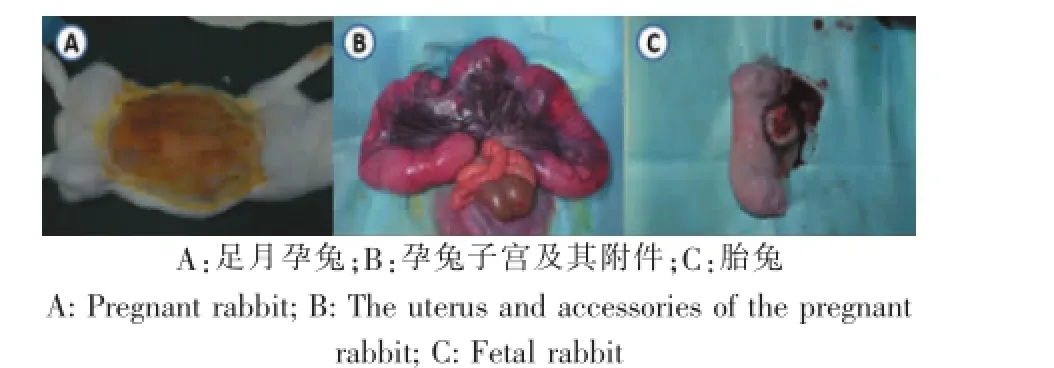
圖1 胎兔模型的建立Fig.1 The establishment of the fetal rabbitmodel
1.2.2 制備細胞-材料復合物并植入裸鼠皮下
把β-TCP制成直徑2mm,厚度3 mm的圓柱體。用75%乙醇浸泡1 h,紫外線照射30 min,置入培養皿中,75%乙醇浸泡3次,最后1次浸泡過夜。次日用PBS洗滌2~3次后,加入含10%血清的DMEM培養液預培養過夜,次日吸干DMEM培養液后準備接種細胞。取第3代胎兔BMSCs,胰酶消化,細胞按30×106cells/m L接種到β-TCP上,每塊材料接種100μL細胞懸液,使之均勻分布于β-TCP上,轉移至培養皿中,于37℃、5%CO2的培養箱中,培養4~5 h后首次加培養液。1 d后換成骨誘導液(10%血清的低糖培養液+0.1μmol/L地塞米松+10mmol/Lβ-磷酸甘油+50mmol/L抗壞血酸),連續誘導2周。共制作復合物3塊,完成體外誘導后植入裸鼠皮下。
1.3 相關檢測方法
1.3.1 BMSCs生長曲線的測定
胎兔第3代細胞(n=3),胰酶消化,計數,2 000個/孔接種于96孔板上,按CCK-8母液∶DMEM=1∶10配置CCK-8工作液,每孔加入100μL工作液避光孵育2 h后,450 nm波長測量1、3、5、7、9、11 d各孔吸光度,計算標準差,Excel繪制生長曲線。
1.3.2 BMSCs克隆形成率的測定
取胎兔第3代細胞,胰酶消化,計數,調整細胞數目至200個/皿,接種于10 cm培養皿上(n=5),3 d換液一次,21 d時多聚甲醛固定,結晶紫染液染色后計數直徑>1 mm的細胞克隆,并計算克隆形成率。克隆形成率=細胞克隆數/接種細胞數×100%。
1.3.3 三向誘導分化
取第3代胎兔BMSCs胰酶消化后,計數,調整細胞數目至0.4×106cells/m L,6孔板每孔加入1 m L細胞懸液,24 h后加入成骨誘導液(10%FBS的低糖培養液+0.1μmol/L地塞米松+10 mmol/Lβ-磷酸甘油+50mmol/L抗壞血酸),3 d換液一次。21 d后4%多聚甲醛固定30min,茜素紅染色后鏡下觀察。成脂誘導方法同前(10%血清的低糖培養液+200μmol/L吲哚美辛+10μmol/L胰島素+1μmol/L地塞米松+ 0.5mmol/L IBMX),21 d后4%多聚甲醛固定,油紅O染色后鏡下觀察。成軟骨誘導方法同前(10%血清的高糖培養液+10 ng/mL TGF-β1+50 ng/mL IGF-I+40 ng/mL地塞米松),21 d后4%多聚甲醛固定,甲苯胺藍染色后鏡下觀察。
1.3.4 胎兔BMSCs細胞凍存與復蘇
取原代BMSCs,胰酶消化后細胞計數并離心,棄去上清液,按DMSO∶胎牛血清∶DMEM=1∶3∶6配置凍存液,加入細胞配成106cells/m L懸液,放入梯度降溫盒中-80℃過夜,然后液氮保存。30 d后取出凍存細胞,37℃水浴中復蘇,接種至10 cm培養皿中,4 h后換液培養,每3~4天傳代一次,并計算第3代生長曲線,方法同上。
1.3.5 細胞-材料復合物掃描電鏡觀察
取胎兔BMSCs-β-TCP沖洗,固定、脫水、干燥后表面噴金,掃描電鏡觀察。
1.3.6 組織學檢測
將BMSCs-β-TCP復合物植入裸鼠皮下,分別于1、3、6個月后取材。各標本經10%福爾馬林固定,用無水乙醇分級脫水,石蠟包埋、切片,HE、VG、Masson染色,比較胎兔BMSCs-β-TCP復合物在體內不同時間段的組織學特征。
2 結果
2.1 胎兔BMSCs細胞形態
鏡下可見胎兔BMSC呈集落樣生長,細胞為梭形、圓形、三角形和不規則形等。傳代后可形成單層,外形似成纖維細胞,增殖迅速,24 h即貼壁生長,2 d達到60%融合,3 d達到80%融合(圖2)。

圖2 倒置相差顯微鏡觀察胎兔BM SCs(第3代)Fig.2 Morphology of BMSCs from fetal rabbit by invert phase contrastm icroscope(P3)
2.2 生長曲線
CCK-8法結果顯示,胎兔BMSCs自3 d起加速生長進入對數期,7 d時速度減慢,9 d時進入平臺期。凍存前后,胎兔第3代BMSC s生長曲線各生長期及增殖速率未發生顯著變化(圖3)。
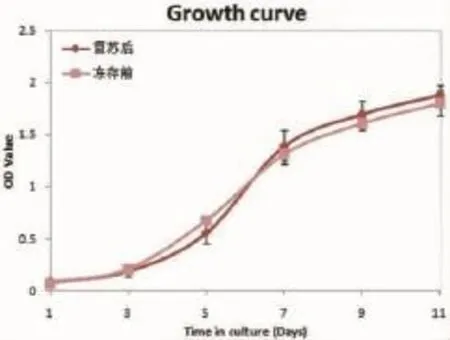
圖3 復蘇前后BM SCs細胞生長曲線Fig.3 The grow th curve before and after thaw ing BMSCs
2.3 克隆形成率對比
經計算,胎兔BMSCs直徑>1mm的細胞克隆形成率超過50%(圖4)。

圖4 胎兔BMSCs克隆形成率Fig.4 Cloning efficiency of BMSCs from fetal rabbit
2.4 成骨、成脂、成軟骨誘導
胎兔BMSCs加入成骨誘導液21 d,茜素紅染色可見深染鈣結節。加入成脂誘導液21 d,油紅O染色可見圓泡樣脂滴。加入成軟骨誘導液21 d,甲苯胺藍染色可見藍色黏多糖。提示胎兔BMSCs具有良好的成骨及多能分化潛力(圖5)。

圖5 胎兔BMSCs的誘導分化Fig.5 Induced differentiation of BMSCs from fetal rabbit
2.5 掃描電鏡
胎兔BMSCs接種于材料培養7 d后,細胞均勻貼附在β-TCP表面,細胞外基質分泌旺盛,細胞間連接密集,呈絲狀分布(圖6)。
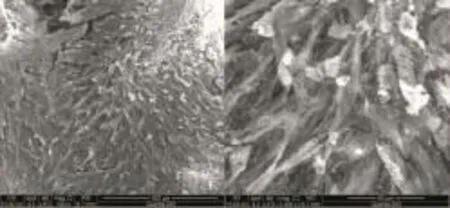
圖6 掃描電鏡觀察細胞與材料黏附性Fig.6 Adhesion of cellsw ith scaffold observed by scanning electricm icroscope
2.6 組織學染色
將不同時間所取標本以甲醛固定、石蠟包埋后HE、VG、Masson染色,行組織學觀察。細胞-材料復合物植入體內1個月時,材料周圍未見淋巴細胞和漿細胞浸潤,新生周圍血管豐富,可見新生纖維樣骨痂,骨陷窩較小,骨痂不成熟。植入體內3個月時,鏡下見血管數量較1個月時明顯減少,新生骨小梁及軟骨細胞較少,但有大量成熟索樣的骨小梁形成,骨髓腔部分有大量骨痂及膠原形成。植入體內6個月時,新生骨干結構完整并得以重塑,鏡下見植入物殘骸已吸收降解,完全由新骨替代,新骨中血管結構與軟骨組織均較少,主要以成熟骨結構為主,含有骨陷窩的骨組織逐漸增厚,結構更為致密,相鄰骨小梁互相連接(圖7)。
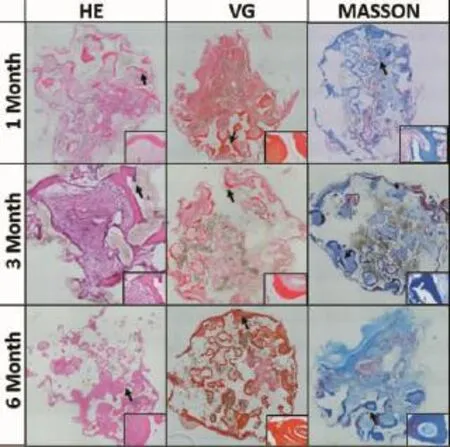
圖7 細胞材料復合物裸鼠皮下植入后1、3、6個月的組織學觀察Fig.7 The histological results of tissue-engineered bone at 1,3,6months after imp lantation into the nudem ice subcutaneously
3 討論
骨組織工程的種子細胞的研究已經開展得較為深入和成熟。當面臨大塊骨缺損或無法獲取自身骨髓時,通過建立同種異體干細胞庫用于組織構建是最佳的解決方法[15]。BMSC作為一種增殖能力強,骨定向分化能力強,免疫原性低,可在體外大量擴增的細胞,已被視為潛在的種子細胞建庫來源[8,16-18]。然而,不同年齡段、不同個體的BMSC易受個體健康程度影響,其免疫應答能力、細胞活力有高低區分[4]。胎齡期的BMSC則在上述方面相對較為統一,受個體健康影響小,而且免疫原性更低。另外,胎齡期細胞比其他來源細胞更純凈,受到病毒以及細菌污染可能更低,細胞特性更穩定,適于建庫儲存。考慮到因人胎齡期BMSCs的來源、原位骨移植修復和同種異體實驗方面的諸多限制,所以選擇合適的動物模型對胎齡期BMSCs的研究具有重要意義。
相對于大鼠等,家兔的免疫排斥與人更接近,相對于豬、狗、羊等大型動物,家兔價格更便宜,更容易飼養,所以更容易擴大樣本量,使實驗結果更具參考性。本實驗以新西蘭大白兔為研究對象,可以獲得穩定的胎齡期BMSCs,手術操作簡單,術后護理方便,術后感染等發生率低。實驗結果提示,在新西蘭大白兔模型中,胎齡期BMSCs的生長曲線自第3天起加速生長進入對數期,7 d時速度減慢,9 d時進入平臺期,且細胞貼壁形態至第3代未發生改變,保持梭形或倒三角形,細胞均勻透亮,提示胎兔細胞在體外可維持自身遺傳生長特征。同時,在成骨、成脂、成軟骨誘導條件下,胎兔BMSCs能觀察到大顆粒的鈣結節、細胞內脂滴及黏多糖,說明具有潛在的成骨能力及多向分化能力,亦可能成為其他組織工程,如脂肪、軟骨等的良好種子細胞來源。經過凍存復蘇后,傳代至第3代胎兔BMSCs,與凍存前相比生長曲線變化不明顯,未見明顯增殖改變,說明經過凍存后,胎兔BMSCs生長增殖能力并不受影響,適合進行凍存建庫,是一種不亞于成年期BMSCs的建庫種子細胞來源。
β-TCP是一種較為成熟的組織工程骨材料,可用于構建骨組織,修復大面積骨缺損[19]。胎兔BMSCs與其體外高密度接種后,細胞與材料貼附良好,掃描電鏡下觀察發現,細胞均勻緊密地覆蓋材料表面,細胞外基質分泌旺盛,呈現簇狀突起,顯示出優秀的骨組織工程材料復合能力。細胞-材料復合物植入裸鼠皮下,于不同時間點取材進行組織學分析,顯示有新生骨組織生成。說明在體內環境下,胎兔BMSCs可以作為組織工程種子細胞構建組織工程骨。
綜上所述,以家兔為研究動物模型,可以在胎齡期獲取并分離得到BMSC,并可在異位構建組織工程骨,是胎齡期間充質干細胞動物研究的新選擇。
[1]Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999,284 (5411)∶143-147.
[2]Bruder SP,Jaiswal N,Haynesworth SE.Growth kinetics,self-renewal, and the osteogenic potential of purified humanmesenchymal stem cells during extensive subcultivation and following cryopreservation[J].JCell Biochem,1997,64(2)∶278-294.
[3]Phinney DG,Kopen G,Righter W,et al.Donor variation in the growth propertiesand osteogenic potential ofhumanmarrow stromal cells[J].JCell Biochem,1999,75(3)∶424-436.
[4]Zhang ZY,Teoh SH,ChongMS,etal.Superiorosteogenic capacity for bone tissue engineering of fetal compared with perinatal and adultmesenchymal stem cells[J].Stem Cells,2009,27(1)∶126-137.
[5]席慶,毛天球,曹罡,等.以鈦網為支架的組織工程骨修復羊下頜骨節段性缺損[J].中國臨床康復,2002,6(8)∶1116-1117.
[6]雷華,唐曉軍,彭喆,等.富含血小板血漿雙相接種法構建的組織工程骨修復山羊顱骨缺損[J].中國美容醫學,2011,20(4)∶581-585.
[7]Zhang ZY,Teoh SH,Chong MS,et al.Neo-vascularization and bone formation mediated by fetalmesenchymal stem cell tissueengineered bone grafts in critical-size femoral defects[J]. Biomaterials,2010,31(4)∶608-620.
[8]Le Blanc K,Pittenger M.Mesenchymal stem cells∶progress toward promise[J].Cytotherapy,2005,7(1)∶36-45.
[9]趙大慶,馬鈺,李青,等.人脂肪基質干細胞復合藻酸鈣體外構建工程軟骨的實驗研究[J].生物醫學工程與臨床,2011,15(5)∶408-412,封3.
[10]呼瑩,馬麗,馬冠杰,等.成人和胎兒骨髓間充質干細胞的比較研究[J].中華血液學雜志,2002,23(12)∶645-648.
[11]朱美玲,陳汝光,劉華,等.人中期胚胎、新生兒臍血及成人骨髓間質干細胞基本生物學特性的比較[J].中山大學學報(醫學科學版),2004,25(6)∶504-507.
[12]TseWT,Pendleton JD,BeyerWM,etal.Suppression ofallogeneic T-cell proliferation by human marrow stromal cells∶implications in transp lantation[J].Transplantation,2003,75(3)∶389-397.
[13]DiNicola M,Carlo-Stella C,MagniM,etal.Human bonemarrow stromal cells suppress T-lymphocyte proliferation induced by cellular or nonspecific mitogenic stimuli[J].Blood,2002,99(10)∶3838-3843.
[14]Horwitz EM,Gordon PL,KooWK,etal.Isolated allogeneic bone marrow-derived mesenchymal cells engraft and stimulate growth in children with osteogenesis imperfecta∶Implications for cell therapy of bone[J].Proc Natl Acad Sci U SA,2002,99(13)∶8932-8937.
[15]Koc ON,Day J,Nieder M,et al.Allogeneic mesenchymal stem cell infusion for treatmentofmetachromatic leukodystrophy(MLD) and Hurler syndrome(MPS-IH)[J].Bone Marrow Transplant, 2002,30(4)∶215-222.
[16]Pountos I,Corscadden D,Emery P,et al.Mesenchymal stem cell tissue engineering∶techniques for isolation,expansion and application[J].Injury,2007,38(Supp l 4)∶S23-S33.
[17]Porada CD,Zanjani ED,Almeida-Porad G.Adultmesenchymal stem cells∶a pluripotent population withmultiple applications[J]. Curr Stem Cell Res Ther,2006,1(3)∶365-369.
[18]KramperaM,Glennie S,Dyson J,etal.Bonemarrowmesenchymal stem cells inhibit the response of naive and memory antigenspecific T cells to their cognate peptide[J].Blood,2003,101(9)∶3722-3729.
[19]劉廣鵬,李宇琳,孫劍,等.人臍血間充質干細胞修復顱骨缺損的實驗研究[J].中華整形外科雜志,2010,26(1)∶34-38.
Rabbit as Animal Model of Fetal Bone Mesenchymal Stem Cells
ZHOU Quan1,QIMeiwu1,ZHANG Zhiyong3,ZHOU Guangdong3,YE Jinyan4,ZHOU Xiao2.1 University of South China,Hengyang 421000,China;2 Department of Plastic Surgery,Hunan Cancer Hospital,Changsha 410013,China;3 Department of Plastic and Reconstructive Surgery,Shanghai Ninth People's Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200011,China;Shanghai Key Laboratory of Tissue Engineering,Shanghai 200011,China;4 Shi Bu Zi Town Health Center,Weifang 262100,China.Corresponding author:ZHOU Xiao(E-mail:cccdon@sina.com).
Objective To construct an animalmodel of fetal bonemesenchymal stem cellswith rabbit.Methods Four pregnant rabbits(pregnancy=3 weeks)were treated with artificial fertilization,and 20 fetal rabbits were obtained with cesarean section.Fetal rabbit bonemarrow was harvested and cultured in vitro.The cellmorphology,growth curve,cloning efficiency and trilinear differentiation of BMSCs of passage 3 were observed.Cryopreserved primary cellswere recovered after 30 days,the growth curve of passage 3 was measured to compare with that non-cryopreserved.With scanning electron microscope,the fetal cells inβ-TCP cell-material compound were observed.Finally,after osteogenic induction,the BMSCsβ-TCP compound was implanted into the nudemice subcutaneously and the histological results of tissue-engineered bone at 1,3,6 months were observed.Results The BMSCs from fetal rabbit demonstrated a spindle-shaped morphology.A fter several passages,themorphology and growth curve remained almost the same.The calcium,fat and mucopolysaccharide were witnessed in trilinear differentiation.After cryopreserved for 30 days,the growth curve of passage 3 showed few changes compared with non-cryopreserved.According to SEM,the fetal cells tightly attached to thematerials and extended well after seeded onβ-TCP for 7 days.The fresh bone tissue were all observed at different time point by histological staining. Conclusion Rabbit as animalmodel can isolate and procure the fetal BMSCs and has good osteogenic ability in vivo.And it can be the new choice of the animalmodel for fetal bonemesenchymal stem cells.
Bonemarrow mesenchymal stem cells;Seed cells;Bone tissue engineering;Rabbit
Q813.1+1
A
1673-0364(2015)02-0099-05
2015年1月17日;
2015年3月10日)
421000湖南省衡陽市南華大學(周權,祁美武);410013湖南省長沙市湖南省腫瘤醫院整形外科(周曉);200011上海市上海交通大學醫學院附屬第九人民醫院整復外科,上海市組織工程研究重點實驗室(張智勇,周廣東);462100山東省濰坊市石埠子鎮衛生院(葉金艷)。
周曉(E-mail:cccdon@sina.com)。

