Cbl-b基因shRNA干擾載體的構(gòu)建及鑒定
胡彬 倪娜娜 呂雅琳 陳浩 劉毅 孫建方
Cbl-b基因shRNA干擾載體的構(gòu)建及鑒定
胡彬 倪娜娜 呂雅琳 陳浩 劉毅 孫建方
目的 構(gòu)建小鼠Cbl-b基因RNA干擾(RNAi)的真核表達(dá)質(zhì)粒,并初步鑒定其干擾效果,為后續(xù)研究Cbl-b在黑素瘤免疫治療中的作用奠定基礎(chǔ)。方法 根據(jù)基因庫提供的Cbl-b cDNA序列,設(shè)計(jì)并合成4對短發(fā)夾結(jié)構(gòu)的互補(bǔ)DNA序列,克隆至載體PGPU6/GFP/Neo構(gòu)建重組質(zhì)粒,并予以DNA測序鑒定。重組干擾質(zhì)粒構(gòu)建成功后,將干擾質(zhì)粒與Cbl-b過表達(dá)載體共轉(zhuǎn)染293T細(xì)胞,于轉(zhuǎn)染后48 h,通過實(shí)時熒光定量PCR法及蛋白質(zhì)印跡法檢測各質(zhì)粒對Cbl-b基因的表達(dá)抑制效應(yīng)。結(jié)果 測序分析證實(shí),4對shRNA寡核苷酸序列分別成功插入至shRNA真核表達(dá)載體PGPU6/GFP/Neo中,將構(gòu)建成功的PGPU6/GFP/Neo-shRNA質(zhì)粒與Cbl-b真核表達(dá)載體共轉(zhuǎn)染細(xì)胞48 h后,通過熒光實(shí)時定量PCR法及Western印跡測定,發(fā)現(xiàn)4條shRNA序列對Cbl-b的表達(dá)均有一定的抑制效應(yīng),其中以1號shRNA序列重組質(zhì)粒對Cbl-b表達(dá)的抑制程度最高(P<0.05)。結(jié)論 成功構(gòu)建并篩選出沉默效應(yīng)最高的Cbl-b shRNA真核細(xì)胞表達(dá)載體。
泛素蛋白連接酶類;RNA,小分子干擾;黑色素瘤;基因,Cbl-b
Cbl-b屬于泛素連接酶E3家族中的成員,近年的研究發(fā)現(xiàn),其直接參與了T細(xì)胞的活化及免疫耐受過程,是體內(nèi)介導(dǎo)T細(xì)胞免疫無能的內(nèi)源性調(diào)節(jié)因子之一[1-2]。我們應(yīng)用RNA干擾技術(shù),參照Cbl-b CDS區(qū)序列,設(shè)計(jì)了4條siRNA候選序列,并據(jù)此設(shè)計(jì)了其相應(yīng)的發(fā)夾狀shRNA序列,構(gòu)建shRNA真核表達(dá)載體,然后通過細(xì)胞轉(zhuǎn)染實(shí)驗(yàn),篩選出對Cbl-b沉默效率最高的shRNA表達(dá)載體。
一、試劑與材料
1.試劑:載體pGPU6/GFP/Neo(上海吉瑪制藥技術(shù)有限公司);pdsRed1-N1-cb1b過表達(dá)質(zhì)粒由本室構(gòu)建;DH5α感受態(tài)細(xì)胞(北京全式金生物公司);293T細(xì)胞(中國科學(xué)院上海生化與細(xì)胞所);DMEM培養(yǎng)基、Opti-MEM培養(yǎng)基、胎牛血清(美國 Gibco公司);脂質(zhì)體 LipofbctamineTM2000、Trizol Reagent(美國Invitrogen公司);SYBR實(shí)時熒光定量試劑盒(日本TaKaRa公司);Cbl-b的單克隆抗體(sc-8006)(美國Santa Cruz公司);HRP標(biāo)記的IgG二抗(北京中杉金橋生物技術(shù)有限公司);PVDF膜(美國Millipore公司);PCR引物由北京六合華大基因科技股份有限公司合成;其余為國產(chǎn)分析純。
2.實(shí)驗(yàn)儀器與設(shè)備:CO2細(xì)胞培養(yǎng)箱(美國Thermo Scientific公司);ABI7300實(shí)時熒光定量 PCR儀(美國Applied Biosystems公司);低溫離心機(jī)、醫(yī)用超低溫冷凍箱、酶標(biāo)儀(美國Thermo Scientific公司);凝膠成像及分析裝置,聚丙烯酰胺凝膠電泳儀,聚丙烯酰胺凝膠垂直電泳槽,微型轉(zhuǎn)膜儀(美國Bio-Rad公司);超純水儀(美國Millipore公司)。
二、方法
1.Cbl-b基因shRNA表達(dá)模板序列設(shè)計(jì)及合成:針對Cbl-b的CDS區(qū)設(shè)計(jì)并合成了針對不同靶位點(diǎn)的siRNA序列,并根據(jù)siRNA序列設(shè)計(jì)合成相應(yīng)的shRNA序列。在shRNA中的循環(huán)結(jié)構(gòu)選擇TTCAAGAGA,避免終止信號的形成,轉(zhuǎn)錄終止信號選用T6結(jié)構(gòu)。shRNA正向鏈的5′添加CACC序列,與Bbs I酶切后形成的粘末端互補(bǔ);反向鏈的5′添加了GATC,與BamH I酶切后形成的粘末端互補(bǔ)。如果siRNA的第1個堿基不是G,則在CACC序列后補(bǔ)加1個G。另設(shè)計(jì)隨機(jī)序列作為陰性對照,并經(jīng)BLAST比較沒有發(fā)現(xiàn)同源序列,命名為NC。
2.shRNA載體的構(gòu)建及鑒定:分別取2μl上述合成的DNA正義和反義鏈表達(dá)模板,加入16μl退火緩沖液,94℃水浴5min,自然冷卻至室溫,使互補(bǔ)的正、反向鏈模板結(jié)合形成雙鏈。將退火后形成雙鏈的寡核苷酸鏈與經(jīng)BamH I和Bbs I雙酶切后的載體pGPU6/GFP/Neo用T4 DNA連接酶連接過夜。以連接產(chǎn)物轉(zhuǎn)化E.coliDH5α感受態(tài)細(xì)菌,在氨芐西林抗性平板上篩選陽性克隆,并對挑選的克隆經(jīng)質(zhì)粒小提后行酶切電泳并送北京六合華大基因科技股份有限公司進(jìn)行測序鑒定。
3.細(xì)胞培養(yǎng)和轉(zhuǎn)染:293T細(xì)胞常規(guī)培養(yǎng)于含10%胎牛血清、100 U/ml青霉素、100 mg/L鏈霉素的DMEM培養(yǎng)基中,37℃、5%CO2飽和濕度培養(yǎng)箱培養(yǎng)。將狀態(tài)良好、處于對數(shù)生長期的細(xì)胞用0.25%胰酶消化,用完全培養(yǎng)基懸浮成單細(xì)胞懸液,細(xì)胞計(jì)數(shù)后,1.5×106細(xì)胞/孔接種6孔板;混勻后于37℃、5%CO2培養(yǎng) 24 h。將 0.8μg干擾表達(dá)載體質(zhì)粒pGPU6/GFP/Neo-shRNA1,pGPU6/GFP/Neo-shRNA2,pGPU6/GFP/Neo-shRNA3,pGPU6/GFP/Neo-shRNA4及陰性對照載體質(zhì)粒pGPU6/GFP/Neo-NC分別與0.8μg Cbl-b過表達(dá)載體pdsRed1-N1-Cbl-b混勻后轉(zhuǎn)染細(xì)胞,轉(zhuǎn)染程序按lipofectamin2000操作說明進(jìn)行。轉(zhuǎn)染48 h后,在熒光倒置顯微鏡下觀察轉(zhuǎn)染效率并收集細(xì)胞。實(shí)驗(yàn)同時設(shè)立過表達(dá)組、過表達(dá)陰性對照組(過表達(dá)載體及陰性對照載體共轉(zhuǎn)染)、空載對照組、陰性對照組(只轉(zhuǎn)染陰性對照質(zhì)粒組)。
4.實(shí)時熒光定量PCR法檢測mRNA水平變化:細(xì)胞轉(zhuǎn)染后48 h,收集細(xì)胞加入Trizol液提取細(xì)胞總RNA,并通過逆轉(zhuǎn)錄試劑盒合成cDNA。然后以各組cDNA為模板進(jìn)行實(shí)時熒光定量PCR擴(kuò)增,根據(jù)實(shí)時熒光定量PCR擴(kuò)增曲線得到各實(shí)驗(yàn)組目標(biāo)和內(nèi)參基因的閾值循環(huán)數(shù)(Ct值),采用△△Ct的方法進(jìn)行相對定量。擴(kuò)增Cbl-b基因所用上游引物為5′-GTGACTGGGGACGGCAATATCCTAC-3′;下游引物 5′-TAAA GATAAAAGCCTTCCCT GCTAC-3′。β肌動蛋白擴(kuò)增上游引物為5′-CCCTGGCACCCAGCA C-3′。下游:5′-GCCGAT CCACACGGAGTAC-3′。擴(kuò)增條件:95℃2min;95 ℃ 10 s;62 ℃ 40 s;40個循環(huán)后行熔解曲線分析。
5.蛋白質(zhì)印跡檢測Cbl-b蛋白表達(dá):細(xì)胞轉(zhuǎn)染48 h后,經(jīng)胰酶消化,4℃離心5min,收集各組細(xì)胞,并用預(yù)冷PBS洗3次。根據(jù)細(xì)胞蛋白提取試劑盒操作步驟提取各組細(xì)胞蛋白。上樣前蛋白樣品與等量2×加樣緩沖液混勻,煮沸5min,上樣到10%SDS-PAGE中,每孔按20μl上樣。電泳分離后轉(zhuǎn)至PVDF膜,使用加樣緩沖液封閉轉(zhuǎn)印膜2 h,加入適當(dāng)稀釋的Cbl-b一抗,4℃孵育過夜,次日TBST漂洗3次后加入二抗,室溫孵育2 h,洗膜,ECL顯色。用Cbl-b與內(nèi)參灰度比值表示Cbl-b蛋白的相對表達(dá)量,使用Gel-Pro Analyzer軟件分析處理。
三、結(jié)果
1.Cbl-b-shRNA序列的設(shè)計(jì)及合成:根據(jù)小鼠Cbl-b基因的編碼序列設(shè)計(jì)的4對siRNA序列,經(jīng)BLAST分析小鼠基因庫中同源序列,未發(fā)現(xiàn)包含該序列的其他基因,說明4個靶點(diǎn)特異性較好。然后結(jié)合shRNA載體的結(jié)構(gòu)及shRNA設(shè)計(jì)原則,由siRNA序列設(shè)計(jì)并合成了相應(yīng)shRNA序列(表1)。同時設(shè)計(jì)相應(yīng)的陰性對照序列。

表1 針對小鼠Cbl-b基因設(shè)計(jì)的4對shRNA寡核苷酸序列
2.重組質(zhì)粒測序結(jié)果:由4對shRNA序列構(gòu)建的重組質(zhì)粒經(jīng)測序鑒定構(gòu)建成功,插入的序列和目標(biāo)序列完全一致,沒有插入、缺失、突變等異常(圖1)。
3.熒光實(shí)時定量PCR檢測結(jié)果:pdsRed1-N1-Cbl-b轉(zhuǎn)染293T細(xì)胞后,細(xì)胞內(nèi)Cbl-b的表達(dá)水平明顯升高(Cbl-b過表達(dá)載體轉(zhuǎn)染組,Cbl-b載體與陰性對照質(zhì)粒共轉(zhuǎn)染組),而pdsRed1-N1-Cbl-b與各干擾質(zhì)粒共轉(zhuǎn)染后,Cbl-b mRNA的水平則明顯下降(Cbl-b過表達(dá)載體+pGPU6/GFP/NeoshRNA1,Cbl-b 過表達(dá)載體 +pGPU6/GFP/Neo-shRNA2,Cblb過表達(dá)載體+pGPU6/GFP/Neo-shRNA3,Cbl-b過表達(dá)載體 +pGPU6/GFP/Neo-shRNA4),其中以shRNA-1載體對Cbl-b基因mRNA的沉默效率最高(圖2),差異有統(tǒng)計(jì)學(xué)意義(n=3,P<0.05)。
4.蛋白質(zhì)印跡檢測結(jié)果:結(jié)果顯示(圖3),pdsRed1-N1-Cbl-b轉(zhuǎn)染后的293T細(xì)胞高表達(dá)Cbl-b蛋白,而共轉(zhuǎn)染干擾質(zhì)粒的實(shí)驗(yàn)組Cbl-b蛋白的表達(dá)水平則明顯減低,其中shRNA-1載體對Cbl-b蛋白的沉默為最高,其蛋白表達(dá)水平經(jīng)灰度分析下調(diào)了 88%(n=3,P<0.05)。
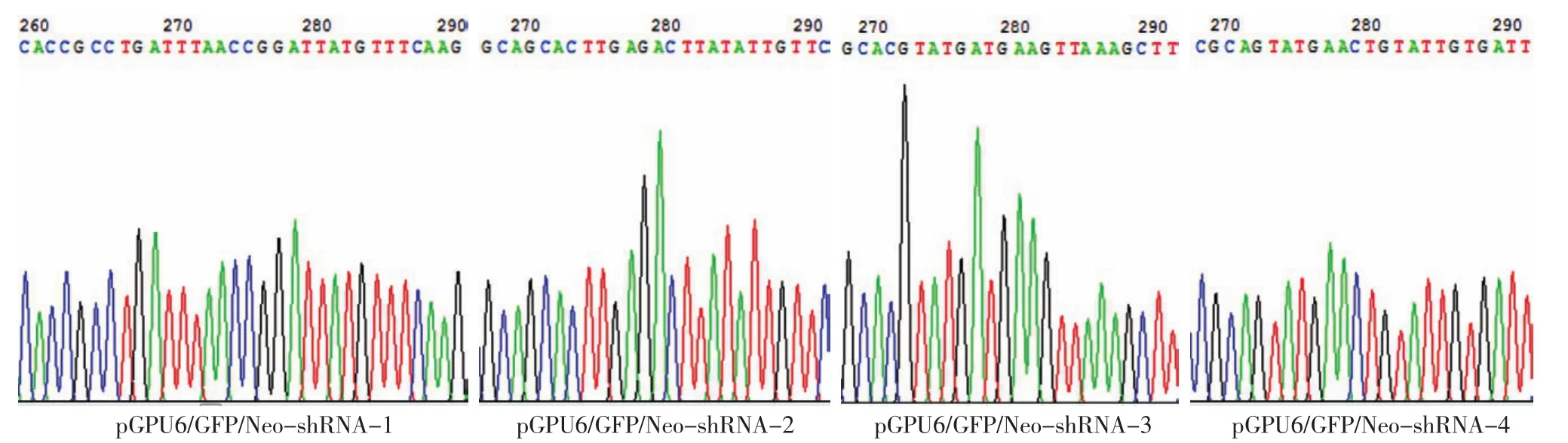
圖1 重組質(zhì)粒的測序結(jié)果 插入的序列和目標(biāo)序列完全一致,沒有插入、缺失、突變等異常

圖2 各組Cbl-b基因mRNA表達(dá)水平的檢測 C:Cbl-b過表達(dá)載體轉(zhuǎn)染組;C+N:Cbl-b載體與陰性對照質(zhì)粒共轉(zhuǎn)染組;B:空白細(xì)胞組;N:陰性對照質(zhì)粒轉(zhuǎn)染組;K:Cbl-b載體對應(yīng)空載組;1:Cbl-b過表達(dá)載體+pGPU6/GFP/Neo-shRNA1;2:Cbl-b過表達(dá)載體+pGPU6/GFP/Neo-shRNA2;3:Cbl-b過表達(dá)載體+pGPU6/GFP/Neo-shRNA3;4:Cbl-b過表達(dá)載體 +pGPU6/GFP/Neo-shRNA4

圖3 蛋白印跡檢測各組Cbl-b基因蛋白水平的表達(dá) 1:Cbl-b過表達(dá)載體+pGPU6/GFP/Neo-shRNA-1組;2:Cbl-b過表達(dá)載體+pGPU6/GFP/Neo-shRNA-2組;3:Cbl-b過表達(dá)載體+pGPU6/FP/Neo-shRNA-3組;4:Cbl-b過表達(dá)載體+pGPU6/GFP/Neo-shRNA-4組;5:Cbl-b載體對應(yīng)空載組;6:Cbl-b過表達(dá)載體轉(zhuǎn)染組;7:Cblb載體與陰性對照質(zhì)粒共轉(zhuǎn)染組;8:陰性對照質(zhì)粒轉(zhuǎn)染組;9:空白細(xì)胞組
四、討論
Cbl-b是泛素連接酶E3家族的重要成員,可使細(xì)胞內(nèi)許多重要信號分子泛素化,使其失去功能或介導(dǎo)其通過泛素-蛋白酶體/溶酶體途徑降解。Cbl-b在免疫耐受、變態(tài)反應(yīng)及細(xì)胞分化等過程中起重要作用[3-4]。Cbl-b控制著T細(xì)胞對弱抗原肽反應(yīng)活化的閾值[5],其表達(dá)的下調(diào)可降低T細(xì)胞對免疫抑制信號的反應(yīng)性。當(dāng)外來抗原刺激時,即使在沒有共刺激信號分子的輔助下,Cbl-b缺陷T細(xì)胞的增殖以及細(xì)胞因子分泌能力也有所增強(qiáng)[6-7]。另外,除了參與控制近端抗原受體信號途徑外,Cbl-b可能還介導(dǎo)某些特定的T細(xì)胞活化途徑,如由Vav1介導(dǎo)的免疫突觸的形成[8]。體外抑制試驗(yàn)發(fā)現(xiàn),Cbl-b-/-CD4+T細(xì)胞對Treg及TGFβ介導(dǎo)的免疫抑制效應(yīng)均可產(chǎn)生一定的抵抗力[9]。對Cbl-b分子的深入研究,有助于尋求腫瘤免疫治療中的新的靶標(biāo)分子。
RNA干擾技術(shù)是一項(xiàng)依賴RNA的轉(zhuǎn)錄后基因沉默技術(shù),能通過雙鏈RNA(dsRNA)特異性地抑制與其序列同源的靶基因mRNA的表達(dá)[10]。它作為一種簡便、高效、特異地抑制靶基因表達(dá)的新技術(shù)而廣泛應(yīng)用于基因功能分析、抗病毒和腫瘤治療的研究中。常用體外化學(xué)合成小片段siRNA,此法操作簡單快速,但其RNA干擾效應(yīng)僅呈瞬時效應(yīng),難以持久。shRNA表達(dá)載體系統(tǒng)產(chǎn)生短發(fā)夾型RNA來完成RNA干擾,其DNA表達(dá)框轉(zhuǎn)錄產(chǎn)物可以在細(xì)胞內(nèi)自發(fā)形成siRNA[11-12]。針對同一基因的不同靶點(diǎn)而產(chǎn)生不同的干擾效果,提示RNA干擾具有一定的靶點(diǎn)效應(yīng),同時也說明利用RNA干擾進(jìn)行相關(guān)研究前,首先需要對干擾序列進(jìn)行篩選。本實(shí)驗(yàn)的目的基因?qū)氩捎幂d體法,針對小鼠Cbl-b基因設(shè)計(jì)合成4條編碼目標(biāo)shRNA的DNA,并插入適用于RNAi實(shí)驗(yàn)的表達(dá)質(zhì)粒pGPU6/GFP/Neo,構(gòu)建編碼目的shRNA的真核表達(dá)質(zhì)粒。這比直接導(dǎo)入siRNA能產(chǎn)生更持久的沉默效應(yīng)。
從實(shí)驗(yàn)結(jié)果可以看出,我們所制備的質(zhì)粒經(jīng)測序鑒定,插入的序列和目標(biāo)序列一致,沒有插入、缺失、突變等異常,表明成功構(gòu)建了攜帶shRNA的真核表達(dá)載體,經(jīng)實(shí)時熒光定量PCR和蛋白質(zhì)印跡檢測,設(shè)計(jì)的shRNA都能在一定程度上沉默靶基因mRNA以及蛋白的表達(dá),其中以shRNA1的沉默效應(yīng)最強(qiáng),其功能有待進(jìn)一步探討。
[1]Heissmeyer V,Macián F,Im SH,et al.Calcineurin imposes T cell unresponsiveness through targeted proteolysis of signaling proteins[J].Nat Immunol,2004,5(3):255-265.
[2]Jeon MS,Atfield A,Venuprasad K,et al.Essential role of the E3 ubiquitin ligase Cbl-b in T cell anergy induction [J].Immunity,2004,21(2):167-177.
[3]Mueller DL.E3 ubiquitin ligases as T cell anergy factors[J].Nat Immunol,2004,5(9):883-890.
[4]Paolino M,Penninger JM.E3 ubiquitin ligases in T-cell tolerance[J].Eur J Immunol,2009,39(9):2337-2344.
[5]Gronski MA,Boulter JM,Moskophidis D,et al.TCR affinity and negative regulation limit autoimmunity [J].Nat Med,2004,10(11):1234-1239.
[6]Bachmaier K,Krawczyk C,Kozieradzki I,et al.Negative regulation of lymphocyte activation and autoimmunity by the molecular adaptor Cbl-b[J].Nature,2000,403(6766):211-216.
[7]ChiangYJ,KoleHK,BrownK,etal.Cbl-bregulatestheCD28dependence of T-cell activation[J].Nature,2000,403(6766):216-220.
[8]Krawczyk C,Bachmaier K,Sasaki T,et al.Cbl-b is a negative regulator of receptor clustering and raft aggregation in T cells[J].Immunity,2000,13(4):463-473.
[9]Wohlfert EA,Callahan MK,Clark RB.Resistance to CD4+CD25+regulatory T cells and TGF-beta in Cbl-b-/-mice[J].J Immunol,2004,173(2):1059-1065.
[10]Ortiz-Quintero B.RNA interference:from origins to a novel tool for gene silencing[J].Rev Invest Clin,2009,61(5):412-427.
[11]Liu YP,Schopman NC,Berkhout B.Dicer-independent processing ofshorthairpinRNAs[J].NucleicAcidsRes,2013,41(6):3723-3733.
[12]韓永智,孫建方,周武慶,等.短發(fā)卡RNA對人黑素瘤細(xì)胞BRAF 基因的沉默作用[J].中華皮膚科雜志,2006,39(11):625-628.
2014-05-22)
(本文編輯:吳曉初)
Construction and identification of a short hairpin RNA expression vector targeting the Cbl-b gene
Hu Bin,Ni Nana,Lyu Yalin,Chen Hao,Liu Yi,Sun Jianfang.Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China
s:Sun Jianfang,Email:Sunjf57@163.com;Liu Yi,Email:dr.liuyi@gmail.com
ObjectiveTo construct a eukaryotic expression plasmid vector encoding Cbl-b gene-specific short hairpin RNAs (shRNAs),and to evaluate its interference effect,so as to lay a foundation for further study on the role of Cbl-b in the immunotherapy of malignant melanoma.MethodsAccording to the sequence of Cbl-b cDNA,4 pairs of shRNAs targeting the Cbl-b gene were designed and synthesized,and then inserted into the plasmid PGPU6/GFP/Neo to construct recombinant plasmids.After identification by DNA sequencing,the 4 shRNA expression vectors were cotransfected into 293T cells with the Cbl-b gene eukarytic expresson plasmid,respectively.The knockdown efficiency of these shRNA expression plasmids on Cbl-b expression was evaluated by real-time(RT)fluorescence-based quantitative PCR and Western blot at 48 hours aftert transfection.ResultsSequencing analysis revealed that all the 4 pairs of shRNAs were successfully inserted into the eukarytic expression vector PGPU6/GFP/Neo.As RT-PCR and Western blot showed,all the 4 shRNA-expressing vectors could downregulate Cbl-b expession,and the NO.1 shRNA-expressing vector displayed the strongest interference effect(P<0.05).ConclusionsA eukaryotic expression plasmid vector was successfully constructed for Cbl-b gene-specific shRNAs,and the most effective shRNA was selected in this study.
Ubiquitin-protein ligases;RNA,small interfering;Melanoma;Genes,Cbl-b
10.3760/cma.j.issn.0412-4030.2015.03.018
國家自然科學(xué)基金面上項(xiàng)目(81171513)
210042南京,中國醫(yī)學(xué)科學(xué)院北京協(xié)和醫(yī)學(xué)院皮膚病研究所
孫建方,Email:sunjf57@163.com;劉毅,Email:dr.liuyi@gmail.com

