卵巢及子宮內膜來源的漿液性癌、子宮內膜樣癌p16、p53表達研究
蔡 健,華 平,胡志敏,王世鳳,王璽皓,余 波
(成都市婦女兒童中心醫院病理科,成都610092)
眾所周知,卵巢和子宮內膜都可以發生子宮內膜樣癌和漿液性癌,按目前流行的卵巢、子宮內膜癌的二元論分類,認為高級別的漿液性癌的預后要明顯差于子宮內膜樣癌,因此,不管腫瘤發生在卵巢還是子宮體,鑒別二者顯得非常重要[1-2]。大量的研究表明p53、p16的表達情況對于鑒別二者起到非常重要的作用。我們將通過回顧性研究一組病例來闡明和進一步印證p53、p16在這兩種疾病中的表達特征和差別。
1 材料及方法
1.1 材料
66例發生在卵巢或子宮內膜的被診斷為高級別漿液性癌或子宮內膜樣癌的標本均選自我院2012~2015年病理科的存檔蠟塊(在本研究中并不特別去區分腫瘤是發生在卵巢還是子宮內膜),標本均經4%甲醛固定,石蠟包埋。所有病例診斷參照WHO第四版標準。患者年齡從42~71歲,平均年齡(56 ±2.5)歲。
1.2 方法
將選定的存檔石蠟塊重新制成2~4μm的切片,蘇木素-伊紅(HE)染色和免疫組化染色,光鏡觀察;免疫組化染色采用SP法,鼠抗人單克隆抗體p16,p53及SP試劑盒均購自廣州太陽生物有限公司,抗體工作濃度1∶100,操作步驟嚴格按說明書進行,以磷酸鹽緩沖液代替一抗作為陰性對照,以已知p16、p53陽性的漿液性癌組織作為陽性對照。結果判定標準:p53陽性定位于細胞核,以細胞核出現清晰的棕黃色顆粒為陽性;p16陽性定位于細胞漿、細胞膜或細胞核,以出現清晰的棕黃色顆粒為陽性。“-或+-”為無或不足5%的陽性細胞;“+”為5%~29%的腫瘤細胞著色,被認為弱陽性;“++”為約30%~69%的腫瘤細胞著色,中強陽性;“+++”為70%以上的腫瘤細胞著色,強陽性;在判定過程中結合細胞著色的強度進行綜合評判,比如超過70%的腫瘤細胞陽性,但著色為中等強度,給予++的評判。然后對免疫組化結果半定量數值化,數值化規則如下:-或+-記為0分,+記為1分,++記為2分,+++記為3分,根據數值化結果建立數值化表。
1.3 工作方式
采用雙盲法,即在結果出來之前組織學診斷和免疫組化結果判定分別獨立進行,二者判定過程不彼此影響。閱片人員由一位副主任醫師,一位高年資主治醫師及一位住院醫師完成。
1.4 統計學方法
采用SPSS19.0軟件,運用卡方檢驗和線性相關分析,P<0.05認為有統計學意義。
2 結果
2.1 免疫組化結果
66例病例中30例診斷為高級別漿液性癌,其鏡下特點為:癌組織分化較低,呈復雜的小乳頭或成片實體結構,三級核,眾多的核分裂、凋亡,p53免疫組化染色:13 例(43.3%)強陽性,10 例(33.3%)中強陽性,7例(23.4%)弱陽性,無陰性表達;p16免疫組化染色:8 例(26.6%)強陽性,9 例(30.0%)中等強度陽性,10例(33.4%)弱陽性,3例(10.0%)陰性;36例被診斷為子宮內膜樣癌,其組織學特點是分化較好,呈腺樣或絨毛腺樣,無或很少實體片狀結構,核異型性不大,核分裂及凋亡少見,免疫組化染色,僅1 例(2.8%)p53 呈強陽性,3 例(8.3%)中強陽性,32例(88.9%)為陰性或弱陽性,同時有2例(5.6%)p16呈中強陽性,其余的均為陰性或弱陽性(見圖1~4,表1、2)。
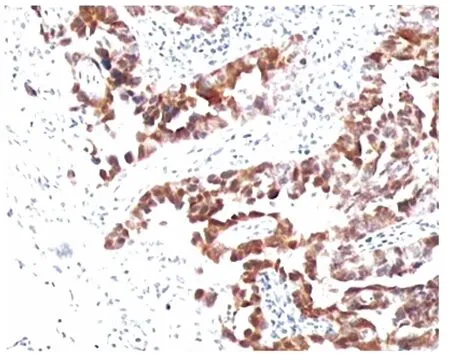
圖1 p16(+++),卵巢漿液性癌示胞漿及胞核強著色(×200倍)
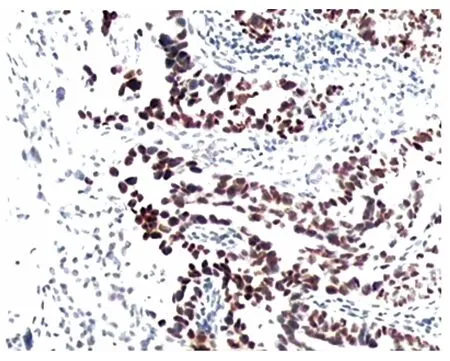
圖2 p53(+++),同上例,切片中同一區域,胞核強著色(×200倍)
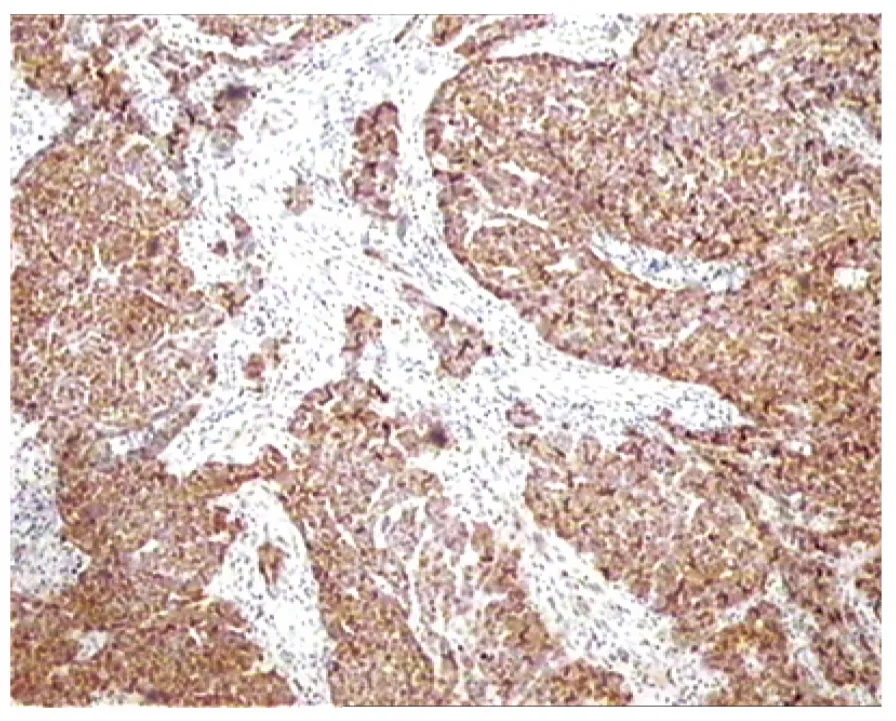
圖3 p16(+++),宮內膜漿液性癌,胞漿及胞核強著色(×100倍)
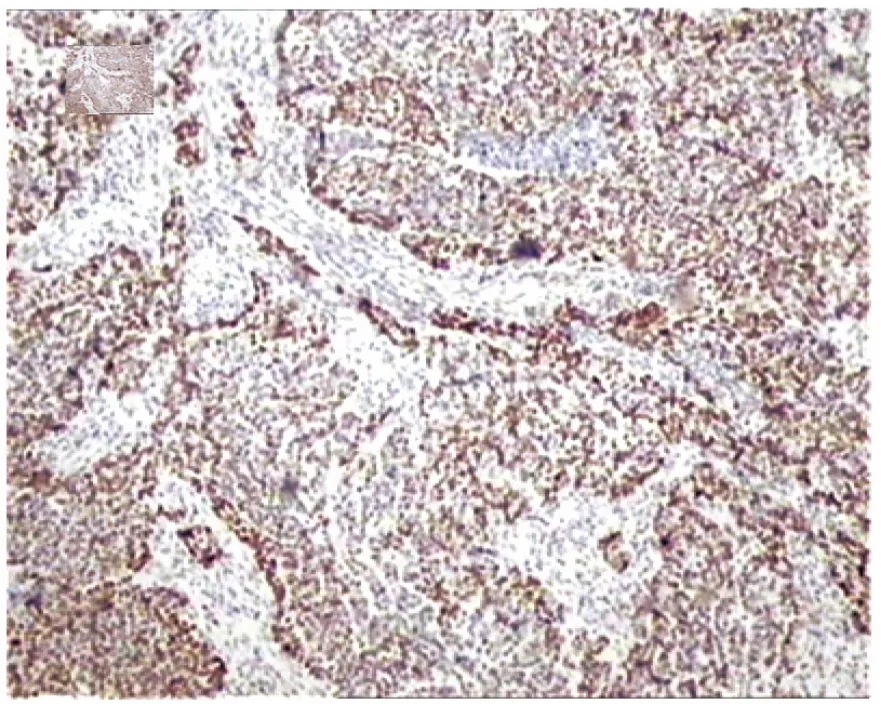
圖4 p53(++),同上例,切片中同一區域胞核中等強度著色(×100倍)
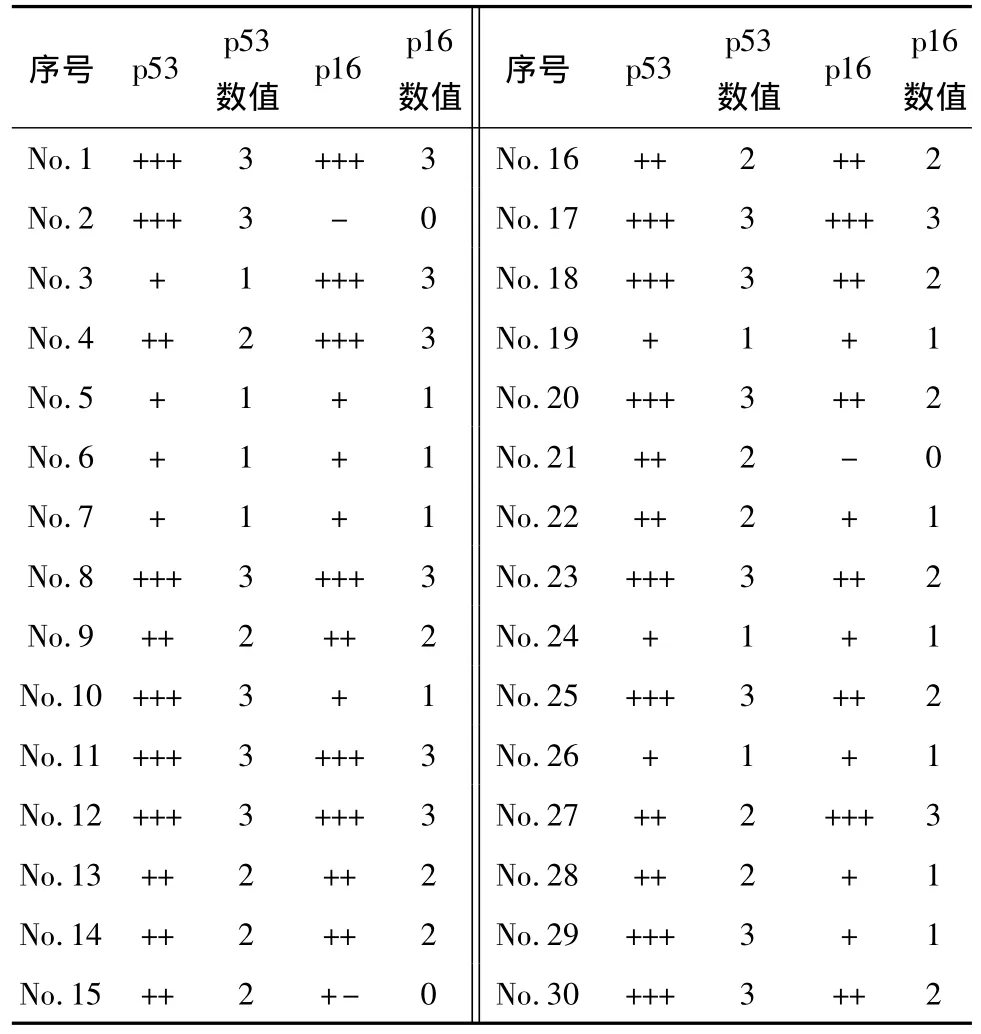
表1 30例漿液性癌p53、p16免疫組化結果及其數值化結果
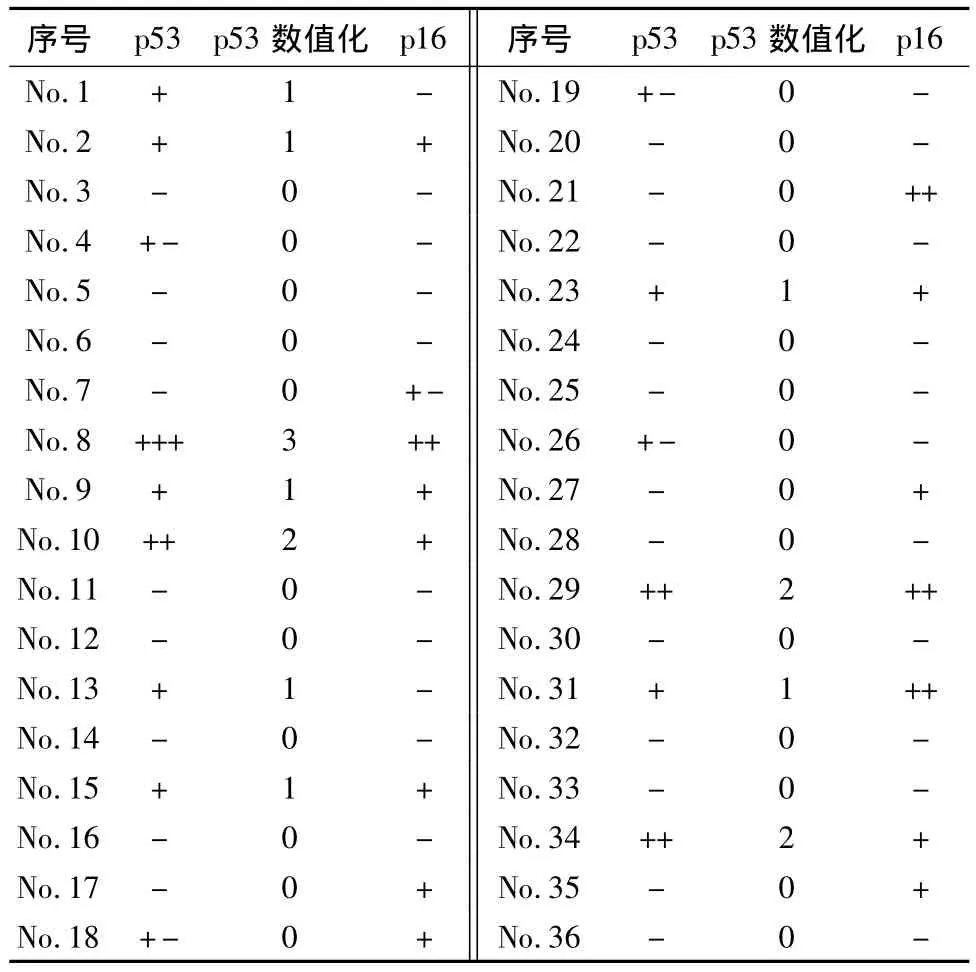
表2 36例子宮內膜樣癌的p53、p16免疫組化結果及p53的數值化結果
2.2 p53、p16在漿液性癌和子宮內膜癌中的表達及相關性
根據數據資料,為使p53結果更加客觀,規定免疫組化數值大于或等于2屬于病理性表達,小于或等于1屬于非病理性表達。理由:野生型p53經常和mdm2發生作用導致其半衰期極短[3-4],不容易被檢測到,而突變型的p53蛋白由于容易和其他分子結合從而屏蔽了與mdm2的相互作用[3],導致其在核內濃度提高,容易被檢測到。結合表1、2數值可得如表3所示p53在子宮內膜樣癌及漿液性癌中的病理性表達和非病理性表達結果。

表3 p53在漿液性癌及子宮內膜樣癌中的病理性表達和非病理性表達合計表(例)
計算的Pearson卡方值 =29.091,差異性顯著(P<0.001),推斷出漿液性癌中p53的病理性表達與子宮內膜樣癌中p53的病理性表達差異非常顯著(P <0.001)。
另一方面,根據表1的抽樣數據,可以計算出在漿液性癌中p16、p53表達情況的Spearman相關系數 (Correlation coefficient)[5]:r(Xp16,Xp53)=0.36,呈弱正相關(顯著水平 P=0.05),具有一定的統計學意義;由此我們認為至少在統計學層面p16和p53就線性關系而言存在內在關聯(P≤0.05)。
由此得出結論:1、高級別漿液性癌與p53的突變強相關,而子宮內膜樣癌基本不存在p53的改變(P<0.005)。2、在高級別漿液性癌中,統計分析發現p53的表達似乎與p16的表達存在某種內在聯系,即二者在這類癌癥中存在同時陽性的傾向(弱線性正相關,相關系數 r=0.33,顯著水平 P≤0.05)。
3 討論
在所有女性惡性腫瘤中,發生在子宮內膜和卵巢的子宮內膜樣癌(endometrioid carcinoma)及高級別漿液性癌(HGSCs)占了很大的比例,近20年國內外眾多學者從形態學、組織發生學、免疫組化及分子生物學等角度的廣泛研究,使人類對這類腫瘤有了相對透徹的了解,直至形成現在廣泛流行的子宮內膜及卵巢癌二元發病模型(dualistic model of carcinogenesis),即將這類腫瘤分為Ⅰ型和Ⅱ型,本文中子宮內膜樣癌和高級別漿液性癌分別代表Ⅰ型和Ⅱ型。
Ⅰ型特征性地發生ERBB2/PI3K/AKT(PKB)/mTOR/cyclinD1或ERBB2/KRAS/BRAF(MAPKKK)/MEK(MAPKK)/ERK(MAPK)信號通路異常[4],分化相對較高,生物學行為較惰性,因此惡性程度較低;Ⅱ型,則特征性地發生p53突變,分化較低,生物學行為高度侵襲。由于生物學行為的顯著不同,準確區分它們在臨床上顯得非常重要[6-8]。從形態學角度,子宮內膜樣癌總顯示一定程度的器官樣分化,呈腺樣或乳頭狀,很少呈實體片狀,癌細胞總顯示一定的分化程度,異型性不是很大;而高級別漿液性癌,癌細胞常常排列成實體片狀,可見纖細的小乳頭,細胞分化程度低,異型性大。這種形態學的差異,本質上是由癌細胞分化程度的高低決定的,前者為中高分化,后者為低分化或未分化,這也是二元論在癌細胞分化方面的體現;從免疫組織化學角度,p53的高表達與癌細胞的低分化相聯系,低表達則與高分化相聯系,這是二元論在p53方面的體現。本研究中p53在漿液性癌和子宮內膜樣癌中表達的顯著差異,佐證了這樣的差別,并顯示形態學分類和分子分類(根據p53的表達情況)具有高度的一致性。
另一方面,本研究顯示了p16在HGSCs的表達特征。如前所述,由于p53蛋白的生化特點,其陽性提示TP53基因的突變。p16蛋白的異常表達反映P16基因怎樣的狀況呢?一般而言蛋白質的異常表達可以出現在基因缺失、基因擴增、染色體畸變、基因突變或者受別的異常生物分子(轉錄因子)的影響。在本研究免疫組化切片中我們經常觀察到p53和p16表達的一致性,即它們傾向于在腫瘤的同一區域陽性(如圖1、2),即使是灶性區域陽性,很多情況下陽性細胞的空間分布也是一致的,從統計學角度考慮,這種現象可能并非偶然。這一事實使我們有理由認為高級別漿液性癌p16的異常表達與突變的p53有關,即p16的異常表達系基因異常轉錄導致,傾向于異常p53上調p16,即突變的p53蛋白可能通過磷酸化的pRB反饋性地上調p16INK4a/p14ARF(這兩個抑癌基因共用2個相同的外顯子,由于讀碼框移位,從而表達不同的蛋白質);本研究結果顯示p53和p16之間的確存在一定程度的線性關系。在文獻報道中,強調了在生理條件下p16基因的一個獨特的轉錄產物ARF(alternate open reading frame,又名p14ARF等),通過屏蔽泛素蛋白連接酶MDM2,穩定野生型p53蛋白,延長了其半衰期,從而發揮腫瘤抑制作用的一個方面,且在病理狀態p16INK4a/p14ARF表達也常常被上調[9-10]。因此在HGSCs情形,我們認為p16INK4a/p14ARF可能由于突變的p53蛋白的存在而被上調,而p14ARF又阻止p53蛋白(可能包括突變型)降解,從而形成一個正反饋環路,強化突變p53的致瘤作用。這是基于免疫組化觀察和統計學結果的關于p53和p16在腫瘤發生發展中的協同關系的一個猜測,事實是否如此尚有待進一步的研究。
綜上所述,本研究進一步證實了p53的異常表達(TP53突變)在子宮內膜樣癌和高級別漿液性癌中的差別,并描述了它們不同的病理臨床特征,由此說明準確區分它們具有重要的臨床意義;提示了p53的異常表達在診斷過程中的重要作用;另一方面,通過p16的表達特點,及與p53的統計學聯系,提示p16與p53之間可能存在的內在關系。這些結果及可能關系加深了我們對該類腫瘤的理解,并促進我們繼續去研究該腫瘤的發生發展問題,揭示疾病更多的本質,為解決臨床問題提供可能存在的幫助。關于p53、p16與女性生殖道上皮低分化癌之間關系更詳盡的分子機制,本資料中并未提示,核內詳盡分子機制(如p53-p16的精確調控關系及臨床應用等)更有待進一步深入研究,以揭示更本質的腫瘤信息,并運用于臨床實踐。
[1] Kurman RJ,Carcangin ML,Herrington CS,et al.WHO Classifi-cation of Tumour of Female Reproductive Organs[M].Fourth Edition.Lyon:International Agency for Research on Cancer,2014:22-24,31-32,130-136.
[2] 張 靜,郭曉青,Jing-song Liu.卵巢漿液性癌的兩級分級系統及其臨床意義[J].中華婦產科雜志,2011,46(10):739.
[3] Roger RJR.癌生物學[M].第二版.北京:科學出版社,2002:78.
[4] 楊 恬.醫學細胞生物學-基礎、進展和趨勢[M].人民衛生出版社 ,2011:263.
[5] 王福保.概率論與數理統計[M].第三版.上海:同濟大學出版社,1994:165-169.
[6] Kurman RJ.Shih IM.Molecular pathogenesis and extraovarian origin of epithelial ovarian cancer—Shifting the paradigm[J].Hum Pathol,2011(42):918-931。
[7] 沈旭霞,喻 林,華 蕊.卵巢低、高級漿液性癌的臨床病理分析及 Paxz,p53,Ki67 表達的意義[J].中華病理學雜志,2011,40(8):511-516.
[8] 林 潔,杜 娟,張春妤.卵巢漿液性癌兩級組織學分級系統一評估及p53蛋白表達的意義[J].中華病理學雜志,2010,39(10):655-660.
[9] 王 芳,關云謙.p16INK4a/p14ARF基因在細胞衰老和腫瘤抑制中的作用研究進展[J].首都醫科大學學報,2011,32(1):100-103.
[10] 王 靜,張小為.CDKN2A基因變異與腫瘤[J].中國優生與遺傳雜志,2007(7):116-118.

