7例胰腺寡囊性漿液性囊腺瘤MSCT分析
王宗勇,熊 燕,陳志凡
(成都大學附屬醫院放射科,成都610081)
胰腺漿液性囊性腫瘤(serous cystic neoplasm,SCN)是一種罕見的胰腺囊性腫瘤,占胰腺外分泌腫瘤的1%~2%,其病因尚不明確,Mohr等[1]認為其發病與von Hippel-Lindau(vHL)病相關。WHO 2010年新病理分類[2]將SCN分為微囊型、寡囊型、實性型、vHL相關型、混合性漿液-內分泌型以及漿液性囊腺癌共6個亞型。其中微囊型最為常見,影像易于診斷,而胰腺漿液性寡囊性囊腺瘤(macrocystic serous cystadenoma of the pancreas,MSAP)由于囊腔較大(直徑>2cm)、數目較少(<6個),易與胰腺黏液性囊腺瘤(mutinous cystic neoplasm,MCN))、導管內乳頭狀黏液瘤(intraductal papillary mucinous neoplasm,IPMN)、假性囊腫 (pancreatic pseudocysts,PPC)等混淆。既往文獻主要集中在對微囊型的研究,對MSAP研究較少。現本文回顧分析7例經病理證實的MSAP的MSCT表現,旨在提高對本病認識。
1 材料與方法
1.1 基本資料
我院2007年12月~2013年12月病理確診7例MSAP,均行腹部平掃及三期增強掃描。其中男1例,女6例。年齡36~70歲(平均47±11歲)。5例為體檢發現,2例以腹部不適就診。所有病例血、尿淀粉酶、血糖、血清腫瘤標記物(CEA、CA19-9、CA125)均為陰性。所有病例均無酗酒、胰腺炎、腹部外傷、多囊腎、多囊肝、vHL等疾病史。7例中4例術前診斷為MSAP,1例診斷為IPMN,2例診斷為MCN。
1.2 檢查方法
采用GE LightSpeed VCT,電壓120kV,電流150~180mA,層厚5mm。增強掃描以高壓注射器經肘靜脈注入對比劑碘海醇70~90ml或1.5ml/Kg,流速3ml/s,開始注射造影劑后35s行動脈期掃描,60s~65s行門脈期掃描,120~130s行延遲期掃描。平掃及增強圖像均行1.25mm薄層重建及冠狀位重建。
1.3 圖像分析
圖像由兩名腹部影像診斷高年資醫師,在不知道患者病理診斷情況下,對病灶部位、形態、囊腔大小及數目、是否含分隔及分隔厚度、囊液密度、是否含有鈣化及纖維瘢痕、病灶邊界、是否含壁結節、囊壁是否可見及厚度、胰管是否擴張進行分析,取二者共同意見。
2 結果
7例MSAP中,2例位于胰頭(圖1)、3例位于胰體(圖2)、2例位于胰尾(圖3)。4例為分葉狀,2例為類圓形,1例形態不規則。4例為多囊(圖4),3例為單囊(圖5)。囊腔大小17~61mm(平均31.2±4.3mm)。4例可見分隔(圖2),其分隔較薄(厚度<2mm),顯細線樣,3例未見分隔(圖5)。囊液CT值3~8HU(平均6±1.7HU)。所有病例均邊界清晰,不含壁結節及實性成分,未見鈣化及纖維瘢痕。病灶胰腺內部分囊壁顯示不清,位于胰腺外部分囊壁均為均勻菲薄(厚度<2mm)。所有7例病變均不與胰管相通,其中5例未見胰管擴張,2例(位于胰頭)可見胰管擴張(圖6)。
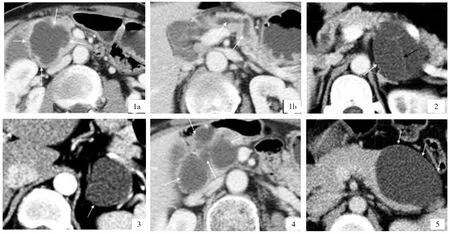
圖1 胰頭部MSAP胰頭部分葉狀占位(1a)及主胰管擴張(1b),門脈期顯示胰頭部分葉狀囊性占位(1a),邊界清晰,囊壁顯示不清,未見分隔及鈣化、壁結節;上方層面(1b)顯示病灶遠端主胰管擴張(白色箭頭)。圖2 胰體部MSAP門脈期顯示胰體部卵圓形囊性占位,其內可見細線樣分隔(黑色箭頭),突出于胰腺部分囊壁菲薄(白色箭頭)。圖3 胰尾部MSAP門脈期顯示胰尾部形態不規則的囊性占位,突出于胰腺部分囊壁菲薄(白色箭頭)。圖4 胰頭部MSAP門脈期顯示胰頭部多囊性占位(白色箭頭)。圖5 胰體部MSAP,門脈期顯示胰腺體部卵圓形囊性占位,其內未見分隔,突出于胰腺部分囊壁菲薄(白色箭頭)。
3 討論
3.1 病理基礎及臨床
MSAP由 Lewandrowski等[3]提出,用于描述一個SCN的一個亞型,此亞型由直徑>2cm和數目<6個的囊腔構成,與微囊型SCN相比,MSAP囊腔更大、數目更少。組織學表現為囊壁內襯富含糖原的單層立方或扁平上皮。肉眼MSAP大多數與鄰近胰腺組織分界清楚,部分腫瘤包膜不完整,可穿插至鄰近胰腺組織。切面MSAP由單個或多個(數目<6個)、較大(直徑>2cm)的囊腔組成,囊內充滿清亮液體。鏡下MSAP由單個或多個較大薄壁囊腔組成,中央星狀纖維瘢痕及鈣化罕見。MSAP內皮細胞不分泌癌胚抗原(arcinoembryonic antigen,CEA),其囊液中CEA水平不高。臨床多見于60歲以上女性,通常無癥狀,常為體檢發現,少數表現為腹痛、惡心、嘔吐、體重減輕,偶可阻塞或壓迫胰管或膽總管。MSAP為良性病變,多數可保守治療,只有引起癥狀(如腹痛、黃疸、反復胰腺炎發作)或影像學診斷不明確時才考慮手術治療。
3.2 MSCT 表現
Cohen-Scali等[4]分析 12例 MSAP及 11例MCN、10例PPC后認為,MSAP主要位于胰頭,其敏感性為50%,特異性為90%。Lewandrowski等[3]報道5例MSAP,其中3例(60%)位于胰頭。Khurana等[5]研究5例MSAP后發現,3例(60%)位于胰腺頭。2010年WHO[2]新病理分型也提到MSAP主要位于胰頭部。而本組2例(28.6%)位于胰頭、3例(42.9%)位于胰體、2 例(28.6%)位于胰尾,與上述報道有所出入,可能與本組病例較少,存在抽樣誤差有關。
Cohen-Scali等[4]等分析 12 例 MSAP,有 7 例(58.3%)為分葉狀,而其分析的11例 MCN、10例PPC輪廓均為圓形或卵圓形,未見分葉狀輪廓,并認為分葉狀輪廓對于診斷MSAP的特異性為100%。Kim等[6]認為多囊、分葉狀輪廓對診斷MSAP及與MCN和IPMN的鑒別最為重要。另外Jin等[7]及Fujiwara等[8]報道了2例MSAP輪廓為不規則狀。本組4 例(57.1%)為分葉,2 例(28.6%)為類圓形,1例(14.3%)形態不規則,與上述報道類似。
Lewandrowski等[3]研究5例MSAP后提出其主要由直徑>2cm和數目<6個的囊腔構成。2010年WHO新病理分型[2]提到MSAP特點是由少量大囊組成。本組4例(57.1%)為多囊,3 例(42.9%)為單囊,囊腔大小17~61mm,平均34mm,與上述報道類似。
Lewandrowski等[3]及 Fujiwara 等[8]均報道MSAP未見分隔。羅華等[9]研究13例MSAP,發現11例(84.6%)可見薄如線樣的分隔。本研究4例可見分隔,其分隔較薄(厚度<2mm),顯細線樣,3例(42.9%)未見分隔。Lewandrowski等[3]及 Fujiwara[8]等研究未見分隔可能與其病例數較少(共6例),存在抽樣誤差有關。
MSAP壁菲薄(厚度<2mm)且均勻,僅被覆一層均勻一致的富含糖原的單層立方或扁平上皮。Cohen-Scali等[4]等分析 12 例 MSAP,有 10 例(83.3%)為薄壁(厚度<2mm)。部分囊壁可增厚,可能是囊內出血所致。本研究所有病例囊壁均為均勻菲薄(厚度<2mm),而當病灶位于胰腺內部時其囊壁顯示不清。
MSAP不累及主胰管,但若病變較大且位于胰頭,胰管可受壓擴張[9],本研究 2 例(28.6%)位于胰頭的病例可見胰管擴張,其余5例(71.4%)均未見胰管擴張,與上述報道類似。
本研究均未見纖維瘢痕及鈣化、壁結節顯示,與胰管不相通,與既往報道類似[3,5,8],2010 年 WHO新病理分型[2]也提到MSAP通常無中央瘢痕及鈣化,病灶與胰管不相通。但羅華等[9]研究13例MSAP,發現2例可見點狀鈣化。其發生原因有待進一步研究。
3.3 鑒別診斷
MSAP的CT表現與胰腺其他囊性腫瘤有部分重疊,其中MCN由于囊腔較大且數目較少,易與MSAP混淆。目前認為MCN屬于惡性或惡性潛能不明腫瘤,發現后應積極手術,而MSAP若未引起癥狀可保守治療,因此,MSAP與MCN的鑒別非常重要,主要鑒別點:①部位:MSAP多位于胰腺頭頸部,MCN多位于胰腺體尾部,較少位于胰頭;②形態:MSAP多為分葉狀,MCN多為圓形或卵圓形;③分隔:MSAP分隔較薄且均勻,而MCN分隔多較厚,且不均勻;Procacci等[10]認為MSAP較少有中央分隔是與黏液性囊腺瘤主要的鑒別點;④鈣化:袁東等[11]認為囊壁鈣化更多見于 MCN,Scott等[12]認為囊壁鈣化僅見于惡性腫瘤,而本組及其他研究[3,5,6,8]均未見鈣化顯示;⑤壁結節:MSAP 為良性病變,不含壁結節,而MCN囊壁可見乳頭狀結節,增強后可見壁結節強化;⑥囊壁:MSAP囊壁菲薄(厚度<2mm)且均勻,而MCN囊壁厚薄不均,一般厚度>3mm,部分可見囊壁鈣化及壁結節;⑦囊液CEA水平:由于MSAP內皮細胞不分泌CEA,其囊液中CEA水平不高,而MCN囊壁細胞可分泌CEA進入囊液,且CEA水平與惡性程度正相關,對于不典型病例可采用細針穿刺行細胞學檢查及囊液腫瘤標記物檢測。
MSAP若位于胰頭部,可導致胰管外壓性擴張,此時需與IPMN將鑒別,主要鑒別點:①形態:MSAP多為分葉狀,而多數分支胰管型IPMN為多囊葡萄樣改變;②與主胰管關系:MSAP與主胰管不相通,而分支型IPMN囊狀擴張的分支胰管與主胰管相通,此點在二者鑒別診斷時尤為重要,需仔細分析薄層及冠狀重建圖像,了解病灶與主胰管的關系;③導管內乳頭狀結節:MSAP擴張的主胰管內不含乳頭狀結節,而分支胰管型IPMN胰管內可見乳頭樣結節;④胰腺形態:部分IPMN伴胰腺萎縮,而MSAP不伴胰腺萎縮;⑤對于不典型病例可選擇MRCP或超聲內鏡、ERCP檢查,以明確病灶與胰管是否相通。
另外,MSAP還應與胰腺非腫瘤性囊腫病變鑒別。根據囊壁有無上皮襯覆分為真性囊腫和假性囊腫(PPC),我們主要討論MSAP與PPC的鑒別:①PPC多繼發于急、慢性胰腺炎或胰腺創傷,診斷前應準確了解病史;②MSAP多位于胰頭部,PPC多位于體、尾部;③MSAP可為分葉狀,PPC基本為圓形或卵圓形;④MSAP囊壁較薄(<2mm),PPC囊壁略厚;⑤MSAP密度均勻,為水樣密度,本組囊液CT值3~8HU,平均6HU;PPC形成早期因其內主要含血液和以蛋白質為主的壞死組織,密度類似軟組織密度,以后可變為水樣密度,若囊內繼發出血或感染期密度可增加;⑥部分PPC可見胰管擴張及沿胰管分布的鈣化、胰周筋脈增厚、鄰近血管受累等慢性胰腺表現。
本組7例中1例術前診斷為IPMN,主要是因為病灶位于胰頭部,與遠端擴張的主胰管關系密切,誤認為病灶與主胰管相通而診斷IPMN,未進行薄層及多平面重建仔細觀察病灶與主胰管關系,也未進一步MRCP/ERCP檢查了解病灶是否與主胰管相通,所以我們建議對于位于胰頭部MSAP應薄層及多平面重建仔細關系病灶是否胰管相通,判斷困難應建議MRCP/ERCP檢查。2例術前診斷為MCN,主要是因為病灶位于胰體部,少囊,囊腔較大,為卵圓形,未見壁結節及鈣化,我們認為此類病例與MCN鑒別較為困難,在鑒別時應注意病灶囊壁厚度、分隔厚度、是否含有壁結節、囊壁是否含有鈣化,鑒別困難時應建議細針穿刺行細胞學檢查及囊液腫瘤標記物檢測。
綜上,MSAP多見于60歲以上女性,影像主要表現為位于胰頭、分葉狀輪廓、薄而均勻的分隔、缺乏中心瘢痕及鈣化、囊壁菲薄、與胰管不相通。病灶若同時具備分葉狀、壁薄、無壁強化和位于胰頭4種征象中的3種,診斷MSAP特異性為100%[4]。對于不典型病例,應結合MRI、超聲內鏡、ERCP等檢查,必要時可行細針穿刺活檢及囊液腫瘤標記物檢測,以提高診斷正確率,有助于治療方案的選擇。
[1] Mohr VH,Vortmeyer AO,Zhuang Z,et al.Histopathology and molecular genetics of multiple cysts and microcystic(serous)adenomas of the pancreas in von Hippel-Lindau patients[J].Am J Pathol,2000,157(5):16l5-1621.
[2] Terris B,Fukushima N,Hruban RH.Serous neoplasms of the pancreas.In Bosman FT,Carneiro F,Hruban RH,et al.WHO classification of tumors of the digestive system[M].4th edition.Lyon(France):IARC Press,2010:296-299.
[3] Lewandrowski K,Warshaw A,Compton C,Macrocystic serous cystadenoma of the pancreas:a morphological variant differing from microcystic adenoma[J].Hum pathol,1992,23(8):871-875.
[4] Cohen-Scali F,Vilgrain V,Brancatelli G,et al.Discrimination of unilocular macrocystic serous cystadenoma from pancreatic pseudocyst and mucinous cystadenoma with CT:initial observations[J].Radiology,2003,228(3):727-733.
[5] Khurana B,Mortelé KJ,Glickman J,et al.Macrocystic serous adenoma of the pancreas:radiologic– pathologic correlation[J].AJR,2003,181(1):119-123.
[6] Kim SY,Lee JM,Kim SH,et al.Macrocystic neoplasms of the pancreas:CT differentiation of serous oligocystic adenoma from mucinous cystadenoma and intraductal papillary mucinous tumor[J].AJR,2006,187(5):1199-1198.
[7] Jin YM,Yim H,Choi IJ.Pancreatic serous cystadenoma mimicking pseudocyst[J].Yonsei Med J,1997,38(1):63-65.
[8] Fujiwara H,Ajiki T,Fukuoka K,et al.Macrocystic serous cystadenoma of the pancreas[J].J Hepatobiliary Pancreat Surg,2000,7(1):92-96.
[9] 羅 華,梁 亮,曾蒙蘇.胰腺巨囊型漿液性囊腺瘤的MSCT表現及其診斷[J].放射學實踐,2011,26(7):739-741.
[10] Procacci C,Graziani,R,Bicego E,et al.Serous cystadenoma of the pancreas:report of 30 cases with emphasis on the imagine findings[J].J Comput Assist Tomogr,1997,21(7):375-382.
[11]袁 東,余 衛,任小波,等.胰腺囊腺瘤的多層螺旋CT表現特征及診斷準確性[J].中國醫學科學院學報,2007,29(2):232-237.
[12] Scott J,Martin I,Redhead D,et al.Mucinous cystic neoplasms of the pancreas:imaging features and diagnostic difficulties[J].Clin Radiol,2000,55(3):187-192.

