南海南部海域異養浮游細菌生長對外源營養物的響應*
侯 瑞,白 潔,劉小沙,高會旺,趙陽國
(中國海洋大學海洋環境與生態教育部重點實驗室,山東 青島 266100)
海洋異養細菌是海洋物質循環和能量流動中的重要組成部分[1],是海洋生態系統有機質的分解者以及重要的二次生產者[2],在海洋中數量大、繁殖速度快、轉換效率高,生物量循環迅速,在海洋生態環境中占有重要地位[3]。海洋異養細菌生長也是海洋碳、氮、磷等元素的生物化學過程的重要環節[4-6],其中異養細菌的生產會消耗海水中的溶解性有機碳DOC和營養鹽(無機氮DIN、磷酸鹽P)并轉換為自身的生物量,而細菌的呼吸會代謝自身產物并轉化為CO2,它們之間的關系會決定異養細菌的轉換效率,進而影響細菌的生長[7]。因此,海水和營養鹽等營養物質是影響異養細菌生長的重要限制因子[8-9]。
南海是中國面積最大的海域,屬于貧營養海區,其表層水溫終年較高(25℃以上)[10],葉綠素和初級生產力水平較低[11]。由于受海水營養的限制,南海異養浮游細菌出現數量較少、分布不均[12-14]。南海屬于陸間海,面臨著大氣沉降、近岸陸源輸入和船舶排放等外來營養源的影響[15],這勢必對海洋異養細菌種群數量、群落結構和功能產生一定的影響[9,16]。然而,對于南海異養浮游細菌與營養鹽關系的研究主要集中于南海北部上升流區域和珠江口及大陸架海區,發現南海北部上升流區域和珠江口區域異養細菌主要受磷限制,而大陸架海區異養細菌主要受DOC限制[12-13],對南海南部異養浮游細菌的研究還要追溯到1986[17]和2009年[18],主要是對異養細菌分布的研究。南海南部海域的環境條件與南海北部類似,但是其還受不同內部物理過程和外部河流輸入的影響[19],所以進行外源營養物對南海南部海域異養細菌生長代謝影響的研究具有著重要意義。
本研究于2012年8月利用現場觀測和模擬培養相結合的方法對南海南部兩個典型站位海水中異養浮游細菌生長的影響因素進行了研究。通過單獨和聯合投加DOC和N、P等營養要素,觀察異養細菌生物量、細菌比生長速率和呼吸速率的響應,研究南海貧營養鹽區域異養細菌生長的限制因子,探討外源營養物對細菌物質轉換效率和異養細菌生態功能的影響。
1 材料與方法
1.1 現場觀測、培養與樣品采集
在南海南部海域選取兩個有代表性的海盆區域站位S1站(112°39.140′E,6°36.052′N)和陸架區域S2站(111°16.647′E,10°29.709′N)進行現場觀測和模擬培養(見圖1)。由船載自容式CTD(Seabird 25,USA)采集表層1m處海水,同時測定現場水溫、鹽度、pH和溶解氧(DO)。水樣采集后,部分樣品置于已加入多聚甲醛的10mL無菌螺口管中,用于細菌生物量的測定;部分水樣過濾后用于營養鹽、DOC測定;部分水樣立即用65μm的篩絹過濾以除去浮游動物的攝食干擾,分裝于1.5L的無菌PET瓶中,裝滿水并加入外源營養物質后用半透膜封口,防止外界干擾但可保持瓶內外交換。將培養瓶置于甲板,在通過循環海水的恒溫條件下培養6d。
培養實驗共設5組:1個對照組和4個營養物添加組,其中C組為對照組、D組只添加DOC、DN組添加DOC和N、DP組添加DOC和P、DNP組同時添加DOC、N和P,每組均設3個平行。添加的DOC為葡萄糖、N為KNO3、P為KH2PO4,實驗分組和添加營養物質的摩爾質量見表1。分別在第0、1、2、3和第6天中午定時取各培養組的水樣用于細菌和環境因子的測定,同時測定培養瓶中的溫度、鹽度、pH和DO。每次均取平行樣。
圖1 南海采樣站位Fig.1 Sampling stations of South China Sea
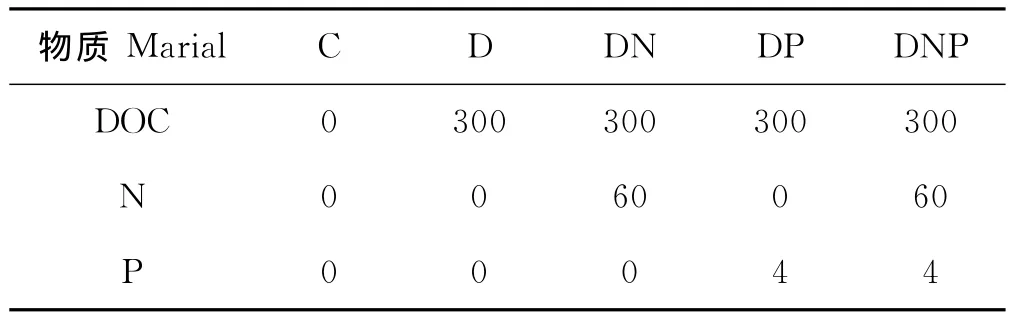
表1 實驗分組及營養物質添加量Table 1 Ambient nutrient concentration /μmol·L-1
1.2 現場環境因子及營養鹽和DOC的測定
現場水溫、鹽度和pH等數據由CTD測得,溶解氧(DO)由WTW 500i便攜水質分析儀測得。
DOC樣品用高溫燃燒氧化法由島津TOC-V型總有機碳測定儀測定[20]。
營養鹽測定使用BRAN+LUEBBE AA3型營養鹽自動分析儀進行。N-N用次氯酸鈉氧化靛酚藍法[20],N-N用銅—鎘柱還原后鹽酸萘乙二胺絡合顯色法,N-N用鹽酸萘乙二胺絡合顯色法[21]。
1.3 細菌活性的測定
1.3.1 細菌生物量 將細菌樣品過濾到0.22μm的核孔膜上,經過DAPI染色后,用Leica全自動熒光顯微鏡對異養細菌進行計數[23]。用換算因子20fg C/cell將異養細菌豐度換算為以碳單位表示的細菌的生物量[1]。
1.3.2 細菌比生長速率 根據公式p=(lnN2-lnN1)/T計算培養3d前后細菌比生長速率,其中N1和N2是培養時間T前后的細菌總數[24]。
1.3.3 細菌呼吸速率 參照Vazquez-Dom在2007年的方法,根據每一時段前后DO濃度的變化量并換算成C消耗量來計算1d前后和3d前后細菌的呼吸速率[25]。
1.4 數據統計
采用SPSS17.0統計軟件進行多因素方差分析(Multivariate Analysis of Variance),計算顯著差異性,其中sig.<0.05代表結果在不同分組上的差異具備顯著性。
應用SPSS17.0的Correlate程序計算分析不同指標類型結果之間的相關性。
2 結果與討論
2.1 不同站位的環境特征分析
本研究所在的S1站位于南海南部南沙群島南部區域,屬于貧營養程度大的海盆區域,受人為影響較小;S2站位于南海西南部近岸陸架區域,靠近湄公河河口區,附近航線比較集中,受人為影響較大。2個站位表層海水的水溫、鹽度、pH、營養鹽現場監測結果見表1,可以看出2個站位均具有南海典型的高水溫、高鹽度、高pH、寡營養鹽特征,其DOC、DIN和磷酸鹽水平大致與Yuan在2011年在南海北部得到的數值(DOC 70μmol/L,DIN 4μmol/L,P0.1μmol/L)相近[12]。因為S2站靠近湄公河河口區,鹽度和營養鹽稍低于S1站,而DOC則高于S1站。S1的N∶P比值為15.87,S2的N∶P比值為17.57,S1站的N∶P比值與Redfield比值接近[26],S2站的N∶P比值高于S1站。S1站和S2站表層水體的異養細菌豐度分別為1.45×105和2.15×105cell/mL,均低于Yuan在南海北部貧營養鹽區域測得的表層海水異養細菌豐度值(6±1)×105cells/mL的結果[12],說明南海南部異養細菌生長受到環境因子的限制高于北部海區。
2.2 異養細菌生物量及對外源營養物的響應
2個站位表層海水異養細菌的生物量見圖2。在S1站,培養期間對照組細菌生物量一直呈現緩慢下降的趨勢;而只添加DOC的D組,細菌生物量在培養1d內即達到最大值0.090 5mg C/L,是培養前的3.12倍;在培養2d后開始迅速下降。同時添加DOC和N或DOC和P的DN組和DP組的細菌生物量增長較D組緩慢,1d后開始迅速增長,在培養2d后分別達到最大值0.086 7和0.098 8mg C/L,分別為對照組的3.22和3.68倍。同時添加DOC、N和P的DNP組細菌生物量上升較其他組緩慢,在2d開始迅速增長,在3d達到最大值0.166 0mg/L,是對照組的8.89倍。在培養結束時的第6天,S1站DOC添加的D組異養細菌生物量較對照組有明顯增長(P<0.05),DN組、DP組異養浮游細菌生物量大于D組但不明顯(P>0.05),而DNP組細菌生物量則明顯大于D組(P<0.05);3種營養物聯合聯合添加使細菌生物量顯著增加的結果表明,在南海南部貧營養的S1站,細菌的生長除受DOC的限制外,受DOC、N和P等環境因子的聯合限制更為明顯。
在離岸相對較近的S2站,各實驗組異養細菌生物量的變化規律與S1站有所不同,各組生物量均在1d后快速增長,并在2d后達到最大值,D組、DN組、DP組、DNP組分別為0.085 8、0.170 8、0.237 6、和0.185 4 mg/L,分別為對照組的1.29 倍、2.56倍、3.56倍和2.78倍。其中,DP組細菌生物量的最大值。S2站各組細菌生物量均在培養第3d后開始逐漸降低。添加DOC的D組異養細菌生物量與對照組的差異不顯著(P>0.05),說明DOC對S2站異養細菌生長的限制不明顯;添加P組的生物量較對照組的顯著增大(P<0.05),表明離岸較近的S2站細菌生物量受P的限制更為明顯。
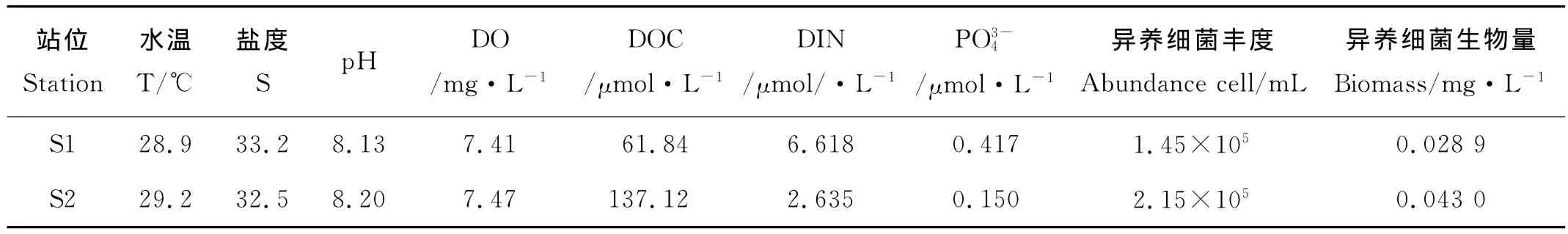
表2 不同站位的現場環境因子及細菌測定結果Table 2 Initial environmental factor of the stations
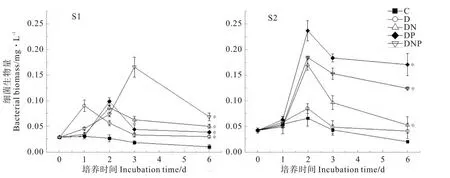
圖2 不同營養物添加組細菌生物量的變化Fig.2 Variation of bacterial biomass among different treatments
2.3 異養細菌呼吸速率及對外源營養物的響應
在培養期間的前3天內,S1站和S2站不同組異養細菌呼吸速率的變化結果見圖3。在遠海的S1站,培養期間對照組細菌呼吸速率呈現緩慢下降的趨勢;添加DOC的D組細菌呼吸速率在1d即有明顯升高并達到最高值,為1.035mg/L·d;DN、DP和DNP組的細菌呼吸速率則在培養期間一直呈現出上升趨勢,在第3天分別為對照組的3.44、3.02和4.01倍。
S2站的細菌呼吸速率與其細菌生物量的變化趨勢比較相似,其中DOC、DN組均在2d達到最大值,分別為0.818和1.155mg/L·d,為對照組的1.28倍和1.81倍,之后稍有下降。而DP組和DNP組的細菌呼吸速率在培養第3d達到最大值,分別為1.288和1.241mg/L·d,是對照組的2.01倍和3.06倍。
隨著營養物質的增加,異養細菌的生長需要更多的能量進行物質合成,所以異養細菌的呼吸作用出現了增大的態勢[26]。在S1站,DOC對異養細菌呼吸速率的促進作用較為明顯(P<0.05),并且在添加DOC的基礎上,聯合添加N、P對異養細菌呼吸速率的作促進用更為顯著(P<0.05);氮的添加對細菌呼吸速率的促進效果比磷的添加更為顯著(P<0.05),同樣表明該海域細菌生長以DOC限制為主,同時可能受氮的限制。
在離岸相對較近的S2站,營養物質添加對細菌呼吸速率的增加與S1有所不同,添加DOC組細菌呼吸效率的增長對照組差異不顯著(P>0.05),聯合添加磷的DP組對細菌呼吸速率的促進效果最為顯著(P<0.05),進一步表明該海域細菌活性受磷的限制更為明顯。
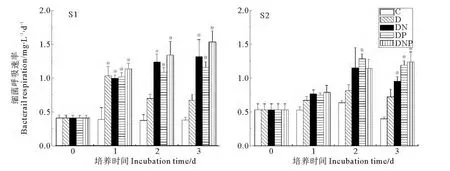
圖3 不同營養物添加組細菌呼吸速率的變化Fig.3 Variation of bacterial respiration rate among different treatments
2.4 異養細菌比生長速率及對外源營養物的響應
不同組異養細菌在培養前3天的比生長速率見表3。在S1站,對照組在培養前3天異養細菌比生長速率為負值,說明不添加外源營養物質,由于營養缺乏會導致異養細菌數量在培養期間緩慢下降。而添加DOC的D組細菌比生長速率明顯大于對照組(P<0.05),表明異養細菌數量的增長受到了DOC的限制;Yuan等在2011年和Kirchman等在2000年也得出海洋異養細菌在近岸海域主要受DOC限制的結論[5,12];DN組、DP組和DNP組的細菌比生長速率明顯大于D組(P<0.05),且DN組的比生長速率明顯大于DP組(P<0.05),而DNP組的細菌比生長速率最大,主要因為當環境中DOC限制緩解后,氮和磷會成為細菌生長的限制因子[29],表明在S1站異養細菌的生長主要受DOC的限制,同時也存在氮的限制。
在S2站,D組前3天的比生長速率比對照組大但不顯著(P>0.05),這與S2站環境中的DOC濃度較高有關。DN、DP和DNP組的比生長速率明顯高于對照組(P<0.05),其中DP組細菌比生長速率較對照組的增長最為明顯,進一步說明在S2站異養浮游細菌生長受磷的限制更為明顯。而DP組的細菌比生長速率大于DNP組;這可能是因為在S2站異養細菌是磷限制且浮游植物是氮限制的,同時加氮和磷會可能促進浮游植物的生長并使其與異養細菌競爭其它營養物質,一定程度上抑制了浮游細菌的生長[27]。
2.5 細菌生長效率及對外源營養物的響應
Pradeep-Ram在2002年曾報道,海水中細菌的呼吸速率與細菌生產之間有著緊密的關系[24]。異養細菌的比生長速率與細菌呼吸速率的比值可作為細菌物質轉換效率的指標。通過對2個站位培養期間前3d的異養細菌比生長速率和呼吸速率進行相關性分析,可見二者之間存在著顯著的正相關關系(r=0.896,P<0.01)。2個站位比生長速率與細菌呼吸速率的比值見表3;比值越大,說明細菌對物質的轉換效率越高,細菌異養程度越高[28]。在不同實驗組中,2個站位聯合添加DOC、氮和磷3種營養物質對于細菌轉換效率的促進作用最為明顯;此外,在S1站氮的添加對細菌轉換效率的促進作大于磷,而在S2站則相反。
外源營養物質在促使異養細菌生物量和呼吸速率增長的同時,使異養細菌的異養程度進一步增大,也增加了細菌的物質轉換效率,將有助于其在南海南部海域生態效率的提高。
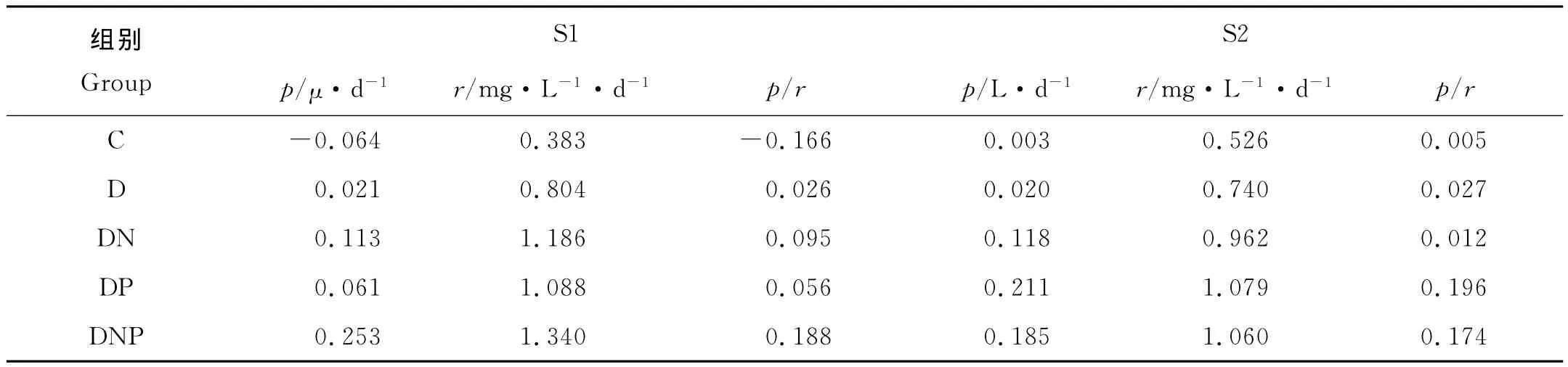
表3 培養3d時異養細菌比生長速率(p)、呼吸速率(r)及二者比值的(p/r)Table 3 Bacterial special growth rate and bacterial respiration rate
3 結論
(1)南海南部2個站位S1、S2都屬貧營養狀態,其異養細菌生物量相對于其他海域較低。在海盆區的S1站,異養細菌生長的主要限制因子是DOC,其次是氮限制;而在近岸的S2站,異養細菌則主要受磷限制。
(2)當南海南部海域2個站位海水受外源營養物輸入時,異養細菌生物量和呼吸速率叫對照組明顯增高。在S1站,同時添加DOC、氮和磷時異養細菌生物量、比生長速率和呼吸速率的增加最為顯著;而近岸的S2站,同時添加DOC和磷時異養細菌生物量、比生長速率和呼吸速率增長最為顯著。外源營養物質的添加使2個站位異養細菌的異養程度明顯增加,將異養細菌的物質轉換效率明顯增加,顯著提高其在南海南部海域的生態作用效率和生態功能。
[1]趙三軍,肖天,岳東海.秋季東黃海異養細菌 (heterotrophic bacteria)的分布特點[J].海洋與湖沼,2003,34(3):295-305.
[2]Azam F,Fenchel T,Field J G.The ecological role of water column microbes in the sea[J].Marine Ecology Progress Series,1983.10:257-263.
[3]孫松,李超倫.中國區域海洋學—生物海洋學[M].北京:海洋出版社,2012:329-337.
[4]Carlson C A,Ducklow H W,Michaels A F.Annual flux of dissolved organic carbon from the euphotic zone in the northwestern Sargasso Sea[J].Nature,1994,37(1):405-408.
[5]Kirchman D L,Meon B,Cottrell M T,et al.Carbon versus iron limitation of bacterial growth in the California upwelling regime[J].Limnology and Oceanography,2000,45:1681-1688.
[6]Yuan X C,Yin K D,Harrison P J,et al.Variations in apparent oxygen utilization and effects of P addition on bacterial respiration in subtropical Hong Kong waters[J].Estuaries and Coasts,2011,34:536-543.
[7]Hugh W D,Mary-Lynn D,David L K,et al.Constraining bacterial production,conversion effciency and respiration in the Ross Sea,Antarctica,January February,1997[J].Deep-Sea Research II,2000,47:3227-3247.
[8]Rivkin R B,Anderson M R.Inorganic nutrient limitation of oceanic bacterioplankton[J].Limnology and Oceanography,1997,42:730-740.
[9]Pinhassi J,Gomez-Consarnau L.Seasonal changes in bacterioplankton nutrient limitation and their effects on bacterial community composition in the NW Mediterranean Sea[J].Aquatic Microbial Ecology,2006,44:241-252.
[10]周宗澄,姚瑞梅,梁子原.南海中部海域異養細菌的生態分布[J].海洋通報,1989,8(3):57-64.
[11]Liu K K,Chao S Y,Shaw P T,et al.Monsoon-forced chlorophyll distribution and primary production in the South China Sea:observations and a numerical study[J].Deep-Sea Research I,2002(49):1387-1412.
[12]Yuan X,He L,Yin K,et al.Bacterial distribution and nutrient limitation in relation to different water masses in the coastal and northwestern South China Sea in late summer[J].Continental Shelf Research,2011,31:1214-1223.
[13]Ning X,William K W L,Cai Y M,et al.Comparative analysis of bacterioplankton and phytoplankton in three ecological provinces of the northern South China Sea[J].Marine Ecology Progress Series,2005,293:17-28.
[14]He L,Yin K,Yuan X C,et al.Spatial distribution of viruses,bacteria and chlorophyll in the northern South China Sea[J].A-quatic Microbial Ecology,2009,54:153-162.
[15]Morton B,Blackmore G.South China Sea[J].Marine Pollution Bulletin,2001,42(12):1236-1263.
[16]張瑜斌,章潔香,孫省利.海水富營養化對海洋細菌影響的研究進展[J].生態學報,2012,32(10):3225-3232.
[17]Ishida Y,Eguchi M,Kadota H.Existence of obligately oligotrophic bacteria as a dominant population in the South China Sea and the West Pacific Ocean[J].Marine Ecology-Progress Series,1986,30:197-203.
[18]Chen B,Liu H,Wang Z.Trophic interactions within the microbial food web in the South China Sea revealed by size-fractionation method[J].Journal of Experimental Marine Biology and Ecology,2009,368:59-66.
[19]王靜,江麗芳.南海南部海域海面溫度異常的時空分布[J].熱帶海洋學報,2009,28(4):72-78.
[20]Knap A,Michaels A,Close A,et al.Protocols for the Joint Global Ocean Flux Study(JGOFS)Core Measurement.Scientific Committee on Oceanic Research Manual and Guides[M].Paris:UNESCO,1994.
[21]孫西艷,洪陵成,葉宏萌.在線鎘柱還原-流動注射法測定水樣中硝酸鹽氮實驗[J].水資源保護,2010,26(5):75-77.
[22]曾愛娣.AA3連續流動注射法測定水中的氨氮和總磷[J].環境研究與監測,2010,22(3):54-55.
[23]Porter K G,Feig Y S.The use of DAPI for identifying and counting aquatic microflora[J].Limnnolog and Oceanography.1980,25(5):943-948.
[24]Pradeep-Ram A S,Nair S,Chandramohan D.Bacterial growth efficiency in the tropical estuarine and coastal waters of goa,Southwest Coast of India[J].Microbial Ecology,2003,45:88-96.
[25]Vazquez-Dom nguez E,Vaque D,Gasol J M.Ocean warming enhances respiration and carbon demand of coastal microbial plankton[J].Global Change Biology,2007,13:1327-1334.
[26]Redfield A.The biological control of chemical factors in the environment[J].Scientific American,1958,46:205-221.
[27]Zohary T,Herut B,Krom M D,et al.P-limited bacteria but N and P colimited phytoplankton in the Eastern Mediterranean-a microcosm experiment[J].Deep-Sea Research II,2005,52:3011-3023.
[28]Itziar L,Thomas L,Estela R.Effects of a dust deposition event on coastal marine microbial abundance and activity,bacterial community structure and ecosystem function[J].Journal of Plankton Research,2010,32(4):381-396.
[29]Douglas P,Simon M,Ryan M D,et al.Limitation of lowland riverine bacterioplankton by dissolved organic carbon and inorganic nutrients[J].Hydrobiologia,2010,652:101-117.

